离子交换层析分离纯化甘薯β-淀粉酶
2017-05-11张万利梁新红孙俊良冉军舰莫海珍
张万利,梁新红,孙俊良,冉军舰,莫海珍
离子交换层析分离纯化甘薯β-淀粉酶
张万利,梁新红,孙俊良,冉军舰,莫海珍
(河南科技学院食品学院,河南新乡453003)
应用新型离子交换柱层析分离甘薯中β-淀粉酶.采用HiTrap Capto Q强阴离子柱对甘薯β-淀粉酶进行分离纯化,纯化的样品经SDS-PAGE分析纯度.结果表明:pH值为6.0的磷酸氢二钠-柠檬酸缓冲液条件下纯化效果最佳,分离色谱图显示洗脱液在280 nm的紫外吸收值最大,为496.32 mAU,蛋白峰面积最大,为225.55;洗脱液经SDS-PAGE分析为单一条带;经HiTrap Capto Q柱分离纯化后,β-淀粉酶比活力提高至96 885 U/mg,纯化倍数为15.32,酶回收率为18.30%.研究表明HiTrap Capto Q柱层析纯化能够快速高效地纯化甘薯β-淀粉酶,纯化工艺过程简单、快速、高效.研究对工业生产中运用此技术提高β-淀粉酶的分离纯化效率具有理论及实践意义.
离子交换层析;纯化;甘薯;β-淀粉酶
甘薯是我国重要的粮食作物之一,其种植面积和总产量分别占世界的42.65%和71.22%,居世界首位,单产比世界平均水平高67%[1].近年来中国甘薯产后淀粉加工比例达到70%~80%[2-3].据报道,中国每年因生产甘薯类淀粉排放的废液约1 650万t,造成较严重的环境污染[4].而甘薯浆中含有大量蛋白,其中甘薯β-淀粉酶是主要的蛋白之一,甘薯中提取的β-淀粉酶是植物β-淀粉酶的最佳来源[5-6].从甘薯制淀粉的废液中提取β-淀粉酶,既节约了生产成本,又大大减少了环境污染.
β-淀粉酶是一种糖苷酶,作用于淀粉时从淀粉链的非还原端开始,外切α-1,4-糖苷键,顺次切下麦芽糖单位[7].β-淀粉酶主要应用于制糖、制药及啤酒等工业.β-淀粉酶是一种活性物质,容易受到提取环境条件的影响,优化其纯化条件对增加纯化产物具有重要意义.
甘薯β-淀粉酶纯化一般从甘薯淀粉废液中获得粗酶液,用硫酸铵沉淀法初步分离,然后再逐级纯化.如Pauline等[8]应用DEAE、G-75、Glycogen precipitation和preparative native PAGE依次进行多步层析分离,Yamasaki等[9]用Sephadex G-200和DEAE-cellulofine分离纯化β-淀粉酶,Kolawole等[10]用DEAE-seharose和α-CD(epoxyl)seharose6B进行多步层析分离,工艺步骤均很繁琐,过程耗时耗力.
Capto Q是强阴离子柱,其以离子交换剂为固定相,根据带电荷的蛋白和层析填料上相反电荷之间的可逆相互作用进行分离.Capto Q柱具有完善的配有传统配体的Capto平台的高分辨率中度纯化和精细纯化,易于优化的高通量纯化,能够提高工艺经济性和生产能力等优点[11].
本文采用强阴离子柱Capto Q柱快速纯化甘薯β-淀粉酶,并对不同的缓冲液及其不同的pH值对Capto Q柱纯化甘薯β-淀粉酶效果的影响进行研究,以期优化纯化工艺流程,提高纯化速度,为β-淀粉酶研究及酶制剂工业生产提供参考.
1 材料与方法
1.1 材料与试剂
甘薯品种为徐薯18号,产自河南科技学院甘薯试验基地;透析袋1 kDa(北京索莱宝科技有限公司);β-淀粉酶标品(美国Sigma公司);其他化学试剂均为国产分析纯.
1.2 仪器与设备
H2050台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);AKTAPURIFIE 10蛋白质纯化仪(美国GE公司);HiTrap Capto Q 5×1 mL离子交换柱(美国GE公司);miniPROTEANⅡ垂直版电泳仪(美国Bio-Rad公司).
1.3 试验方法
1.3.1 甘薯β-淀粉酶粗酶液制备将鲜甘薯预处理,切块称取100 g,加入蒸馏水200 mL,于粉碎机中粉碎1 min.过40目筛,滤液置于冷冻离心机中4℃、4 000 r/min离心15 min.取上清液,加入硫酸铵至饱和度为70%,于4℃冰箱中静置4 h.设置离心机参数为温度4℃,转速8 000 r/min,冷冻离心15 min,收集沉淀.用适量缓冲液将沉淀溶解,选用截留分子量为1 kDa的透析袋透析除盐24 h[12].
1.3.2 甘薯β-淀粉酶柱层析分离纯化用离子交换柱HiTrap Capto Q(柱体积5 mL)柱层析纯化甘薯β-淀粉酶,用0.02 mol/L缓冲液平衡柱子,β-淀粉酶粗酶液用0.22μm膜过滤,上样量1 mL,控制流速1.0 mL/min.用相同缓冲液洗脱,收集器按照每管5.0 mL收集洗脱液.
1.3.3 β-淀粉酶与碘试剂反应淀粉具有遇碘变蓝的特性[13].收集出峰的洗脱液与碘试剂反应,淀粉无颜色变化则初步判断为洗脱液含有酶液.具体方法为:称取1 g淀粉,加少量0.2 mol/L的缓冲液,煮沸冷却后用相同缓冲液定容到100 mL,取0.5 mL加入试管中,然后加入出峰部分的洗脱液1 mL,于60℃水浴中反应5 min,加入少量的碘试剂,检验淀粉的水解情况.
1.4 分析方法
1.4.1 蛋白质含量测定采用Folin-酚法[14].
1.4.2 β-淀粉酶活性的测定采用3,5-二硝基水杨酸(DNS)法[15].
1.4.3 β-淀粉酶电泳方法十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE法)[15].每个泳道上样量为20μL.
2 结果与分析
2.1 不同p H值的磷酸氢二钠-磷酸二氢钠缓冲液对甘薯β-淀粉酶分离纯化的影响
以磷酸氢二钠-磷酸二氢钠为缓冲液体系,考察pH值为6.0~8.0时HiTrap Capto Q柱对甘薯β-淀粉酶的分离效果,结果见图1.

图1 磷酸氢二钠-磷酸二氢钠p H值为6.0~8.0时HiTrap Capto Q对甘薯β-淀粉酶分离图谱Fig.1 HiTrap Capto Q chromatography purification ofβ-amylase from sweetpotato atNa2HPO4-NaH2PO4pH 6.0~8.0
由图1可知,β-淀粉酶在不同pH值的磷酸氢二钠-磷酸二氢钠缓冲液下的紫外吸光值不同.pH值的改变不影响出峰时间,只改变吸光值的大小.图中有3个洗脱峰及1个流穿峰,分别收集每个峰所对应的收集管里的洗脱液.依据方法1.3.3,洗脱峰2中洗脱液与碘试剂反应无颜色变化,而洗脱峰1、洗脱峰3和流穿峰中洗脱液与碘试剂反应呈蓝色,因此洗脱峰2中含有β-淀粉酶.计算在不同pH下洗脱峰2的峰面积和峰高可知:pH值为6.0时,洗脱峰2的峰高为408.26 mAU,峰面积为170.36;pH值为7.0时,洗脱峰2的峰高为300.38 mAU,峰面积为140.31;pH值为8.0时,洗脱峰2的峰高为182.30 mAU,峰面积为55.88.
以磷酸氢二钠-磷酸二氢钠为缓冲液时,在pH值为6.0时,HiTrap Capto Q对甘薯β-淀粉酶分离纯化的β-淀粉酶分离效果最好,洗脱液在280 nm的紫外吸收值最大,其值为408.26 mAU,此时峰面积也达到最大,其值为170.36.
2.2 不同p H值的磷酸氢二钠-柠檬酸缓冲液对甘薯β-淀粉酶分离纯化的影响
以磷酸氢二钠-柠檬酸为缓冲液体系,考察pH值为6.0~8.0时HiTrap Capto Q柱对甘薯β-淀粉酶的分离效果,结果见图2.

图2 磷酸氢二钠-柠檬酸缓冲液pH值为6.0~8.0时HiTrap Capto Q对甘薯β-淀粉酶分离色谱图Fig.2 HiTrap Capto Qchromatography purification ofβ-amylase from sweetpotato at Na2HPO4-citric acid pH 6.0~8.0
由图2可知,β-淀粉酶在不同pH值的磷酸氢二钠-柠檬酸缓冲液下的紫外吸光值不同.pH值的改变不影响出峰时间,只改变吸光值的大小.图中有3个洗脱峰和1个流穿峰,分别收集每个峰所对应的收集管中的洗脱液.依据方法1.3.3,洗脱峰2中洗脱液与碘试剂反应无颜色变化,而洗脱峰1、洗脱峰3和流穿峰中洗脱液与碘试剂反应呈蓝色,因此洗脱峰2中含有β-淀粉酶.计算在不同pH值下洗脱峰2的峰面积和峰高可知:pH值为6.0时,洗脱峰2的峰高为496.32 mAU,峰面积为225.55;pH值为7.0时,洗脱峰2的峰高为370.35 mAU,峰面积为140.31;pH值为8.0时,洗脱峰2的峰高为223.04 mAU,峰面积为60.62.
以磷酸氢二钠-柠檬酸缓冲液为缓冲液时,在pH 6.0时HiTrap Capto Q对甘薯β-淀粉酶分离纯化的β-淀粉酶分离效果最好,洗脱液在280 nm的紫外吸收值最大,其值为496.32 mAU,此时峰面积也达到最大,其值为225.55.
总结两种缓冲液及其不同pH值对甘薯β-淀粉酶分离纯化的影响可知,在以磷酸氢二钠-柠檬酸为缓冲液、pH值为6.0时分离纯化甘薯β-淀粉酶效果最好,此时蛋白浓度最大,280 nm的紫外吸收值最大为496.32 mAU,峰面积最大为225.55.
2.3 HiTra p Ca pto Q柱对甘薯β-淀粉酶纯化效果
以pH值为6.0的磷酸氢二钠-柠檬酸为缓冲液,应用HiTrap Capto Q柱对甘薯β-淀粉酶进行分离纯化,对粗酶液和图2-a色谱图中洗脱峰2对应的洗脱液进行酶活及蛋白质含量测定,以比活力及提纯倍数等为指标对β-淀粉酶纯化效果进行比较,结果见表1.
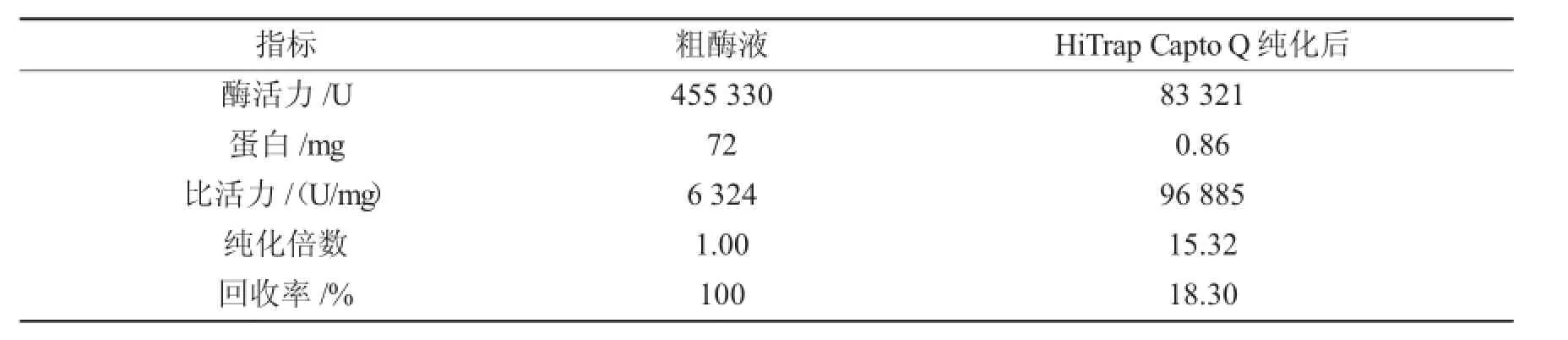
表1 HiTrap Capto Q柱对β-淀粉酶纯化效果Tab.1 Purification ofβ-amylase using HiTrap Capto Q
由表1可知,经HiTrap Capto Q柱分离纯化后,β-淀粉酶比活力提高至96 885 U/mg,纯化倍数为15.32,酶回收率为18.30%.
2.4 电泳鉴定结果
以pH值为6.0的磷酸氢二钠-柠檬酸为缓冲液,应用HiTrap Capto Q柱对甘薯β-淀粉酶进行分离纯化,对图2-a中色谱图中对应的3个洗脱峰和1个流穿峰对应的洗脱液进行SDS-PAGE电泳,结果见图3.
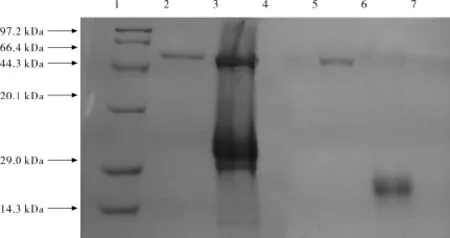
图3 甘薯β-淀粉酶SDS-PAGE电泳图谱Fig.3 SDS-PAGE electrophoresis spectrums ofβ-amylase from sweetpotato
由图3可知,色谱图中洗脱峰1、洗脱峰3和流穿峰中不含有甘薯β-淀粉酶,与β-淀粉酶标品条带相比较,粗酶液和洗脱峰2中含有甘薯β-淀粉酶.由电泳图谱可知,洗脱峰2为单一条带,其位置在Mark蛋白的第2条和第3条带之间,分子量约为45~50 kDa.由此可见,应用AKTApurifier纯化仪,以HiTrap Capto Q离子交换技术分离纯化β-淀粉酶有很好的纯化效果,得到的β-淀粉酶纯度很高.
3 结论
研究应用AKTApurifier Plus层析系统,选用HiTrap Capto Q离子交换柱对甘薯β-淀粉酶进行分离纯化.分别在磷酸氢二钠-磷酸二氢钠和磷酸-柠檬酸两种缓冲液的不同pH值条件下进行试验,结果表明,pH值为6.0的磷酸氢二钠-柠檬酸为缓冲液时效果最佳,分离色谱图表明洗脱液在280 nm处的紫外吸收值最大为496.32 mAU,蛋白峰面积最大为225.55;洗脱液经SDS-PAGE分析为单一条带;经HiTrap Capto Q柱分离纯化后,β-淀粉酶比活力提高至96 885 U/mg,纯化倍数为15.32,酶回收率为18.30%.由此可见在β-淀粉酶分离纯化过程中新层析技术结合此缓冲液效果更佳.研究对工业生产中运用此技术提高β-淀粉酶的纯度具有重大理论及实践意义.
参考文献:
[1]戴起伟,钮福祥,孙健,等.中国甘薯加工产业发展现状与趋势分析[J].农业展望,2016(4):39-43.
[2]GUO J,LIU L,LIANX,et al.The properties ofdifferentcultivars ofJinhaisweetpotato starches in China[J].International Journalof BiologicalMacromolecules,2014,67(6):1-6.
[3]戴起伟,钮福祥,孙健,等.中国甘薯产品消费结构与国内外市场贸易分析[J].农业展望,2016(1):72-77.
[4]木泰华,陈井旺.中国薯类加工现状与展望[J].中国农业科学,2016,49(9):1744-1745.
[5]NAKAMURA K,OHTO M A,YOSHIDA N,et al.Sucrose-induced accumulation of beta-amylase occurs concomitant with the accumulation ofstarch and sporamin in leaf-petiole cuttings ofsweetpotato[J].Plant Physiology,1991,96(3):902-909.
[6]贾彦杰,梁新红,朱文学,等.不同沉淀方法分离甘薯β-淀粉酶的研究[J].食品科学,2010,31(18):22-25.
[7]MIHAJLOVSKI K R,RADOVANOVIC N R,VELJOVIC T N,et al.Improvedβ-amylase production on molasses and sugar beet pulp by a novelstrain Paenibacillus chitinolyticus CKS1[J].IndustrialCrops&Products,2016,80:115-122.
[8]LIZOTTE P A,HENSON C A,DUKE S H.Purification and characterization of pea epicotylβ-amylase[J].Plant Physiology, 1990,92(3):615-621.
[9]YAMASAKIY.β-Amylase in germinating milletseeds[J].Phytochemistry,2003,64(5):935-939.
[10]KOLAWOLE A O,AJELE J O,SIRDESHMUKHA R.Purification and characterization of alkaline-stableβ-amylase in malted African finger millet(Eleusine coracana)seed[J].Process Biochemistry,2011,46(11):2178-2186.
[11]陆丽芳,隋礼丽.新型层析技术在人乳头瘤病毒L1蛋白病毒样颗粒快速纯化中的应用[J].中国生物制品学杂志, 2013,26(11):1682-1685.
[12]梁新红,王田林,孙俊良.两步超滤法分离甘薯β-淀粉酶[J].食品科学,2015,36(21):180-184.
[13]马永强,韩春然,方蕾.玉米萌发过程中淀粉酶性质的研究[J].食品科学,2007,28(11):294-297.
[14]SAGUS T,NSO E J,HOMANN T.Extraction and purification of beta-amylase from stems of Abrus precatorius by three phase partitioning[J].Food Chemistry,2015,183:144-153.
[15]LOWRY O,ROSEBROUGH N,FARR L.Protein measurement with folin phenol reagent[J].Journal of Biological Chemistry, 1951,193(1):265-275.
(责任编辑:邓天福)
Purification ofβ-amylase from sweet potato using ion-exchange chromatography technique
ZHANG Wanli,LIANG Xinhong,SUN Junliang,RAN Junjian,MO Haizhen
(Schoolof Food Science,Henan Institute of Science and Technology,Xinxiang 453003,China)
Ion-exchange chromatography technique to separateβ-amylase from sweet potato was investigated.Sweet potatoβ-amylase were purified with a novel chromatographic technique based on the principles of anion exchange resin Capto Q with high resolution.The samples purified were identified by SDS-PAGE.The results showed that the best effect at sodium phosphate dibasic-citric acid buffer pH 6.0,and the separating chromatogram showed that the maximum ultraviolet absorption value was 496.32 mAU,the maximum peak area of protein was 225.55.The high purityβ-amylase was also reflected in the single band obtained on SDS-PAGE.Under these conditions,the specific activities of was 96 885 U/mg,purification(fold)was 15.32,and yield was 18.30%.HiTrap Capto Q may be used for purificationβ-amylase from sweet potato,which was simple,rapid,easy to be scaled-up and suitable for large-scale production.The research has the important significance in theory and practice on high efficiently separatingβamylase from sweet potato.
ion-exchange chromatography technique;purification;sweet potato;β-amylase
TS209,TQ925+.1
A
1008-7516(2017)02-0023-06
10.3969/j.issn.1008-7516.2017.02.006
2016-12-16
河南省科技计划项目(142102110127);河南省教育厅自然科学研究资助计划项目(14A550010);河南省高校科技创新团队支持计划项目(16IRTSTHN007)
张万利(1990―),男,河南兰考人,硕士研究生.主要从事食品生物技术研究.
梁新红(1971―),女,河南新乡人,博士,副教授.主要从事食品生物技术研究.
