草螺菌Herbaspirillum sp.WT00F的生理生化性质和促生作用研究
2017-05-11刘伟林占桂婷王婷程伟尤恒李珂徐萧丁坤明饶辉福张君岱程长松李亚东李洋吴文华王行国
刘伟林, 占桂婷,王婷, 程伟,尤恒,李珂,徐萧,丁坤明饶辉福,张君岱,程长松,李亚东,李洋,吴文华,王行国
(1.湖北大学生命科学学院,湖北 武汉 430062;2.湖北咸宁市农业科学院,湖北 咸宁437100)
草螺菌Herbaspirillumsp.WT00F的生理生化性质和促生作用研究
刘伟林1, 占桂婷1,王婷1, 程伟1,尤恒1,李珂1,徐萧1,丁坤明2饶辉福2,张君岱2,程长松2,李亚东1,李洋1,吴文华1,王行国1
(1.湖北大学生命科学学院,湖北 武汉 430062;2.湖北咸宁市农业科学院,湖北 咸宁437100)

0 引言
草螺菌(Herbaspirillumsp.)是新近才发现的一类嗜用有机酸、耐性强、微需氧、略呈弯曲的革兰式阴性非发酵杆菌,可在高糖培养基上生长但不利用蔗糖的新细菌类群,隶属于β-变形菌纲(β-Proteobacteria)草酸杆菌科(Oxalobacteraceae) 草螺菌属(Herbaspirillum).织片草螺菌(Herbaspirillumseropedicae)是草螺菌属的代表菌株.一些草螺菌具有固氮能力,常见于禾谷类植物和双子叶植物(如玉米、小麦、甘蔗、高粱、香蕉和菠萝)中[1-3].另一些从火山灰或水体分离出的草螺菌则不能固氮,其中从污泥中分离出的荧蒽降解菌H.chlorophenolicum还具有高效降解氯酚的能力[4].由于多数植物草螺菌具有固氮或产生植物激素的功能并具有使宿主植物增产的潜能,因此逐渐受到国内外科研工作者的重视. Baldani等[5]发现,接种织片草螺菌(H.seropedicae) 的植株,根部发育明显加快. Rothballer等[6]也发现佛莱辛草螺菌(H.frisingense)具有类似的功效.目前织片草螺菌已应用于农作物的田间试验研究,接种织片草螺菌能使高粱和水稻增加产量[7].本实验室从茶树组织中分离出两株内生草螺菌,经16S rRNA基因序列和生化鉴定为草螺菌并命名为Herbaspirillumsp.WT00C 和WT00F[8].
与草螺菌WT00C一样,草螺菌WT00F也产生植物激素吲哚乙酸(IAA)、NH4+和嗜铁载体[8].在体外培养条件下,IAA 含量可达(24.9±1.5) mg /L[8].将pUC18质粒导入内生草螺菌后接种不同的农作物,发现内生草螺菌仅在茶树内定殖,不能在水稻、小麦、油菜、白菜内定殖;其感染方式为创口入侵,浇灌和喷洒都不能感染受试植物;注射接种后也未见任何受试植物产生病理症状[9].茶树扦插实验显示草螺菌WT00C具有明显的促生作用,不仅诱导扦插枝下部的不定根形成而且促进上端新生芽的生长[9].本文中报道了草螺菌WT00F的生理生化特性以及它对茶树生长发育的影响.虽然它在生理生化性质方面与草螺菌WT00C不完全相同,但草螺菌WT00F同样对茶树扦插杆生根和对荼树新芽生长发育具有明显的促生作用,有望作为一种新型的绿色生物促生剂应用于茶树栽培以提高茶叶产量和减少化肥的使用.
1 材料与方法

1.2 细菌生长温度、pH和盐耐受性测定
1.2.1 细菌生长温度测定 将10 μL活化的细菌接入10 mL NB液体培养基中,置不同温度(4、20、25、30、34、37、40 ℃)条件下培养.培养16 h后,在分光光度计上测定细菌的OD600值.

1.2.3 盐耐受性测定 将10 μL活化的细菌接入10 mL含不同浓度NaCl的NB培养基中培养.NaCl终浓度分别为0、0.5、1、1.5、2、2.5、3%. 34 ℃培养16 h后,测定细菌的OD600值.





按照文献[14]报道的方法,使用API ZYM系统试剂条(bioMérieux)测定19种酶的活性.首先在LB固体培养基中进行划线接种,37 ℃ 培养48 h.挑单菌落并接种5 mL LB液体培养基,37 ℃、160 r/min培养20 h.取1 mL 菌液,用灭菌的H2O稀释至OD550为0.5.依照生产厂家的说明,在API ZYM 条孔内放入65 μL细菌稀释液,盖上盖子,37 ℃培养箱内培养20 h.然后分别加入33 μL ZYM A(三羟甲基-氨基-甲烷25 g,37% 盐酸11 mL,月桂硫酸盐10 g,加水至100 mL)和ZYMB(固兰BB盐0.12 g,甲醇40 mL,DMSO 60 mL) 试剂. 5 min后将试验条置于 1 000瓦灯泡下 10 s,观察结果.
1.6 茶树扦插杆的选择与草螺菌WT00F处理
1.6.1 草螺菌WT00F的培养 按1∶100比率将34 ℃活化过夜的草螺菌WT00F菌液接入500 mL LB液体培养基(含5 μg/mL壮观霉素),37 ℃摇床(200 rpm)培养至OD600=1.2时备用.

1.6.3 茶树扦插杆浸泡处理 按1水∶2细菌培养物的比例稀释,制备草螺菌WT00F工作液.将扦插茶杆垂直放入工作液中浸泡1、2、3 h,每个处理组50株.对照组则用清水作相同的处理.

1.6.5 扦插苗草螺菌WT00F的检测 扦插160 d后,拔出扦插苗.按照根、扦插杆、新茎、新叶4部位取材.按照文献[8-9]描述的方法消毒根、茎、叶,消毒后的根、叶于5 mL无菌PBS中研磨,研磨液涂布在含5 μg/mL 壮观霉素、的LB固体平板上;茎则切成1 cm厚的小圆片并直接放在相同的培养基平板上.37 ℃培养48 h后观察菌落生长情况.所有操作都在无菌条件下进行.如有菌落长出,则挑出菌落并接种至含有5 μg/mL壮观霉素的LB液体培养基,然后按文献[8-9]描述的方法检测IAA含量,加以验证.
1.7 茶树修剪与草螺菌WT00F处理
1.7.1 大田茶树枝的修剪与细菌制剂喷洒 选用咸宁崇阳有机茶种植园5年生鄂茶一号作为实验材料.待春茶采收完后用电动切割机修剪,剪掉茶树枝条顶端部分,用喷雾器立即喷酒草螺菌WT00F工作液.实验分5组, 即清水对照组、1∶2(v/v)配比实验组、1∶1(v/v)配比实验组、2∶1(v/v)配比实验组、肽肥阳性对照组.每组茶地面积为 48 m2(48 m×1 m).草螺菌WT00F制剂按上述1.5节描述的方法制备,喷洒工作液按细菌制剂∶水来配制.每组实际喷洒量为63 mL/m2,对照组仅喷洒清水,阳性对照组则在茶树根部地面施用42 g/m2肽肥(水解蛋白粉剂).
1.7.2 促生效果检测 修剪喷洒后,让茶树生长60 d,用剪刀从每个枝条修剪处取出新长的幼枝,每个处理组选取6个不同的区域,每一区域取100枝,共600枝.放入保鲜袋并称重,同时测量新生幼枝的长度.收集数据并进行统计学分析.
2 结果与分析
2.1 草螺菌WT00F的生理生化特性 使用22种糖醇类、21种有机酸类和13种氨基酸作为唯一碳源,在碳源利用培养基中逐一检测内生草螺菌WT00F的生长情况.结果显示,草螺菌WT00F能利用16种糖醇类、17种有机酸类和5种氨基酸作为碳源,并能利用14种糖醇类物质产酸(见表1).这些结果说明草螺菌WT00F能广泛利用多种糖醇类和有机酸类物质作为细菌生长所需的碳源.草螺菌WT00F能利用21种有机酸类物质中的17种,说明该细菌与其他草螺菌属的细菌一样嗜用有机酸.
细菌酶活检测结果显示,草螺菌WT00F拥有β-半乳糖苷酶、色氨酸脱氨酶、氧化酶、脲酶、硝酸盐还原酶、碱性磷酸酶、酸性磷酸酶、脂酶(C4)、类脂脂酶(C8)、酚-AS-BI-磷酸水解酶、亮氨酸芳胺酶的活性(见表2).API ZYM试剂条可同时检测19种酶,草螺菌WT00F仅显示β-半乳糖苷酶、碱性磷酸酶、酸性磷酸酶、脂酶(C4)、类脂脂酶(C8)、酚-AS-BI-磷酸水解酶和亮氨酸芳胺酶活性(见图1),其中碱性磷酸酶、酸性磷酸酶和酚-AS-BI-磷酸水解酶活性较高,类脂脂酶(C8)和亮氨酸芳胺酶活性则较弱.这些实验结果不仅可用来了解草螺菌WT00F的生物学特性而且可用来作为菌种鉴定的指标.
抗生素敏感性测定显示,草螺菌WT00F对链霉素、氨苄青霉素、氯霉素、四环素、卡那霉素、庆大霉素、利福平敏感,仅对壮观霉素有微弱的抗性.大于5 μg/mL壮观霉素对内生草螺菌WT00F的生长有严重的抑制作用.草螺菌WT00F对多种抗生素敏感暗示它缺乏与其他环境微生物竞争的能力,即在其他环境微生物存在的条件下,草螺菌WT00F在土壤环境中生存困难.

表1 草螺菌WT00F的碳源利用特性

±:生长微弱;+:生长或产酸;++:生长迅速或产酸能力强
-:阴性;±:微弱阳性;+:阳性

图1 API ZYM试剂条检测草螺菌WT00F酶活的结果
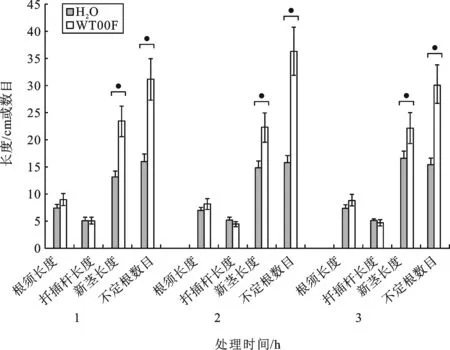
图2 草螺菌WT00F促进扦插苗生根和生长的结果(来自内生草螺菌WT00F浸泡扦插160 d的数据)

图3 草螺菌WT00F浸泡扦插280 d后的扦插苗(a) 浸泡1 h;(b) 浸泡2 h;(c) 浸泡3 h
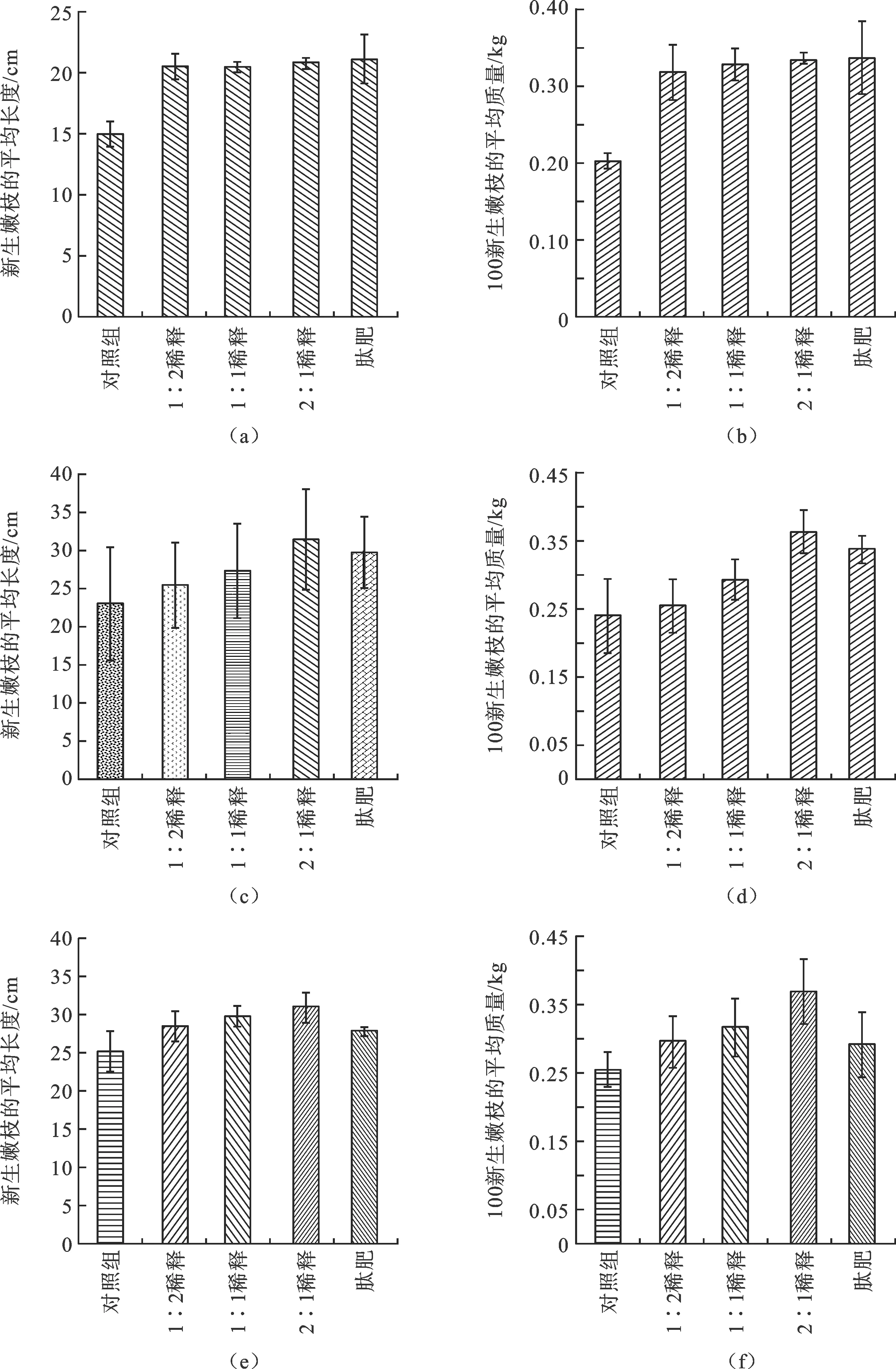
图4 草螺菌WT00F喷洒修剪茶树的实验结果(a)和(b)为第一次采样数据;(c)和(d)为第二次采样数据;(e)和(f)为第三次采样数据


使用上述内生草螺菌检测方法,检查扦插160 d后扦插苗的各部分是否含有内生草螺菌WT00F.在10株随机挑选的扦插苗中,所有扦插杆内含有草螺菌WT00F,而根、新茎和新叶部位未发现内生草螺菌WT00F.这表明,通过浸泡过程,草螺菌WT00F确实进入到茶树扦插杆并能在扦插杆中定殖,且定殖的草螺菌WT00F不易有效地迁移至茶树苗的幼嫩部位.
2.4 草螺菌WT00F对大田茶树侧生新芽的促生效应 为了测试内生草螺菌WT00F是否可以通过茶树枝条顶端创口进入茶枝内部,用剪刀剪去盆栽1年生茶树顶端部分,再用滴管滴一滴1∶1稀释的细菌培养液,一周后检测修剪枝内是否含有草螺菌WT00F.结果在测试的茶树修剪枝上部2 cm 处都含有内生草螺菌,说明草螺菌WT00F是可以通过茶树枝条顶端创口进入并定殖于茶枝.
为了进一步测试草螺菌WT00F是否对茶树侧生新芽的生长具有促生作用,分别使用不同比例稀释的细菌培养物喷洒机械修剪后的大田茶树,60 d后采样收集数据.采样时,每组分6区采集新长出的幼嫩茶枝,每区100株,称湿重和测量长度,共计600株.统计分析显示每组6个区采集的样本质量和长度之间无显著性差异(P>0.05).图4a、b的结果表明,不同比例稀释的内生草螺菌WT00F喷洒的茶树修剪枝,长出的新生幼枝平均长度和100株平均质量均无显著性差异(P>0.05),与肽肥阳性对照组相近但均大于清水喷洒对照组(P>0.05).自喷洒细菌后茶地不再施用任何肥料,第二年春茶采收后进行机械修剪,60 d后进行第二次采样,每组采集新长出的幼嫩茶枝600株,称湿重并测量长度(见图4c、d).待夏茶采收后再次进行机械修剪,60 d后进行第三次采样,每组同样采集新长出的幼嫩茶枝600株,称湿重并测量长度(见图4e、f).统计分析显示第二次和第三次采样的结果相似,1∶2稀释喷洒组的新生幼枝平均长度和100株平均质量略大于清水喷洒对照组,但差异不显著(P>0.05);1∶1稀释喷洒组的新生幼枝平均长度和100株平均质量仍大于清水喷洒对照组,差异性显著(P<0.05);2∶1稀释喷洒组的新生幼枝平均长度和100株平均质量均大于清水喷洒对照组,差异极显著(P<0.01), 并优于肽肥阳性对照组.与第一次采样结果比较,第二次和第三采样中1∶2稀释喷洒组和1∶1稀释喷洒组新生幼枝平均长度和100株平均质量都呈下降趋势,尤其是1∶2稀释喷洒组下降明显,几乎接近清水对照组;唯有2∶1稀释喷洒组的新生幼枝平均长度和100株平均质量与第一次采样的结果相似,无显著性变化.可能原因有:1) 过量稀释后,喷洒到修剪枝顶端的细菌数较少,细菌在茶枝内有效定殖或细菌有效定殖的茶枝比例较小,导致细菌难以发挥持久的促生效应,以致于新生幼枝平均长度较短和100株平均质量下降.2) 体外培养时茶树内生草螺菌WT00F能有效分泌IAA和产NH4+,以至于喷洒液中有一定含量.因此,第一次采样的结果可能来自定殖的细菌、喷洒液中的IAA和NH4+的综合效应,而第二次和第三次采样的数据则真正反映定殖细菌的促生效应.在第三次采样的结果中,肽肥组的新生幼枝平均长度和100株平均质量与对组照组基本相同,但细菌实验组的数据仍优于对照组,说明此时肽肥的肥力已经耗尽,而细菌仍具有促生效应.2∶1稀释应是大田喷洒较含适的稀释比例,它能使茶树内生草螺菌WT00F有效定殖并发挥持久性的促生作用.
3 讨论
草螺菌WT00F能将多种糖醇类、有机酸类以及少数几种氨基酸作为碳源利用,其中许多糖醇类、有机酸类都是植物的代谢产物或代谢途径中的中间代谢物,暗示寄主与细菌之间的共生关系.与其他植物内生草螺菌如织片草螺菌(H.seropedicae)[1]、红苍白草螺菌(H.rubrisubalbicans)[16]、佛莱辛草螺菌(H.frisingense)[17]一样,嗜用有机酸类物质且不利用蔗糖.但是,与其他植物内生草螺菌不同,草螺菌WT00F无固氮酶活性.草螺菌WT00F的生理生化性质与另一株草螺菌WT00C[8-9]相似,不同之处主要有: 草螺菌WT00C有过氧化氢酶活性而草螺菌WT00F没有; 草螺菌WT00C对10 μg/mL氨苄青霉素表现抗性而草螺菌WT00F敏感;草螺菌WT00F能利用乳糖产酸而草螺菌WT00C则不能.虽然草螺菌WT00F和草螺菌WT00C的生理生化性质稍有不同,它们应是同一个种内的不同菌株.两者虽不能固氮但都能产生IAA、NH4+和嗜铁载体[8]、都具有促进植物生长发育的潜能.

[1] Baldani J I, Baldani V L D, Seldin L, et al. Characterization ofHerbaspirillumseropedicaegen.nov., sp. Nov., a root-associated nitrogen-fixing bacterium[J]. Int J Syst Bacteriol, 1986, 36(1):86-93.
[2] Magalhaes Cruz L, de Souza E M, Weber O B, et al. 16S ribosomal DNA characterization of nitrogen-fixing bacteria isolated from banana(Musaspp.)and pineapple(Ananascomosus(L.)Merril)[J].Appl Environ Microbiol,2001,67(5):2375-2379.[3] Olivares F L, Baldani V L D, Reis V M, et al. Occurrence of endophytic diazotrophsHerbaspirillumspp. in roots, stems and leaves predominantly of Gramineae[J]. Biol Fert Soils, 1996, 21(1): 197-200.
[4] Ding L, Yokota A. Proposals ofCurvibactergracilisgen.nov.,sp.Nov. andHerbaspirillumputeisp.nov.for bacterial strains isolated from well water and reclassification ofPseudomonashuttiensis,Pseudomonaslanceolata,AquaspirillumdelicatumandAquaspirillumautotrophicumasHerbaspirillumhuttiensecomb.Nov.,Curvibacterlanceolatuscomb.Nov.,Curvibacterdelicatuscomb.nov. andHerbaspirillumautotrophicumcomb.Nov.[J]. Int J Syst Evol Microbiol,2004,54(6): 2223-2230.
[5] Baldani J I, Baldani V L. History on the biological nitrogen fixation research in graminaceous plants: special emphasis on the Brazilian experience[J]. Anais da Academia Brasileira de Ciencias, 2005, 77(3): 549-579.
[6] Rothballer M, Eckert B, Schmid M, et al. Endophytic root colonization of gramineous plants byHerbaspirillumFrisingense. FEMS Microbiology Ecology, 2008, 66(1):85-95.
[7] James E K, Olivares F L, Baldani J I, et al.Herbaspirillum, an endophytic diazotroph colonizing vascular tissue ofSorghumbicolorL[J]. Moench J Exp Bot, 1997, 48(1):785-798.
[8] 王婷,杨升,陈亚雪,等. 两株内生草螺菌的微生物学特性[J].微生物学报, 2014, 54(4): 424-432.
[9] Zhan G, Cheng W, Liu W, et al. Infection, colonization and growth-promoting effects of tea plant(CamelliasinensisL.) by the endophytic bacteriumHerbaspirillumsp. WT00C[J]. Afr J Agric Res, 2016, 11(3):130-138.
[10] 美国食品与药品管理局.细菌学分析手册[M].甄宏太,俞平,译.北京:轻工业出版社,1986.
[11] 刘国生.微生物学实验技术[M]. 北京:科学出版社, 2007.
[12] Dbereiner J, Day J M.Associative symbioses and nitrogen-fixing sites[C]// Newton W E, Nyman C J. International Symposium on Nitrogen fixation Washington. Washington State University, 1975: 518-538.
[13] 李倍金, 罗明, 周俊, 等. 几种禾草内生固氮菌的分离及固氮活性测定[J].草业学报, 2008, 17(1)37-42.
[14] Humble M W, King A, Phillips I. API ZYM: a simple rapid system for the detection of bacterial enzymes[J]. J Clin Path, 1977,30: 275-277.
[15] Glick B R. Plant growth-promoting bacteria: mechanisms and applications[J]. Scientifica, 2012, 2012: 1-15.
[16] Baldani J I,Pot B,Kirchhof G, et al. Emended description ofHerbaspirillum; inclusion of [Pseudomonas]rubrisubalbicans, a mild plant pathogen, asHerbaspirillumrubrisubalbicanscomb. nov.; and classification of a group of clinical isolates(EF Group 1) asHerbaspirillumspecies 3[J]. Int J Syst Bacteriol, 1996, 46(3): 802-810.
[17] Kirchhof G,Eckert B,Stoffels M,et al.Herbaspirillumfrisingensesp.nov., a new nitrogen-fixing bacterial species that occurs in C4-fibre plants[J]. Int J Syst Bacteriol, 2001, 51:157-168.
(责任编辑 游俊)
Physiochemical properties and growth-promoting effects ofHerbaspirillumsp.WT00F
LIU Weilin1, ZHAN Guiting1, WANG Ting1, CHENG Wei1, YOU Heng1, LI Ke1XU Xiao1, DING Kunming2, RAO Huifu2, ZHANG Jundai2, CHENG Changsong2LI Yadong1, LI Yang1, WU Wenhua1, WANG Xingguo1
(1. College of Life Sciences, Hubei University, Wuhan 430062,China;2.Xianning Academy of Agricultural Science, Xianning 437100,China)
Herbaspirillumsp.WT00F was an endophytic bacterium isolated fromCamelliasinensisL.It used 16 glycitols, 17 organic acids and 5 amino acids as sole carbon source among 22 glycitols, 21 organic acids and 13 amino acids tested, and also utilized 14 glycitols to produce acid. Moreover, this bacterium displayed activities of 11 enzymes in the tested 33 enzymes. The bacterium grew well at pH 5.0—8.0 or when the final concentration of NaCl was≤1%. The bacterium was able to grow at wide range of temperature(20—40 ℃) with the optimal temperatures of 34—37 ℃.Herbaspirillumsp.WT00F was sensitive to all 8 antibiotics tested, only showed very weak resistance to spectinomycin(≤5 μg/mL). Although this bacterium did not show nitrogen-fixing activity, tea cuttings soaked or the pruned tea twigs sprayed with the bacterial culture demonstrated thatHerbaspirillumsp.WT00F not only induced the rooting of tea cuttages,but also stimulated the growth and development of newborn lateral buds.Whatever soaking or spraying method was applied, tea plats inoculated withHerbaspirillumsp.WT00F grew vigorously without any disease symptom. Our studies suggested thatHerbaspirillumsp.WT00F could be used as a novel green-bioaccelerator for both tea-cuttage propagation and tea-plant cultivation in tea farms.Key words:Herbaspirillum; physiochemical properties; asexual propagation of tea plant; bioaccelerator
2016-10-28
湖北省自然科学基金重点项目(2015CFA089)资助
刘伟林(1990-),男, 硕士生;王行国,通信作者,教授,博士生导师, E-mail: xgwang@hubu.edu.cn
1000-2375(2017)03-0291-08
Q93-332
A
10.3969/j.issn.1000-2375.2017.03.014
