茶多酚对过氧化氢损伤PC12细胞抗氧化酶系统的影响
2017-05-11邓凤君肖凌杨吟宇文向华
邓凤君+肖凌+杨吟宇+文向华

[摘要] 目的 研究茶多酚(TP)对过氧化氢(H2O2)损伤大鼠嗜铬细胞瘤PC12细胞抗氧化酶系统的影响。 方法 PC12细胞用TP及H2O2处理(TP终浓度5、10、20 μmol/L,H2O2终浓度500 μmol/L),以噻唑蓝(MTT)法观察细胞活力,试剂盒测定细胞内抗氧化酶系统超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)的水平。 结果 500 μmol/L H2O2作用PC12细胞2 h,细胞出现明显损伤,细胞活力下降(P < 0.01);细胞破碎后上清液中SOD、GSH-Px的活性下降,MDA的水平增高(P < 0.01或P < 0.05);5、10、20 μmol/L TP预处理可降低受损PC12细胞MDA的水平,增加SOD、GSH-Px的活性(P < 0.01)。 结论 TP能提高受损PC12细胞抗氧化酶系统的作用。
[关键词] 茶多酚;PC12细胞;过氧化氢;抗氧化酶系统
[中图分类号] R421 [文献标识码] A [文章编号] 1673-7210(2017)03(a)-0020-04
Effects of tea polyphenols on antioxidant enzyme system in PC12 cells damaged by hydrogen peroxide
DENG Fengjun1 XIAO Ling1 YANG Yinyu1 WEN Xianghua2
1.Department of Pharmacy, Yiyang Medical College, Hu'nan Province, Yiyang 413000, China; 2.General Office, Stomatological Hospital Affiliated to Yiyang Medical College, Hu'nan Province, Yiyang 413000, China
[Abstract] Objective To explore the effects of tea polyphenols (TP) on antioxidase system in pheochromocytoma PC12 cells of rats damaged by hydrogen peroxide (H2O2). Methods PC12 cells was treated with TP and H2O2 (the final concentration of TP was 5, 10, 20 μmol/L, the final concentration of H2O2 was 500 μmol/L). The cell viability was detected by methyl thiazolyl tetrazolium (MTT) assay. The activity of antioxidase system superoxide dismutase (SOD), malondialdehyde (MDA) and glutathion peroxidase (GSH-Px) in PC12 cells was measured by the kits. Results PC12 cells were treated with 500 μmol/L H2O2 for 2 h, which were damaged obviously and the celluar viability was decreased (P < 0.01); besides, after disruption of cells, the activity of supernatant GSH-Px and SOD was reduced, and the MDA was increased (P < 0.01 or P < 0.05); while 5, 10, 20 μmol/L of TP pretreatment could decrease the level of MDA and improve the activity of SOD and GSH-Px in the PC12 cells (P < 0.01). Conclusion TP can enhance the activity of antioxidase system in induced-injury PC12 cells.
[Key words] Tea polyphenols; PC12 cells; H2O2; Antioxidase system
茶多酚(TP)為绿茶的主要活性成分,有显著的抗氧化作用,作用于与自由基有关的酶,抑制氧化酶系,如抑制氧化酶黄嘌呤氧化酶系(XO)、细胞色素P2450环氧酶等,同时TP通过直接作用于自由基,再生或保护体内高效抗氧化剂、络合诱导氧化的过渡金属离子,能高效清除自由基,产生显著的抗氧化、抗炎等作用[1-3]。本研究用PC12细胞株作为体外实验的神经细胞,H2O2为诱导损伤剂,造成受损神经细胞体外损伤模型,从TP对抗氧化酶系统的影响等方面研究了TP对神经细胞体外损伤模型的作用。通过本研究,希望为TP用于神经组织损伤性疾病提供切实可信的实验依据。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 高糖DMEM培养基(GIBCO公司,USA),噻唑蓝(MTT,Sigma-Aldrich,USA),二甲基亚砜(DMSO,UNI-CHEM公司),胎牛血清(FBS,杭州四季青生物公司);TP(98%,江西绿康公司),过氧化氢(H2O2,汕头光华化学厂),丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成)。752型紫外分光光度计(上海第二分析仪器厂),酶标仪(Model 680,Bio-RAD,USA),超声波清洗器(中国华南超声波设备厂),离心机(TGL-16aR,上海安亭科学仪器厂),倒置相差显微镜(XDS-1B,Olympus,日本)。PC12细胞购自中国科学上海细胞生物学研究所细胞库,源于大鼠肾上腺嗜铬细胞。
1.1.2 实验溶液配制 TP:精确称取适量,用无血清的DMEM溶解成一定浓度的母液,过滤除菌,用无血清的DMEM稀释成终浓度为5、10、20 μmol/L的三种浓度,现用现配。H2O2:量取适量后过滤除菌,4℃避光贮存,用前用无血清的DMEM配置成所需浓度。
1.2 方法
1.2.1 细胞培养与处理 PC12细胞2×105/mL孵育在50 mL培养瓶中,DMEM高糖培养基(含100 μg/mL链霉素、100 U/mL青霉素、10%胎牛血清),置37℃、5%CO2恒温培养箱内常规孵育,每24小时换培养液1次,每48小时约80%满瓶时传代[4-6]。取对数生长期PC12细胞,以每孔2×105/mL分别接种在96孔板(MTT实验)或6孔板中(SOD、MDA、GSH-Px测定实验),于37℃、5%CO2培养箱中进行培养,24 h内细胞达到80%~90%融合后,用DMEM孵育细胞24 h(含体积分数0.01% FBS),同步化细胞。TP(终浓度分别为5、10、20 μmol/L)预孵育细胞1 h,再加入H2O2(终浓度500 μmol/L)共同培养2 h。
1.2.2 建立损伤PC12细胞模型 用MTT实验确立PC12细胞损伤模型[7]。取对数生长期细胞,接种在96孔板(每孔2×105/mL),如上“1.2.1细胞培养和处理”所述接种孵育与同步化。空白对照组加入等量的培养液使H2O2终浓度为0 μmol/L,其余各组分别加入H2O2(终浓度为100~600 μmol/L)孵育2 h,所有组别均设6个平行孔。弃培养液,加终浓度1 g/L MTT 液,培养4 h,弃上清,每孔加DMSO 150 μL,平板震荡仪轻微震荡5 min,用酶标仪在570 nm处测定吸光度值。细胞存活率按公式计算:细胞存活率=A570 nm(处理组)/A570 nm(对照组)×100%。
1.2.3 测定受损PC12细胞SOD水平 取对数生长期细胞,接种在6孔板上(每孔2×105/mL),如上“1.2.1”所述接种孵育与同步化。分为5组,空白对照组(加等量的培养液)、H2O2组(即模型组,仅加终浓度500 μmol/L H2O2)以及3种不同浓度的TP组(加入TP使终浓度为5、10、20 μmol/L,预孵育1 h,再加终浓度500 μmol/L H2O2共同孵育2 h),5组各设3个平行孔。弃培养液,0.125%胰蛋白酶使细胞脱壁,每孔细胞数为(1~5)×106,1500 r/min(离心力151×g,离心半径6 cm),离心5 min,收集细胞至0.5 mL裂解缓冲液(0.1 mol/L PBS中含0.5% Triton X-100,pH 7.0),用超声粉碎仪破碎细胞,直到显微镜下观察大部分细胞已破碎,1200 r/min(离心力97×g,离心半径6 cm)4℃离心20 min,取细胞破碎后上清,按照试剂盒说明进行测试。
1.2.4 测定受损PC12细胞MDA水平 按照“1.2.3”法收集细胞破碎后的上清液,根据试剂盒说明进行测试。
1.2.5 受损PC12细胞GSH-Px活性的测定 按照“1.2.3”法收集细胞破碎后的上清液,根据试剂盒说明进行测试。
1.3 统计学方法
统计处理采用SPSS 16.0软件完成,计量资料数据以均数±标准差(x±s)表示,数据分析采用One-way ANOVA分析,各组之间多重比较采用LSD或Dunnett多重比较法,采用LSD多重比较法分析SOD和MDA实验结果,Dunnett T3多重比较法分析GSH-Px实验结果。以P < 0.05为差异有统计学意义。
2 结果
2.1 H2O2对PC12细胞活力的影响
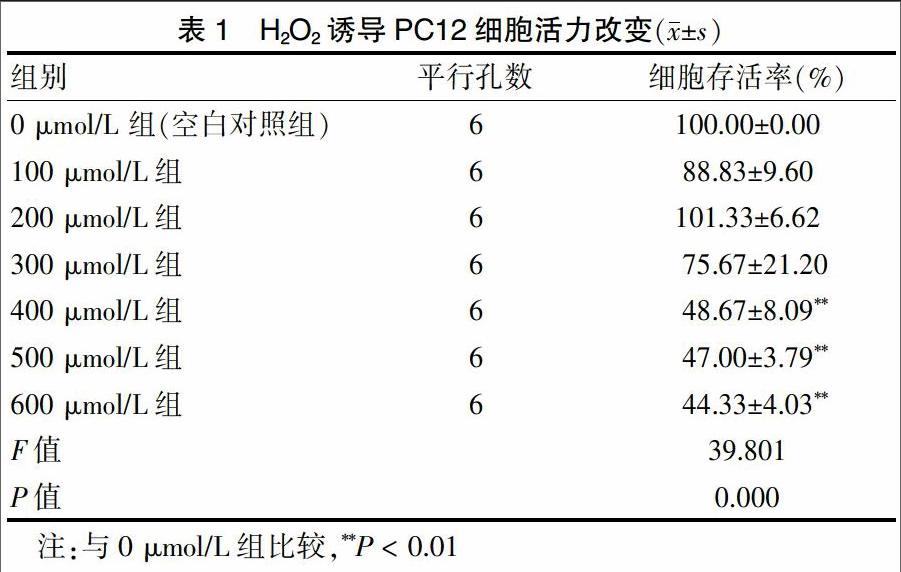
空白对照组(即0 μmol/L组)细胞形态完整体积饱满,而损伤组细胞间隙增大,体积明显缩小,表面变光滑,突起消失,出現不同程度损伤,损伤程度以600 μmol/L最严重,见图1。数据分析也显示,PC12细胞被H2O2孵育2 h,细胞活力下降,与空白对照组比较,100~300 μmol/L剂量H2O2能降低细胞活力,但是差异无统计学意义(P > 0.05),400~600 μmol/L剂量H2O2能降低细胞活力,差异有高度统计学意义(P < 0.01),见表1。本研究采用了500 μmol/L剂量作为诱导PC12细胞损伤剂量。
2.2 TP对抗氧化酶系统的影响
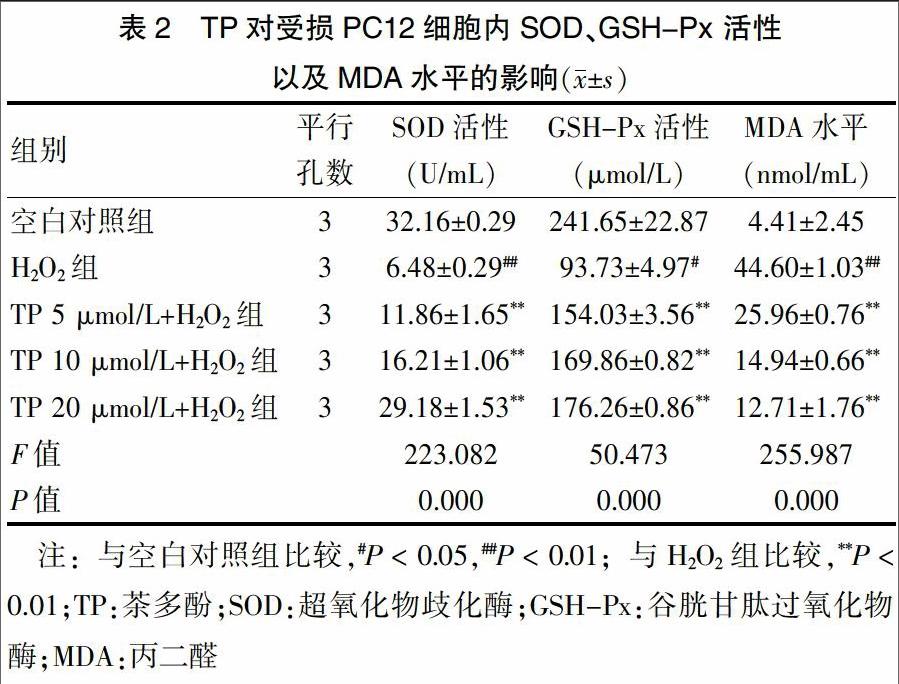
H2O2损伤PC12细胞后,显著抑制了细胞的SOD、GSH-Px活性,升高了MDA水平,H2O2组与空白对照组比较差异有统计学意义(P < 0.01或P < 0.05)。TP预孵育1 h,TP三个浓度组细胞内SOD、GSH-Px活性上升,MDA水平下降,与H2O2组比较差异有高度统计学意义(P < 0.01),见表2。说明TP能显著提高受损细胞内抗氧化酶SOD、GSH-Px水平,有效拮抗H2O2导致的受损细胞内抗氧化酶系统水平的降低。
3 讨论
茶作为药用已有千年历史,其药用价值已经得到全世界广泛认同。目前已经开发出了具有药用价值的牙膏与洗发水等产品。茶中具有药用价值的活性成分主要是TP。它是新型高效天然的抗氧化剂,能有效清除体内自由基,具有护肤、护发、防癌、提高免疫力、抗衰老、降血脂等一系列优异功能[8]。尤其因其具有显著抗氧化作用,TP拮抗氧自由基介导的疾病是目前医学研究的活跃领域,而且TP能透过血脑屏障,缓解脂质过氧化状态[9],因此我们假定它也许是治疗神经细胞损伤的备选药物。
本研究采用500 μmol/L H2O2作为外源性活性氧族(ROS)造成PC12细胞损伤,通过预孵TP,探索TP对细胞内抗氧化酶系统的影响。PC12细胞是大鼠肾上腺髓质嗜铬细胞瘤克隆化的细胞株,普遍被用来研究多种神经系统疾病,如阿尔茨海默病、帕金森病等[10-12]。H2O2能够穿透并且损伤生物膜、线粒体,亦是最主要、最稳定的ROS家族成员,因而H2O2常常作为毒性物质来模拟氧化应激体外模型[13-16]。因而,本研究通过PC12细胞被H2O2诱导损伤,造成神经损伤体外模型,来评价TP对受损神经细胞抗氧化酶系统的影响。
正常组织在氧化代谢过程中会有少量的自由基产生,同时细胞内存在一系列有效的抗氧化防御系统,用以减少自由基在有氧代谢过程中对细胞的损害,维持氧自由基的代谢平衡,其中包括清除ROS的SOD、GSH-Px等[17-18]。机体清除氧自由基能力愈强,SOD与GSH-Px活性愈高,而MDA为自由基作用于膜脂质发生过氧化反应的最终产物,具有细胞毒性,其水平反映了细胞受自由基攻击的严重程度[19]。本研究发现,H2O2孵育PC12细胞2 h,能降低细胞内SOD、GSH-Px活性,升高MDA水平。而给予TP处理后,受损细胞内SOD、GSH-Px活性升高,MDA水平下降。此结果说明TP能提高受损PC12细胞内抗氧化酶系统的作用。
综上所述,通过对受损P12细胞氧化酶系统影响的实验,显示TP能提高受损P12细胞内抗氧化酶系统活性,结合本课题的其他研究结果[20],揭示TP对受损神经细胞有一定的保护作用,其可能的机制之一是TP能提高受损PC12细胞内的抗氧化酶系统活性。但TP抑制H2O2诱导PC12细胞损伤的分子信号等机制尚需进一步的研究。
[参考文献]
[1] 严斌,余非,王立胜,等.茶多酚对大鼠骨关节软骨氧化损伤的保护作用[J].中国医药导报,2015,12(2):16-19.
[2] Tao J,Shen XH,Ai YH,et al. Tea polyphenols protect against ischemia/reperfusion-induced liver injury in mice through anti-oxidative and anti-apoptotic properties [J]. Exp Ther Med,2016,12(5):3433-3439.
[3] Kulandaivelu K,Mandal AK. Positive regulation of biochemical parameters by tea polyphenol encapsulated solid lipid nanoparticles at in vitro and in vivo conditions [J]. IET Nanobiotechnol,2016,10(6):419-424.
[4] 何潆,何嘉娜,付俊,等.β-细辛醚对Aβ1-42诱导星形胶质细胞活化所致PC12细胞损伤的保护作用研究[J].中国中药杂志,2016,41(7):1282-1288.
[5] 窦梦云,何淑芳,黄成,等.慢病毒介导的NGF基因沉默对PC12细胞分化的影响[J].中国药理学通报,2016,32(8):1153-1158.
[6] 刘金城,庄文欣,李锋杰,等.香椿子多酚提取物对6-OHDA诱导的PC12细胞损伤的保护作用[J].神经解剖学杂志,2016,32(1):31-36.
[7] Guo X,Chen Y,Liu Q,Wu J,et al. Ac-cel,a novel antioxidant,protects against hydrogen peroxide-induced injury in PC12 cells via attenuation of mitochondrial dysfunction [J]. J Mol Neurosci,2013,50(3):453-461.
[8] Deng FJ,Li RB,Ying YB,et al. Neuroprotective effect of epigallocatechin-3-gallate on spialcord injury:in vivo and in vitro Studies [J]. Neural Regen Res,2011,6(6):405-411.
[9] 邱燕祥.茶多酚对家兔血脂影响的观察研究[J].中国医药导报,2013,10(11):14-15.
[10] Silva JP,Gomes AC,Coutinho OP. Oxidative DNA damage protection and repair by polyphenolic compounds in PC12 cells [J]. Eur J Pharmacol,2008,601(1/2/3):50-60.
[11] Ravichandran A,Low BC. SmgGDS antagonizes BPGAP1-induced Ras/ERK activation and neuritogenesis in PC12 cell differentiation [J]. Mol Biol Cell,2013,24(2):145-156.
[12] Guo DJ,Li F,Yu PH,et al. Neuroprotective effects of luteolin against apoptosis induced by 6-hydroxydopamine on rat pheochromocytoma PC12 cells [J]. Pharm Biol,2013,51(2):190-196.
[13] Manasa K,Vani R. In Vitro Susceptibility of Wistar Rat Platelets to Hydrogen Peroxide and AAPH-Induced Oxidative Stress [J]. Indian J Hematol Blood Transfu,2015, 31(1):90-97.
[14] Jia M,Di W,Liu Y,et al. ROS-induced oxidative stress in nobile-type dendrobium protocorm-like bodies(PLBS)during vitrification [J]. Cryo Letters,2016,37(4):253-263.
[15] Valko M,Leibfritz D,Moncol J,et al. Free radicals and antioxidants in normal physiological functions and human disease [J]. Int J Biochem Cell Biol,2007,39(1):44-84.
[16] 張瑾,张建华,赵欣媛.山奈酚联合环孢素A抑制人滋养细胞氧化应激损伤的研究[J].中国医药导报,2016, 13(7):24-27.
[17] Nishikawa H,Kitani S. Tea catechins have dual effect on mast cell degranulation induced by compound 48/80 [J]. Int Immunopharmacol,2008,8(9):1207-1215.
[18] Kim J,Mizokami A,Shin M,et al. SOD3 acts as a tumor suppressor in PC-3 prostate cancer cells via hydrogen peroxideaccumulation [J]. Anticancer Res,2014,34(6):2821-2831.
[19] Pei J,Guo S,Zhang C,et al. Effects of tea polyphenols on the activity of GSH-Px and NOS,and the content of MDA and NO in rats fed with high methionine diet [J]. Wei Sheng Yan Jiu,2011,40(6):750-752.
[20] 邓凤君,徐江平,杨迎暴,等.茶多酚对H2O2诱导PC12细胞损伤的保护作用[J].中草药,2010,41(6):945-949.
