紫背天葵(Begonia fimbristipula Hance)回归植株存活及叶片生物学特性研究
2017-05-10汪越易慧琳邵玲陈雄伟陈刚王俊刘楠王少平任海
汪越, 易慧琳,2, 邵玲, 陈雄伟, 陈刚, 王俊, 刘楠, 王少平, 任海*
紫背天葵(Hance)回归植株存活及叶片生物学特性研究
汪越1, 易慧琳1,2, 邵玲3, 陈雄伟3, 陈刚3, 王俊1, 刘楠1, 王少平1, 任海1*
1. 华南植物园, 广州 510650 2. 仲恺农业工程学院, 广州 510225 3. 肇庆学院生命科学学院, 广东肇庆 526061
紫背天葵(Hance)是中国特有的珍稀濒危植物, 采用原位和异位土壤、异地和增强回归处理, 研究了紫背天葵回归的存活情况及其叶片的生态生物学特性。结果表明: 增强回归因受啮齿类哺乳动物的取食而失败; 异地回归取得成功, 异位土壤和原位土壤上回归植株的成活率分别为46.7%和83.3%。原位和异位土壤这两种异地回归植株与野生植株相比, 在叶片的形态、解剖及生理特征上都表现出一定的差异性, 其光适应能力减弱、抗寒旱能力降低、光合能力降低、光合产物积累减少; 异位土壤回归的植株比原位土壤回归的植株相比更差。异地回归紫背天葵叶片花青素含量较低, 仅为野生植株含量(2.33μmol·g–1)的16.95%。异地回归植株所表现出的上述特征可能受回归点与原生境不同微生境(气候和土壤)的影响, 也可能是与组培球茎与野生球茎在表现遗传学上有所差异有关。在开展紫背天葵野外回归实践时, 要充分考虑回归地点的微生境、捕食者和病菌对紫背天葵存活的影响、以及药用有效成分的含量。
紫背天葵; 异地回归; 增强回归; 叶片特性; 鼎湖山
1 前言
由于资源过度开发、生境恶化和气候变化, 大量珍稀濒危植物面临灭绝的风险[1-2]。植物回归是珍稀濒危植物的保护及种群恢复的重要策略之一, 其保护效果超出了单纯的就地保护和迁地保护, 能更有效地对极小种群野生植物进行拯救和保护[2]。回归是在迁地保护的基础上, 通过人工繁殖把植物引入到其原来分布的自然或半自然的生境中, 以建立具有足够遗传资源来适应进化改变、可自然维持和更新的新种群, 主要有增强回归(augmentation, 指在现存种群中通过添加个体增加种群大小)、重建回归(reestablishment, 指通过人工修复那些受到破坏的种群, 使其尽可能恢复到历史的状态)和异地回归(translocation, 指从某个种历史分布区迁移到分布区外的回归)三种形式[3-4]。虽然回归工作在世界各地都有进行, 但成功的案例并不多, 药用植物回归研究则更少[5-6]。许多研究在进行物种回归时只关注物种的引入和种群的建立, 对物种成功回归的原因及回归中可能存在的问题尚缺乏系统的研究[7-8]。药用植物的地道性非常重要, 也是影响药材质量的关键因素, 已有的研究表明土壤理化性质及气候因子能显著影响药材的药效和品质[9]。因此, 在对药用珍稀濒危植物进行回归保护工作时, 除了关注回归效果外, 更需关注生境中土壤和气候因子对药材地道性的影响。
紫背天葵(Hance)是生长在阴湿石壁上的秋海棠科的一种药用植物, 为中国特有种, 具有清热凉血、润肺止咳、散瘀消肿、消暑除热的药效[10-11], 生长期为每年1月下旬至次年5月, 主要药用部位为叶。因频繁的采摘及自身生存环境的脆弱, 加之繁殖系数低, 紫背天葵已被列为珍稀濒危植物[12]。目前对紫背天葵的研究主要是集中在植株元素成分和叶片内红色素的提取工艺, 同时对紫背天葵野外自然分布状况及其所在生境也有一定的调查研究, 此外也有小规模人工栽培试验[13-16]。目前尚无对这一珍稀药用植物的迁地保护的相关研究。
本文主要科学问题有: (1)紫背天葵回归的存活率如何?(2)与野生植株相比, 异地回归后植株叶片性状有哪些差异?导致这种差异的原因是什么?另外, 本文在进行原生境增强回归的同时, 在平均温度高于原生境的另一地点开展异地回归, 为探索珍稀濒危药用植物在全球变暖背景下的有效的保护方式提供参考。
2 材料与方法
2.1 自然概况
增强回归试验样地位于广东省肇庆市鼎湖山自然保护区(23°10¢N, 112°31¢E)庆云寺后山处山谷, 鼎湖山自然保护区属低山丘陵地貌。该地属南亚热带季风气候, 年平均气温21.3 ℃, 最热月(7月)平均温度28.0 ℃, 最冷月(1月)平均温度12.6 ℃。年平均降水量为1927.3 mm。异地回归试验样地位于广东省广州市中国科学院华南植物园(23o35¢N, 112o57¢E), 园内以低丘陵台地为主。该地也属于南亚热带季风气候, 年平均温度21.8 ℃, 最热月(7—8月)平均气温28.3 ℃,最冷月(1月)平均温度13.3 ℃。年降水量为1623.6—1899.8 mm[17]。经过测定, 在紫背天葵生长期间, 不同回归点的土壤和温湿度条件如表1和2所示, 异位土壤的pH值、NH4+-N含量要显著地大于原位土壤(<0.05), 而全磷含量显著小于原位土壤(< 0.05); 植物园异地回归点各月大气温度要显著高于鼎湖山原生境增强回归点(<0.05), 二者空气湿度只在二月份存在显著性差异(< 0.05)。
2.2 实验设计
本试验为两因素两水平析因设计, 回归地点和回归土壤为试验因素, 其中回归点有植物园和鼎湖山两个水平, 回归土壤有植物园异位土壤和鼎湖山原位土壤两个水平。
研究材料为紫背天葵组培苗经过无性繁殖所得球茎(组培苗为肇庆学院通过野生植株组织离体繁殖植株)。增强回归和异地回归各三个区组, 每个区组10个球茎。试验从2013年12月持续到2014年4月, 期间定期监测和记录测植株生长状况, 于2014年4月中旬分别选取长势相同且良好3—9株回归植株和相同地点的野生植株, 每个植株选取1片叶子进行相关指标的测定比较。其中光响应曲线和叶绿素荧光参数测定时间为2014.04.13—04.16, 测定完成后将叶片收获洗净, 于2014.04.16—04.20完成叶片面积、色素等指标的室内测定。
2.3 测定指标
2.3.1 叶面积和比叶面积
将9片(每个区组各3株, 每株各1片)来自不同植株叶片收获洗净后平铺于标准坐标纸上, 数码相机拍照后用Image-J计算叶片面积[18]。之后将其置于65℃烘箱内烘干至恒重, 称量干重后计算比叶面积(SLA=总叶面积/总叶重)。

表1 不同地点土壤理化性质

表2 2014.1—2014.4紫背天葵植株增强回归点和异地回归点的空气温、湿度
2.3.2 形态解剖结构指标测量
用光学显微镜(SZX12, Olympus, Japan)观察叶片横切面结构并拍照, 测量叶片厚度、栅栏组织厚度和海绵组织厚度等指标(每个处理9个重复); IB-5型离子镀膜仪喷涂后置于扫描电镜(日本电子T-300)下观察并拍照, 分析气孔密度、上、下表皮毛密度等指标(每个处理9个重复); 日立H-800透射电子显微镜下观察叶绿体超微结构并拍照, 分析叶绿体大小、基粒厚度等指标, 每个处理取自3个叶片的27个叶绿体。
2.3.3 光响应曲线测定
选取3株(每区组一株)长势良好的植株, 在晴朗无风的天气, 用便携式光合仪(LI-6400, USA)测定其光响应曲线, 测定过程中保持环境稳定, CO2为400 (μmol·μmol–1), 叶温25 ℃, 设定光合有效辐射梯度从1400 (μmol·m–2·s–1), 依次降为1200、1000、800、500、300、150、100、50、30、15、0 (μmol·m–2·s–1)。光响应曲线用非直角双曲模型进行拟合, 通过模型拟合方程得出最大光合速率(max)、暗呼吸速率(R)、表观量子效率()、光补偿点()、光饱和点()、瞬时水分利用效率(IWUE=Pn/Tr)、瞬时光能利用效率(=P/)等参数[18–19]。
非直角双曲模型公式为:

2.3.4 叶绿素荧光参数测定
叶绿素荧光参数测定与光响应曲线同时测定, 利用便携式荧光仪(PAM-2100, Germany)测定叶绿素荧光诱导动力学参数, 每个测量9个重复。先将待测叶片置于叶夹中暗适应30 min, 测定主要参数如下: 光系统II最大光化学效率F/F= (F–F)/F、光化学荧光淬灭= (F'–F)/(F'–F')、非光化学荧光淬灭= (F–F')/F'。其中,F和F是暗适应后的最大和初始荧光,F'和F'是为光适应后的最大和初始荧光[21]。
2.3.5 色素含量测定
从5个叶片(三个区组中分别选1或2株的叶片)不同部位打孔得到直径为0.6cm的圆叶片, 用80%丙酮溶液提取, 用紫外分光光度计(UV-3802, Unico)对浸出液进行测定, 得到在663、645、440 nm处的吸光值, 后计算叶绿素a、叶绿素b和类胡萝卜素含量[22]。
在4℃黑暗条件下, 用甲醇和盐酸混合溶液(甲醇:盐酸=99:1, V/V)提取叶片材料的花青素, 用紫外分光光度计(UV-3802, Unico)测定浸出液在530和650 nm处的吸光值后计算总花青素含量[23–24], 每个处理5个重复。
用甲醇溶液提取叶片内原花青素, 参照Skerget M的方法[25]。每个处理5个重复(采样同上), 计算原花青素含量。
2.3.6 营养元素测定
2014年1月中旬, 将叶片材料置于65 °C下烘干至恒重后测定其有机质、全氮、全磷含量[26], 每个处理3个重复。
2.4 数据分析方法
采用SPSS统计分析软件包对各项指标进行单因素方差分析和LSD多重比较, 数据差异显著临界值=0.05。并用SPSS统计分析软件包进行光响应曲线拟合, 对紫背天葵叶片性状进行聚类分析、因子分析和主成分分析[27–28]。
3 结果
3.1 回归苗萌发率及存活率
结果显示, 各点回归萌发率和存活率方差分析显示(表3), 回归地点和回归所用土壤对紫背天葵回归萌发率都没有影响。而在存活率方面, 鼎湖山增强回归实验由于实验后期受啮齿动物干扰, 回归苗球茎被啃食而没有存活下来的幼苗。植物园异地回归点植株由于生长过程中受到真菌感染, 导致异位和原位土壤处理存活率分别下降36.4%和7.4% (表3)。对异地回归植株存活率方差分析显示, 用原位土壤回归植株存活率要显著高于异位土壤回归植株存活率(<0.05, 表3)。
3.2 异地回归植株与野生植株叶片形态解剖结构的比较
与野生的植株相比(表4, 图1和2), 原位土壤回归的紫背天葵叶片叶面积、上表皮厚度、栅栏组织/海绵组织、上表皮毛密度、下表皮毛密度、栅栏组织叶绿体个数显著小于野生植株。栅栏组织厚度、海绵组织厚度、叶绿体大小显著大于野生植株(<0.05)。异位土壤回归的紫背天葵叶片面积、上表皮厚、气孔密度、上表皮毛密度、下表皮毛密度、栅栏组织叶绿体个数显著小于野生植株, 栅栏组织厚、栅栏组织/海绵组织、叶绿体大小、基粒厚度和片层数显著大于野生植株(<0.05, 表3)。

表3 回归萌发率和存活率
注: “-”: 没有成活个体。

表4 异地回归不同土壤处理下紫背天葵及野生植株叶片形态解剖结构
通过聚类分析将紫背天葵叶片形态解剖结构分为三类, 其中叶面积和叶厚度为第一类指标, 基粒厚度为第二类指标, 其余各指标为第三类指标。而对第三类指标进行因子分析和主成分分析将这12个因子分成两类(表5), 在第一主成分上气孔密度有较高载荷, 在第二类主成分上栅栏组织厚度有较高载荷。因此比较回归紫背天葵植株与野生植株性状差异性时, 在形态解剖结构特征中筛选出叶面积、叶厚、基粒厚度、气孔密度和栅栏组织厚度这5个因子进行比较。结果显示, 只有在气孔密度和基粒厚度这两个特征上, 原位土壤、异位土壤回归植株与野生植株才表现出不同的差异性。在气孔密度上, 原位土壤回归植株与野生植株间无显著差异性 (>0.05), 异位土壤回归的植株显著降低29.3% (<0.05)。原位土壤回归植株与野生植株基粒厚度相比无显著差异性(>0.05), 异位土壤回归植株的基粒厚度显著增加70.7%(<0.05)。
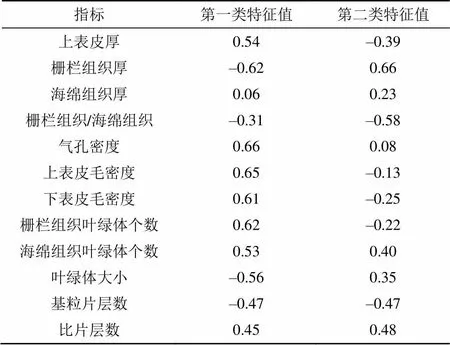
表5 紫背天葵形态解剖结构第三类指标主成分分析特征值
3.3 异地回归植株与野生植株叶片光合生理比较
原位土壤回归的植株与野生植株相比,max、、F/F、及显著减小(<0.05, 表6),R、显著增加。与野生植株相比, 异位土壤回归的植株max、、F/F、及显著减小,R、显著增大(<0.05, 表6)。
对紫背天葵叶片光合生理指标聚类分析, 光饱和点为第一类指标, 其余为第二类指标。对第二类生理指标进行因子分析和主成分将7个指标分成两大主成分。由各指标在两类主成分上特征值可知(表7), 最大光合速率在第一类主成分上载荷最大, 表观量子效率在第二类主成分上载荷最大。在表观量子效率上, 原位土壤和异位土壤回归的紫背天葵与野生植株都没有显著性差异。原位土壤回归的紫背天葵最大光合速率比野生植株显著下降33.3%, 异位土壤回归植株比野生植株显著下降40.3%(<0.05)。

表6 异地回归不同土壤处理下紫背天葵及野生植株光响应曲线参数
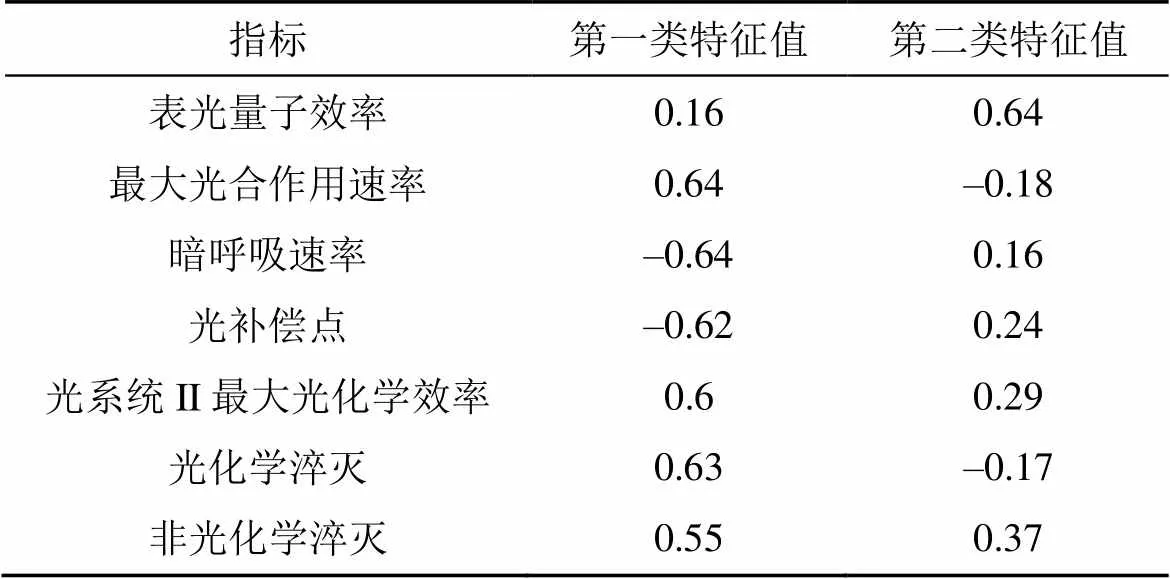
表7 紫背天葵第二类光合生理指标主成分分析特征值
在光饱和点上, 原位土壤回归植株与野生植株相比显著下降27.2%, 异位土壤回归植株显著下降29.3% (<0.05)。
3.4 异地回归植株与野生植株叶片色素含量
与野生植株相比, 原位土壤和异位土壤回归的紫背天葵植株叶片中总叶绿素、总花青素、原花青素含量显著降低(表8,<0.05)。原位土壤和异位土壤回归植株只在类胡萝卜素上含量与野生植株表现出不同的差异性, 其中原位土壤回归植株类胡萝卜素含量与野生植株没有显著差异(>0.05)。异位土壤回归植株叶片叶绿素含量与野生植株相比, 显著下降19.9%(<0.05)。
4 讨论
4.1 回归效果
在鼎湖山紫背天葵原生境进行的增强回归初期, 紫背天葵具有较高的萌发率, 回归所用土壤对其萌发率也没有影响, 但回归后期由于球茎受啮齿类动物啃食的影响, 导致紫背天葵增强回归失败。这表明在紫背天葵植株野外增强型回归过程中, 除了考虑到生境中土壤理化性质、空气湿度、光照等非生物环境因子外, 动物啃食等因素对回归效果的影响也不可小觑。IUCN也曾指出回归点生境条件涉及到动物的捕食行为[29]。紫背天葵的野生植株通常生长于悬崖石缝中, 这种生境特征也可能与躲避捕食者有一定关系。
植物园异地回归中, 不同土壤处理对紫背天葵最初的萌发率无显著影响。但在异地回归实验中, 可能由于温度、空气湿度及群落结构都与鼎湖山原生境有所差异, 对其所在环境微生物有一定的影响, 因而在其生存过程中出现了真菌感染的现象, 降低了回归最后的存活率, 用原位土壤回归的紫背天葵存活率为83.3%, 用异位土壤回归的存活率仅为46.7%, 用原位土壤回归的植株存活率显著大于用异位土壤回归植株的存活率。

表8 异地回归不同土壤处理下紫背天葵及野生植株叶片色素含量
4.2 异地回归植株与野生植株的差异
与野生植株相比, 原位土壤回归的植株显著减小的叶面积降低了其光能接受面积, 上、下表皮毛密度降低则使得其抗寒抗旱能力降低[30–31], 显著减小的叶绿体个数及叶绿素含量则进一步降低了其光合能力。其通过减小上表皮厚度以增加光照透过叶片的能力, 同时增加栅栏组织和海绵组织的厚度来增加光在栅栏组织间的散射, 增大叶绿体大小来增加对有限光能的接收, 在一定程度上弥补所处环境过低的光照强度[32–34]。这些形态结构及物质含量上的差异使得原位土壤回归紫背天葵叶片光合能力显著低于野生植株, 其最大光合速率显著下降, 暗呼吸速率显著升高使得自身光合产物的积累能力大大减弱。研究表明光补偿点能显示植物对弱光的利用能力, 光饱和点能揭示植物对强光的利用能力[35–36], 光补偿点显著升高和饱和点的显著下降则显示回归紫背天葵叶片对光能的利用能力远低于野生植株, 同时光系统II最大光化学效率显著降低揭示其潜在光合作用能力低于野生植株。
异位土壤处理的紫背天葵植株个体与野生植株相比, 其叶片面积、上、下表皮毛密度、叶绿体个数及叶绿素含量显著降低使得自身对光能获取及减小水分散失能力减弱, 气孔密度下降使得其对气体交换调节能力降低[30–31]。通过减小上表皮厚, 增加栅栏组织和海绵组织厚度及叶绿体大小来增加自身光能捕获和利用能力, 以维持自身生长代谢。在光合能力上, 植物园土壤处理植株光系统II最大光化学效率和光化学淬灭显著降低显示其光系统II最大光捕获能力和光能利用能力降低, 光补偿点升高和饱和点降低表明其光适应能力减弱[37]。
土壤作为植物营养的主要来源, 在植物生长发育的过程中占据着重要地位[38]。不同土壤回归紫背天葵与野生植株叶片性状都显示出一定的差异, 差异的大体趋势相似, 但幅度不同。对紫背天葵各类指标进行聚类、因子分析及主成分分析, 筛选出主要指标比较用原位土壤和异位土壤回归的紫背天葵与野生植株性状的差异性。结果显示, 用异位土壤回归的紫背天葵与野生植株相比, 在各主要因子上表现出更大的差异性。用原位土壤和异位土壤进行异地回归的植株所处气候生境一致, 因此在解释两者表现的不同差异性时, 土壤是首要因子。土壤是植物异地保护中不可忽视的重要因子, 刘鹏等对珍稀濒危植物七子花土壤研究表明, 用原生境土壤扦插时存活率高达90%, 而异地土壤扦插存活率仅为5%, 并通过进一步研究不同扦插的土壤推测土壤中钼和锰是七子花分布的限制因子[39–40]。本研究结果显示, 植物园异位土壤的pH、NH4+-N含量显著的高于鼎湖山原位土壤, 但全磷含量仅为原生境土壤的10%, 前期对紫背天葵野生植株的研究显示, 紫背天葵生长可能受到磷元素的限制, 而植物体内磷都通过根系从土壤中吸收, 土壤中磷含量对植物生长影响甚大[41], 因此土壤磷含量的差异可能使得原位土壤回归植株具有更高的存活率。异位土壤与原生境土壤上存在的差异对所生长紫背天葵叶片性状产生影响, 从而使得其与野生植株表现出更大的差异性。但异地回归紫背天葵花青素含量都较低, 只占野生植株含量(2.33 μmol·g–1)的16.95%, 这可能是由于异地回归生境与原生境相比光照、温度、湿度等存在差异, 对植株生理代谢和次生代谢产物积累产生影响。还有研究表明, 组培繁殖的植株与野生植株相比, 基因组成上没有差异, 但甲基化水平上具有一定的差异[42], 这也可能是造成利用组培苗繁殖所得球茎进行异地回归所得植株花青素含量显著低于野生植株的原因。
4.3 回归研究的启示
植物回归是珍稀濒危植物有效的保护措施之一, 也是全球生物多样性保护战略中十分重要的一个环节[43]。然而, 目前开展的珍稀濒危植物异地保护工作中, 人们多重视物种的引入, 忽视了回归过程中存在和可预测的生长繁殖障碍, 更缺乏研究物种迁地保护所需要的土壤营养条件[7]。本次对紫背天葵的增强回归和异地回归研究表明, 要实现回归对某一物种的保护效果, 必须将物种、生物环境和非生物环境因子三者有机的结合起来考虑。当采用回归对紫背天葵进行保护时, 在生境选择上, 注意动物捕食对回归效果的影响, 预先调查回归点是否存在啃食其球茎的啮齿类哺乳动物及生境中微生物组成都对回归工作的顺利开展具有重要意义。结合紫背天葵异地回归不同土壤处理下叶片与野生紫背天葵叶片性状对比可知, 气候因子和土壤因子都能影响回归植物叶片形状、光合能力及花青素合成。
5 结论
异地回归的成功, 表明利用回归可在一定程度上保护紫背天葵。增强回归过程中啮齿类动物以及异地回归真菌和土壤磷含量对回归植株成活的影响, 进一步揭示回归过程中生物因子对植物回归的重要影响。异地回归植株与野生植株相比形态结构、物质含量及光合特性上存在显著差异(<0.05), 其光能接受、利用能力及减小水分散失能力减弱, 光适应能力减弱, 抗寒旱能力降低, 气体交换调节能力降低, 光合产物积累减少, 且利用原位土壤回归的植株差异更大; 异地回归紫背天葵花青素含量都较低, 仅为野生植株含量(2.33 μmol·g–1)的16.95%。
在进行回归工作时物种的成功生长只是初步, 对回归后续的监测及分析, 特别是回归成败的原因对植物有效的回归工作开展尤为重要。此外, 对于药用植物来说, 其体内药用有效成分多为植物体内次生代谢物, 也是回归工作需要重视的一个方面, 植物本身性状与环境因子息息相关, 而异地回归生境中土壤和气候因子的差异都有可能导致植株在适应过程中发生性状的改变, 从而影响其体内代谢产物含量发生变化。
[1] ALCAMO J, BENNETT E M. Millennium Ecosystem Assessment. Ecosystems and Human Well-being: A Framework for Assessment [M]. USA, Washington, DC: Island Press, 2003.
[2] REN Hai, JIAN Sshuguang, LIU Hongxiao, et al. Advances in the reintroduction of rare and endangered wild plant species[J]. Science China Life Sciences, 2014, 57(6): 603–609.
[3] MAUNDER M. Plant reintroduction: an overview [J]. Biodiversity and Conservation, 1992(1): 1: 51–61.
[4] 周翔, 高江云. 珍稀濒危植物的回归: 理论和实践[J]. 生物多样性, 2011, 19(1): 97–105.
[5] GUERRANT E O, KAYE T N. Reintroduction of rare and endangered plants: common factors, questions and approaches [J]. Australian Journal of Botany, 2007, 55(3): 362–370.
[6] 肖培根, 陈士林, 张本刚, 等. 中国药用植物种质资源迁地保护与利用[J]. 中国现代中药, 2010, 12(6): 3–6.
[7] 万开元, 陈防, 陈树森, 等. 珍稀濒危植物迁地保护策略中植物营养问题的探讨[J]. 生物多样性, 2006, 14(2): 172–180.
[8] ARMSTRONG D P, SEDDON P J. Directions in reintroduction biology [J]. Trends in Ecology and Evolution, 2008, 23(23): 20–25.
[9] 李艳丽, 许亮, 杨燕云, 等. 中药特色之一地道药材研究进展[J]. 中华中医药学刊, 2012, 30(4):797–799.
[10] 古翠芝. 中国植物志[M].北京: 科学出版社, 1999: 190–192.
[11] 邵玲, 陈雄伟, 梁广坚, 等. 广东肇庆鼎湖地区野生紫背天葵种质资源研究[J]. 中药材, 2014, 37(2): 202–206.
[12] 邢福武. 中国的珍稀植物[M]. 长沙, 湖南教育出版社, 2005: 107–108.
[13] 张兰英, 李耿光. 影响紫背天葵试管苗花青甙含量的因素Ⅱ[J]. 云南植物研究, 1986, 8(1): 60–66.
[14] 许旋, 卢忠, 罗一帆. 不同等级紫背天葵微量元素含量的测定[J]. 广东微量元素科学, 2000,7(4): 55–57.
[15] 邵玲, 梁霞. 秋海棠科紫背天葵生物学特性[J]. 农学学报, 2012, 2(08): 49–52.
[16] 汪越, 陈雄伟, 邵玲, 等. 珍稀濒危植物紫背天葵(Hance)的生态生物学研究进展[J].中国野生植物资源, 2014,33(6): 26–32.
[17] 杨勇, 赖永超, 刘楠, 等. 艳桢桐的生态生物学特征[J]. 安徽农业科学, 2010, 38(19):10040-10043, 10071.
[18] LIU Nan, GUAN Lanlan. Linkages between woody plant proliferation dynamics and plant physiological traits in South western North America [J]. Journal of Plant Ecology, 2012, 5(4): 407–416.
[19] NIJS I, FERRIS R, BLUM H. Stomatal regulation in a changing climate: a field study using free air temperature increase (FATL) and free air CO2enrichment (FACE) [J]. Plant Cell and Environment. 1997, 20(8): 1041–050.
[20] LARCHER W. Physiological Plant Ecology [M]. Berlin: Springer, 1980.
[21] SOUZA RP, MACHADO EC, SILVA JAB, et al. Photosynthetic gas exchange, chlorophyll fluorescence and some associated metabolic changes in cowpea () during water stress and recovery [J]. Environmental and Experimental Botany, 2004, 51(1): 45–56.
[22] LIN Zhifang, LI Shuangshun, LIN Guizhu, et al. Superoxide dismutase activity and lipid peroxidation in relation to senescence of rice leaves [J]. Acta Botanica Sinica, 1984, 26(1): 605–615.
[23] MURRAY J R, HACKETT W P. Dihydroflavonol reductase activity in relation to differential anthocyanin accumulation in juvenile and mature phase[J]. Plant Physiology, 1991, 97(1): 343–351.
[24] REDDY V S, DASH S, REDDY A R. Anthocyanin pathway in rice (L.): identification of a mutant showing dominant inhibition of anthocyanins in leaf and accumulation of proanthocyanins in pericarp [J]. Theoretical and Applied Genetics. 1995, 91(2): 301–312.
[25] SKERGET M, KOTNIK P, HADOLIN M, et al. Phenols, proanthocyanidins, flavones and flavonols in some plant materials and their antioxidant activities [J]. Food Chemistry, 2005, 89(2): 191–198.
[26] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 18–96.
[27] 张元明. 中国怪柳植物花粉形态特征聚类分析[J].西北植物学报, 2004, 24(9): 1702–1707.
[28] 田贺, 张志东,李亚东, 等. 主成分分析法在茶藨属植物果实品质评价指标上的应用研究[J].吉林农业大学学报, 2009, 31(5): 632–636.
[29] IUCN. Guidelines for Reintroductions [M]. Prepared by the IUCN/Species Survival, 1998.
[30] 孟雷, 陈温福, 李磊鑫, 等. 减弱光照强度对水稻叶片气孔性状的影响[J].沈阳农业大学学报, 2002, 33 (2): 87–89.
[31] 吕晋慧, 王玄, 冯雁梦, 等. 遮荫对金莲花光合特性和叶片解剖特征的影响[J]. 生态学报, 2012, 32 (19): 6033–6043.
[32] DENG Yanming, LI Congcong, SHAO Qiqngsong, et al. Differential responses of double petal and multi petal jasmine to shading: I. Photosynthetic characteristics and chloroplast ultrastructure [J]. Plant Physiology and Biochemistry, 2012, 55(2): 93–102.
[33] QUERO J L, VILLAR R, MARANON T, et al . Interactions of drought and shade effects on seedlings of four Quercus species: physiological and structural leaf responses [J]. New Phytologist, 2006, 170(4): 819–834.
[34] MARKESTEIJN L, POORTER L, BONGERS F. Light- dependent leaf trait variation in 43 tropical dry forest tree species [J]. American Journal of Botany. 2007, 94(4): 515–525.
[35] 张其德. 大气CO2含量升高对光合作用的影响[J]. 植物通报, 1992 , 9(4): 18–23.
[36] 刘玲, 刘淑明, 孙丙寅. 不同产地花椒幼苗光合特性研究[J]. 西北农业学报, 2009, 18(3): 160–165.
[37] DEMMIG-ADAMS B, ADAMS W W. Photoprotection in an ecological context: the remarkable complexity of thermal energy dissipation [J]. New Phytologist, 2006, 172(1): 11–21.
[38] EMANUEL E. Plant biologists need to get back to their roots [[J].Nature, 2004, 430(7002): 430, 829.
[39] 刘鹏, 徐根娣, 金静芳, 等. 七子花土壤的研究及种质资源的保护[J]. 农业环境保护, 1999, 18(4): 178–181.
[40] 刘鹏, 徐根娣, 方兴凤. 钼、锰对七子花扦插繁殖的影响[J]. 浙江师大学报(自然科学版), 2011, 24(2): 181–183.
[41] 张雨瑶, 李世友. 土壤磷与植物关系研究进展[J]. 世界林业研究, 2013, 26(5): 19–24.
[42] KUBIS S E, CASTILHO A M, VERSHININ A V, et al. Retroelements, transposons and methylation status in the genome of oil palm () and the relationship to somaclonal variation [J].Plant Molecular Biology, 2003, 52 (1): 69–79.
[43] Brian F L, Nigel M. Preserving diversity [J]. Nature, 1993, 361(6413): 361–579.
Survival and eco-biological characteristics ofHance in the process of reintroduction
WANG Yue1, YI Huilin1,2, SHAO Ling3, CHEN Xiongwei3, CHEN Gang3, WANG Jun1, LIU Nan1, WANG Shaoping1, REN Hai1*
1. South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China 2. Zhongkai College of Agricultural Technology, Guangzhou 510225, China 3. College of Life Science, Zhaoqing University, Zhaoqing 526061, China
Hance is a rare and critically endangered herb, and endemic medicine plant to China. This paper studied the survival and eco-biological characteristics ofin the process of reintroduction, under the treatments of augmentation and translocation reintroduction with in-situ and ex-situ soil, respectively. The augmentation reintroduction offailed due to predation by rodents while the translocation reintroduction succeeded. The survival rates of translocated individuals on the ex-situ and in-situ soil were 46.7% and 83.3%, respectively. Compared with the wildindividuals, the translocated individuals grown on both in-situ and ex-situ soil were inferior in the ability of light adaptation and photosynthesis, resistance to both drought and cold stresses, and also accumulation of photosynthetic products. The leaf traits of translocated individuals on ex-situ soil were more different than those of wildindividuals. The anthocyanin content in the leaves of translocated individuals was low, and was only 16.95% of wild individuals. The survival rate, anthocyanin contents and photosynthetic physiological characteristics of translocated individuals might be influenced by the microhabitats (climate and soil) of the reintroduction site, or the epigenetic difference between tissue culture bulbs and wild bulbs. In conclusion, during the process of reintroduction (augmentation and translocation), micro-habitat, interspecific relationship, and effective medicine components of reintroduced individuals should be considered.
Hance, translocation, augmentation, leaf characteristics, Dinghu Mountain
10.14108/j.cnki.1008-8873.2017.02.005
Q949.95
A
1008-8873(2017)02-032-10
2015-10-23;
2016-07-04
广州市科技计划项目(2014J4500035)
前两名作者对本文做了同等贡献。汪越(1989—), 女, 硕士研究生, 主要研究方向: 恢复生态学, E-mail: yueyayue@126.com; 易慧琳(1991—), 女, 硕士研究生, 主要研究方向: 园林植物与观赏园艺, E-mail: YHL0314@yeah.net。
任海, 男, 博士, 研究员, 主要从事植被生态恢复研究, E-mail: renhai@scib.ac.cn
汪越, 易慧琳, 邵玲, 等. 紫背天葵(Hance)回归植株存活及叶片生物学特性研究[J]. 生态科学, 2016, 36(2): 32-41.
WANG Yue, YI Huilin, SHAO Ling, et al. Survival and eco-biological characteristics ofHance in the process of reintroduction[J]. Ecological Science, 2017, 36(2): 32-41.
