3.0 TMRI对子宫肌瘤高强度聚焦超声治疗后的早期效果评价
2017-05-10王铭洁李彩英王峥王亚敏宫宁牛宗宝
王铭洁 李彩英 王峥 王亚敏 宫宁 牛宗宝
·论著·
3.0 TMRI对子宫肌瘤高强度聚焦超声治疗后的早期效果评价
王铭洁 李彩英 王峥 王亚敏 宫宁 牛宗宝
目的 采用3.0 TMRI平扫及增强扫描对子宫肌瘤高聚焦超声(HIFU)早期疗效评价。方法 33例子宫肌瘤患者,其中单发肌瘤20例,多发肌瘤13例,共59个,患者平均年龄(34.3±8.7)岁,所有患者均于HIFU术前及术后1 d行MRI平扫、增强扫描检查,观察并定量测定肌瘤、肌壁HIFU术前、后T2压脂、T2WI、T1WI平扫及增强扫描信号值,并计算肌瘤最大消融区面积,对其疗效进行评估。结果 59个肌瘤于HIFU术后在T1WI增强扫描序列均出现无强化的消融区,平均消融率达70.9%。MRI增强扫描消融区T1信号值与术前比较明显减低(P<0.01)。术后消融区在T1平扫像上呈不同程度高信号,T2像上消融区范围显示不明确,但T2信号值较术前明显升高(P<0.01)。MRI平扫所见术后T1信号增高区
MRI;增强扫描;高聚焦超声;子宫肌瘤
子宫肌瘤为女性最常见的疾病,影响着广大女性的生活质量。高聚焦超声(HIFU)治疗症状性子宫肌瘤以其微创、快速、损伤小的优势,得到临床的认可。MRI以其高分辨率图像,直观、可重复性强等优点成为子宫肌瘤HIFU 术后有效的评价手段。本研究采用3.0T MRI对子宫肌瘤HIFU治疗后早期进行评价,旨在探讨子宫肌瘤HIFU治疗后病理改变及疗效。
1 资料与方法
1.1 一般资料 选择保定市第一中心医院和河北医科大学第二医院妇科2012年8月至2013年6月经HIFU治疗前后行MRI检查的子宫肌瘤患者33例,年龄26~55岁,平均年龄(34.3±8.7)岁;瘤体均径1.1~9.6 cm,平均(5.5±1.6)cm。单发肌瘤20例,多发肌瘤13例,总共肌瘤59个。所有病例均于HIFU术前及术后1 d内行MRI平扫、DWI及增强检查。
1.2 纳入与排除标准 依据多中心临床试验方案确定标准,筛选临床表现、妇科检查及超声综合确诊为子宫肌瘤的患者入组。
1.2.1 纳入标准:①绝经前女性;②有子宫肌瘤的临床症状;③要求保留子宫,拒绝手术治疗;④治疗系统机载超声可显示肌瘤;⑤能准确交流超声消融治疗过程中的感受并同意、签字者。
1.2.2 排除标准:①宫颈超薄细胞检测(TCT)提示异常细胞;②短期内子宫肌瘤生长迅速者;③子宫后倾固定,俯卧位时子宫或子宫肌瘤仍压迫直肠者;④合并妇科其他疾病(如阴道炎、盆腔炎、肿瘤,阴道出血严重等);⑤腹部纵行瘢痕患者;⑥月经期女性、孕妇(妊娠试验阳性)及哺乳期女性;⑦其他有MRI 检查及麻醉禁忌的患者。
1.3 设备及扫描参数 采用 PHILIPS 3.0 T 超导磁共振仪,取仰卧位,采用相控阵体部表面线圈。扫描序列采用:TSE T1WI轴位、矢状位TR/TE=531 ms/10 ms,层厚5 mm,层间距5 mm,矩阵300×236、268×204。TSE T2WI轴位TR/TE= 3 000 ms/70 ms,层厚5 mm,层间距1 mm,矩阵300×234。T2WI压脂矢状位TR/TE=3 600 ms/70 ms,层厚4 mm,层间距1 mm,矩阵300×234。扩散加权成像采用:EPI-DWI轴位TR/TE=1 035 ms/59 ms,层厚5 mm,层间距1 mm,矩阵80×80, b=0、500、1 500 s/mm2。增强扫描采用3D-THRIVE 动态增强序列,薄层容积扫描。造影剂采用钆喷酸葡胺注射液20 ml,注射速率2 ml/s。
1.4 HIFU治疗 采用JC型聚焦超声肿瘤治疗系统(重庆海扶技术有限公司生产)。治疗前常规备皮、灌肠、留置尿管,取俯卧位,应用HIFU 治疗系统对肌瘤实施一次性、消融性治疗。采用镇静止痛条件下的治疗方式。于术前及术中给予镇静止痛药物,维持镇静止痛状态。治疗前通过机载超声系统进行肌瘤靶区定位,以5 mm层厚将靶区分成多个治疗层面,逐层采集图像,确定靶区。移动HIFU 焦域,分别对各治疗层面的靶区实施治疗。根据各靶区的形状,通过焦域形成的点、线、面的组合,完成对治疗靶区的适形性消融治疗。治疗频率0.5~2.0 MHz,焦距140 mm。治疗扫描方式为点扫描,扫描速度3 mm/s,层厚5 mm。治疗声功率为240~400 W,治疗过程中,根据患者耐受程度、肿瘤及声通道中组织变化情况进行实时调整,以20~40 W的梯度逐步提高或降低治疗功率。观察到治疗后靶区超声图像持续稳定出现10 个灰阶以上增强时,判为治疗有效。术后常规口服抗生素3 d,监测不良反应。
1.5 治疗评价
1.5.1 利用飞利浦Extend MR WorkSpace 2.6.3.4测量子宫肌瘤消融术前、术后区体积,计算消融率。体积测量由具有5年以上工作经验MRI医师利用工作站体积定量软件进行,选取术前MR增强扫描T1WI序列轴位,对子宫肌瘤病变层面,逐层勾画子宫肌瘤边缘,每一层得出截面积,待勾画完所有层面后,由软件自动测出体积。消融术后,同样方法,勾画消融区病变的边缘,得出逐层的截面积,利用体积软件,自动得到消融区体积。消融率=术后消融体积/肿瘤体积×100%。
1.5.2 测量子宫肌瘤HIFU术前术后信号,选取T2WI压脂、T2WI、T1WI及T1WI增强扫描等序列,选取子宫肌瘤最大截面,ROI勾画沿肌瘤边缘,测量三次,取其平均信号值。测量肌壁兴趣区选择可明确识别的肌壁区,范围为10 mm2,避开结合带。术前、术后选取相同层面、同样大小ROI。
1.5.3 对子宫肌瘤消融术后T1WI信号升高区及增强扫描T1WI无灌注区最大面积进行测量,并行比较分析。

2 结果
2.1 肌瘤HIFU术前、后信号变化 59个肌瘤均经HIFU成功治疗,肌瘤术前平均体积(82.7±70.0)cm3,术后平均体积(83.1±70.9)cm3,消融体积平均(64.1±60.8)cm3,消融率达(70.9±16.2)%。
2.1.1HIFU术后子宫肌瘤消融区在T1WI平扫像上呈不同程度高信号,在T2WI像上消融区范围显示不明确,但信号值升高,术前术后消融区T1WI、T2WI信号值差异有统计学意义(P<0.01)。T1WI增强扫描延迟序列在术后出现无强化低信号区,即消融区,增强T1WI信号值明显减低,与术前比较差异有统计学意义(P<0.01)。见图1~6,表1。
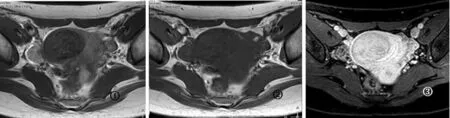

图1 子宫肌瘤术前T2WI图像图2 子宫肌瘤术前T1WI图像图3 子宫肌瘤术前T1WI增强图像
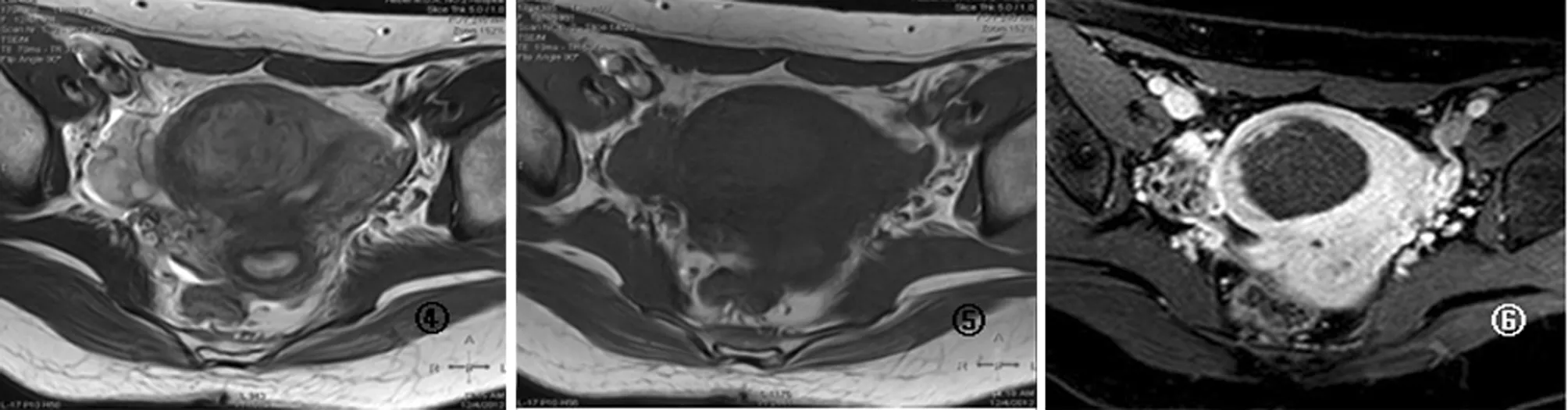

图4 术后T2WI图像,示子宫肌瘤消融区信号均增高 图5 术后T1WI图像,示子宫肌瘤消融区信号均增高 图6 术后T1WI增强扫描图像,示子宫肌瘤消融区为无强化低信号区
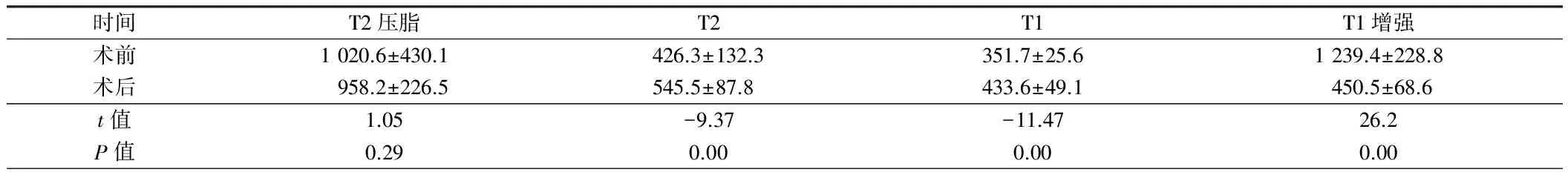
时间T2压脂T2T1T1增强术前1020.6±430.1426.3±132.3351.7±25.61239.4±228.8术后958.2±226.5545.5±87.8433.6±49.1450.5±68.6t值1.05-9.37-11.4726.2P值0.290.000.000.00
2.1.2 对MRI平扫采用T1WI定量测量,术后平扫T1WI信号增高区范围 表2HIFU术后3.0TMRI不同序列显示消融面积比较 指标消融面积T1增强1192.2±948.8T1 904.9±777.6t值-6.5P值0.00 2.2 肌壁HIFU术前、后信号变化 本组单发肌瘤20例,多发肌瘤13例。单发肌瘤组邻近肌壁增强扫描术后T1WI信号较前减低(P<0.05)。多发肌瘤组肌壁T2WI压脂术后信号较前减低(P<0.05)。单发肌瘤组距肌瘤不同距离(<0.5 cm,0.5~1.0 cm,>1.0 cm)测量肌壁T2WI压脂信号,2组术前、术后组间差异无统计学意义(P>0.05)。见表3、4。 表3 采用T2压脂像对单发肌瘤HIFU术后距子宫肌瘤不同距离肌壁分析 ±s 表4 采用3.0MRI对子宫肌瘤HIFU术后子宫残余正常肌壁分析 ±s 子宫肌瘤是育龄女性生殖器官的常见疾病,肿瘤较大会影响女性生活质量,患者常伴有经期延长及经量增多、下腹包块、肠道压迫等症状,故多需治疗。传统的手术、腹腔镜切除和介入栓塞等,均为有创治疗,特别是手术,且术后并发症多。目前,子宫肌瘤的治疗方法较多,总体趋向保留子宫、微创伤的方向发展,其中HIFU可进行非侵入性消融治疗,具有保留子宫等优势。它是将超声波由体外发出聚焦于体内病变组织,利用超声波的组织穿透性和能量沉积性,利用超声的机械效应、热效应和空化效应杀死肿瘤细胞[1],并对肿瘤周围组织损伤小,有效改善患者症状,且安全、无创,更易于患者接受。 当前,超声和MRI是临床上普遍使用的超声消融治疗后的疗效评价手段。超声价格低廉,快捷适用,但其空间分辨率较MRI低,易受到骨骼、气体的影响,且操作人员的主观性较强。与超声相比,MRI以其较高分辨率能更准确、直观的判断肿瘤的形态、大小及解剖学位置,增强图像能清楚反映肌瘤的血供情况,并且MRI检查客观性及可重复性强,逐步成为HIFU术后首选的检查方法。 HIFU利用超声波的聚焦性和组织穿透性及其他物理性能,将体外低能量超声波束聚焦在体内目标区域,通过焦域处高能量超声波产生的热效应、机械效应及空化效应等,使局部瞬间产生高温,达65℃以上,导致焦域区内细胞产生不可逆死亡、蛋白质变性及组织凝固性坏死,同时能破坏靶区的肿瘤内径小于2mm的供血血管[2],引起组织缺血,加速靶区坏死。HIFU治疗子宫肌瘤主要依赖于应用影像学测量术后肿瘤无血供区,即消融区的大小及体积的变化评价疗效,对体积的评估需要数周至数月甚至长期随访才能实施,MRI增强扫描可以清楚显示术后肌瘤无血供的消融区,本组33例59个肌瘤HIFU术后1d均可见增强扫描无强化低信号消融区,消融率70.9%,可以作为无创评价子宫肌瘤疗效的手段。 有研究示HIFU术后消融区T1WI序列出现高信号代表消融区范围[3],本研究采用T1WI观察高信号范围与增强扫描消融范围进行对比,发现T1WI出现信号增高区,小于增强无灌注区,但与增强无灌注区范围高度相关,可作为平扫序列有效反映HIFU术后肌瘤的坏死区。T1WI高信号产生由于肌瘤蛋白质变性,微小血管破坏,微血栓形成导致T1弛豫时间变短,术后T1WI信号增高,其范围与增强扫描消融区高度相关,所以T1WI增高信号区可以及时、敏感的反映组织的坏死区。MRI平扫可以评估消融区域,这样可以减少增强扫描造影剂的引入检查产生的复杂性和风险性,本研究中59个肌瘤于HIFU术后1d均显示T1WI高信号,其最大面积小于T1WI增强扫描显示的消融区范围,而刘映江等[3]研究示HIFU术后6个月,观察T1高信号体积与增强扫描消融区体积高度一致,差异无统计学意义(P>0.05)。可能与本组病例为术后超早期,消融区内的细胞还没有完全坏死有关。 HIFU术后早期,聚焦的热效应引致消融区肌瘤组织细胞能量代谢异常,减低细胞膜上的钠-钾离子ATP酶的活性,致细胞内水分子增加,细胞肿胀,类似细胞毒性水肿状态,导致T2WI信号增高,进而,由于消融区中央能量沉积较多,细胞出现坏死、崩解,组织间隙水份增多,呈血管源性水肿,T2WI信号亦较高[4]。肌瘤消融区周围水肿及炎性反应,亦可导致肌瘤术后边缘T2信号增高[5]。本研究发现HIFU术后早期,T2WI信号不均匀增高。本组33例59个肌瘤,术前为T2WI均匀或不均匀低信号,少部分呈T2WI高信号,术后1d采用定量测量发现T2WI平均信号值增高(P<0.01),但不能明确显示消融区及坏死区的边界。 有研究显示HIFU治疗过程中,位于焦域周围的组织及声通道上的组织不会受到损伤[6,7]。因此本组对残余正常肌壁术前、后信号做了比较。单发肌瘤距肌瘤不同距离肌壁(<0.5 cm,0.5~1.0 cm和>1.0 cm)和多发肌瘤可识别残余正常肌壁T2WI压脂及T2WI信号术后均较术前减低,只有多发肌瘤组肌壁T2WI压脂信号有统计学意义(P<0.05),单发及多发肌瘤组肌壁术后增强信号值均较术前减低,单发组有统计学意义(P<0.05),可能和HIFU热损伤,肌壁水分减少,微循环障碍有关。T1WI术前、后残余肌壁信号未见明确统计学差别。 HIFU术后子宫肌瘤于3.0T MRI各序列出现不同信号变化。增强扫描可以清楚显示HIFU术后肌瘤的血流阻断区。T1WI术后出现的高信号区的范围与增强扫描无灌注区高度相关,可以作为评价HIFU疗效的平扫序列。 1 Ter Haar G.Uhrasound focal beam surgery.Uhrasound Med Boil,1995,21:1089-1100. 2 敬宗玉,邹建中,李发琪,等.一种评价HIFU聚焦性能的仿组织体模的建立,临床超声医学杂志,2006,8:705-707. 3 刘映江,刘仙明,彭松,等.常规MRI在子宫肌瘤超声消融疗效评价及随访中的价值.中国医学影像技术,2011,27:2098-2101. 4 张俊成,杨振华,赵相胜,等.MR扩散成像在子宫肌瘤HIFU术后早期疗效评价中的价值.放射学实践,2012,27:1356-1360. 5 徐宏刚,徐波,陈亮,等.高能聚焦超声治疗后兔VX2肝癌MR 灌注加权成像与微血管密度比较.中国CT和MRI杂志,2011,38:43-45. 6 Yang R,Reilly CR,Rescorla FJ,et al.High intensity focused ultrasoundin the treatment of experimentalliver cancer.Arch Surg,1991,126:1002-1009. 7 黄海玉,刘小乐,王冰,等.高强度聚焦超声治疗子宫肌瘤的研究进展.罕少疾病杂志,2009,16:23-25. Early efficiency evaluation of 3.0T MRI on uterine fibroids after treated by high-intensity focused ultrasound WANGMingjie*,LICaiying,WANGZheng*,etal. Objective Using 3.0T MRI unenhanced and enhanced MRI scanning to evaluate the early therapeutic effects of high-intensity focused ultrasound (HIFU) on uterine fibroids.Methods Thirty-three patients with uterine fibroids including 20 cases of solitary uterine fibroid and 13 cases of multiple uterine fibroids,a total of 59 uterine fibroids,whose mean age was (34.3±8.7) years,were enrolled in the study. All the patients underwent unenhanced MRI scan and enhanced MRI scan before HIFU and after HIFU to observe and calculate quantitatively the signal value of T2WI fat suppression, T2WI, unenhanced and enhanced T1WI of uterine fibroids and uterine wall,moreover, to calculate the maximum ablation area of fibroids and to evaluate the therapeutic effects.Results The 59 fibroids did not appear enhancement of ablation zone in T1W1 enhanced scan sequence after HIFU,with average ablation rate being 70.9%.The signal value of enhanced T1WI was significantly decreased,as compared with that before HIFU (P<0.01).ThepostoperativeablationzoneshoweddifferentdegreehighsignalsinunenhancedT1plainscanimage,andtheablationzonerangedisplayedunclearlyinT2image,andT2signalvaluewassignificantlyincreased,ascomparedwiththatbeforeHIFU(P<0.01).ThehighsignalareaofT1WIafterpostoperativeMRIscanwassmallerthanthatintheablationareaofenhancedMRIscan(P<0.01).TheareaofincreasedsignalofenhancedT1WIwascloselycorrelatedtotheablationareaofenhancedMRIscan(r=0.94).ThesignalintensityinmusclewallinsolitarymyomagroupwassignificantlydecreasedafterHIFU,ascomparedwiththatbeforeHIFU(P<0.05).ThesignalintensityofT2WIfatsuppressionscaninmusclewallinmultiplefibroidsgroupwasobviouslydecreased(P<0.05).TherewasnosignificantdifferenceinthesignalintensityofT2WIfatsuppressionscaninmusclewallatdifferentdistancestofibroids(<0.5cm,0.5~1.0cm,>1.0cm)amongsolitaryuterinefibroidgroups.Conclusion The 3.0T MRI enhanced scan can show the fibroid ablation zone directly and accurately, moreover, the high signal area of postoperative T1WI can display necrosis area of fibroids after HIFU and can evaluate the ablation range. MRI; enhanced scan; high-intensity focused ultrasound; uterine fibroids 10.3969/j.issn.1002-7386.2017.09.013 071000 河北省保定市第一中心医院(王铭洁、王峥、王亚敏);河北医科大学第二医院(李彩英);中国人民解放军第252医院(宫宁);河北大学附属医院(牛宗宝) 李彩英,050011 石家庄市,河北医科大学第二医院; E-mail:wmjwzh20080808@163.com R 445.14 A 1002-7386(2017)09-1331-04 2016-11-11)
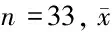
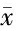
3 讨论
*TheFirstCentralHospitalofBaodingCity,Hebei,Baoding071000,China
