碳酸钡去除综合冶炼废水中Ca2+和
2017-05-10何静旻李绪忠
何静旻,李绪忠
(长沙有色冶金设计研究院有限公司,湖南长沙410011)
碳酸钡去除综合冶炼废水中Ca2+和
何静旻,李绪忠
(长沙有色冶金设计研究院有限公司,湖南长沙410011)
提高工业废水的回用率减少外排是循环经济促进法中工业节水的重要途径,也是解决我国水资源紧张的重要途径。有色金属冶炼厂每年会产生大量含有重金属的酸性废水,目前,在重金属废水处理中,最普遍采用的方法是石灰中和法,但工业实践工程中发现,石灰中和法处理后的出水中硫酸根和钙离子浓度偏高,不适合作为工业循环水系统的补充水。因此本试验针对石灰中和法处理后的出水采用较为经济的碳酸钡作为投加药剂,通过动态试验,研究不同投加剂量、温度、反应时间以及沉淀时间等因素对碳酸钡粉末去除水中硫酸根、钙离子的影响,并分析相应的反应机理,使得处理后的水中残余硫酸根和钙硬度分别稳定在250 mg/L和50 mg/L(以CaCO3计)以下,达到《城市污水再生利用工业用水水质》和《再生水水质标准》中敞开式循环冷却水系统补充水的要求。
碳酸钡;硫酸根;钙离子;重金属酸性废水
有色金属冶炼厂酸性废水的主要来源由两部分组成:一部分是由于精矿主要为硫化矿,而硫化矿的冶炼过程中会产生大量的含尘SO2和SO3烟气,烟气通常制取副产品硫酸,在硫酸制备过程中会排放还有重金属离子的污酸;另一部分是电解车间电解槽及极板清洗时会排放高浓度重金属酸性污水[1,2]。目前,处理有色金属冶炼厂酸性废水的方法大多采用石灰中和法[3]和石灰铁盐法[4],这些方法能使除汞之外的所有重金属离子共沉,处理后的出水能够达标外排,但是在作为冶炼厂的循环冷却水系统的补充水时结垢和腐蚀严重[5,6]。在有色冶炼厂的生产新水中,据统计将近60%用作冷却循环水系统的补充水[7],若完全采用新水补充则不符合经济性原则和节约用水的理念。本文以某工业园区重金属废水处理资源化项目污水处理站预处理出水为研究对象,采用碳酸钡[8,9]作为深度处理药剂,进行了试验研究,结果表明处理后的水中残余硫酸根和钙硬度分别稳定在250 mg/L和50 mg/L(以CaCO3计)以下,达到冷却循环水系统的补充水水质要求。
1 碳酸钡去除水中Ca2+和SO2-4机理
1.1 溶度积原理
水中的硫酸根离子和钙离子在加入碳酸钡后发生作用,产生如下的沉淀反应:
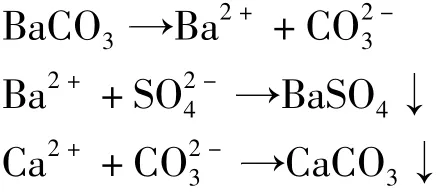
各反应物、生成物的溶度积见表1。
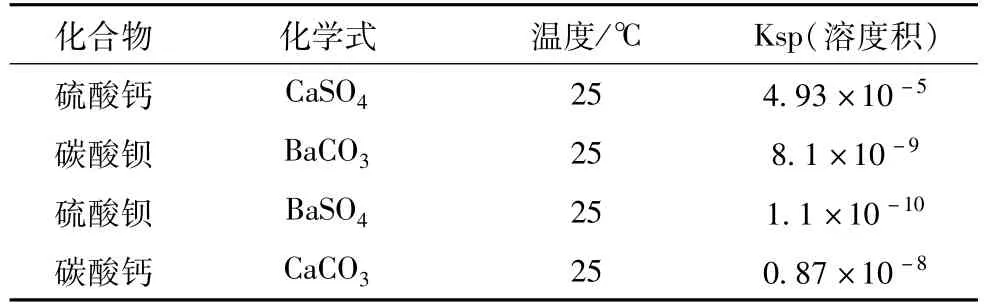
表1 化学物质溶度积表
因此反应溶液中若有足够的Ba2+和CO2-3存在,反应就可以进行,达到脱除硫酸根离子和钙离子的目的。
常温下,可知CaSO4·2H2O的饱和溶解度为2.55 g/L,即溶液中的[Ca2+]=[SO2-4]=1.48× 10-2mol/L。而在BaCO3的饱和溶液中[Ba2+]=
所以,可以计算得出浓度熵:

因为:
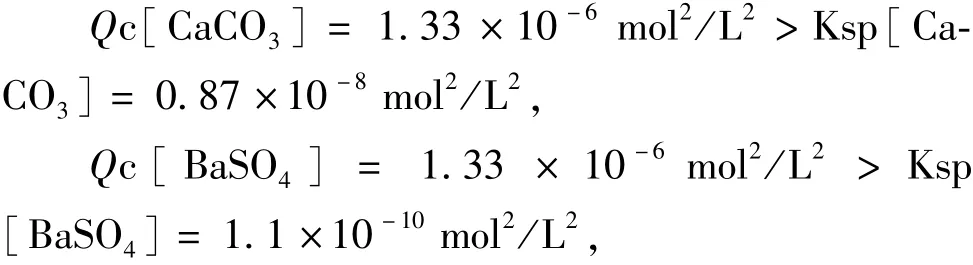
式中:Q c为浓度熵/mol2·L-2;Ksp为溶度积。
由上述计算看出,本试验基于溶度积原理是可以进行的。
1.2 热力学原理
试验将采用碳酸钡去除水中的钙离子和硫酸根离子。化学平衡方程如下:
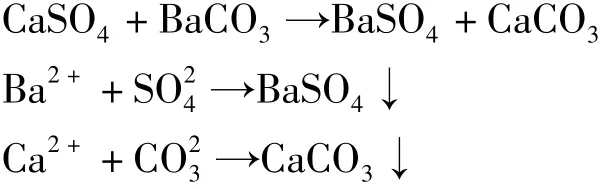
各反应物、生成物的热力学数值见表2。
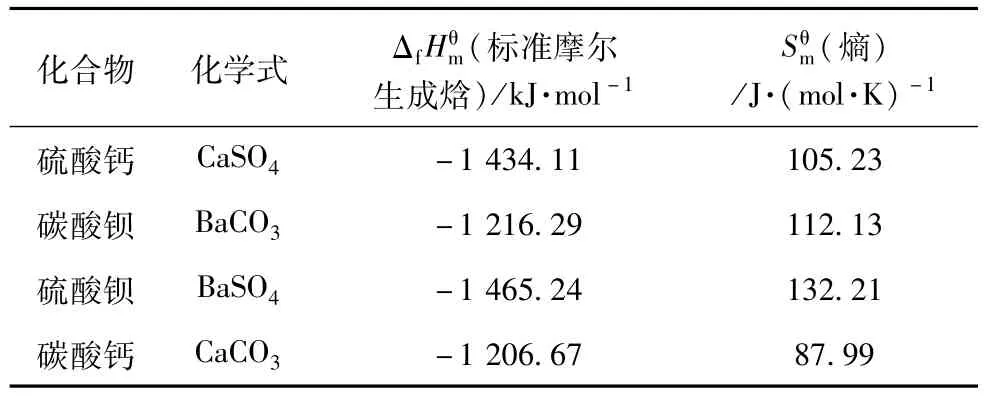
表2 物质在温度为298 K下的热力学数值
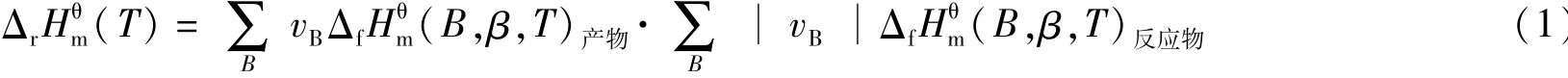
因此由焓变公式:式中:ΔrHθm(T)为标准摩尔焓变/kJ·mol-1;ΔfHθm为标准摩尔生成焓/kJ·mol-1;vB为物质B的化学计量数。
可以算出ΔH=-21.51 kJ/mol,由于ΔH=-21.51 kJ/mol<0,可以判断该反应为吸热反应;
由熵变公式:
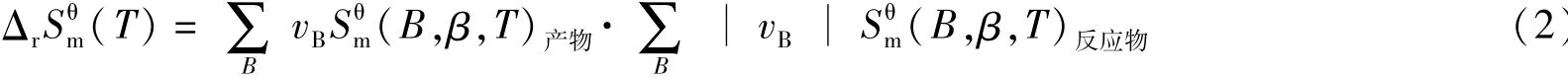
式中:Δr(T)为标准摩尔熵变/J·(mol·K)-1;Sθm为标准摩尔熵/J·(mol·K)-1;vB为物质B的化学计量数。
可以算出ΔS=2.84 J/molK>0。
所以,根据ΔG=ΔH-TΔS,可以算出:
ΔG=-867.83 kJ/mol<0
ΔH<0,ΔS>0;ΔG<0,反应可以正向自发进行。
式中:ΔG为吉布斯自由能变/kJ·mol-1;ΔH为焓变/kJ·mol-1;T为绝对温度/K;ΔS为熵变/J·(mol·K)-1。
2 废水试验结果与分析
2.1 废水的性质
废水取自河池·南丹工业园区重金属废水处理站的出水,离子含量见表3,测定实际废水pH值为11.0。其中钙离子含量为1 867.9 mg/L,硫酸根为4 482.88 mg/L。

表3 实际废水中离子含量
2.2 废水搅拌时间对试验结果的影响
拟定搅拌时间控制在20 min。各取300 mL废水置于4个500 mL的烧杯中,溶液中SO2-4和Ca2+的含量分别为4 482.88 mg/L和1 867.87 mg/L。
采用一段搅拌法,搅拌速率:460 r/min、温度:50℃,改变BaCO3与CaSO4投加比对去除率的影响,试验结果见表4。
小区楼下,一对住在这里的外地夫妻在吵架,说的是方言,其他人都听不懂,但仍然有不少人围观。那男的不耐烦地吼:“你们看什么呀,听得懂吗?”
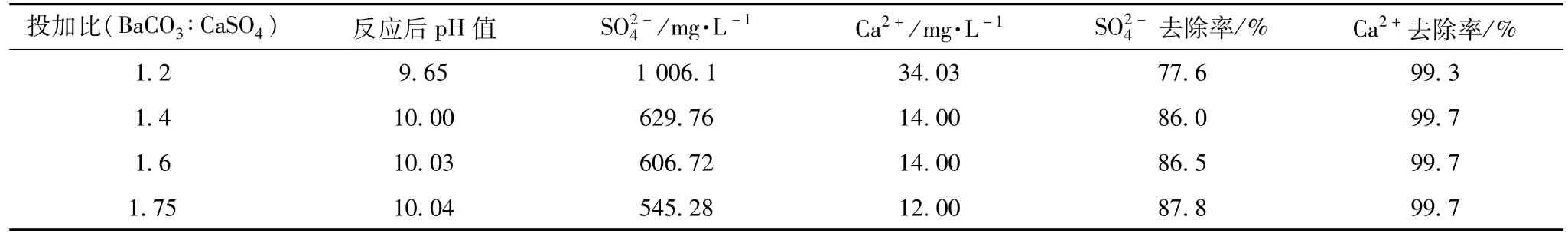
表4 废水中投加比对去除率的影响
由表4数据可以看出,废水中的硫酸根含量较高,考虑投加的碳酸钡需要和溶液中离子反应充分等问题,采用分两段进行搅拌做对比试验寻求最佳搅拌时间。
采用两段搅拌法,将反应温度控制在50℃,搅拌速率460 r/min,BaCO3与CaSO4投加比控制在1.5。改变废水分段搅拌时间对试验结果的影响见表5。
采用两段搅拌法,将反应温度控制在50℃,搅拌速率460 r/min,第一段搅拌时间控制在控制在20 min,搅拌完成后静置6 h;第二段搅拌时间控制在10 min,搅拌完成后静置6 h。改变BaCO3与CaSO4投加比对试验结果的影响见表6。
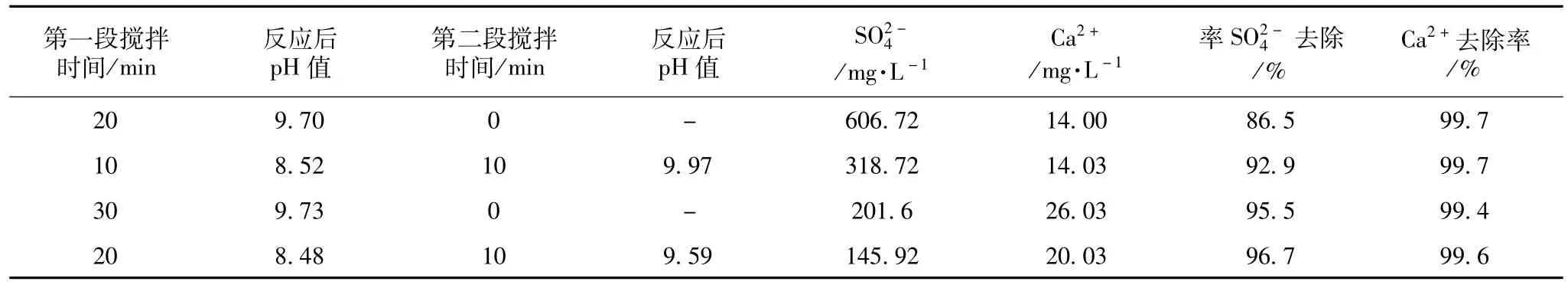
表5 废水分段搅拌时间对去除率的影响
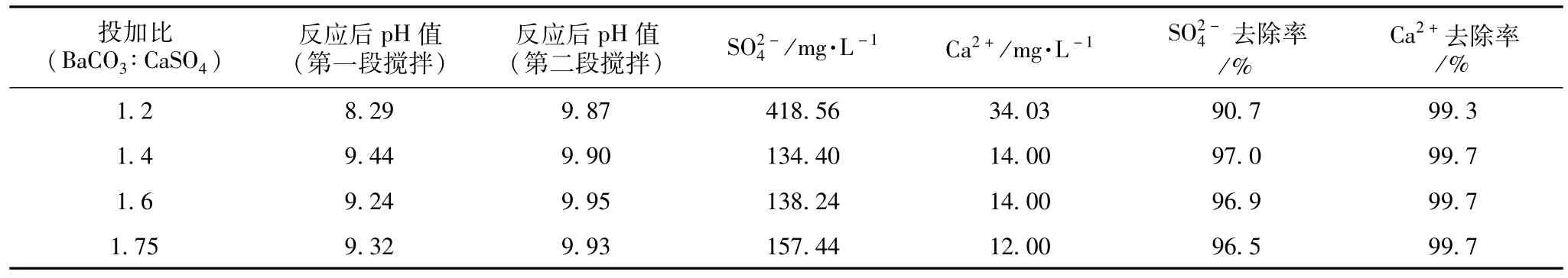
表6 废水在不同投加比时分段搅拌对去除率的影响
由此可以看出,充分的搅拌时间是影响废水试验去除率的一个关键因素。采用分两段搅拌方式即先搅拌20 min后静置6 h,再搅拌10 min后静置6 h,测得溶液中剩余钙离子和硫酸根较为理想。对比表5和表6可以看到,当采用分两段搅拌后,硫酸根的去除率明显上升,并在投加比控制在1.4~1.6时到达最佳。
2.3 废水反应温度对试验结果的影响
采用两段搅拌法,BaCO3与CaSO4投加比控制在1.5,第一段搅拌时间控制在20 min,搅拌完成后静置6 h;第二段搅拌时间控制在10 min,搅拌完成后静置6 h。不同反应温度对试验结果的影响见表7,对去除率的影响如图1所示。
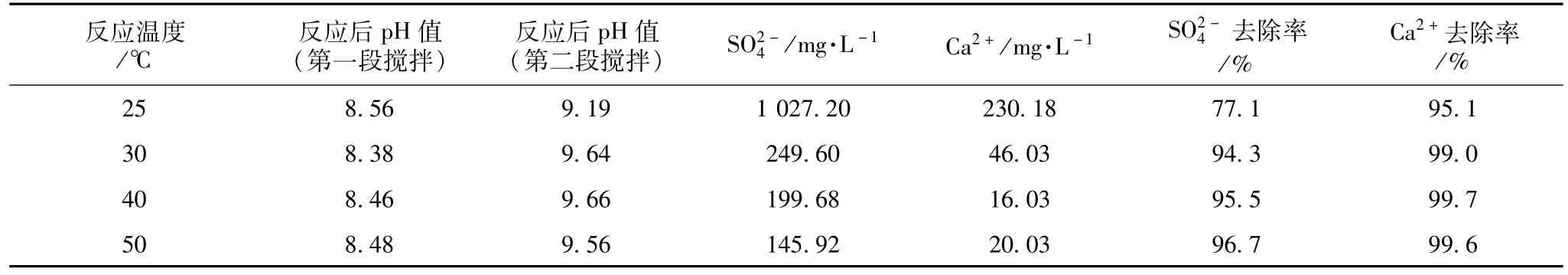
表7 废水反应温度对去除率的影响
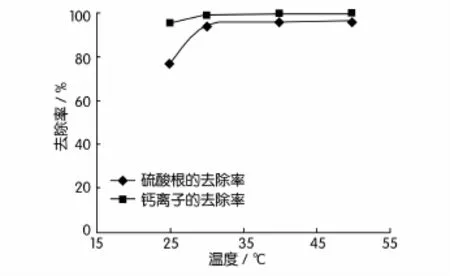
图1 废水投加比为1.5时反应温度对去除率的影响
由表7、图1可知,在废水反应中,室温下的去除效果并不理想。的去除率在温度为30℃时出现转折,在30~50℃时,去除率曲线趋于平坦。由此可以看出,废水试验中的最佳反应温度范围确定在30~50℃之间,考虑到温度每升高1℃所投入的设备损耗费用和电费,可认为废水去除率最高时的温度为50℃,而最佳反应温度为30℃。
两段搅拌后,从试验数据来看,投加比控制在1.4~1.6为最佳。因此,投加比的范围选取在1.3~1.6之间寻找。
采用两段搅拌法,反应温度控制在30℃,第一段搅拌时间控制在20 min,搅拌完成后静置6 h;第二段搅拌时间控制在10 min,搅拌完成后静置6 h。改变BaCO3与CaSO4投加比对试验结果的影响见表8,对去除率的影响如图2所示。
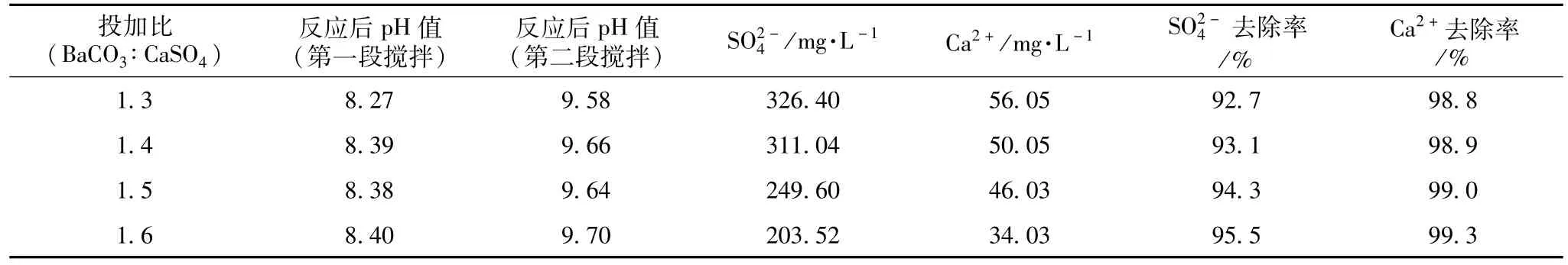
表8 废水投加比对去除率的影响
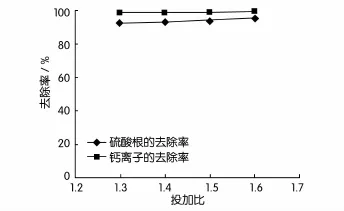
图2 废水反应温度为30℃时投加比对去除率的影响
2.5 沉淀时间对废水试验结果的影响
在废水试验过程中,需要注意到的一点是,每次搅拌完以后的沉淀时间对于和Ca2+的去除率有着很大的影响。从下面一组数据可以看出:
采用两段搅拌法,反应温度控制在40℃,BaCO3与CaSO4投加比控制在1.4,第一段搅拌时间控制在20 min,,第二段搅拌时间控制在10 min。不同沉淀静置时间对试验结果的影响见表9。

表9 废水沉淀时间对反应的影响
采用两段搅拌法,反应温度控制在40℃,BaCO3与CaSO4投加比控制在1.6,第一段搅拌时间控制在20 min,第二段搅拌时间控制在10 min。不同沉淀静置时间对试验结果的影响见表10。
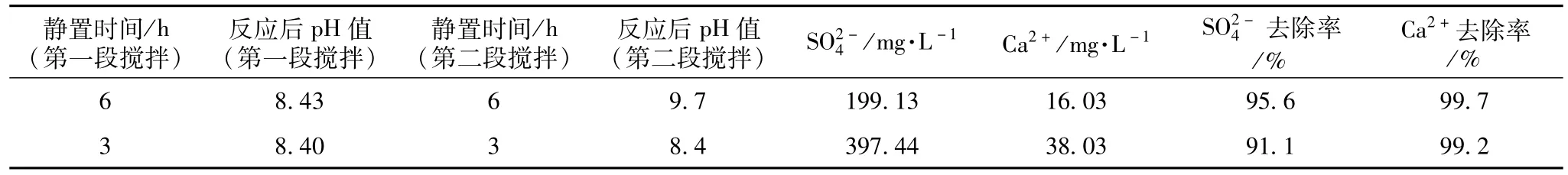
表10 废水沉淀时间对反应的影响
由以上两组对比数据可以看到,当沉淀时间较短,反应时间不够充足时,即便是在同样的投加比、搅拌时间和反应温度下,所得到的结果差距是很大的。所以每次搅拌过后的沉淀静置时间是废水试验的一个关键因素。
3 成本估算
除硫酸根的化学方法主要有BaCl2法,CaCl2法和BaCO3法,对三种方法进行经济性比较,若用这三种方法同时处理1 t废水,所产生的费用见表11。
表11 BaCl2法、CaCl2法和BaCO3法去除的费用对比

表11 BaCl2法、CaCl2法和BaCO3法去除的费用对比
沉淀剂投加比(加入量与硫酸根的摩尔比)1.2 1 880 2.19 CaCl21.5 750 0.58 BaCO3万元BaCl2价格/元·t-1)金额/1.5 1 450 2.0
从表11可以看出,CaCl2法去除的费用最低,然而该处理后的工业废水将作为工业循环用水的补充水,用CaCl2法处理后出水中的产生的CaSO4是微溶沉淀,增加了水中Ca2+含量,不宜采用。而且CaCl2法和BaCl2法除硫酸根的同时引入了氯离子,也会对系统造成腐蚀,所以这两种方法都不宜采用。BaCO3法除硫酸根比BaCl2法更节约费用,且碳酸钡法在除硫酸根的同时把钙离子也去除了,无需再投加新的药剂去除超标的钙离子。综上所述,三法比较下来,采取碳酸钡法除水中硫酸根和钙离子为最经济。
4 结 论
1.碳酸钡法除钙离子和硫酸根从理论以及实践上来说都是切实可行的。
2.废水试验中去除钙离子和硫酸根的最佳运行参数是:温度30℃,投加比为1.5,采取分两段搅拌方式,两段搅拌的搅拌速率均控制在460 r/min,第一段搅拌时间20 min,反应后沉淀6 h后,进行第二段搅拌,搅拌时间10 min,反应后沉淀6 h后溶液待测,此时水中的和Ca2+浓度均能达到:[]<250 mg/L,[Ca2+]<50 mg/L(以CaCO3计)。
3.相较于传统方法,碳酸钡法除钙离子和硫酸根更加经济、合理,在工业工艺循环水的处理上将带来巨大的经济效益。
4.在实际生产或中试试验中,考虑到运用斜板沉淀池来完成沉淀过程可以适当缩短沉淀时间,也可以考虑投加絮凝剂来加快沉淀速度。
[1] 王忠福.我国水资源利用中的问题与可持续利用对策[J].西安邮电学院学报,2011,16(5):123-127.
[2] 罗胜联.有色重金属废水处理与循环利用研究[D].长沙:中南大学,2006.
[3] 张玉霞,谢洪勇,陈卫东.超高石灰铝法去除工业废水中高浓度硫酸根离子[J].上海第二工业大学学报,2016,33(4):278-282.
[4] 王玉东,赵丹,董延茂,等.钙矾石沉淀法去除镁剂脱硫废水中硫酸根离子研究[J].工业水处理,2015,35(6):54-57.
[5] 牛风明.矿井水中硫酸根、总硬度去除试验研究[D].太原:太原理工大学,2008.
[6] 胡冬冬.高矿化度矿井水硫酸盐、总硬度去除的试验研究[D].太原:太原理工大学,2008.
[7] 王卉春.矿井水中硫酸根及总硬度去除效果的试验研究[D].太原:太原理工大学,2008.
[8] Mulopo J,Motaung S.Carbothermal reduction of barium sulfate-rich sludge from acid mine drainage treatment[J].MineWater and the Environment,2014,33(1):48-53.
[9] Tony J,David L P.Microbial sulfate reduction under sequentially acidic conditions in an upflow anaerobic packed bed bioreactor[J]. Water Research,2006,40:2 561-2 571.
Ca2+andRemoval by Barium Carbonate in Com prehensive Smelting W astewater
HE Jing-min,LIXu-zhong
(CINF Engineering Co.,Ltd.,Changsha 410011,China)
Improving the industrialwastewater reuse rate of decrease in efflux of circular economy an importantway to promote industrial water-savingmethod,is also an important way to solve the shortage of water resources in china. Every year,non-ferrous metal smelting factory will produce large amounts of acidic wastewater containing heavy metals.At present,in the treatment of wastewater containing heavy metals,the most commonly used method is lime neutralization method.But the industrial practice found,sulfate and calcium ion concentration after the treatment of the waste station is high,which is not appropriately used asmake-up water for industrial circulating water system. Therefor this experiment using more economical barium carbonate,which is used in the treated water after lime neutralization method.Through dynamic test,study the different dosage,temperature,reaction time and sedimentation time on the barium carbonate powder removal of sulfate,calcium effects,and analyze the corresponding reaction mechanisms,make water residual sulfate and calcium hardness after treatment can be stabilized at250 mg/L and 50 mg/L(CaCO3),reached by supplementary water requirements of cycle cooling water system in"The reuse of urban recycling water-Water quality standard for industrial uses"and"Standards of reclaimed water quality".
barium carbonate;sulfate;calcium;heavymetal acidic wastewater
X703.1
A
1003-5540(2017)02-0056-05
2017-2-22
何静旻(1987-),女,工程师,从事市政给排水,民建给排水,有色金属冶炼废水处理等领域研究和设计工作。
