朱顶红花梗与子房组织培养技术研究
2017-05-10上海町硕花卉有限公司上海市浦东新区201302
王 宇 江 黎 (上海町硕花卉有限公司,上海市浦东新区 201302)
朱顶红花梗与子房组织培养技术研究
王 宇 江 黎 (上海町硕花卉有限公司,上海市浦东新区 201302)
为探索适合朱顶红组织培养的方法,从而为朱顶红工厂化生产提供技术依据,以朱顶红花梗和子房为外植体,探究了不同培养基对愈伤组织诱导的影响、不同激素配比对不定芽诱导的影响、不同激素配比对试管苗继代增殖的影响、不同基质对组培苗成活的影响。结果表明,朱顶红花梗最适诱导培养基配方为1/2 MS+2.0 mg/L 6-BA+0.5 mg/L NAA+0.5 g/L AC,子房最适诱导培养基配方为1/2 MS+4.0 mg/L 6-BA+0.5 mg/L NAA+0.5 g/L AC。继代增殖培养基配方为1/2 MS+4.0 mg/L 6-BA+0.2 mg/L NAA+2.0~4.0 mg/L PP333+0.5 g/L AC。移栽基质为纯沙∶田园土=1∶1。
朱顶红;花梗;子房;组织培养;技术研究
朱顶红别名朱顶兰、孤挺花、华胄兰、百子莲,为单子叶亚纲石蒜科朱顶红属多年生具鳞茎的观赏植物。杂种朱顶红花大色艳、高贵美观,具有极高的观赏价值;再加上朱顶红商品球容易运输、栽培相对简单,随着网络购物的发展,成为了网络园艺店主的首推品种,杂交朱顶红商品种球的需求也越来越大[1]。
目前,国产的朱顶红种球数量极少且质量较差,生产中多依赖于进口,价格昂贵;同时,朱顶红鳞茎的自然繁殖率较低,多数杂交品种不产子球。因此,建立优质高效的朱顶红种球繁殖技术体系是提高其种球数量和质量的关键。近年来,国内外已广泛采用鳞茎扦插和刻伤法进行朱顶红繁殖,但鳞茎扦插和刻伤法操作程序繁琐、成本高、生根率低、扦插苗长势弱、成苗率低。组织培养技术是目前植物快繁的有效方法之一,具有繁殖系数高、成苗时间短和便于商品化和产业化生产的优势。
目前,虽然国内外关于朱顶红组织培养的研究一直不断,且在用朱顶红鳞茎盘和双鳞片诱导不定芽等方面取得了良好的效果,但使用鳞茎为外植体代价太大、污染严重、死亡率和褐化率较高[2、3],对比传统的鳞茎扦插没有太大优势[4]。除鳞茎盘和双鳞片外,也有关于用朱顶红花梗和子房作外植体诱导植株成功的报道研究,但均未成系统、再现性差[5-7]。为此,本试验在总结前人研究的基础上,以朱顶红花梗和子房为外植体,探究了不同培养基对愈伤组织诱导的影响、不同激素配比对不定芽诱导的影响、不同激素配比对试管苗继代增殖的影响、不同基质对组培苗成活的影响,以期系统地探索适合朱顶红组织培养的方法,旨在通过组织培养提高朱顶红的繁殖速度,为朱顶红工厂化生产提供技术依据。
1 材料与方法
1.1 试验材料与地点
本试验所用材料为荷兰朱顶红杂交品种“花孔雀”。试验设在上海町硕花卉有限公司园艺场进行。
1.2 试验设计
从朱顶红母株上采集未开放的花蕾,放入烧杯中用自来水冲洗10 min,然后在超净工作台上,把材料放入75%酒精中消毒30 s,再用0.1%HgCl2处理8 min,然后用无菌水冲洗5次。用无菌刀将花蕾剥开,将花序分开,把花梗和子房分别切成1 mm左右切片(以1朵花序平均具4朵花计算,大概可切得100~120片),用镊子将切片平铺在培养基上,每瓶接种5片。
1.2.1 不同处理对朱顶红外植体褐变的抑制效果
组培过程中外植体褐变现象严重,为抑制褐变程度,在采取不定芽诱导的同时,结合暗培养48 h,在培养基中分别添加不同浓度的Vc与活性炭(AC),以不添加作对照,观察外植体褐变情况与生长状态,Vc浓度分别为0.2、0.5、1.0 g/L;活性炭浓度分别为0.2、0.5、1.0 g/L。每个培养基配方中均添加琼脂粉5.2 g/L、蔗糖30 g/L,pH为5.8~6.0。每个处理接种10瓶,每处理重复3次。
1.2.2 不同培养基对朱顶红花梗、子房诱导不定芽的影响
诱导不定芽试验采用的3种基本培养基分别为MS、1/2 MS、B5,NAA设0.1、0.5、1.0 mg/L三个水平,6-BA设0.5、1.0、2.0、4.0 mg/L四个水平。每个培养基配方中均添加琼脂粉 5.2 g/L、蔗糖 30 g/L、活性炭0.5 g/ L,pH为5.8~6.0。培养温度24 ℃,先暗培养48 h,再进行光照培养(光照时间为16 h/d,光照强度为1500 Lx)。每个处理接种10瓶,每处理重复3次。
1.2.3 不同激素配比对朱顶红继代增殖培养的影响
以1/2 MS为基本培养基,研究不同浓度6-BA、NAA、多效唑(PP333)对朱顶红继代增殖培养的影响。NAA设0.1、0.2、0.5 mg/L三个水平,6-BA设1.0、2.0、4.0 mg/L三个水平,PP333设1.0、2.0、4.0、6.0 mg/L四个水平。每个培养基配方中均添加蔗糖45 g/L、琼脂粉5.2 g/L,pH为5.8~6.0。
1.2.4 不同基质对朱顶红移栽的影响
选择继代增殖获得的朱顶红生根苗移到大棚,开盖炼苗3 d,然后取出洗净根部培养基,浸入多菌灵1000倍液中消毒3 mim,稍晾干,移栽至3种基质中(纯沙,蛭石,纯沙∶田园土=1∶1)。保证苗床温度在22~28 ℃,适当遮阴,光强强度为10000 Lx,每2 d浇水1次。4周后观察朱顶红幼苗生长情况。
2 结果与分析
2.1 不同处理对朱顶红外植体褐变的抑制效果
据观察,朱顶红花梗和子房在接种1 d后,培养基上部的外植体表层会出现轻微的褐化现象,颜色呈浅黄色,而与培养基接触的部位未变色;到第3天,鳞茎盘外层褐化加重,与培养基接触的部位也出现轻微褐色。由表1可知,朱顶红外植体褐变现象严重,在不添加附加物的条件下,褐变死亡率达64.2%。添加不同浓度的Vc与AC,对外植体褐变均有一定的抑制效果,其中添加1.0 g/L Vc和1.0 g/L AC处理的褐变死亡率明显低于对照,分别为16.3%和0,添加1.0 g/L AC处理的褐变死亡率虽为最低,但外植体生长状态较对照缓慢,诱导率明显降低;而Vc控制褐化效果不佳,且容易导致愈伤组织玻璃化,降低诱导率。因此,以在培养基中加入0.5 g/L AC为宜,可取得理想的褐变抑制效果。
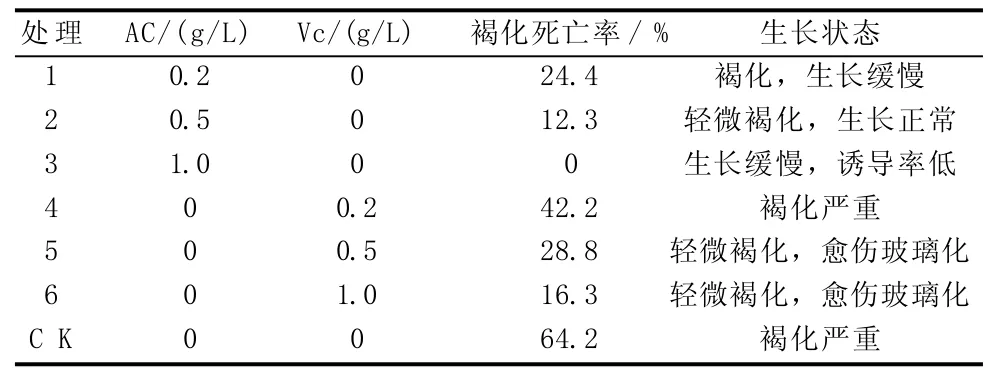
表1 不同处理对朱顶红外植体褐变的抑制效果
2.2 不同培养基配方对朱顶红花梗、子房诱导不定芽的影响
朱顶红花梗和子房在接种1周后,有的外植体开始膨大、变绿,到第3周时,有的外植体变褐死亡,有的开始出现玻璃化,有的继续膨大形成绿色突状物,到第5周时,部分外植体开始长出根或不定芽,于第8周统计各处理的不定芽诱导率、平均不定芽数量。
2.2.1 对花梗诱导不定芽的影响
由表2可知,以花梗为外植体,在基本培养基1/2 MS中,不定芽诱导率达48.1%、不定芽数量为4.1个,明显高于在MS和B5培养基。

表2 不同培养基配方对朱顶红花梗诱导不定芽的影响
由表3可知,在NAA浓度一定时,随着6-BA浓度的增大,平均不定芽增殖数量增大。以0.5 mg/L NAA、4.0 mg/L 6-BA时不定芽增殖数量最大,达7.2个,但此处理不定芽诱导率不是最高。以0.5 mg/L NAA、2.0 mg/L 6-BA时不定芽诱导率最高,达84.3%,表明6-BA继续增加浓度会导致不定芽诱导率下降。当NAA浓度为1.0 mg/ L时,不定芽诱导率、不定芽增殖数量均很低。综合考虑,最佳组合为2.0 mg/L 6-BA、0.5 mg/L NAA。

表3 不同激素配比对朱顶红花梗诱导不定芽的影响
2.2.2 对子房诱导不定芽的影响
由表4可知,以子房为外植体,在基本培养基1/2 MS中,不定芽诱导率达52.6%、不定芽数量为6.4个,明显高于MS和B5培养基。
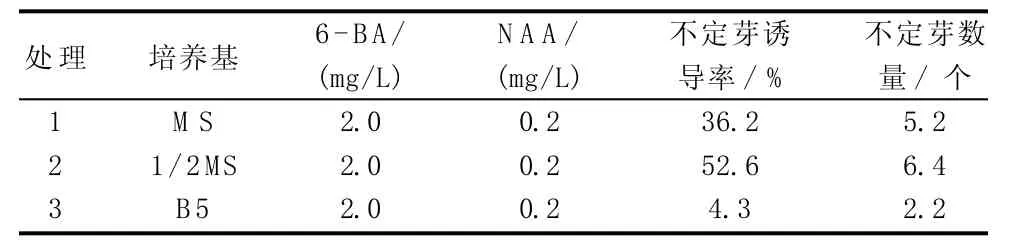
表4 不同培养基配方对朱顶红子房诱导不定芽的影响
由表5可知,在NAA浓度为0.5 mg/L时,随着6-BA浓度的增大,平均不定芽诱导率增大,于6-BA浓度为4.0 mg/L时,达到最高值(86.2%),此时不定芽数量也较大(8.2个),均高于NAA浓度为0.1、1.0 mg/L的处理。因此,最佳组合为4.0 mg/L 6-BA与0.5 mg/L NAA。

表5 不同激素配比对朱顶红子房诱导不定芽的影响
2.3 不同激素配比对朱顶红继代增殖培养的影响
2.3.1 6-BA、NAA不同浓度配比对朱顶红继代增殖培养的影响
通过初代培养,从花梗和子房外植体诱导出的朱顶红小鳞茎需要进一步切割进行继代增殖培养,以获得更多无菌植株。将小鳞茎对半切成0.5 cm2大小的方块,接种到6-BA、NAA不同浓度配比的培养基中,培养30 d后统计结果(见表6)。在NAA浓度一定时,随着6-BA浓度的增加,增殖系数明显增加,均以6-BA浓度为4.0 mg/L时达最佳。NAA浓度为0.1 mg/L、0.2 mg/L间增殖系数差异不明显,而NAA浓度为0.5 mg/L时,增殖系数急剧下降,这是因为小鳞茎长了很多愈伤组织,抑制了小鳞茎的产生。

表6 不同浓度6-BA、NAA配比对朱顶红继代增殖培养的影响
2.3.2 不同浓度PP333对朱顶红继代增殖培养的影响
薛寒青在百合组培试验中得出,PP333能改变同化物的分配,将同化物运输到正在生长的球茎上,促进百合球茎或鳞茎的形成与生长[8,9]。由表7可知,PP333对朱顶红的鳞茎生长有明显促进作用,对朱顶红鳞茎的分化与形成也有一定促进作用。其中处理(2)、(3)相比对照,鳞茎直径和增殖系数均明显增加,但当PP333浓度超过4.0 mg/L时,鳞茎直径和增殖系数明显下降,根系变短且少,表明过大浓度的PP333会抑制叶片和根的生长,从而对鳞茎的形成和生长产生抑制作用。因此,PP333最适浓度为2.0~4.0 mg/L。

表7 不同浓度PP333对朱顶红继代增殖培养的影响
2.4 不同基质对朱顶红移栽的影响
朱顶红生根苗移栽至3种基质中,据4周后观察结果(见表8),朱顶红生根苗在纯沙中成活率最低,但也达87.3%,表明朱顶红移栽成活较容易;在纯沙与田园土混合基质中,朱顶红生根苗生长情况最好,生长量最大,叶片长度达12.2 cm、鳞茎直径达19.2 mm。分析其原因是纯砂透水性好,但保湿性差,干燥后结构紧实,会对根部造成挤压,使根系不容易往下伸展,而田园土与纯沙混和,则能有效利用田园土中的养分,同时拌合了纯沙,能提高基质的透水性,更有利于植株的旺盛生长。蛭石透水性、保水性适中,但本身不含营养,只能维持植株的一般性生长。

表8 不同基质对朱顶红移栽的影响
3 结论与讨论
试验结果表明,采用未开放的朱顶红花序作外植体进行消毒,因为其外层有未展开的花瓣包裹,消毒后污染率接近0。与其它部位外植体相比,花器官不需要破坏种球,且子房和花梗平均可切得100~120片外植体,而1个直径20 cm的种球最多只能切得60片左右双鳞片或鳞茎盘外植体[3]。因此,利用子房和花梗作外植体成本优势明显。对于外植体褐化的抑制效果,王培军[10]在外植体接种5 d后,取出刮去外层褐色部分,转接到新的培养基里,每5 d转接1次,连续转接3次,可基本控制褐变。而本文通过暗培养48 h与添加0.5 g/L的活性炭也能有效控制外植体褐化现象,但Vc的褐化抑制效果不明显,且易导致外植体玻璃化,这与李萍等[11]人对牡丹使用防褐剂的研究一致。同时,在继代增殖培养中,采用0.5 g/L活性炭能在抑制褐变的同时,有利于根系的生长,省去了生根的环节。朱顶红生根苗的移栽只要保证适宜的温度(22~28 ℃)、避免过强的光照(光照强度≤10000 Lx)和定期浇水,无论在纯沙、蛭石还是纯沙与田园土混合基质中,成活率都较高,其中以纯沙与田园土比例为1∶1混合的基质最有利于生长。
综合考虑,得出结论如下:朱顶红花梗最适诱导培养基配方为1/2MS+2.0 mg/L6-BA+0.5 mg/L NAA+0.5 g/L AC,子房最适诱导培养基配方为1/2MS+4.0 mg/L 6-BA+0.5 mg/L NAA+0.5 g/LAC。继代增殖培养基配方为1/2MS+4.0 mg/L 6-BA+0.2 mg/L NAA+2.0~4.0 mg/ L PP333+0.5 g/L AC。移栽基质为纯沙∶田园土=1∶1。
[1] 马媛媛,吴沙沙,焦雪辉,等.朱顶红的栽培与应用[J].农业工程技术·温室园艺,2010(8):55-61.
[2] 娄晓鸣,周玉珍,孔贤,等.杂交朱顶红鳞茎不定芽诱导研究[J].安徽农业科学,2009,37(34):16769-16770.
[3] 原雅玲,张延龙,赵锦丽,等.朱顶红鳞茎切块的繁殖方法[J].西北农林科技大学学报(自然科学版),2008,36(9):108-112.
[4] 王贤,熊敏,卫尊征,等.朱顶红研究综述[J].农业科技与信息:现代园林,2014(8):49-54.
[5] EN O'Rourke, WM Fountain, S Sharghi.Propagation of Hippeastrum from floral tissues by invitroculture[J].Herbertia, 1991,47(1/2):51-52.
[6] 原雅玲,张亚玲.朱顶红组织培养最佳繁殖途径的研究[C]//中国园艺学会观赏园艺专业委员会年会.2006:628-636.
[7] 姜明兰,钟文田.朱顶红愈伤组织的诱导和植株再生[J].植物生理学报,1984(1):37-40.
[8] 薛寒青.PP333在百合组织培养中的作用[J].河北林业科技, 2007(3):25-26.
[9] 刘冬云,史宝胜,李银华,等.不同碳源及PP(333)、GA3对山丹组培苗鳞茎增大的影响[J].河北农业大学学报,2005,28(2):32-35.
[10] 王培军.不同培养基对朱顶红愈伤组织诱导影响的研究[J].科技创新与生产力,2005(S2):45-47.
[11] 李萍,成仿云,张颖星.防褐剂对牡丹组培褐化发生、组培苗生长和增殖的作用[J].北京林业大学学报,2008,30(2):71-76.
2016-12-22
上海市科委星火富民项目《大花朱顶红种球国产化繁育与推广》(编号:153919178000)。
