微碱条件生物酶法提取大鲵肝脏油脂及其脂肪酸组成分析
2017-05-10胡代花
胡代花
(1.陕西理工大学 维生素D生理与应用研究所/大鲵研究所,陕西 汉中 723000; 2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
生物工程
微碱条件生物酶法提取大鲵肝脏油脂及其脂肪酸组成分析
胡代花1,2
(1.陕西理工大学 维生素D生理与应用研究所/大鲵研究所,陕西 汉中 723000; 2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
以大鲵肝脏为原料,采用微碱条件生物酶法提取大鲵肝脏油脂。通过单因素试验及正交试验,研究了pH、料液比、加酶量、酶解时间、酶解温度对提取率的影响,确定了大鲵肝脏油脂提取的最佳工艺参数,并用气相色谱对其脂肪酸组成进行分析。结果表明:大鲵肝脏油脂的最佳提取条件为酶解时间 3 h、碱性蛋白酶加酶量1 500 U/g、料液比1∶2、pH 7、酶解温度30℃,在该工艺条件下大鲵肝脏油脂的提取率为81.67%;大鲵肝脏油脂中主要含12种脂肪酸,分别为C18∶1 24.51%、C16∶0 21.74%、C16∶1 13.02%、C18∶3(ω-6)12.61%、C18∶2 6.18%、C18∶3(ω-3)4.04%、C22∶6 3.51%、C22∶0 3.45%、C14∶0 2.97%、C20∶4 2.83%、C24∶0 2.65%、C18∶0 2.48%,其中饱和脂肪酸(SFA)占33.29%,不饱和脂肪酸(UFA)占66.70%,单不饱和脂肪酸(MUFA)占37.53%,多不饱和脂肪酸(PUFA)占29.17%,具有保健功能作用的ω-6型PUFA为21.62%,ω-3型PUFA为7.55%。研究表明大鲵肝脏具有较高的营养价值和脂质开发潜力。
大鲵肝脏;油脂;生物酶法;碱性蛋白酶;脂肪酸组成
中国大鲵(Andriasdavidianus)是我国珍稀名贵特产,属国家二类保护动物,具有极高的营养及药用价值,被誉为“水中人参”[1-3]。为保护和利用大鲵资源,20世纪60年代以来大鲵的人工养殖取得重要进展。随着原生态、仿生态和全人工三大繁育模式技术的突破,全国大鲵繁殖与养殖总量约170万尾[4]。资源量的增加也使大鲵产品的开发利用成为可能,养殖大鲵具有极大的市场前景和产业化开发价值,目前已被开发为食品、保健食品、药品及护肤品等多样化产品[5-6]。大鲵油含有多种不饱和脂肪酸,是治疗烫伤、烧伤的特效药,大鲵油还具有预防心血管疾病的作用[7]。大鲵肝脏油脂丰富,杨红生等[8]研究分析了大鲵肝脏中8种常见脂肪酸(C14∶0, C16∶0, C16∶1, C18∶0, C18∶1, C18∶2,C18∶3, C20∶4)的含量,刘绍等[9]测定了大鲵肝脏中3种必需脂肪酸(C18∶2, C18∶3, C20∶4)和DHA(C22∶6)的含量,但对大鲵肝脏油脂的提取条件优化及脂肪酸组成分析尚未见系统报道。
传统的油脂提取方法主要有蒸煮法、淡碱水解法等。其中蒸煮法会对油脂功能成分造成一定程度的破坏,而淡碱水解法产生的废液中钠盐含量高,不能进一步有效利用[10]。酶解法是利用蛋白酶对蛋白质的水解作用,破坏蛋白质和脂肪的结合关系,从而释放出油脂。其条件温和且酶解产物易于继续利用,可提高原料附加值,已成为油脂提取工艺发展的新趋势而得到较广泛应用[11-15]。
本文旨在采用微碱条件生物酶法提取大鲵肝脏油脂,通过单因素试验和正交试验对提取条件进行优化,并应用气相色谱对其脂肪酸组成进行分析,期望能为大鲵肝脏的精深加工和高值化综合利用提供一定理论基础和现实依据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
新鲜大鲵肝脏:由汉中龙鲵生物科技有限公司提供,将其用组织捣碎机匀浆处理,于-18℃冻藏,每次使用前取出放入 4℃冷藏箱过夜解冻,参照GB/T 5009.6—2003方法测定其粗脂肪含量为26.36%。37种脂肪酸甲酯混合标准品(47885 U):美国Supelco 公司;碱性蛋白酶(活性≥200 000 U/g):北京奥博星生物技术有限责任公司;氢氧化钠、正己烷、甲醇、异丙醇等均为分析纯:天津市富宇精细化工有限公司。
1.1.2 仪器与设备
TYLD022组织捣碎机:九阳股份有限公司;RV10数显型旋转蒸发仪:德国IKA公司;BSA224SCW分析天平:赛多利斯科学仪器(北京)公司;5810 R高速离心机:德国Eppendorf公司;1013A电热鼓风干燥箱:天津市泰斯特仪器有限公司;GC-2010型气相色谱仪:日本岛津公司(GC Real Time Analysis色谱工作站,配备FID检测器);JOYNSXT06脂肪测定仪:上海乔跃电子有限公司。
1.2 试验方法
1.2.1 大鲵肝脏油脂的制备
取一定量的大鲵肝脏经解冻后,按一定的料液比加入蒸馏水,调节pH至一定范围,加入适量碱性蛋白酶,适宜温度下酶解一定时间,趁热离心分离肝脏油脂。油脂提取率=提取油脂质量(g)/肝脏中粗脂肪质量(g)×100%。
1.2.2 脂肪酸组成分析
样品甲酯化:取3~4滴大鲵肝脏油脂,加入1 mL 2.5 mol/L的H2SO4-CH3OH溶液充分溶解,70℃充氮气水浴30 min,再加入2 mL正己烷充分摇匀,静置分层后,取上清液,重复加入2 mL正己烷充分摇匀,合并上清液,供气相色谱分析。
色谱条件:InertCap-WAX 毛细管柱(30 m×0.25 mm×0.25 μm);进样量1 μL,分流比100∶1;进样口温度250℃;检测器温度250℃;载气(氮气)流速49.5 mL/min;辅助气(氢气)流速500 mL/min;升温程序为120℃保持5 min,5℃/min 升温至 215℃,保持38 min,整个分析过程62 min。
1.2.3 数据处理
每个样品平行测定3次,采用SPSS 16.0软件对数据进行统计分析,单因素方差分析(ANOVE,Tukey’s检验)进行显著性检验,并采用Duncan’s法进行单因素多重比较分析,P<0.05为差异显著。
2 结果与分析
2.1 单因素试验
2.1.1 料液比对大鲵肝脏油脂提取率的影响
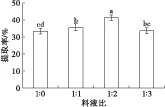
在pH 7、加酶量300 U/g、酶解时间2 h、酶解温度50℃ 的条件下,不同料液比(1∶0、1∶1、1∶2、1∶3)对大鲵肝脏油脂提取率的影响如图1所示。
注:图中标记不同字母的两项间具有显著差异(P<0.05),下同。
图1 不同料液比对大鲵肝脏油脂提取率的影响
由图1可知,料液比对大鲵肝脏油脂提取率有一定影响,油脂提取率随着料液比的升高呈现先增加后降低的趋势。当料液比为1∶2时,提取率最大,达41.32%±0.60%。继续增加料液比至1∶3,提取率反而降低,为33.64%±0.77%,且与料液比为1∶2 时的提取率存在显著差异(P<0.05),而较高的料液比易造成溶剂和能源的浪费。因此,确定大鲵肝脏油脂提取的料液比为1∶2。
2.1.2 pH对大鲵肝脏油脂提取率的影响
在料液比1∶2、加酶量300 U/g、酶解时间2 h、酶解温度50℃的条件下,不同pH(6、7、8、9)对大鲵肝脏油脂提取率的影响如图2所示。
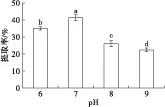
图2 不同pH对大鲵肝脏油脂提取率的影响
由图2可知,pH对大鲵肝脏油脂提取率的影响较大,油脂提取率随着pH的升高呈现先增加后降低的趋势。当pH为7时提取率最大,达41.37%±0.76%。当pH增至8和9时,提取率显著降低,分别为26.12%±0.71%和22.36%±0.48%,且二者均与pH为7时的提取率差异显著(P<0.05)。因此,确定大鲵肝脏油脂提取的pH为7。
2.1.3 加酶量对大鲵肝脏油脂提取率的影响
在料液比1∶2、pH 7、酶解时间2 h、酶解温度50℃ 的条件下,不同加酶量(300、600、900、1 500 U/g)对大鲵肝脏油脂提取率的影响如图3所示。
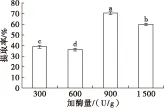
图3 不同加酶量对大鲵肝脏油脂提取率的影响
由图3可知,加酶量对大鲵肝脏油脂提取率的影响较大,当加酶量为900 U/g时提取率最大,达70.76%±0.42%。当继续增加加酶量至1 500 U/g时,提取率反而降低,为59.84%±0.47%,且二者差异显著(P<0.05)。因此,确定大鲵肝脏油脂提取的加酶量为900 U/g。
2.1.4 酶解温度对大鲵肝脏油脂提取率的影响
在料液比1∶2、pH 7、加酶量900 U/g、酶解时间2 h的条件下,不同酶解温度(30、40、50、60℃)对大鲵肝脏油脂提取率的影响如图4所示。
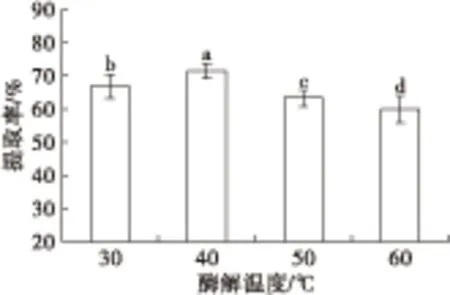
图4 不同酶解温度对大鲵肝脏油脂提取率的影响
由图4可知,酶解温度对大鲵肝脏油脂提取率的影响较大,油脂提取率随着酶解温度的升高呈现先增加后降低的趋势。当酶解温度为40℃时提取率最大,达71.52%±0.51%。当酶解温度逐渐升至50℃和60℃时,提取率显著降低,分别为63.58%±0.53%和60.01%±0.97%,且二者均与40℃时的提取率差异显著(P<0.05)。因此,确定大鲵肝脏油脂提取的酶解温度为40℃。
2.1.5 酶解时间对大鲵肝脏油脂提取率的影响
在料液比1∶2、pH 7、加酶量900 U/g、酶解温度40℃的条件下,不同酶解时间(0.5、1、3、5 h)对大鲵肝脏油脂提取率的影响如图5所示。
由图5可知,酶解时间对大鲵肝脏油脂提取率的影响较大,油脂提取率随着酶解时间的延长呈现先增加后降低的趋势。当酶解时间为3 h时提取率最大,达65.81%±1.04%。当继续延长酶解时间至5 h时,提取率反而降低,为55.68%±0.53%,且与酶解时间为3 h时的提取率存在显著差异(P<0.05)。因此,确定大鲵肝脏油脂提取的酶解时间为3 h。
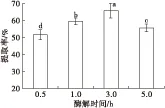
图5 不同酶解时间对大鲵肝脏油脂提取率的影响
2.2 正交试验优化
根据单因素试验结果,固定料液比1∶2,选取酶解时间(A)、加酶量(B)、pH(C)和酶解温度(D)作为考察因素,油脂提取率作为考察指标,以四因素三水平进行正交试验对酶解条件进行优化,正交试验设计及结果见表1。
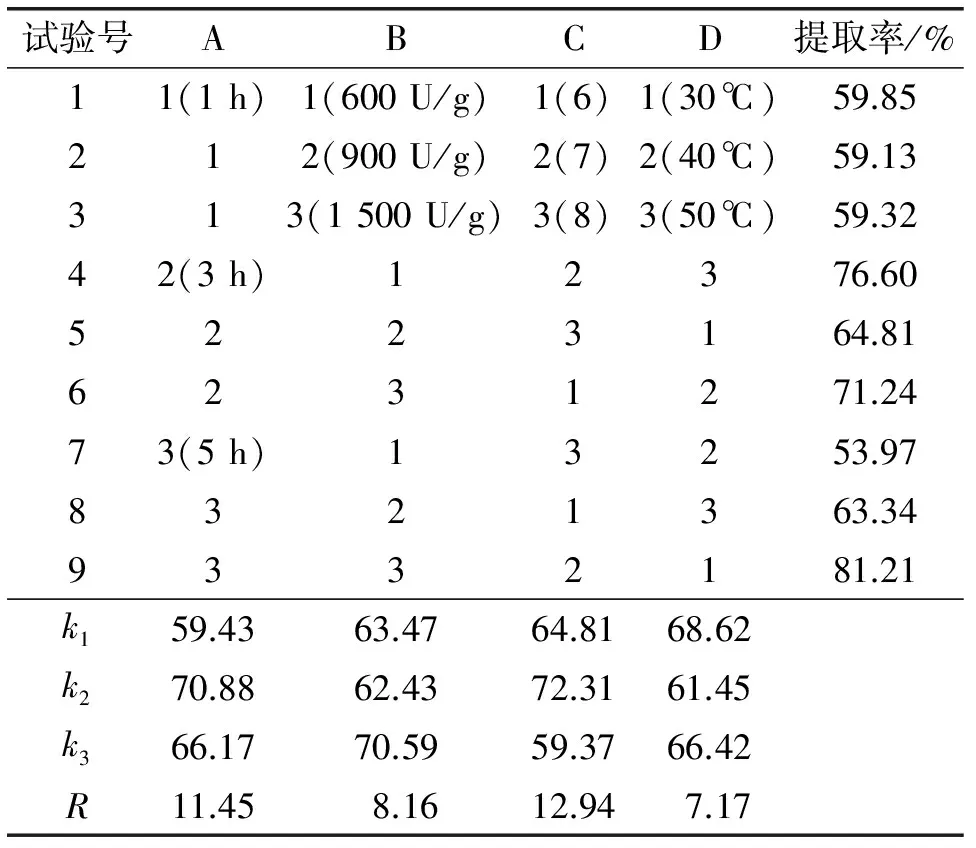
表1 正交试验设计及结果
由表1可以看出,各因素对大鲵肝脏油脂提取率的影响依次为: pH>酶解时间>加酶量>酶解温度,即pH的影响最大,酶解时间和加酶量次之,酶 解温度的影响最小。优化试验条件为A2B3C2D1,即酶解时间3 h,加酶量1 500 U/g,pH 7,酶解温度30℃。对优化条件进行验证试验,提取率高达81.67%。
2.3 大鲵肝脏油脂的脂肪酸组成分析
将优化条件下所提取的大鲵肝脏油脂经甲酯化处理,采用气相色谱法对其脂肪酸组成进行分析,样品气相色谱图见图6;通过标准品对照和数据库检索对其脂肪酸组成进行定性分析,并按峰面积归一化法进行定量分析[16-18],大鲵肝脏油脂脂肪酸组成及相对含量见表2。
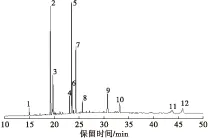
图6 大鲵肝脏油脂气相色谱图
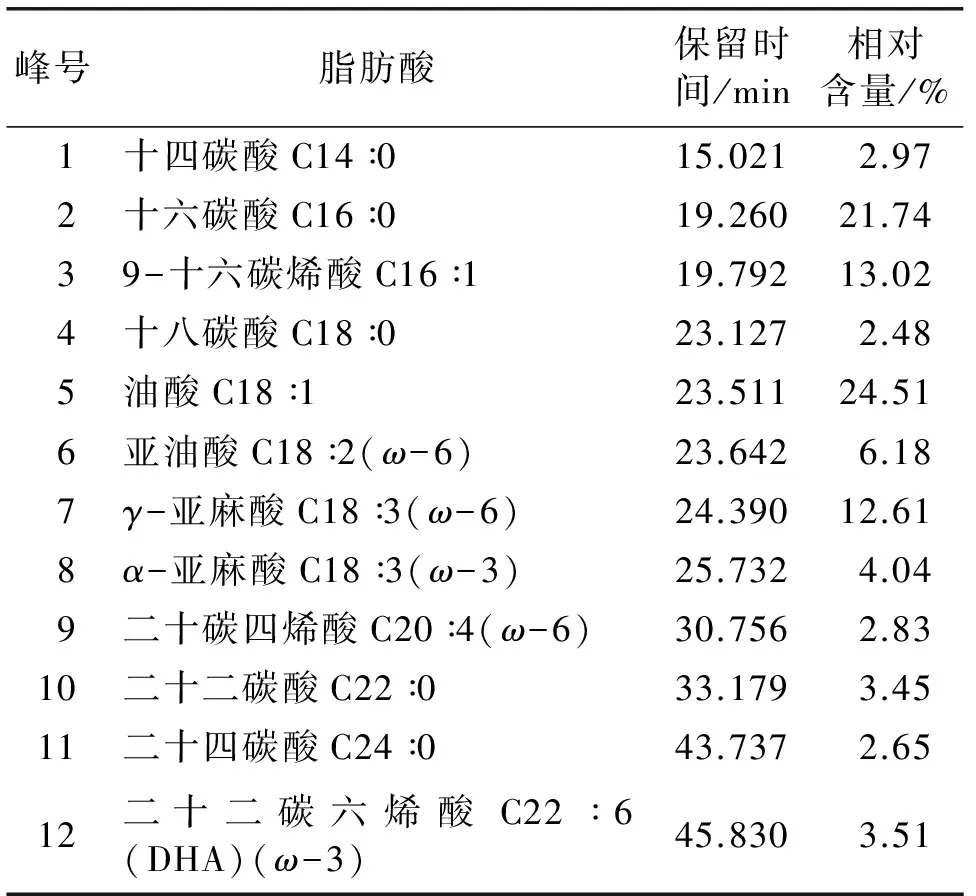
峰号脂肪酸保留时间/min相对含量/%1十四碳酸C14∶015.02102.972十六碳酸C16∶019.26021.7439-十六碳烯酸C16∶119.79213.024十八碳酸C18∶023.12702.485油酸C18∶123.51124.516亚油酸C18∶2(ω-6)23.64206.187γ-亚麻酸C18∶3(ω-6)24.39012.618α-亚麻酸C18∶3(ω-3)25.73204.049二十碳四烯酸C20∶4(ω-6)30.75602.8310二十二碳酸C22∶033.17903.4511二十四碳酸C24∶043.73702.6512二十二碳六烯酸C22∶6(DHA)(ω-3)45.83003.51
由表2可以看出,大鲵肝脏油脂中主要含12种脂肪酸:C18∶1 24.51%、C16∶0 21.74%、C16∶1 13.02%、C18∶3(ω-6)12.61%、C18∶2 6.18%、C18∶3(ω-3) 4.04%、C22∶6 3.51%、C22∶0 3.45%、C14∶0 2.97%、C20∶4 2.83%、C24∶0 2.65%、C18∶0 2.48%。其中饱和脂肪酸(SFA)占33.29%,不饱和脂肪酸(UFA)占66.70%,单不饱和脂肪酸(MUFA)占37.53%,多不饱和脂肪酸(PUFA)占29.17%,具有保健功能作用的ω-6型PUFA为21.62%,ω-3型PUFA为7.55%。研究表明大鲵肝脏具有较高的营养价值和脂质开发潜力。
3 结 论
(1)通过单因素试验和正交试验优化得到微碱条件生物酶法提取大鲵肝脏油脂的最佳条件:料液比1∶2,酶解时间3 h,加酶量1 500 U/g,pH 7,酶解温度30℃。在最佳提取条件下,大鲵肝脏油脂的提取率为81.67%。
(2)大鲵肝脏油脂中主要含12种脂肪酸,分别为C18∶1 24.51%、C16∶0 21.74%、C16∶1 13.02%、C18∶3(ω-6)12.61%、C18∶2 6.18%、C18∶3(ω-3) 4.04%、C22∶6 3.51%、C22∶0 3.45%、C14∶0 2.97%、C20∶4 2.83%、C24∶0 2.65%、C18∶0 2.48%,其中饱和脂肪酸(SFA)占33.29%,不饱和脂肪酸(UFA)占66.70%,单不饱和脂肪酸(MUFA)占37.53%,多不饱和脂肪酸(PUFA)占29.17%,具有保健功能作用的ω-6型PUFA为21.62%,ω-3型PUFA为7.55%。研究表明大鲵肝脏具有较高的营养价值和脂质开发潜力。
[1] 赵尔宓. 中国濒危动物红皮书: 两栖类和爬行类[M]. 北京: 科学出版社, 1998: 30-32.
[2] 章克家, 王小明, 吴巍, 等. 大鲵保护生物学及其研究进展[J]. 生物多样性, 2002, 10(3): 291-297.
[3] 侯进慧, 朱必才, 童玉玮, 等. 中国大鲵研究进展[J]. 四川动物, 2004, 23(3): 262-265.
[4] 于讯. 汉中大鲵已成为陕西渔业经济一大亮点[J]. 现代渔业信息, 2010(3): 29.
[5] 罗庆华. 中国大鲵营养成分研究进展及食品开发探讨[J]. 食品科学, 2010,31(19): 390-393.
[6] 李莉, 王锡昌, 刘源. 中国养殖大鲵的食用、药用价值及其开发利用研究进展[J]. 食品工业科技, 2012, 33(9): 454-458.
[7] PENG Z, YUE Q C, YI F L, et al. The complete mitochondrial genome of the Chinese giant salamander,Andriasdavidianus[J]. Gene, 2003, 311(5): 93-98.
[8] 杨红生, 杨干荣, 王辉. 大鲵六种组织中游离脂肪酸的分析[J].河南师范大学学报(自然科学版), 1992, 20(1): 115-117.
[9] 刘绍, 刘卉琳, 周治德, 等. 饲养中国大鲵肝脏与肌肉中几种重要脂肪酸的测定与分析[J].食品与机械,2009,25(3): 21-22,26.
[10] 陶宁萍, 鲍丹. 鱼油的营养和药用价值及其提取工艺的研究进展[J]. 上海水产大学学报, 2005, 14(2): 197-201.
[11] 姚东瑞, 周鸣谦, 刘云鹤, 等. 响应面法优化酶法提取泥鳅鱼油的研究[J]. 中国粮油学报,2012, 27(6): 66-70.
[12] 洪鹏志, 刘书成, 章超桦, 等. 酶解法提取鱼油的工艺参数优化[J]. 湛江海洋大学学报, 2006, 26(3): 45-49.
[13] 刘书成, 章超桦, 洪鹏志, 等. 酶解法从黄鳍金枪鱼鱼头中提取鱼油的研究[J]. 福建水产, 2007(1):46-50.
[14] 吴祥庭. 优化水酶法提取鲐鱼鱼油的酶解条件[J]. 食品科学, 2006, 27(11): 270-273.
[15] 吴祥庭. 响应面法优化酶法水解提取鲨鱼鱼油条件[J]. 中国粮油学报, 2007, 22(1): 91-94.
[16] 李加兴, 李偲, 吴越, 等. 黄秋葵籽油的提取工艺优化及脂肪酸组成分析[J]. 中国油脂, 2013, 38(10): 5-8.
[17] 李子璇, 秦公伟, 江海, 等. 3种干果中脂肪酸的组成及其分析比较[J]. 食品与发酵工业, 2009, 35(12): 137-139.
[18] 唐萍, 鲜欣言, 胡怀容, 等. 超声波辅助提取黄秋葵籽油及其脂肪酸组成分析[J]. 中国油脂, 2014, 39(8): 14-17.
Extraction ofAndriasdavidianusliver oil by micro alkali enzymatic hydrolysis and analysis of its fatty acid composition
HU Daihua1,2
(1.Vitamin D Research Institute/Institute of Chinese Giant Salamander, Shaanxi University of Technology, Hanzhong 723000, Shaanxi, China; 2.College of Food Science and Engineering, Northwest A & F University, Yangling 712100, Shaanxi, China)
TheAndriasdavidianusliver oil was extracted by the method of micro alkali enzymatic hydrolysis fromAndriasdavidianusliver. The effects of pH, ratio of material to liquid, dosage of enzyme, enzymatic hydrolysis time and enzymatic hydrolysis temperature were discussed and the optimal parameters were obtained by single-factor experiment and orthogonal experiment. In addition, the fatty acid composition of the oil was analyzed by gas chromatography. The results indicated that the optimal extraction conditions ofAndriasdavidianusliver oil were obtained as follows: enzymatic hydrolysis time 3 h, dosage of alkaline protease 1 500 U/g, ratio of material to liquid 1∶2, pH 7 and enzymatic hydrolysis temperature 30℃. Under these conditions, the extraction rate was 81.67%. There were totally twelve kinds of fatty acids inAndriasdavidianusliver oil with their contents as follows: C18∶1 24.51%, C16∶0 21.74%, C16∶1 13.02%, C18∶3(ω-6) 12.61%, C18∶2 6.18%, C18∶3(ω-3) 4.04%, C22∶6 3.51%, C22∶0 3.45%, C14∶0 2.97%, C20∶4 2.83%, C24∶0 2.65%, C18∶0 2.48%. And there were 33.29% of saturated fatty acids (SFA), 66.70% of unsaturated fatty acids(UFA), 37.53% of monounsaturated fatty acids(MUFA), and 29.17% of polyunsaturated fatty acids(PUFA), and the contents ofω-6 PUFA andω-3 PUFA were 21.62% and 7.55% respectively. The research indicated that theAndriasdavidianusliver had a high nutritional valve and considerable potential for lipid exploitation.
Andriasdavidianusliver; oil; enzymatic hydrolysis; alkaline protease; fatty acid composition
2016-09-19;
2017-01-13
陕西理工大学博士后科研专项项目(SLGBH16-04);陕西省自然科学基金项目(2014JQ2083)
胡代花(1983),女,讲师,博士,主要从事生物资源开发与应用方面的研究工作(E-mail)hudaihua007@163.com。
TS225.2;TQ644.3
A
1003-7969(2017)04-0113-05
