马来酸酐酰化改性对大豆分离蛋白功能性质的影响
2017-05-10由耀辉陈利维项能双熊林颖郑小刚
由耀辉,陈利维,项能双,熊林颖,郑小刚
(1.内江师范学院 化学化工学院,四川 内江641000;2.内江师范学院 果蔬类废弃物资源化四川省高等学校重点实验室,四川 内江641000)
马来酸酐酰化改性对大豆分离蛋白功能性质的影响
由耀辉1,2,陈利维1,项能双1,熊林颖1,郑小刚1
(1.内江师范学院 化学化工学院,四川 内江641000;2.内江师范学院 果蔬类废弃物资源化四川省高等学校重点实验室,四川 内江641000)
研究马来酸酐酰化改性对大豆分离蛋白功能性质的影响。结果表明:随着马来酸酐用量的增大,大豆分离蛋白的酰化度增大,等电点降低;随着酰化度的增大,大豆分离蛋白构象松散,色氨酸残基的微环境趋向于暴露于水的状态,亲水性增强;经马来酸酐酰化改性后,大豆分离蛋白的溶解性、发泡性、乳化性及乳化稳定性均显著提升,但泡沫稳定性有所下降。研究表明,马来酸酐酰化改性大豆分离蛋白是一种非常有前景的功能性食品添加剂。
大豆分离蛋白;马来酸酐;酰化度;功能性质
大豆分离蛋白具有资源量丰富、成本低廉、营养价值高等优点备受人们青睐,广泛应用于食品工业领域。然而,大豆分离蛋白较差的水溶性、乳化性、发泡性等缺点限制了其规模应用[1-3]。因此,如何改善大豆分离蛋白的功能性质是当前研究的热点。
研究发现酰化改性是改善蛋白质功能性质的有效途径,其中又以琥珀酰化效果较佳。Franzen等[4]比较了琥珀酰化和乙酰化改性对大豆蛋白功能性质的影响,发现琥珀酰化比乙酰化更有效地提升大豆蛋白的水溶性、乳化性、发泡性等,该实验结果同样得到了熊正俊等[5]的证实。Gruener等[6]分别对油菜籽12S球蛋白进行琥珀酰化和乙酰化改性,结果表明,酰化后油菜籽12S球蛋白的发泡性和乳化性显著提升。Achouri等[7]对水解大豆分离蛋白琥珀酰化改性,琥珀酸酐的引入改变了水解大豆分离蛋白的亲疏水及电荷性能,导致水解大豆分离蛋白相对分子质量及构象的变化,进而改善了水解大豆分离蛋白水溶性、乳化性、发泡性等。然而,琥珀酸酐不溶于水,其酰化反应是非均相反应,容易引起反应不均一等问题。与之相比,马来酸酐是另一种常见的酰化试剂,其结构与琥珀酸酐相似,但水溶性优于琥珀酸酐,此外马来酸酐还具备不饱和双键结构,有利于进一步改性修饰,有望用于改善大豆分离蛋白的功能性质。从现有资料来看,已有采用马来酸酐对菜籽蛋白及非洲槐豆蛋白改性的相关报道[8-9],但鲜见关于马来酸酐对大豆分离蛋白改性的报道。因此,本文尝试以马来酸酐对大豆分离蛋白酰化改性,系统研究不同酰化度对大豆分离蛋白结构及性能的影响,以期为大豆分离蛋白改性应用提供有益的参考。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
大豆分离蛋白(食品级),郑州博研生物科技有限公司;茚三酮(分析纯),上海三爱思试剂有限公司;D-果糖(分析纯),成都市科龙化工试剂厂;马来酸酐(分析纯),成都市科龙化工试剂厂;其他试剂均为分析纯。
1.1.2 仪器与设备
TU-1950紫外分光光度计,北京普析通用仪器有限责任公司;F-4600荧光分光光度计,日本日立公司;ZS90Zeta电位仪,英国马尔文公司。
1.2 实验方法
1.2.1 马来酸酐酰化大豆分离蛋白
马来酸酐酰化大豆分离蛋白的反应机理如图1所示。较佳的反应条件如下:称取5 g大豆分离蛋白分散于100 mL蒸馏水中,用1 mol/L的NaOH溶液调pH至10,转移至装有温度计、搅拌器、恒压滴液漏斗的三口烧瓶中,于60℃下孵化30 min。马来酸酐的添加量分别为大豆分离蛋白质量的20%、40%、60%,添加方式采用分批滴加。先称取一半质量的马来酸酐将其配制成水溶液(即刻使用以减少马来酸酐水解作用,下同),滴加至体系中,在60℃条件下搅拌反应1.5 h后,将余下的马来酸酐配制成水溶液滴加至体系中,再反应1.5 h,反应过程中控制体系pH为9~10,最终体系pH调至6.0。选择截留相对分子质量为3 500的透析袋对酰化大豆分离蛋白透析24 h以去除杂质,冻干后用于分析表征。
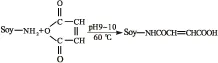
图1 马来酸酐酰化大豆分离蛋白的反应机理
1.2.2 酰化度测定
称取酰化前后的大豆分离蛋白粉末配制相应的质量浓度,采用茚三酮比色法测定伯氨基含量[10],方法简要如下:以0.5 mol/L的磷酸缓冲液(pH 6.0)为溶剂,配制5 g/L的茚三酮溶液,棕色瓶储存备用。取2 mL已知浓度的蛋白质溶液和1 mL茚三酮溶液混合,沸水浴反应15 min,冷却后加入体积分数40%的乙醇溶液定容到10 mL,以蒸馏水作空白,于570 nm波长下测定吸光值,代入甘氨酸标准曲线计算伯氨基含量。酰化度的计算公式如下:
酰化度=(未酰化大豆分离蛋白伯氨基含量-酰化大豆分离蛋白伯氨基含量)/未酰化大豆分离蛋白伯氨基含量
1.2.3 等电点测定
称取酰化前后的大豆分离蛋白粉末配制1 g/L溶液,调节pH在2~8之间,测定Zeta电位,当Zeta电位为0时的pH即为等电点(pI)。
1.2.4 荧光分析
以0.1 mol/L的磷酸缓冲液(pH 7.2)作为溶剂,配制质量浓度为1 g/L的酰化前后大豆分离蛋白溶液,在激发波长295 nm、发射波长范围320~450 nm、狭缝宽度5 nm条件下,测定蛋白质溶液荧光强度。
1.2.5 溶解性测定
以0.1 mol/L的磷酸缓冲液(pH 7.2)作为溶剂,配制40 mL质量浓度为10 g/L的酰化前后大豆分离蛋白溶液,充分搅拌20 min后,于4 000 r/min离心5 min,采用茚三酮比色法测定上清液单位体积中的伯氨基含量[10],与离心前原液单位体积中伯氨基含量的比值即为溶解性。
1.2.6 发泡性及泡沫稳定性测定
以0.1 mol/L的磷酸缓冲液(pH 7.2)作为溶剂,配制50 mL质量浓度为10 g/L的酰化前后大豆分离蛋白溶液,将溶液置于搅拌机搅拌2 min后迅速转移至250 mL量筒中,记录0 min(初始)和30 min(终止)时的泡沫高度,初始高度(mL)作为发泡性指标,终止高度与初始高度的百分比作为泡沫稳定性指标。
1.2.7 乳化性及乳化稳定性测定
以0.1 mol/L的磷酸缓冲液(pH 7.2)作为溶剂,配制质量浓度为10 g/L的酰化前后大豆分离蛋白溶液,取25 mL大豆分离蛋白溶液和15 mL菜籽油,充分混合5 min后,置于带刻度的离心管,4 000 r/min离心5 min,以离心后乳化层占总液体体积的百分比作为乳化性指标。再次于4 000 r/min离心20 min,以残留乳化层占原乳化层的百分比作为乳化稳定性指标。
2 结果与分析
2.1 酰化度
酰化反应主要发生在大豆分离蛋白的伯氨基上,因此伯氨基数量的变化可以直接反映出酰化反应是否有效地进行。马来酸酐用量对大豆分离蛋白酰化度的影响如图2所示。经测定未酰化大豆分离蛋白的伯氨基含量为31 mmol/100 g,与文献[11]报道的基本一致。由图2可知,随着马来酸酐用量的增大,大豆分离蛋白的酰化度增大。当马来酸酐用量为20%、40%和60%时,酰化度分别达到了0.66,0.80和0.92,这表明酰化反应成功进行。

图2 马来酸酐用量对大豆分离蛋白酰化度的影响
2.2 等电点
大豆分离蛋白是典型的两性化合物,当其溶液Zeta电位为0时的pH即为大豆分离蛋白的等电点(pI)。马来酸酐酰化对大豆分离蛋白等电点的影响如图3所示。由图3可知,未改性大豆分离蛋白的pI为4.8,随着酰化度的增加,大豆分离蛋白的pI逐渐降低,当酰化度为0.66、0.80和0.92时,pI分别下降至4.2、4.0和3.9。这是因为酰化反应将大豆分离蛋白阳离子的伯氨基转化为阴离子的马来酰基,导致了pI向低pH处偏移。这一实验结果进一步佐证了酰化反应成功进行。

图3 酰化度对大豆分离蛋白等电点的影响
2.3 荧光分析
大豆分离蛋白的内源荧光主要源于分子中色氨酸、酪氨酸及苯丙氨酸的苯环和共轭双键结构,一般来说,采用280 nm激发,内源荧光主要来自疏水性色氨酸残基和亲水性酪氨酸残基,但由于存在酪氨酸残基向色氨酸残基的能量转移,酪氨酸与色氨酸的荧光光谱不能被区分;采用295 nm激发,仅有疏水性色氨酸残基被激发[12-14]。因此,本文选择295 nm作为内源荧光激发波长,研究马来酸酐酰化对大豆分离蛋白色氨酸残基荧光特性的影响,结果如图4所示。由图4可知,随着酰化度的增加,大豆分离蛋白的荧光强度逐渐减小。其原因可能是酰化反应使色氨酸残基所处微环境发生变化,引入的马来酰基(双键结构)对色氨酸残基产生了荧光猝灭作用。
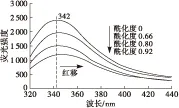
图4 酰化度对大豆分离蛋白内源荧光光谱的影响
根据Burstein等[15]提出的色氨酸残基微环境的3个特点:当最大荧光发射波长在330~332 nm时,色氨酸残基微环境处于完全非极性区域;当最大荧光发射波长在340~342 nm时,色氨酸残基有限暴露于水中;当最大荧光发射波长在350~353 nm时,色氨酸残基完全暴露于水中。由图4可知,未改性大豆分离蛋白的最大荧光发射波长在342 nm,此时色氨酸残基处于有限暴露于水的状态,随着酰化度的增大,最大荧光发射波长红移,这表明酰化反应破坏了大豆分离蛋白原有的有序结构,使部分包埋在分子内部的色氨酸残基趋向于完全暴露于水的状态。其原因可能是酰化过程处于碱性条件下,有助于大豆分离蛋白分子的溶胀,使分子结构松散[12],同时酰化反应将大豆分离蛋白阳离子的伯氨基转变为阴离子的马来酰基,与原有的阴离子基团形成静电排斥,导致多肽链的伸展和水分子的渗入[4,8]。
2.4 溶解性
图5为酰化度对大豆分离蛋白溶解性的影响。由图5可知,酰化改性能显著提高大豆分离蛋白的溶解性,随着酰化度的增大,大豆分离蛋白的溶解性增加,当酰化度为0.66、0.80和0.92时的溶解性分别是未改性大豆分离蛋白的1.35、1.54倍和1.82倍。溶解性的增加一方面是由于酰化过程碱性溶胀作用及马来酰基引入产生的静电排斥导致大豆分离蛋白分子构象变得更加松散,与水分子间的相互作用增强;另一方面源于引入的马来酰基具有较强的亲水性,同时产生的静电排斥使大豆分离蛋白分子间不易聚集[16]。
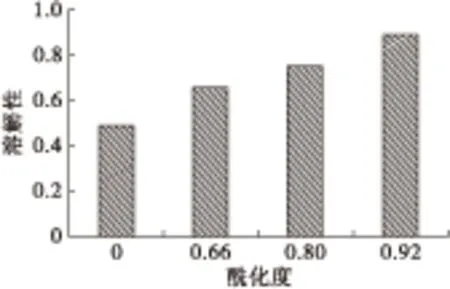
图5 酰化度对大豆分离蛋白溶解性的影响
2.5 发泡性及泡沫稳定性
图6为酰化度对大豆分离蛋白发泡性及泡沫稳定性的影响。由图6可知,大豆分离蛋白的发泡性随酰化度的增大而不断提高。未改性的大豆分离蛋白发泡性仅为32 mL,而酰化度为0.66、0.80和0.92 时,其发泡性分别达到68、85 mL和91 mL,比未改性的大豆分离蛋白分别增加了113%、166%和184%。同时也可以发现,酰化后大豆分离蛋白的泡沫稳定性明显下降。未改性大豆分离蛋白的泡沫稳定性为84.4%,而酰化度为0.66、0.80和0.92时,其泡沫稳定性分别下降为33.8%、30.6%和28.5%。这是因为酰化反应后,大豆分离蛋白的肽链伸展,活性基团充分暴露,有利于泡沫的形成,并且溶解性的提高使更多的蛋白质分子参与到泡沫的形成;而马来酰基的引入导致蛋白质分子间的静电排斥,阻碍蛋白质分子在泡沫气液表面的稳定分布,从而降低了泡沫的稳定性[9,17-18]。
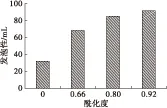
图6 酰化度对大豆分离蛋白发泡性及泡沫稳定性的影响
2.6 乳化性及乳化稳定性
大豆分离蛋白富含亲疏水基团,是一种天然的乳化剂。但是未改性的大豆分离蛋白水溶性差,且大部分疏水基团包埋在分子内部,故而乳化性能较差。图7为酰化度对大豆分离蛋白乳化性及乳化稳定性的影响。由图7可知,随着酰化度的增大,大豆分离蛋白的乳化性及乳化稳定性均显著增强。这是由于酰化反应改善了大豆分离蛋白的水溶性,分子构象松散,肽链伸展,疏水基团充分暴露,有利于将油脂包裹形成胶束,从而使乳化性提高;马来酰基的引入使形成的乳化胶束与水之间具有良好的亲和性,同时又增强了胶束间的静电排斥作用,使胶束高度分散不易聚结,从而提高了乳化稳定性[19-20]。
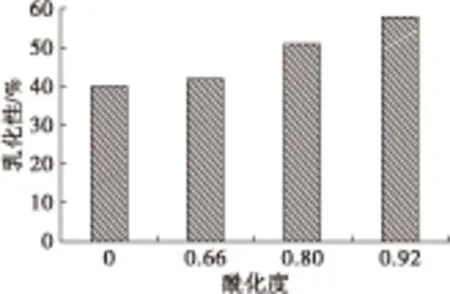
图7 酰化度对大豆分离蛋白乳化性及乳化稳定性的影响
3 结 论
如何改善大豆分离蛋白的功能性质是当前食品领域研究的热点。以马来酸酐为酰化剂对大豆分离蛋白酰化改性,通过改变酰化剂用量合成不同酰化度大豆分离蛋白。研究发现:随着酰化度的增大,大豆分离蛋白的溶解性、发泡性、乳化性及乳化稳定性得到明显改善,但泡沫稳定性有所下降。机理研究表明:酰化反应导致大豆分离蛋白分子构象松散,疏水基团暴露于水相;马来酰基的引入一方面增加了亲水基团,另一方面也加强了大豆分离蛋白分子的静电排斥作用,使之更稳定地存在水中。
[1] CHEN L, CHEN J, YU L, et al. Improved emulsifying capabilities of hydrolysates of soy protein isolate pretreated with high pressure microfluidization[J]. LWT-Food Sci Technol, 2016, 69: 1-8.
[2] LEE H, YILDIZ G, SANTOS L C, et al. Soy protein nano-aggregates with improved functional properties prepared by sequential pH treatment and ultrasonication[J]. Food Hydrocoll, 2016, 55: 200-209.
[3] MATEMU A O, KAYAHARA H, MURASAWA H, et al. Improved emulsifying properties of soy proteins by acylation with saturated fatty acids[J]. Food Chem, 2011, 124(2): 596-602.
[4] FRANZEN K L, KINSELLA J E. Functional properties of succinylated and acetylated soy protein[J]. J Agric Food Chem, 1976, 24(4): 788-795.
[5] 熊正俊, 赵国华. 酰化对大豆蛋白结构和功能性质影响[J]. 粮食与油脂, 2001(9): 5-7.
[6] GRUENER L, ISMOND M A H. Effects of acetylation and succinylation on the functional properties of the canola 12S globulin[J]. Food Chem, 1997, 60(4): 513-520.
[7] ACHOURI A, ZHANG W, SHIYING X.Enzymatic hydrolysis of soy protein isolate and effect of succinylation on the functional properties of resulting protein hydrolysates[J]. Food Res Int, 1998, 31(9): 617-623.
[8] PURKAYASTHA M D, BORAH A K, SAHA S, et al. Effect of maleylation on physicochemical and functional properties of rapeseed protein isolate[J]. J Food Sci Technol, 2016, 53(4): 1784-1797.
[9] LAWAL O S, DAWODU M O. Maleic anhydride derivatives of a protein isolate: preparation and functional evaluation[J]. Eur Food Res Technol, 2007, 226(1): 187-198.
[10] YOU Y, ZENG Y, LIU Y, et al. Fabrication of highly hydrophobic paper by coating with modified collagen hydrolysate[J]. J Soc Leath Technol Chem, 2014, 98(2): 69-75.
[11] 赵新淮, 冯志彪. 大豆蛋白水解物水解度测定的研究[J]. 东北农业大学学报, 1995, 26(2): 178-181.
[12] 王中江, 江连洲, 魏东旭, 等. pH对大豆分离蛋白构象及表面疏水性的影响[J]. 食品科学, 2012, 33(11): 47-51.
[13] 刘平, 胡志和, 吴子健, 等. 超高压引发胰蛋白酶构象变化与酶活间的关系[J]. 光谱学与光谱分析, 2015, 35(5): 1335-1339.
[14] 晋可, 张家兴, 尹宗宁. 用荧光参数表征牛血清白蛋白溶液的构象变化过程[J]. 中国药学杂志, 2013, 48(7): 535-536.
[15] BURSTEIN E A, VEDENKINA N S, IVKOVA M N. Fluorescence and the location of tryptophan residues in protein molecules[J].Photochem Photobiol, 1973, 18(4): 263-279.
[16] 宋寅, 严梅荣, 鞠兴荣. 酰化和酶水解对菜籽油蛋白功能性质和抗氧化活性的影响[J]. 食品科技, 2012, 37(2): 81-85.
[17] 邵平, 孙培龙, 孟祥河, 等. 琥珀酰化和蛋白酶改性对小麦面筋蛋白功能性质的影响[J]. 核农学报, 2007, 21(3): 268-272.
[18] 姚玉静, 杨晓泉, 邱礼平, 等. 酰化对大豆分离蛋白发泡性能的影响[J]. 中国油脂, 2008, 33(11): 21-23.
[19] 李磊, 迟玉杰, 王喜波. 琥珀酰化提高大豆分离蛋白乳化性的研究[J]. 中国粮油学报, 2010, 25(9): 17-22.
[20] XIANG Z, RUNGE T. Emulsifying properties of succinylated arabinoxylan-protein gum produced from corn ethanol residuals[J]. Food Hydrocoll, 2016, 52: 423-430.
欢迎订阅2017年度《中国油脂》

Effect of maleylation on functional properties of soy protein isolate
YOU Yaohui1,2,CHEN Liwei1,XIANG Nengshuang1, XIONG Linying1,ZHENG Xiaogang1
(1.College of Chemistry and Chemical Engineering,Neijiang Normal University,Neijiang 641000, Sichuan, China; 2. Key Laboratory of Fruit Waste Treatment and Resource Recycling of the Provincial Higher Learning Institutes, Neijiang Normal University,Neijiang 641000,Sichuan,China)
The effect of maleylation on functional properties of soy protein isolate was studied. The results showed that the acylation degree of soy protein isolate increased, and the isoelectric point of soy protein isolate decreased with dosage of maleic anhydride increasing. With acylation degree increasing, the conformation of soy protein isolate was loose, and the microenvironment of tryptophan residue tended to expose to water, and the hydrophilicity of soy protein isolate improved. While maleylation impaired the foam stability, the solubility, foam capacity, emulsifying capacity and emulsion stability of maleylated soy protein isolate were markedly ameliorated. The research showed good potential for maleylated soy protein isolate as functional food additive.
soy protein isolate; maleic anhydride; acylation degree; functional property
2016-08-31;
2017-01-04
国家自然科学基金(21506103)
由耀辉(1986),男,讲师,博士,研究方向为生物质资源化利用(E-mail)allenyouyaohui@163.com。
郑小刚,讲师,博士(E-mail)zhengxg123456@163.com。
TS201.2;TQ937
A
1003-7969(2017)04-0099-05
