醇洗法提取杜仲籽仁粕中桃叶珊瑚苷及制取浓缩蛋白
2017-05-10刘玉兰焦惠丽
刘玉兰,焦惠丽,李 骁
(河南工业大学 粮油食品学院,郑州450001)
油料蛋白
醇洗法提取杜仲籽仁粕中桃叶珊瑚苷及制取浓缩蛋白
刘玉兰,焦惠丽,李 骁
(河南工业大学 粮油食品学院,郑州450001)
以杜仲籽仁粕为原料,利用醇洗工艺提取桃叶珊瑚苷同时制备浓缩蛋白,并采用高效液相色谱法(HPLC-UV)检测杜仲籽仁及其粕、浓缩蛋白中桃叶珊瑚苷含量。结果表明:不同产地杜仲籽仁及其粕中桃叶珊瑚苷含量分别为6.86%~15.44%、5.25%~16.60%。利用含水乙醇对杜仲籽仁粕进行醇洗时,浓缩蛋白和提取液均会变黑,且基本检测不出桃叶珊瑚苷。只有用无水乙醇作为醇洗溶剂时,才能得到乳白色的浓缩蛋白和富含桃叶珊瑚苷的提取液,此时浓缩蛋白的蛋白质含量达到51.78%,较杜仲籽仁粕中提高16.54个百分点。以无水乙醇为溶剂提取杜仲籽仁粕中的桃叶珊瑚苷,最佳提取条件为提取温度80℃、提取时间20 min、液料比8∶1、提取次数2次。在最佳提取条件下,桃叶珊瑚苷的提取率达到94.82%。
杜仲籽;杜仲籽仁粕;桃叶珊瑚苷;醇洗;浓缩蛋白
杜仲,落叶乔木,是我国特有的单科植物。《神农百草经》和《本草纲目》中记载,杜仲的干燥树皮是我国特有的名贵滋补药材,它具有强筋健骨和防止衰老的功效。杜仲翅果油脂含量为13.53%~16.36%,杜仲翅果由籽仁和果壳组成,籽仁油脂含量为27.70%~31.84%[1-2]。杜仲籽油中不饱和脂肪酸含量高达90%,其中α-亚麻酸占脂肪酸总量的60%以上,是一种优质食用油[3]。卫生部2009年12号公告将杜仲籽油确定为新资源食品。杜仲籽仁除了富含油脂,还含有较为丰富的蛋白质及必需氨基酸[4],以及多种次生代谢产物,主要有木脂素类、环烯醚萜类、黄酮类、苯丙烷类、多糖、酚类、三萜类、甾类、有机酸、氨基酸、微量元素等[5]。其中桃叶珊瑚苷(aucubin,AU)是杜仲籽仁中含量最高的一种环烯醚萜类活性成分。在已报道含有AU的植物中,杜仲籽仁中AU的含量最高,达8%~11%[6]。AU又名珊瑚木苷,化学名为β-D-吡喃葡萄糖苷,易溶于水、甲醇、乙醇,几乎不溶于亲脂性有机溶剂(乙醚、氯仿、苯及石油醚)[7]。AU具有抗炎消肿镇痛、抗氧化、抗衰老、利尿、抗骨质疏松、促进干细胞再生、抗肿瘤、保护肝脏的作用[8-9]。有不少以AU为主要药性成分的药品和洗化用品,包括含有AU成分的染发剂,因为AU能与氨基酸反应生成棕黑色到黑色的树脂状聚合物沉淀,这种沉淀与发纤维附着性强,且色泽自然,对皮肤无刺激[10]。
AU含量测定方法有硫酸铜-分光光度法、薄层色谱分离-分光光度法、对二甲氨基苯甲醛法、高效液相色谱法等[11-12]。其中高效液相色谱法的分离效率高,选择性好,检测灵敏度高。本课题采用高效液相色谱法(HPLC-UV)进行样品中AU含量测定,以杜仲籽仁粕为原料,研究醇洗法制取浓缩蛋白同时得到富集AU提取液的方法和工艺条件,浓缩蛋白可以作为食用,富集AU提取液可以作为提纯AU产品的优良原料。本课题研究结果旨在为杜仲籽制油综合加工和资源高效利用提供支持。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
3个产地杜仲翅果原料样品,其中样品1产地为陕西省略阳县,样品2产地为河南省灵宝市,样品3产地为贵州省遵义市。
95%乙醇、无水乙醇、甲醇、甲酸、硫酸铜、硫酸钾、硫酸、硼酸、氢氧化钠、甲基红、溴甲酚绿:分析纯;甲醇:色谱纯;AU标准品:纯度≥99.0%,Sigma公司。
1.1.2 仪器与设备
Kjeltec 8100凯氏定氮仪,丹麦Foss公司;e2695高效液相色谱仪(配2489紫外检测器),美国Waters公司;RE52-86A旋转蒸发仪;KQ3200DE型数控超声波清洗器;LD5-10型低速离心机。
1.2 实验方法
1.2.1 HPLC-UV检测样品中AU含量[13]
液相色谱条件:Waters symmetryC18色谱柱(4.6 mm×250 mm,5.0 μm); 流动相为乙腈-水(体积比5∶95);检测波长206 nm;柱温30℃;流速0.6 mL/min;进样量10 μL。
标准溶液的配制:精确称取AU标准品25 mg于25 mL的棕色容量瓶中,用甲醇溶解,定容,得到质量浓度为1 000 mg/L的AU标准母液。用甲醇对母液逐级稀释,得到15.625、31.25、62.5、125、250、500 mg/L的系列标准溶液,0.22 μm有机滤膜过滤后进入液相色谱检测。
样品的前处理:6 mL甲醇(40%)溶解适量杜仲籽仁或浓缩蛋白样品,超声2 min,提取3次。
1.2.2 杜仲籽仁及浓缩蛋白主要组分测定
水分测定参照GB/T 5497—1985;粗脂肪测定参照GB/T 5512—2008;粗蛋白质测定参照GB/T 14489.2—2008。
1.2.3 AU的提取及醇洗浓缩蛋白制取
杜仲籽仁粕的制取:杜仲翅果经手工剥壳取籽仁,籽仁经粉碎后用石油醚在40℃条件下进行浸出取油,脱脂后的粕经真空干燥脱溶,用高速粉碎机粉碎,过80目筛,筛下物置于黑色自封袋内,放入4℃的冰箱中保存,备用。
AU的提取及醇洗浓缩蛋白制取[14]:称取一定量的杜仲籽仁粕,在设定的提取温度、提取时间、液料比、提取次数条件下进行搅拌萃取,然后抽滤得到固形物及萃取液。固形物在洁净的培养皿中进行真空干燥,得到杜仲浓缩蛋白,测定其蛋白质含量和AU含量,同时测定提取液中AU含量。
2 结果与讨论
2.1 AU含量检测标准曲线、回收率和重复性
采用HPLC-UV检测AU含量,所得AU的质量浓度(X)与峰面积(Y)具有良好的线性关系,线性回归方程为:Y=7 044.967 4X-4 843.385 8,R2=0.999 9。线性范围为15.625~500 mg/L。对该方法进行加标回收和重复性实验,结果表明:该方法回收率在85.34%~99.09%之间,RSD在0.95%~1.78%之间,重复性实验RSD在1.60%~4.36%之间,具有较好准确性和重复性。
2.2 杜仲籽仁与其粕中主要组分及AU含量
对3个产地的杜仲籽仁和粕中主要组分及AU含量进行测定,结果见表1。从表1可以看出,不同产地杜仲籽仁中粗脂肪含量和AU含量均有差别,其中陕西略阳县籽仁中AU含量(6.86%)明显低于河南灵宝市和贵州遵义市籽仁AU含量(14.41%、15.44%),这可能与原料产地有关,也可能与原料采收年份有关(陕西略阳县杜仲翅果产于2013年,河南灵宝市和贵州遵义市的产于2014年)。而粕中AU含量(5.25%~16.60%)与籽仁中含量有关。
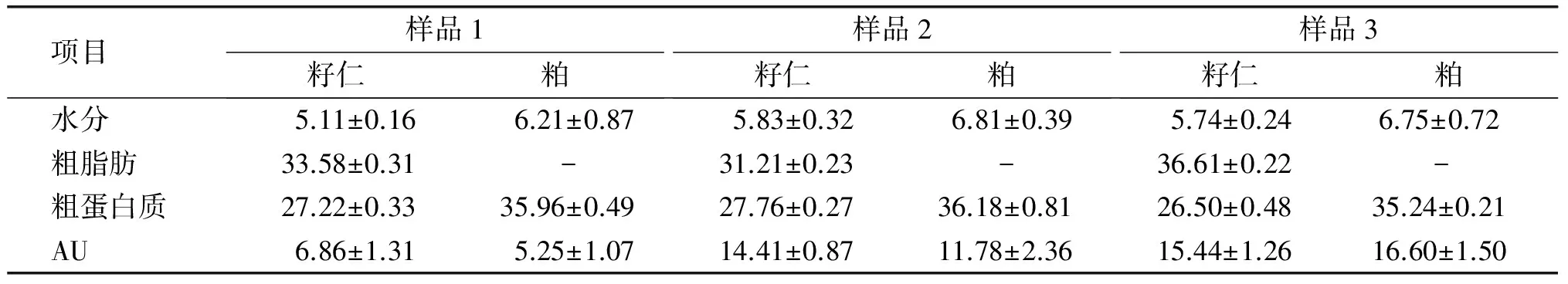
表1 不同产地杜仲籽仁与其粕中主要组分及AU含量 %
注:以干基表示;“-”表示含量小于1%;蛋白质与氮的换算系数以6.25计。
2.3 醇洗浓缩蛋白制取及AU提取条件确定
2.3.1 乙醇体积分数对醇洗浓缩蛋白制取及AU提取效果的影响
以样品3杜仲籽仁粕为原料,采用醇洗工艺制取浓缩蛋白。液料比10∶1,提取温度50℃,提取时间60 min,考察不同乙醇体积分数对浓缩蛋白产品中蛋白质含量、AU含量和提取液中AU含量的影响,结果见表2。
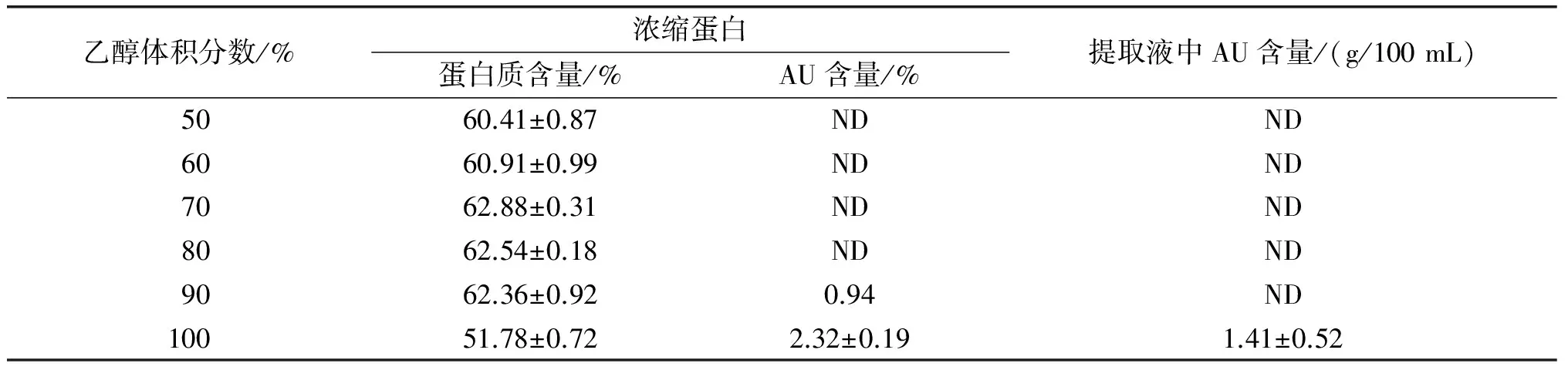
表2 醇洗浓缩蛋白的蛋白质含量和AU含量
注:“ND”表示未检出。
从表2可以看出,乙醇体积分数为70%时,浓缩蛋白产品中蛋白质含量最高(62.88%)。但实验中发现,将体积分数为50%~90%的乙醇溶液与乳白色的粕粉混合于烧杯中进行萃取时,5 min后乳白色的溶液逐渐变绿,20 min后溶液变为深绿色,最终变为墨绿色。用抽滤法将提取液与浓缩蛋白进行分离时,发现两者分离缓慢,分离出的提取液为黑色,浓缩蛋白经真空干燥后为黑色。乙醇体积分数为50%~80%时,浓缩蛋白和提取液中均未检出AU,脱除溶剂后的浓缩蛋白的颜色由褐色逐渐过渡到黑色。乙醇体积分数为90%时,提取液中同样未检出AU,浓缩蛋白的颜色为草绿色,检测AU含量为0.94%。
与上述情况明显不同的是,当提取溶剂为无水乙醇时,提取液为黄色,浓缩蛋白与籽仁、粕的颜色一致,均为乳白色。检测到提取液中AU含量为1.41 g/100 mL,浓缩蛋白中AU含量为2.32%。从上述实验结果可以看出,用含水乙醇对杜仲籽仁粕进行醇洗时,AU会损失或转化。推测原因可能是杜仲蛋白容易被水解为氨基酸,而AU能与氨基酸反应生成棕黑色至黑色的树脂状聚合物[10]。据此,利用杜仲籽仁、饼或粕进行醇洗浓缩蛋白制取及AU提取时,选用无水乙醇最合理。
2.3.2 提取温度对AU提取效果的影响
选用无水乙醇为提取溶剂,选取液料比为4∶1,提取时间30 min,提取1次,考察不同提取温度对AU提取效果的影响,结果如图1所示。
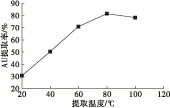
图1 提取温度对AU提取率的影响
从图1可以看出,提取温度在20~80℃时,AU提取率持续升高,80℃时提取率达到最大(81.50%),从80℃升温到100℃时,AU提取率有所下降。这表明无水乙醇在微沸状态下对AU的溶解能力最好。因此,选取提取温度80℃为宜。
2.3.3 提取时间对AU提取效果的影响
以无水乙醇为提取溶剂,选取液料比4∶1,提取温度80℃,提取1次,考察不同提取时间对AU提取效果的影响,结果如图2所示。
从图2可以看出,提取时间由10 min延长至20 min,AU提取率明显提高,20 min时提取率达到最大(88.61%)。再延长提取时间,AU提取率逐渐下降,这可能是由于AU具有烯醇式的缩醛结构,提取时间过长会使其氧化的缘故[9]。因此,选取提取时间20 min为宜。
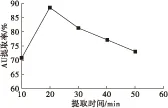
图2 提取时间对AU提取率的影响
2.3.4 液料比对AU提取效果的影响
以无水乙醇为提取溶剂,选取提取温度80℃,提取时间20 min,提取1次,考察不同液料比对AU提取效果的影响,结果如图3所示。
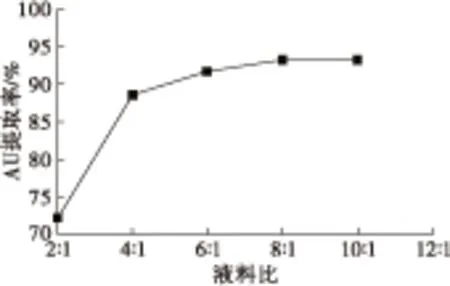
图3 液料比对AU提取率的影响
从图3可以看出,随着液料比的增加,AU提取率不断增加。当液料比达到8∶1时,提取率达到93.20%,再增加液料比,AU提取率基本不变。因此,选取液料比8∶1为宜。
2.3.5 提取次数对AU提取效果的影响
以无水乙醇为提取溶剂,选取提取温度80℃,提取时间20 min,液料比8∶1,考察提取次数对AU提取效果的影响,结果如图4所示。
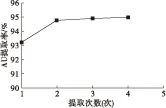
图4 提取次数对AU提取率的影响
从图4可以看出,提取2次时,AU提取率已达到94.82%,再增加提取次数,提取率增幅已很小。考虑到溶剂用量的经济性,选取提取次数2次为宜。
综上,以无水乙醇为提取溶剂,采用提取温度80℃、提取时间20 min、液料比8∶1、提取2次的工艺条件,杜仲籽仁粕中AU提取率达到94.82%。
3 结 论
采用高效液相色谱法(HPLC-UV)检测杜仲籽及其粕和浓缩蛋白中桃叶珊瑚苷含量,方法回收率在85.34%~99.09%之间,RSD在0.95%~1.78%之间,重复性实验RSD在1.60%~4.36%之间,具有较好准确性和重复性。
不同产地的杜仲籽仁及其粕中桃叶珊瑚苷含量为6.86%~15.44%、5.25%~16.60%。利用含水乙醇对杜仲籽仁粕进行提取时,浓缩蛋白和提取液均会变黑,且基本检测不出桃叶珊瑚苷。只有用无水乙醇为提取溶剂时,才能得到乳白色的浓缩蛋白和富含桃叶珊瑚苷的提取液,此时浓缩蛋白中蛋白质含量达到51.78%,较杜仲籽仁粕中提高16.54个百分点。以无水乙醇为溶剂对杜仲籽仁粕进行桃叶珊瑚苷提取,最佳提取条件为提取温度80℃、提取时间20 min、液料比8∶1、提取次数2次。在最佳提取条件下,桃叶珊瑚苷提取率可达到94.82%。
[1] 焦惠丽,刘玉兰,张东东.不同产地和不同制油工艺对杜仲籽仁油品质分析[J].粮食与油脂,2015,28(9):53-57.
[2] 朱莉伟,陈素文,蒋建新,等.杜仲种仁化学成分研究[J].中国野生植物资源,2005,24(2):41-42,45.
[3] 赵德义,徐爱遐,张博勇,等.杜仲籽油与紫苏籽油脂肪酸组成的比较研究[J].西北植物学报,2005,25(1):191-193.
[4] 舒象满,杨建军,李伟,等.杜仲籽蛋白的提取及纯化工艺研究[J].中国油脂,2015,40(7):20-25.
[5] 王亚琴,张康健.杜仲次生代谢物的研究进展[J].中草药,2004,35(7):836.
[6] 马龙,周先汉,孙兰萍,等.杜仲翅果中桃叶珊瑚甙提取工艺研究[J].安徽农业科学,2010,38(17):9222-9224.
[7] 康桢,吴卫华,王俊杰,等.桃叶珊瑚苷及其苷元的药理研究进展[J].中国中药杂志,2007,32(24):2585-2587.
[8] 朱媛,王亚琴.桃叶珊瑚苷的研究进展[J].中草药,2006,37(6):947-949.
[9] 张京京,杜红岩,李钦,等.杜仲药理与毒理研究进展[J].河南大学学报(医学版),2014,33(3):217-222.
[10] 孙婧.天然中草药中乌发成分的提取和性能测定[D].江苏 无锡:江南大学,2005.
[11] 马柏林,梁淑芳,张康健.薄层色谱分离和分光光度法测定桃叶珊瑚甙[J].分析化学,2000,28(3):346-348.
[12] 胡江宇,张永康,李辉,等.高效液相色谱法测定杜仲果仁中的桃叶珊瑚苷[J].生命科学仪器,2006,4(6):39-42.
[13] 杜红岩,李钦,李福海,等.杜仲种仁桃叶珊瑚苷含量的测定及积累规律[J].林业科学研究,2009,22(5):744-746.
[14] 张晓丽,刘玉兰,王立新.冷榨花生饼生产醇洗花生浓缩蛋白工艺条件的研究[J].粮油加工,2010(3):21-27.
Preparation of aucubin and protein concentrate from eucommia seed kernel meal by alcohol leaching method
LIU Yulan, JIAO Huili, LI Xiao
(College of Food Science and Technology, Henan University of Technology, Zhengzhou 450001, China)
With eucommia seed kernel meal as raw material, aucubin and protein concentrate were prepared from eucommia seed kernel meal by alcohol leaching method. The aucubin contents in eucommia seed kernel, meal and protein concentrate were determined by HPLC-UV. The results showed that the aucubin contents in emucommia seed kernel and its meal from different areas were 6.86%-15.44% and 5.25%-16.60% respectively. The protein concentrate and the extract were black and the aucubin could not be detected when the extraction solvent was hydrous ethanol. Only with anhydrous ethanol as extraction solvent, the milky white protein concentrate could be obtained and the extract was rich in aucubin. And the content of protein in protein concentrate was 51.78%, which increased by 16.54 percentage points than eucommia seed kernel meal. The aucubin in the meal was extracted by anhydrous ethanol, and the optimal extraction conditions were obtained as follows: extraction temperature 80℃, extraction time 20 min, ratio of liquid to material 8∶1, extraction times twice. Under these conditions, the extraction rate of aucubin reached 94.82%.Key words:eucommia seed kernel; eucommia seed kernel meal; aucubin; alcohol leaching; protein concentrate
2016-08-08
刘玉兰(1957),女,教授,硕士生导师,研究方向为植物油料资源高效利用与品质安全(E-mail)liuyl7446@163.com。
TS229;TQ936.2
A
1003-7969(2017)04-0089-04
