海洋产油酵母菌筛选及油脂提取条件优化
2017-05-10陶永佳薛永常
陶永佳,李 根,薛永常
(大连工业大学 生物工程学院,辽宁 大连 116034)
海洋产油酵母菌筛选及油脂提取条件优化
陶永佳,李 根,薛永常
(大连工业大学 生物工程学院,辽宁 大连 116034)
采用苏丹黑B染色法,从海洋淤泥和岩石附着藻类中筛选得到一株高产油脂的海洋酵母菌,利用生理生化特征结合分子生物学方法进行目的菌株的鉴定,结果证明其为季也蒙毕赤酵母(Meyerozymaguilliermondii)。利用酸热法进行油脂提取,在单因素实验的基础上通过正交实验对提取条件进行优化。得到最优条件为:每0.5 g干菌体需4 mol/L盐酸10 mL,酸热时间10 min,有机溶剂氯仿-甲醇(体积比2∶1)25 mL,0.15% NaCl溶液10 mL。在最优提取条件下,油脂得率为40.12%。
季也蒙毕赤酵母;筛选;油脂提取;正交实验
微生物油脂又叫单细胞油脂,是由细菌、霉菌、酵母和藻类产生的[1]。微生物油脂的成分与动植物油脂类似,但其原料来源广泛、生产周期短、能连续大规模生产、不受季节和气候的影响[2-3],因此开发利用微生物油脂不仅可缓解植物油紧缺,且可生产功能性油脂、制备生物柴油、类可可脂以及高级不饱和脂肪酸等[4-7],对人类可持续发展和提高生活质量有重要的贡献。目前对陆地微生物研究较多,而海洋微生物研究较少,海洋低温、高压、无光照的特异环境,使海洋微生物代谢产物中发现了许多具有特异、新颖、多种多样化学结构的生物活性物质,包括抗肿瘤、抗菌的活性物质和脂肪酸等,开发海洋微生物具有重要意义[8]。
本文采用苏丹黑B染色法[9-10],从海洋淤泥和岩石附着藻类中筛选海洋高产油脂酵母菌,通过生理生化鉴定和分子生物学方法对目的菌株进行鉴定,并利用单因素实验和正交实验对酸热法提取油脂的条件进行优化,对进一步探索海洋微生物油脂生产和利用有重要意义。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
大连星海湾浅海淤泥和岩石表面附着藻类;盐酸、甲醇、氯仿、氯化钠均为分析纯。
1.1.2 培养基
分离培养基:蛋白胨20 g/L,酵母膏10 g/L,葡萄糖20 g/L,琼脂粉20 g/L,陈海水配制,pH 6.0,121℃灭菌20 min;产油培养基:葡萄糖70 g/L,酵母浸粉0.5 g/L,(NH4)2SO42 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,琼脂粉20 g/L,陈海水配制,pH 6.0,121℃灭菌20 min;发酵培养基:葡萄糖70 g/L,酵母浸粉0.5 g/L,(NH4)2SO42 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,陈海水配制,pH 6.0,121℃灭菌20 min。
1.1.3 仪器与设备
TP600 PCR仪;DYY-2C型电泳仪;TGL-16C台式离心机;SPX-150-Z振荡培养箱;DHG-9030A电热恒温鼓风干燥箱;数显式电热恒温水浴锅;B210S型精密电子分析天平。
1.2 实验方法
1.2.1 苏丹黑B染色筛选
将采集的样品用灭菌陈海水洗涤后涂平板,在恒温培养箱中28℃培养2 d,然后进行连续的分离纯化,直至得到单菌落,然后用苏丹黑B分别染色(脂肪粒散布在细胞质内,可被脂溶性染料苏丹黑B氧化成黑蓝色,根据脂肪粒的多少区别是否为高产菌株[11])并镜检,筛选高产油脂酵母。
1.2.2 形态和生理生化特征鉴定
对筛选所得的目的菌株进行形态观察,并依据《酵母菌的特征和鉴定手册》进行生理生化特征鉴定。
1.2.3 分子生物学鉴定
参照生工生物工程(上海)股份有限公司的Ezup柱式基因组DNA抽提试剂盒(酵母)说明书提取目的菌株基因组DNA。使用真菌的ITS区序列扩增的通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)通过PCR扩增5.8s rRNA基因[4]。PCR扩增产物交由北京六合华大基因股份有限公司测序,测序结果提交到NCBI数据库BLAST,并用Clustal X 2.0同源性分析和MEGA 6.0构建进化树。
1.2.4 干菌体的获得
将筛选得到的菌株接发酵培养基,在恒温摇床中28℃、180 r/min培养3 d。然后离心收集菌体,于60℃烘箱烘干至恒重。
1.2.5 酸热法提取油脂[12-13]
称取0.5 g干菌体,加入4 mol/L盐酸10 mL,室温放置1 h,沸水浴10 min,迅速置于-20℃中30 min,然后加有机溶剂氯仿-甲醇(体积比2∶1)20 mL进行提取,分离有机相,用10 mL 0.15 % NaCl溶液洗涤,在60℃蒸发氯仿,之后在80℃烘1 h,并计算油脂得率和油脂相对得率,以上条件为基础条件进行单因素实验和正交实验。
油脂得率=(M2-M1)/0.5×100%,油脂相对得率=Xi/Xmax×100%。式中:M1为试管质量,g;M2为试管和油脂总质量,g;Xi为油脂得率,Xmax为油脂得率的最大值。
2 结果与分析
2.1 高产油脂酵母的形态及生理生化特征
经苏丹黑B染色筛选,得到1株产油酵母,暂命名为T-1。其菌落呈乳白色,表面较光滑、湿润、有光泽,细胞较小,呈椭圆形,为芽殖。T-1菌株生理生化特征如表1所示。

表1 T-1菌株生理生化特征
注:“+”为阳性反应;“-”为阴性反应。
根据T-1的菌落形态特征和生理生化特征鉴定,初步判定筛选得到的T-1菌株属于季也蒙毕赤酵母(Meyerozymaguilliermondii)。
2.2 菌株的分子生物学鉴定
2.2.1 菌株基因组DNA的提取
利用生工生物工程(上海)股份有限公司的Ezup柱式基因组DNA抽提试剂盒(酵母)提取菌株T-1的基因组DNA,用0.8%琼脂糖凝胶电泳,结果如图1所示。
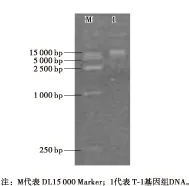
图1 菌株T-1基因组DNA电泳图
由图1可知,在15 000 bp有1条清晰整齐的条带,说明提取的基因组DNA比较完整,因此可以用于后续PCR扩增。
2.2.2 PCR扩增5.8s rRNA
以菌株T-1的基因组DNA为模板,利用真菌的ITS区序列扩增的通用引物ITS1和ITS4进行PCR扩增5.8s rRNA基因,PCR产物用2%的琼脂糖凝胶电泳,结果如图2所示。
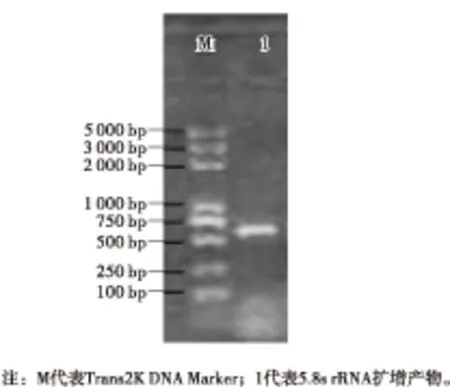
图2 5.8s rRNA扩增电泳图
由图2可知,在600 bp左右有1条清晰整齐的条带,与预期大小一致,因此将PCR产物送至北京六合华大基因股份有限公司测序。
2.2.3 系统进化树分析
测序结果显示目的菌株T-1的5.8s rRNA序列长度为587 bp,将其提交到NCBI数据库进行BLAST,菌株T-1的序列与季也蒙毕赤酵母菌(Meyerozymaguilliermondii)相似度为99%。选取5株与目的菌株T-1同源性较高的菌株,构建系统进化树,结果如图3所示。
由图3可知,菌株T-1与M.guilliermondii32A属于同一分支,说明亲缘关系较近。证明菌株T-1属于季也蒙毕赤酵母,并暂且命名为MeyerozymaguilliermondiiT-1,用于后续工作。
2.3 单因素实验
2.3.1 盐酸体积对油脂相对得率的影响
盐酸能与细胞壁中的蛋白质和多糖等反应,从而疏松细胞壁,为油脂的提取奠定基础。因此,对不同体积的4 mol/L盐酸对油脂相对得率的影响进行考察,结果如图4所示。
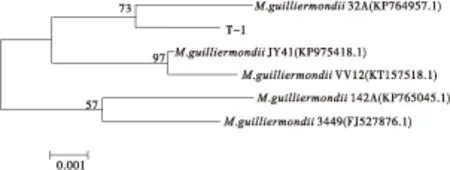
图3 T-1菌株系统发育进化树
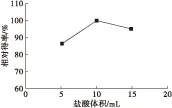
图4 盐酸体积对油脂相对得率的影响
由图4可知,在4 mol/L盐酸体积为10 mL时油脂相对得率最高。盐酸过少,则细胞壁通透性差,不利于提取,盐酸过多,则可能使油脂部分发生分解。
2.3.2 酸热时间对油脂相对得率的影响
酸热时间直接影响疏松细胞破壁的效果以及油脂的分解,因此对酸热时间对油脂相对得率的影响进行考察,结果如图5所示。
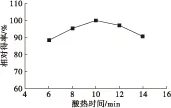
图5 酸热时间对油脂相对得率的影响
由图5可知,在酸热时间为10 min时油脂相对得率最大。酸热时间太短或过长,油脂相对得率都较低。时间短则破壁不完全,时间过长则油脂发生分解。
2.3.3 有机溶剂体积对油脂相对得率的影响
油脂易溶于非极性有机溶剂氯仿,因此对不同体积有机溶剂氯仿-甲醇(体积比2∶1)对油脂相对得率的影响进行考察,结果如图6所示。
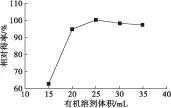
图6 有机溶剂体积对油脂相对得率的影响
由图6可知,在有机溶剂氯仿-甲醇(体积比2∶1)体积为25 mL时油脂相对得率最大。随着有机溶剂体积增加,油脂相对得率相应提高,但有机溶剂过多时则相对得率降低,可能是蒸发带走过多的油脂。
2.4 正交实验
在单因素实验的基础上,以油脂得率为考察指标进行正交实验,正交实验因素水平见表2,正交实验设计与结果见表3,方差分析见表4。

表2 正交实验因素水平
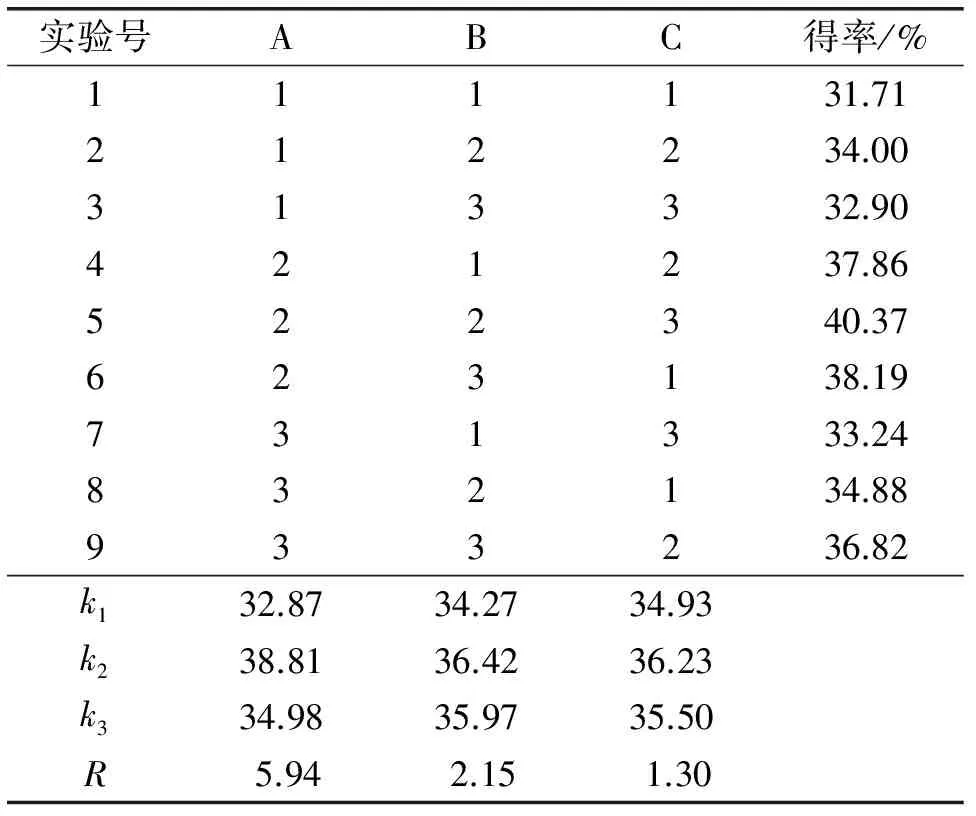
表3 正交实验设计与结果
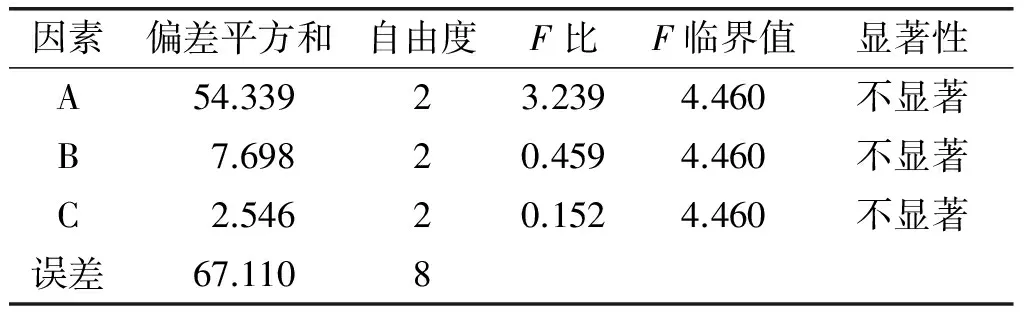
表4 方差分析
由表3可知,3个因素对油脂得率的影响次序依次为A>B>C。通过表4方差分析可知,其因素影响均不显著,因此不必再进行各因素水平间的多重比较。由表3k值可知,最优条件为A2B2C2,即4 mol/L盐酸体积10 mL,酸热时间10 min,有机溶剂体积25 mL。按照最优条件进行3次平行实验,平均油脂得率为40.12%。
3 结 论
本实验通过苏丹黑B染色从海洋淤泥和岩石附着藻类中筛选得到高产油脂酵母菌株T-1,综合形态观察、生理生化特征和分子生物学鉴定,证明其属于海洋季也蒙毕赤酵母属,暂且命名为MeyerozymaguilliermondiiT-1。在单因素实验基础上,通过正交实验进行酸热法油脂提取条件优化,得到最佳的油脂提取条件为每0.5 g干菌体需4 mol/L盐酸10 mL、酸热时间10 min、有机溶剂氯仿-甲醇(体积比2∶1)25 mL、0.15% NaCl溶液10 mL,在此条件下的油脂得率为40.12%。研究结果对进一步探索海洋产油酵母菌的油脂生产和工业化应用有重要意义。
[1] RATLEDGE C. Lipid biotechnology: a wonderland for the microbial physiologist[J]. J Am Oil Chem Soc,1987,64(12):1647-1656.
[2] 高媛,李元媛,王常高,等. 高产油脂酵母的筛选及发酵条件的研究[J]. 化学与生物工程,2010,27(1):55-58.
[3] 王莉,宋兆齐,李慧真,等.一株丝孢酵母属菌株发酵产油脂的研究[J].中国油脂,2015,40(5):84-89.
[4] 唐文佳,张怀渊,陈卫,等. 柠檬酸在产油酵母油脂积累过程中的中心作用[J]. 食品科学,2013,34(19):326-329.
[5] 魏涛,王丽娟,张飞,等.一株高产油脂酵母菌株的分离鉴定及其油脂组分的分析[J].中国酿造,2013,32(7):50-52.
[6] IZARD J,LIMBERGER R J. Rapid screening method for quantitation of bacterial cell lipids from whole cells[J]. J Microbiol Methods,2003,55(2):411-418.
[7] PATNAYAK S,SREE A. Screening of bacterial associates of marine sponges for single cell oil and PUFA[J]. Lett Appl Microbiol,2005,40(5):358-363.
[8] 秦艳红,叶德赞. 海洋产油真菌的简便初筛[J]. 台湾海峡,2010,29(1): 128-134.
[9] 李凡正,高新蕾,刘晔. 真菌油脂含量快速测定方法[J]. 中国油脂,2010,35(9):70-73.
[10] WANG J F,LI R M,LU D,et al. A quick isolation method for mutants with high lipid yield in oleaginous yeast[J]. World J Microbiol Biotechnol,2009,25(5):921-925.
[11] 杜连祥,路福平. 微生物学实验技术[M].北京:中国轻工业出版社,2006.
[12] 叶思特,郭丽琼,刘晓蓉,等. 产油微生物的筛选[J]. 华南农业大学学报,2012,33(3):384-387.
[13] 孔凡敏,赵祥颖,田延军,等. 酸热法提取酵母油脂条件的研究[J]. 中国酿造,2010(5):143-146.
Screening of oleaginous yeast from sea and optimization of oil extraction process
TAO Yongjia, LI Gen, XUE Yongchang
(School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, Liaoning, China)
An oleaginous yeast was screened from sea mud and algae attached rock by Sudan Black B staining method and it was identified asMeyerozymaguilliermondiiby physicochemical and biochemical characteristics combined with molecular biological methods. The oil was extracted by acid-heating method. Based on single factor experiment, the extraction conditions were optimized by orthogonal experiment. The optimal extraction conditions were obtained as follows: 0.5 g of dried cells, 4 mol/L HCl 10 mL, acid-heating time 10 min, organic solvent(volume ratio of chloroform to methanol 2∶1) 25 mL, 0.15% NaCl 10 mL. Under these conditions, the oil yield was 40.12%.
Meyerozymaguilliermondii; screening; oil extraction; orthogonal experiment
2016-08-11;
2016-12-23
陶永佳(1992),男,硕士研究生,研究方向为海洋微生物(E-mail)1127383109@qq.com。
薛永常,教授(E-mail)xueych@dlpu.edu.cn。
TQ644;Q93-3
A
1003-7969(2017)04-0012-04
油脂加工
