硫化氢在外源性雷帕霉素预处理人结肠癌细胞增殖中的作用
2017-05-10李豫江陈志刚黄桂林
李豫江 张 伟 陈志刚 黄桂林 赵 磊
(石河子大学医学院第一附属医院普外二科,新疆 石河子 832008)
硫化氢在外源性雷帕霉素预处理人结肠癌细胞增殖中的作用
李豫江 张 伟 陈志刚 黄桂林 赵 磊1
(石河子大学医学院第一附属医院普外二科,新疆 石河子 832008)
目的 探讨外源性硫氢化钠(NaHS)(H2S供体)对体外培养人结肠癌细胞增殖的影响及其机制。方法 体外培养人结肠癌细胞,随机分为正常对照组、NaHS(100 μmol/L)组、雷帕霉素(1 μg/ml)组、NaHS(100 μmol/L)+雷帕霉素(1 μg/ml)组,采用CCK-8检测各组干预48 h后对人结肠癌细胞增殖的影响,流式细胞术检测各组干预48 h后对人结肠癌细胞细胞周期的影响,Western印迹检测各组干预48 h后对人结肠癌细胞中mTOR蛋白表达的影响。结果 与正常对照组比较,NaHS组人结肠癌细胞增殖显著增加,G0/G1期细胞显著减少,S期细胞显著增加,mTOR蛋白表达均显著增加(P<0.01)。雷帕霉素组人结肠癌细胞增殖显著减少,G0/G1期细胞显著增加,S期细胞显著减少,mTOR蛋白表达均显著减少(P<0.01)。而与NaHS组比较,NaHS+雷帕霉素组人结肠癌细胞增殖显著减少,G0/G1期细胞显著增加,S期细胞显著减少,mTOR蛋白表达均显著减少(均P<0.01)。结论 PI3K/Akt/mTOR信号通路可能介导参与了H2S对人结肠癌细胞增殖的调控作用。
结肠癌细胞;硫化氢;细胞增殖;PI3K/Akt/mTOR信号通路
研究发现,一氧化氮(NO)参与了结肠癌的增殖和迁移〔1,2〕。而硫化氢(H2S)被认为是继NO和一氧化碳(CO)之后的第三种气体信号分子〔3〕。研究发现H2S可促进结肠癌细胞的增殖,但其具体机制尚不清楚〔4〕。研究证实:磷脂酰肌醇-3(PI3K)/蛋白激酶(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路是细胞存活、增殖及凋亡过程中较为关键的通路,该通路被持续激活可促进细胞增殖,抑制细胞凋亡〔5〕。为进一步深入探讨H2S对人结肠癌细胞增殖的作用机制,本实验在体外研究了 PI3K/Akt/mTOR 信号通路在H2S 影响人结肠癌细胞增殖的作用。
1 材料与方法
1.1 材料与试剂 人结肠癌细胞Caco-2(中科院上海细胞库)保持了正常人结肠癌细胞基本形态和生物学特性。 高糖DMEM培养基、胎牛血清胰蛋白酶(美国Gibco公司),DMSO、硫氢化钠(NaHS)、CCK-8试剂盒、碘化丙啶(美国Sigma公司),雷帕霉素冻干粉(上海生工生物),兔抗人mTOR单克隆抗体(Cell Signaling公司),山羊抗兔二抗(北京中杉金桥)。
1.2 仪器与设备 细胞培养箱(美国Thermo公司),流式细胞仪(Partec公司),倒置相差显微镜(Olympus公司),酶标仪、半干转转移电泳槽、凝胶电泳成像仪(美国Bio-Rad公司)。
1.3 实验方法
1.3.1 人结肠癌细胞培养 人结肠癌细胞复苏后用含10%胎牛血清的高糖DMEM培养基于5%CO2、37℃饱和湿度条件下培养,当细胞生长至70%~80%融合时,用0.25%胰蛋白酶消化传代继续培养,细胞传代周期稳定后即可用于实验。
1.3.2 实验分组 收集人结肠癌细胞,计数后接种于培养板中,待细胞完全贴壁后,弃完全培养基,加入无血清DMEM培养液同步化24 h,按实验要求分为正常对照组、NaHS(100 μmol/L)组、雷帕霉素(1 μg/ml)组、NaHS+雷帕霉素组。
1.3.3 CCK-8法检测各组人结肠癌细胞增殖情况 收集对数期生长的人结肠癌细胞,以2×104个/ml接种于96孔细胞培养板中,200 μl/孔,按照实验分组干预培养48 h,结束前4 h,向每孔加入10 μl CCK-8溶液,在细胞培养箱中继续培养4 h后终止培养。用酶标仪测定各孔在450 nm波长处的吸光度值(A450),每组设4个复孔,并设无细胞孔作为空白调零孔,实验重复3次。并按以下公式计算细胞抑制率(IR)=(A对照组-A实验组)/(A对照组)×100%。
1.3.4 流式细胞术检测各组人结肠癌细胞周期 收集对数期生长的人结肠癌细胞,以1×106个/ml接种于6孔细胞培养板中,2 ml/孔,按照实验分组干预培养48 h后,常规消化收集细胞,磷酸盐缓冲液(PBS)洗涤细胞2遍,用70%冰乙醇吹打混匀,4℃冰箱固定过夜,上机前再次离心,弃乙醇,用PBS洗涤细胞两次,最后用500 μl PBS重悬细胞,加入RNA酶,使其终质量浓度为0.25 mg/ml,于37℃条件下反应30 min后,加入碘化丙啶,使其终浓度为50 μg/ml,室温、避光条件反应30 min。流式细胞仪检测各组细胞的细胞周期,并采图。上述实验重复3次,并计算细胞增殖指数(PI)。
1.3.5 Western印迹检测各组mTOR蛋白表达 收集对数期生长的人结肠癌细胞以1×106个/ml接种于6孔培养板中,每孔2 ml,按照验组分组给予不同的处理因素,48 h后用PBS洗2次,加入细胞裂解液,4℃静置20 min,12 000 r/min离心25 min,取上清,采用紫外分光光度计法测定蛋白浓度,统一蛋白浓度为10 g/L,蛋白变性后待用。每孔每次加样10 μl,在 SDS-PAGE 凝胶中电泳分离,Marker位置标记,半干转法将蛋白从凝胶中转移至PVDF膜上,室温下5%脱脂奶粉封闭2 h,加兔抗人mTOR单克隆一抗(1∶1 000),4℃冰箱过夜,TBST洗膜后加入辣根过氧化物酶标记的二抗(1∶30 000),室温下孵育2 h,TBST 洗膜后加入化学发光试剂曝光,显影、定影后将胶片置于凝胶成像分析进行定量分析。用同样方法检测β-actin内参蛋白的表达。
1.4 统计学方法 采用SPSS17.0软件进行单因素方差分析。
2 结 果
2.1 各组人结肠癌细胞增殖情况 与正常对照组比较,NaHS组能显著促进人结肠癌细胞的增殖(P<0.01),雷帕霉素组能显著抑制人结肠癌细胞的增殖(P<0.01),NaHS+雷帕霉素组能显著抑制人结肠癌细胞的增殖(P<0.01)。而与NaHS组比较,NaHS+雷帕霉素组亦能显著抑制人结肠癌细胞的增殖(P<0.01)。见表1。
2.2 各组人结肠癌细胞细胞周期分布情况 与正常对照组比较,NaHS组G0/G1期细胞显著减少,S期、G2/M期细胞显著增加(均P<0.01),雷帕霉素组G0/G1期细胞显著增加,S期、G2/M期细胞显著减少(均P<0.01),NaHS+雷帕霉素组G0/G1期细胞显著增加,S期、G2/M期细胞显著减少(均P<0.01)。而与NaHS组比较,NaHS+雷帕霉素组G0/G1期细胞显著增加,S期、G2/M期细胞显著减少(均P<0.01)。见表2。

表1 各组人结肠癌细胞增殖情况±s,n=3)
与正常对照组比较:1)P<0.01;与NaHS组比较:2)P<0.01;下表同
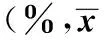
表2 各组人结肠癌细胞细胞周期分布情况±s,n=3)
2.3 各组人结肠癌细胞中mTOR蛋白表达情况 见图1。与正常对照组(0.557 2±0.032 1)比较,NaHS组能显著促进人结肠癌细胞中mTOR蛋白的表达(0.802 5±0.085 1,P<0.05),雷帕霉素组能显著抑制人结肠癌细胞中mTOR蛋白的表达(0.287 7±0.060 1,P<0.05),NaHS+雷帕霉素组能显著抑制人结肠癌细胞中mTOR蛋白的表达(0.452 1±0.015 5,P<0.05)。而与NaHS组比较,NaHS+雷帕霉素组亦能显著抑制人结肠癌细胞中mTOR蛋白的表达(P<0.05)。
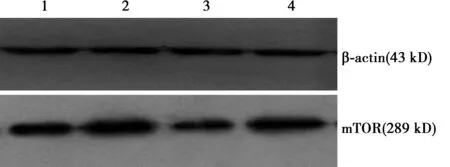
1~4:正常对照组、NaHS组、雷帕霉素组、NaHS+雷帕霉素组图1 各组人结肠癌细胞中mTOR蛋白表达情况
3 讨 论
结肠癌是发病率较高的消化道恶性肿瘤,每年约有 100 万人口因结肠癌而死亡,其5年生存率为62%〔6〕。目前直肠癌的治疗方案主要还是采用手术结合放化疗的综合治疗方案,但是其生存期没有很大改善,中位生存期不足 20 个月〔7〕。因此,研究结肠癌发生的机制,从根本上遏制其进展,对临床上治疗结肠癌,延长结肠癌患者的生存期具有重要的意义。本研究发现,NaHS可显著促进人结肠癌细胞增殖与国内外相关研究结果一致〔4,8〕,进一步研究发现NaHS对人结肠癌细胞的促增殖作用,可能是通过激活PI3K/Akt/mTOR信号通路而发挥作用。雷帕霉素是一种新型大环内酯类免疫抑制剂,其作用的靶蛋白是 mTOR,具有明确的抗肿瘤作用〔9〕。NaHS可显著促进人结肠癌细胞的增殖,且其具体作用可能是通过激活PI3K/Akt/mTOR信号通路而发挥作用。然而,由于实验经费的欠缺,本实验未应用PI3K抑制剂,未检测该通路中其他蛋白的表达,是本实验的不足之处。下一步本课题组将进一步采用LY294002作用结肠癌细胞,然后检测细胞的增殖情况,并检测该通路中其他蛋白的表达。
1 Bocca C,Bozzo F,Bassignana A,etal.Antiproliferative effect of a novel nitrooxy derivative of celecoxib in human colon cancer cells:role of COX-2 and nitric oxide〔J〕.Anticancer Res,2010;30(7):2659-66.
2 Babykutty S,Suboj P,Srinivas P,etal.Insidious role of nitric oxide in migration/invasion of colon cancer cells by upregulating MMP-2/9 via activation of cGMP-PKG-ERK signaling pathways〔J〕.Clin Exp Metastasis,2012;29(5):471-92.
3 Kashfi K,Olson KR.Biology and therapeutic potential of hydrogen sulfide and hydrogen sulfide-releasing chimeras〔J〕.Biochem Pharmacol,2013;85(5):689-703.
4 洪 敏,唐小卿,何 葵,等.硫化氢对人结肠癌细胞增殖和迁移的影响〔J〕.南方医科大学学报,2014;34(5):699-703.
5 Mori H,Inoki KM,Asutani K,etal.The m TOR pathway is highly activated in diabetic nephropathy and rapamycin has a strong therapeutic potential〔J〕.Biochem Biophys Res Commun,2009;384(4):471-5.
6 Jemal A,Siegel R,Ward E,etal.Cancer statistics,2009〔J〕.CA Cancer J Clin,2009;59(4):225-49.
7 Roper J,Richardson MP,Wanq WV,etal.The dual PI3K/mTOR inhibitor NVP-BEZ235 induces tumor regression in a genetically engineered mouse model of PIK3CA wild-type colorectal cancer〔J〕.PLoS ONE,2011;6(9):e25132.
8 Cai WJ,Wang MJ,Ju LH,etal.Hydrogen sulfide induces human colon cancer cell proliferation:role of Akt,ERK and p21〔J〕.Cell Biol Int,2010;34(6):565-72.
9 Meric-Bernstam F,Gonzalez-Angulo AM.Targeting the mTOR signaling network for cancer therapy〔J〕.J Clin Oncol,2009;27(13):2278-87.
〔2015-12-13修回〕
(编辑 苑云杰/曹梦园)
赵 磊(1975-),男,医学硕士,副教授,主要从事结直肠肿瘤的发生机制研究。
李豫江(1970-),男,医学硕士,副主任医师,主要从事结直肠肿瘤的发生机制研究。
R735.3+5
A
1005-9202(2017)08-1895-03;
10.3969/j.issn.1005-9202.2017.08.031
1 石河子大学医学院生理教研室
