长期运动对慢性心力衰竭大鼠左室重构的抑制作用
2017-05-10甄洁
甄 洁
(郑州大学体育系,河南 郑州 450001)
长期运动对慢性心力衰竭大鼠左室重构的抑制作用
甄 洁
(郑州大学体育系,河南 郑州 450001)
目的 观察8 w运动对心力衰竭大鼠左室结构、功能和重构基因表达的影响,探讨运动改善左室重构的可能机制。方法 40只SD大鼠随机分为心力衰竭对照组(HC组,n=10)、心力衰竭运动组(HE组,n=10)、假手术对照组(SC组,n=10)和假手术运动组(SE组,n=10),心力衰竭模型采用冠状动脉结扎术。HE组和SE组进行8 w跑台运动,SC组和HC组在鼠笼内自由活动。超声心动图检测左室结构和功能;分离左室后行Masson染色法进行组织病理学观察并获得胶原容积分数(CVF);实时荧光定量PCR检测左室心肌心钠素(ANF)、α-肌球蛋白重链(α-MHC)、β-肌球蛋白重链(β-MHC)和肌质网Ca2+-ATP酶(SERCA2a)mRNA表达量。结果 ①与SC组比较,SE组大鼠左室出现离心性肥大,心功能提高,α-MHC和SERCA2a mRNA升高(P<0.05);②与SC组比较,HC组左室出现向心性肥大,心功能降低,CVF明显增加(P<0.05),心肌α-MHC和SERCA2a mRNA表达下调(P<0.05),ANF和β-MHC mRNA表达上调(P<0.05);③与HC组比较,HE组大鼠左室发生离心性肥大,心功能提高,CVF明显减少(P<0.05),心肌α-MHC和SERCA2a mRNA表达上调(P<0.05),ANF和β-MHC mRNA表达下调(P<0.05)。结论 长期运动抑制心力衰竭大鼠左室重构并改善心功能,其机制与心肌纤维化程度减轻、胚胎基因表达下调、收缩蛋白表达上调有关。
运动;慢性心力衰竭;左室重构
心力衰竭高患病率、高致残率和高死亡率严重影响患者的生活质量〔1〕。心力衰竭的发病机制极为复杂,近年研究认为以神经内分泌为主、多种因素参与的以左室病理性重构为主要特征的心脏负荷过度是心力衰竭发生最主要的原因〔2〕。研究发现,规律运动特别是有氧运动对于稳定期心力衰竭患者具有积极作用,可提高运动耐力并改善生活质量〔3~6〕。此外,运动员经过长期运动训练,心脏出现生理性重构并伴随心功能提高〔7〕。运动对心力衰竭时左室病理重构的影响以及运动诱导的生理重构在其中的作用鲜有关注,因此本研究以SD大鼠为受试对象,通过结扎冠状动脉造模,观察8 w运动对左室结构、功能和重构基因表达的影响,探讨运动改善左室重构的可能机制。
1 资料与方法
1.1 实验动物 健康雄性SPF级SD大鼠40只,体质量250~300 g,由军事医学科学院实验动物中心提供,分笼饲养,自由进食水。
1.2 动物分组与造模 将大鼠随机分为心力衰竭对照组(HC组)、心力衰竭运动组(HE组)、假手术对照组(SC组)和假手术运动组(SE组)各10只。心力衰竭造模采用冠状动脉结扎术,方法为:腹腔麻醉后胸部备皮,连接小动物呼吸机,在心尖搏动处开胸暴露心脏,0号丝线结扎冠状动脉前降支,心电图示心肌缺血性改变持续 30 min标志手术成功,迅速放回心脏缝合胸壁。术后连续3 d给予青霉素肌注以预防感染。SC组和SE组动物开胸后只栓线不结扎左冠状动脉前降支。
1.3 运动方案 SC组和HC组动物在鼠笼内自由活动,HE组和SE组在术后4 w开始进行跑台适应性训练(10~15 m/min,坡度为0°,30 min/d,共5 d),之后开始正式训练,速度为16 m/min(50%~60%VO2max),坡度为0°,60 min/d,5 d/w,共8 w。
1.4 左室结构与功能检测 末次训练后48 h,腹腔麻醉大鼠,胸部备皮,仰卧位固定,用小动物超声影像诊断系统(Vevo 770,加拿大visualsonics公司)进行左室结构与功能检测,指标包括左室舒张末内径(LVEDD)、左室壁厚度(LVWT)、心率(HR)、左室缩短分数(LVFS)和左室射血分数(LVEF)。
1.5 动物取材 超声检测后称体重(BW),迅速分离心脏,冷PBS洗净称量心脏重量(HW)后分离左室,滤纸吸干,称量左室重量(LVW),分别计算与体重比值为心脏重量指数(HWI)和左室心脏重量指数(LVWI)。取左侧肺叶,称量得肺湿重,于干燥箱干燥24 h后称量肺干重,计算肺含水率(LWR)=(肺湿重-肺干重)/ 肺湿重×100%。切取左室非梗死区心肌,分成两份,一份进行心脏组织病理学观察,另一份用于基因表达检测。迅速将组织置于液氮中并转移至-80℃冰箱冻存待测。
1.6 心脏组织病理学观察 将左室心肌组织固定于10%的福尔马林中,经脱水、透明、包埋、切片(5 μm)后行Masson染色,普通光镜观察各组心肌组织病理学变化。每张切片随机选取5个视野,用图像分析软件测量胶原组织面积,胶原组织面积占所测视野面积的百分比即为胶原容积分数(CVF)。
1.7 mRNA表达检测 将心室肌组织匀浆后,用Trizol法抽提心肌总RNA,用722型紫外分光光度计测定RNA浓度并测定A260/A280比值(1.8~2.0为高纯度)。逆转录反应获得cDNA,实时荧光定量PCR(7300型荧光定量PCR仪,美国Applied Biosystems公司)测定心钠素(ANF)、α-肌球蛋白重链(α-MHC)、β-肌球蛋白重链(β-MHC)和肌质网Ca2+-ATP酶(Ca2+-ATPase,SERCA2a)mRNA表达量。扩增条件为:预变性94℃/3 min;94℃/45 s,55℃/30 s,72℃/90 s,共35个循环。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,计算目的基因的相对表达量(SC组的倍数)。引物序列:ANF正义链5′-GGACTAGGCTGCAACAGCTTC-3′,反义链5′-GTGACACACCACAAGGGCTTA-3′;α-MHC正义链5′-ATCAAGGAGCTCACCTACCAG-3′,反义链5′-CACTCCTCATCGTGCATTTTC-3′;β-MHC正义链5′-ATGTGCCGGACCTTGGAA-3′,反义链5′-CCTCGGGTTAGCTGAGAGATCA-3′;SERCA2a正义链5′-CTGTGGAGACCCTTGGTTGT-3′,反义链5′-CAGAGCACAGATGGTGGCTA-3′;GAPDH正义链5′-TGTGTCCGTCGTGGATCTGA-3′,反义链5′-TTGCTGTTGAAGTCGCAGGAG-3′。
1.8 统计学方法 应用SPSS15.0统计软件进行单因素方差分析及LSD检验。
2 结 果
2.1 BW与心脏指数 与SC组比较,SE组和HE组HW、HWI、LVW、LVWI升高(P<0.05);HC组HW、HWI、LVW、LVWI和LWR升高(P<0.05);与HC组比较,HE组LWR降低(P<0.05);所有组间差异均有统计学意义,见表1。
2.2 左室结构与功能 与SC组比较,SE组LVEDD、LVFS和LVEF升高P<0.05,HR降低(P<0.05);HC和HE组LVEDD、LVFS和LVEF降低(P<0.05),LVWT和HR升高(P<0.05)。与HC组比较,HE组LVEDD、LVFS和LVEF升高(P<0.05),HR降低(P<0.05);所有组间差异均有统计学意义,见表2。
2.3 心脏组织病理学改变 左室心肌Masson染色显示:胶原纤维呈蓝色,心肌细胞呈红色。SC组和SE组心肌纤维着色均匀,无胶原成分;HC组心肌细胞减少,胶原成分显著增多,纤维化程度明显,CVF高于SC组(P<0.05);HE组较HC组心肌细胞增多且排列较为整齐,胶原纤维(即CVF)明显减少(P<0.05),但仍高于SC组(P<0.05)。见图1及表3。
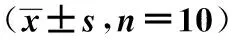
表1 各组大鼠BW与心脏指数
与SC组比较:1)P<0.05;与HC组比较:2)P<0.05,下表同
表2 各组大鼠左室结构与功能
2.4 mRNA表达的变化 与SC组比较,SE组α-MHC和SERCA2a升高(P<0.05);HC组α-MHC和SERCA2a降低,ANF和β-MHC升高(P<0.05)。与HC组比较,HE组α-MHC和SERCA2a升高,ANF和β-MHC降低(P<0.05);所有组间差异均显著,见表3。
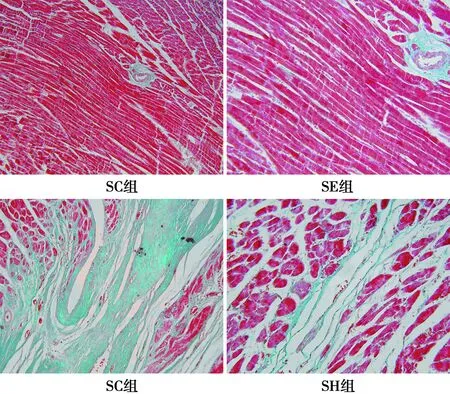
图1 心肌Masson染色(×200)表3 各组心肌ANF mRNA表达和 β-MHC、α-MHC、SERCA2a、CVF变化
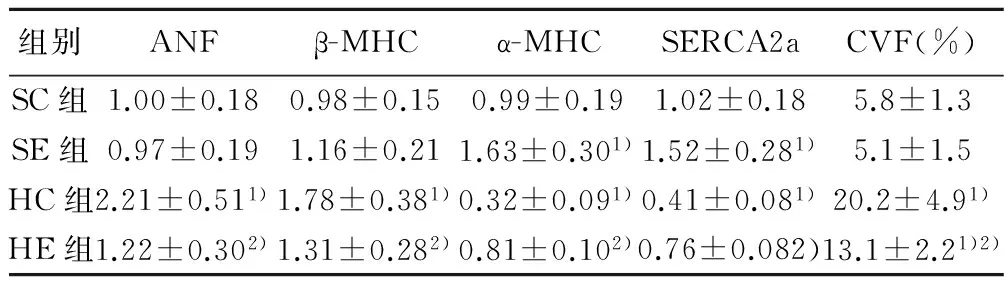
组别ANFβ-MHCα-MHCSERCA2aCVF(%)SC组1.00±0.180.98±0.150.99±0.191.02±0.185.8±1.3SE组0.97±0.191.16±0.211.63±0.301)1.52±0.281)5.1±1.5HC组2.21±0.511)1.78±0.381)0.32±0.091)0.41±0.081)20.2±4.91)HE组1.22±0.302)1.31±0.282)0.81±0.102)0.76±0.082)13.1±2.21)2)
3 讨 论
近年研究认为,左室病理性重构是心力衰竭发生发展最重要的病理生理学机制〔8〕。左室肥大和心功能下降是左室病理重构的主要标志〔9〕。本研究提示心力衰竭后发生病理性心脏肥大,表现为心脏重量和左室重量增加、心腔缩小、心壁增厚,即向心性肥大,收缩功能随之降低,肺水肿明显。胚胎基因重新激活是心肌肥大发生的重要机制,其中MHC和ANF是心肌肥大的分子标志物,其表达水平能影响心肌功能和预后,在左室重构中发挥关键作用〔10〕。MHC由两种基因α-MHC和β-MHC编码,前者ATP酶活性高,肌肉收缩速率最快,后者则相反,调节二者的转换对调节心肌收缩功能至关重要〔11〕。成年心室肌肌球蛋白α-MHC占优势,胚胎期则以β-MHC为主〔12〕。ANF具有抗氧化作用,其表达水平与心力衰竭程度正相关〔13〕。本研究提示心力衰竭时肌球蛋白ATP酶活性降低,心肌收缩力下降。此外,SERCA2a是一种钙离子泵(收缩蛋白),可将胞质中的Ca2+逆浓度梯度泵入肌浆网,参与对细胞内Ca2+浓度的调节〔14〕。本研究中HC组SERCA2a表达下降,不仅导致心肌细胞内Ca2+超载,而且影响心脏的舒缩功能。心肌细胞外基质过度沉积是左室重构的另一特征〔15〕。心肌细胞外基质主要由Ⅰ型和Ⅲ型胶原组成,其生理功能在于为心肌细胞提供支持、传导应力并保证心肌顺应性〔16〕。本研究中,HC组心肌Masson染色显示心肌细胞变性坏死、胶原成分明显增多,CVF升高,纤维化程度明显。研究表明,胶原由正常的3%增至10%时,心室壁顺应性明显下降,舒张功能受限,超过20%则出现心肌细胞被阻隔,收缩功能明显下降〔17〕。此外,心肌纤维化可增加心肌电异质性,是造成心律失常和猝死原因之一〔18〕。
与左室病理性重构不同,运动训练诱导的心脏肥大(运动性心脏肥大或运动员心脏)是心脏对于运动应激的良性适应,属于生理性重构〔19~21〕。本研究提示长期运动训练诱导左室出现离心性肥大,即心腔扩大,室壁增厚不明显。由于心功能增强(LVFS和LVEF增加,HR降低),因此这种结构变化属于生理性肥大。在基因水平上,胚胎基因(ANP和β-MHC)无明显变化,收缩蛋白基因(α-MHC和SERCA2a)表达上调,进一步证实运动性心脏肥大是对长期训练适应的结果〔22〕。运动诱导的左室生理重构在心力衰竭康复中的作用尚无定论,本研究显示左室心力衰竭时“向心性肥大”经过运动康复逐渐转变为“离心性肥大”,其机制可能与有氧运动增加心脏前负荷有关。研究发现〔23〕,长期有氧运动(如长跑或游泳等耐力型运动员)通过增加回心血量(即心脏前负荷或容量负荷)造成心室壁应力增大,引起心肌细胞肌节串联排列为主,心脏扩大以适应增加的容量负荷。本研究提示,运动诱导的左室生理性重构与病理性重构在心力衰竭大鼠运动康复过程中同时存在并相互抗衡〔24〕,最终前者的良性作用逆转了后者的负面效应,表现为左室结构由病理性肥大向生理性肥大转变。因此,长期有氧运动通过抑制心力衰竭时左室重构改善心功能。这一结论在Garciarena等〔25〕针对自发性高血压大鼠的研究中也得到进一步证实,提示心力衰竭患者在运动康复过程中,即使在原有心脏病理肥大(如高血压或心肌梗死造成的心脏向心性肥大)的基础上出现离心性肥大,其坚持运动的收益可能远远大于风险。
1 Griffiths A,Paracha N,Davies A,etal.The cost effectiveness of ivabradine in the treatment of chronic heart failure from the U.K.National Health Service perspective〔J〕.Heart,2014;100(13):1031-6.
2 Sabbah HN,Gupta RC,Kohli S,etal.Chronic therapy with a partial adenosine A1-receptor agonist improves left ventricular function and remodeling in dogs with advanced heart failure〔J〕.Circ Heart Fail,2013;6(3):563-71.
3 Brum PC,Bacurau AV,Cunha TF,etal.Skeletal myopathy in heart failure:effects of aerobic exercise training〔J〕.Exp Physiol,2014;99(4):616-20.
4 Schwarz S,Halle M.Exercise training in heart failure patients〔J〕.Dtsch Med Wochenschr,2014;139(16):845-50.
5 罗智敏,李 容,赵华云,等.抗阻训练联合有氧训练对慢性心力衰竭患者心功能和运动耐力及生活质量的影响研究〔J〕.中国全科医学,2014;17(13):1490-4.
6 张永宏,陈四清.运动康复对老年慢性心力衰竭患者心功能和生活质量的改善作用〔J〕.中国老年学杂志,2013;33(21):5307-8.
7 Weiner RB,Baggish AL.Acute versus chronic exercise-induced left-ventricular remodeling〔J〕.Exp Rev Cardiovasc Ther,2014;12(11):1243-6.
8 O'Meara E,Rouleau JL,White M,etal.Heart failure with anemia:novel findings on the roles of renal disease,interleukins and specific left ventricular remodeling processes〔J〕.Circ Heart Fail,2014;7(5):773-81.
9 Ljubojevic S,Radulovic S,Leitinger G,etal.Early remodeling of perinuclear Ca2+stores and nucleoplasmic Ca2+signaling during the development of hypertrophy and heart failure〔J〕.Circulation,2014;130(3):244-55.
10 Dirkx E,da CMPA,De Windt LJ.Regulation of fetal gene expression in heart failure〔J〕.Biochim Biophys Acta,2013;1832(12):2414-24.
11 Michael JJ,Gollapudi SK,Chandra M.Effects of pseudo-phosphorylated rat cardiac troponin T are differently modulated by alpha-and beta-myosin heavy chain isoforms〔J〕.Basic Res Cardiol,2014;109(6):442-50.
12 Chugh S,Ouzounian M,Lu Z,etal.Pilot study identifying myosin heavy chain 7,desmin,insulin-like growth factor 7 and annexin A2 as circulating biomarkers of human heart failure〔J〕.Proteomics,2013;13(15):2324-34.
13 Wang D,Gladysheva IP,Fan TH,etal.Atrial natriuretic peptide affects cardiac remodeling,function,heart failure and survival in a mouse model of dilated cardiomyopathy〔J〕.Hypertension,2014;63(3):514-9.
14 Wang Y,Tsui H,Ke Y,etal.Pak1 is required to maintain ventricular Ca2+homeostasis and electrophysiological stability through SERCA2a regulation in mice〔J〕?Circ Arrhythm Electrophysiol,2014;7(5):938-48.
15 Skrbic B,Bjornstad JL,Marstein HS,etal.Differential regulation of extracellular matrix constituents in myocardial remodeling with and without heart failure following pressure overload〔J〕.Matrix Biol,2013;32(2):133-42.
16 Halper J,Kjaer M.Basic components of connective tissues and extracellular matrix:elastin,fibrillin,fibulins,fibrinogen,fibronectin,laminin,tenascins and thrombospondins〔J〕.Adv Exp Med Biol,2014;802(6):31-47.
17 Segura AM,Frazier OH,Buja LM.Fibrosis and heart failure〔J〕.Heart Fail Rev,2014;19(2):173-85.
18 Toprak G,Yuksel H,Demirpence O,etal.Fibrosis in heart failure subtypes〔J〕.Eur Rev Med Pharmacol Sci,2013;17(17):2302-9.
19 Weiner RB,Baggish AL.Exercise-induced cardiac remodeling〔J〕.Prog Cardiovasc Dis,2012;54(5):380-6.
20 魏晓峰,魏 伟,史娇娇,等.运动性和高血压性心脏肥大心肌间质胶原网络重塑及其对左心室功能的影响〔J〕.广州体育学院学报,2013;33(3):81-6.
21 钱帅伟,张瑞萍,张安民.运动性心脏肥大:AT1受体、细胞自噬和miRNAs的调节〔J〕.中国病理生理杂志,2014;30(3):551-7.
22 Radovits T,Olah A,Lux A,etal.Rat model of exercise-induced cardiac hypertrophy:hemodynamic characterization using left ventricular pressure-volume analysis〔J〕.Am J Physiol Heart Circ Physiol,2013;305(1):H124-34.
23 Lewis EJ,McKillop A,Banks L.The morganroth hypothesis revisited:endurance exercise elicits eccentric hypertrophy of the heart〔J〕.J Physiol,2012;590(Pt 12):2833-4.
24 刘冠楠,陈 钢.运动性与病理性心脏肥大〔J〕.沈阳体育学院学报,2014;33(2):90-6.
25 Garciarena CD,Pinilla OA,Nolly MB,etal.Endurance training in the spontaneously hypertensive rat:conversion of pathological into physiological cardiac hypertrophy〔J〕.Hypertension,2009;53(4):708-14.
〔2015-12-11修回〕
(编辑 苑云杰/曹梦园)
河南省体育局项目(HT2013-05)
甄 洁(1973-),女,讲师,硕士,主要从事运动人体科学研究。
G804.5
A
1005-9202(2017)08-1881-04;
10.3969/j.issn.1005-9202.2017.08.025
