双氢青蒿素对肺癌细胞增殖的抑制作用
2017-05-10周国运曹干生
周国运 王 熙 曹干生 宋 烨
(武汉市中医医院综合药学部,湖北 武汉 430014)
双氢青蒿素对肺癌细胞增殖的抑制作用
周国运 王 熙1曹干生 宋 烨
(武汉市中医医院综合药学部,湖北 武汉 430014)
目的 探讨双氢青蒿素对肺癌细胞生长增殖的抑制作用。方法 用MTT法观察浓度为4、8、16、32、64、128、256 μmol/L的双氢青蒿素对三种不同的肺癌细胞SPC-A-1、Calua-3、PC-14作用48 h的增殖抑制作用,同样用MTT检测29 μmol/L的双氢青蒿素作用时间为12、24、48、72、96 h后的肺癌细胞增殖情况,经DNA ladder和流式细胞仪检测细胞凋亡情况。结果 双氢青蒿素对三种肺癌细胞的抑制率从大到小依次为:SPC-A-1、PC-14、Calua-3。肺癌细胞SPC-A-1在双氢青蒿素的作用下细胞抑制率较PC-14、Calua-3肺癌细胞大,利用软件计算出细胞SPC-A-1、PC-14、Calua-3的IC50分别为28.9、46.9、78.6 μmol/L。双氢青蒿素作用时间为12、24、48、72和96 h的细胞抑制率较0 h差异显著(P<0.01)。说明随着作用时间的加长,抑制增殖效果越强。29 μmol/L的双氢青蒿素作用48 h后的肺癌细胞出现明显的类似梯子样条带,说明双氢青蒿素可以促进肺癌细胞的增殖。流式细胞仪结果表明,经药物作用后的SPC-A-1细胞的凋亡率较对照组显著增高(P<0.01),这表明双氢青蒿素抑制肺癌细胞SPC-A-1的增殖主要是通过诱导细胞凋亡所引起的。结论 双氢青蒿素可通过诱导细胞凋亡抑制肺癌细胞增殖分化。
双氢青蒿素;肺癌细胞;凋亡;增殖
传统的治疗肺癌的方法主要有手术治疗和化疗,疗效有限,而且手术治疗对患者身体状况要求较高,化疗会损害人体正常的组织细胞〔1〕。青蒿素是从菊科蒿属黄花蒿茎叶中提取的一种内酯类〔2〕。有研究表明,中药青蒿素除了具有抗疟等作用外,还具有抗肿瘤的作用,相比于传统的化疗,副作用小,安全性高。双氢青蒿素为青蒿素的衍生物之一,在青蒿素的衍生物中活性较强〔3〕。已经有研究表明,双氢青蒿素可以抑制肝癌、胃癌、乳腺癌等癌症的发生和发展。本研究选用3种不同的肺癌细胞系SPC-A-1、Calua-3、PC-14,通过噻唑蓝(MTT)法选出最为敏感细胞系,经DNA ladder琼脂糖凝胶电泳和流式细胞仪检测双氢青蒿素与肺癌细胞凋亡作用的相关性。
1 材料与方法
1.1 材料 细胞:人肺癌细胞系SPC-A-1、Calua-3、PC-14购于上海生化所细胞库。主要仪器及试剂:水浴锅:长沙基隆仪器仪表有限公司,超净工作台:苏州尚田洁净技术有限公司,酶标仪:赛飞(中国)有限公司,倒置显微镜:日本尼康,流式细胞仪:杭州联科生物科技有限公司,离心机:盐城市凯特实验仪器有限公司,青链霉素、RPMI1640、胰蛋白酶:美国Sigma,PBS:鼎国生物试剂有限公司,胎牛血清(FBS):上海易利生物科技有限公司,双氢青蒿素:山东新华制药有限公司,碘化丙啶(PI):鼎国生物试剂有限公司,膜联蛋白(Annexin)V:鼎国生物试剂有限公司。
1.2 方法
1.2.1 细胞增殖抑制作用 肺癌细胞用含10%FBS的PRMI-1640细胞生长液培养,放置于37℃,5%CO2的细胞培养箱中培养,用含0.02%乙二胺四乙酸(EDTA)的0.25%胰蛋白酶消化液对细胞进行消化并传代。
1.2.1.1 双氢青蒿素浓度对肺癌细胞生长影响 根据细胞不同,将细胞分为3组,观察1组细胞为SPC-A-1;观察2组细胞为Calua-3;观察3组细胞为PC-14。取含有胰蛋白酶含量为0.25%的消化液消化3组对数生长期的单层肺癌细胞,用10%FBS的RPMI 1640细胞生长液悬浮细胞,接种于96孔细胞培养板中,调整细胞浓度为每孔6×103个,每孔加入细胞生长液100 μl,置于CO2培养箱中,37℃,培养24 h后分别加入不同浓度的双氢青蒿素,浓度分别为4、8、16、32、64、128、256 μmol/L,每组样品设置5个复孔,并设立阴性对照组,在阴性组中加入等量的二甲基亚砜(DMSO)代替双氢青蒿素,在空白组中加等量药物但不加细胞,放置于CO2培养箱中,37℃,培养48 h后,加入体积20 μl浓度为5 mg/ml的MTT溶液,37℃孵育4 h,小心倒掉上清,在沉淀中加入150 μl的DMSO,持续10 min,观察结晶物充分溶解后,用酶联免疫检测仪在波长为490 nm处检测每个孔的光吸收值(OD),记录结果并计算细胞抑制率:细胞抑制率=1-细胞存活率。
1.2.1.2 双氢青蒿素作用时间对肺癌细胞生长影响 接种对数生长期的SPC-A-1细胞于96孔细胞培养板中,按每孔200 μl,调整细胞个数为每孔6×103个,37℃,培养24 h,加入浓度为29 μmol/L的双氢青蒿素,同时设置阴性组和空白组,设置方法同1.2.1.1,分别经过12、24、48、72和96 h作用时间后,用MTT法测量计算细胞的抑制率,测量及计算方法同1.2.1.1。
1.2.2 双氢青蒿素诱导细胞凋亡作用
1.2.2.1 DNA ladder 检测细胞凋亡 取处于对数期的SPC-A-1细胞与双氢青蒿素浓度为29 μmol/L药物相互作用,同时设置对照组,对照组中不加药物,只加等量的DMSO(浓度为0.1%),37℃,孵育48 h,收集细胞。在细胞中加入600 μl细胞裂解液后转移至离心管中,冰浴1 h待细胞完全裂解后,12 000 r/min离心5 min,用平衡酚、酚/氯仿及氯仿分别抽提,取上清液,加入2倍体积的无水乙醇及0.1 mol/L的Nacl(使其终浓度为0.2 mmol/L),在-20℃放置1 h,12 000 r/min离心10 min,弃上清液,加入TE 10 μl和2 μl 浓度为10 mg/ml的RNase充分溶解。提取的DNA ladder经1.2%的琼脂糖凝胶电泳后观察并拍照。
1.2.2.2 流式细胞仪检测细胞凋亡 培养SPC-A-1细胞,待细胞生长至对数期,在细胞培养液中加入29 μmol/L的双氢青蒿素,同时设置对照组不加双氢青蒿素,加入0.1%DMSO,置于CO2培养箱中,37℃,培养48 h后,收集细胞,用磷酸盐缓冲液(PBS)调整待测细胞浓度为1×106个/ml,取1 ml细胞1 000 r/min 4℃离心10 min,弃上清液,加入预冷的PBS 1 ml悬浮细胞,1 000 r/min 4℃离心10 min,弃上清,用PBS重复洗涤1次,用Binding Buffer 200 μl重悬细胞,同时加入5 μl PI和10 μl Annexin-V,放置于室温下,避光反应15 min 后加入300 μl的缓冲液后,立即检测细胞凋亡情况。
1.3 统计学方法 应用SPSS22.0软件进行t检验。
2 结 果
2.1 双氢青蒿素浓度对肺癌细胞生长的影响 随着双氢青蒿素的浓度的增大,3种不同的肺癌细胞系的细胞存活率明显下降,双氢青蒿素3种肺癌细胞的抑制率从大到小依次为:SPC-A-1、PC-14、Calua-3。肺癌细胞SPC-A-1在双氢青蒿素的作用下细胞抑制率较PC-14、Calua-3大,利用软件计算出细胞系SPC-A-1、PC-14、Calua-3的IC50分别为28.9、46.9、78.6μmol/L。见图1。
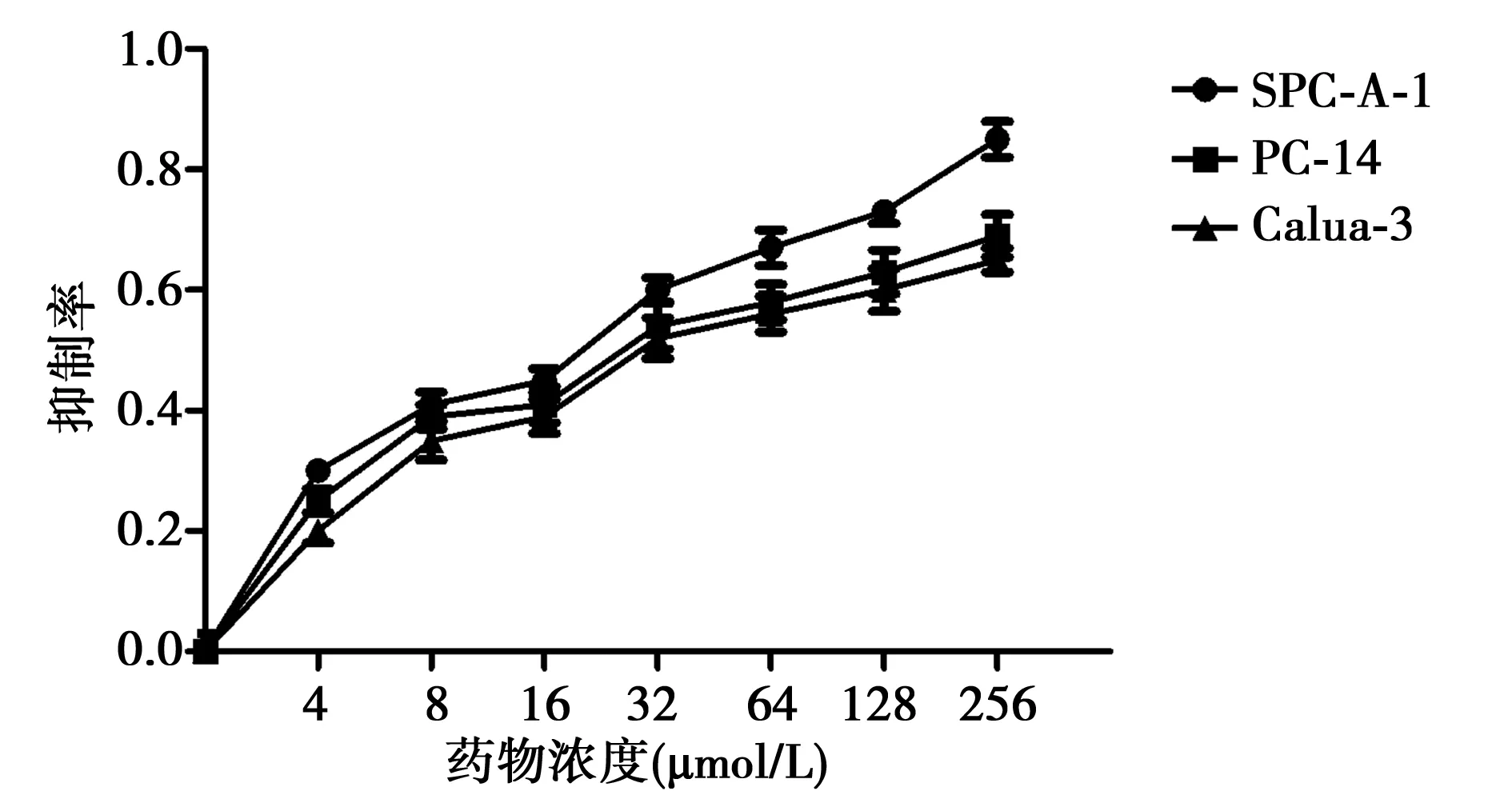
图1 双氢青蒿素对肺癌细胞SPC-A-1、Calua-3、 PC-14增殖的影响
2.2 双氢青蒿素作用时间对肺癌细胞的影响 双氢青蒿素作用时间为12、24、48、72、96 h的细胞抑制率〔(0.21±0.03)、(0.28±0.02)、(0.47±0.06)、(0.62±0.07)、(0.73±0.09)〕较0 h(0)差异显著(P<0.01)。说明随着作用时间的加长,抑制增殖效果越强。
2.3 DNA ladder 检测细胞凋亡情况 细胞凋亡时DNA在核小体间断裂,形成的DNA片段,提取纯化后,凝胶电泳呈现很多条带。肺癌细胞SPC-A-1与双氢青蒿素作用后,提取其DNA,琼脂糖凝胶电泳后,与对照组相比出现很多条大小不同的亮带,证明药物作用后的SPC-A-1细胞出现了细胞凋亡。见图2。
2.4 流式细胞仪检测细胞凋亡 经药物作用后的SPC-A-1细胞的凋亡率(0.59±0.12)较对照组(0.18±0.03)显著增高(P<0.01),这表明双氢青蒿素抑制肺癌细胞SPC-A-1的增殖主要是通过诱导细胞凋亡所引起的。
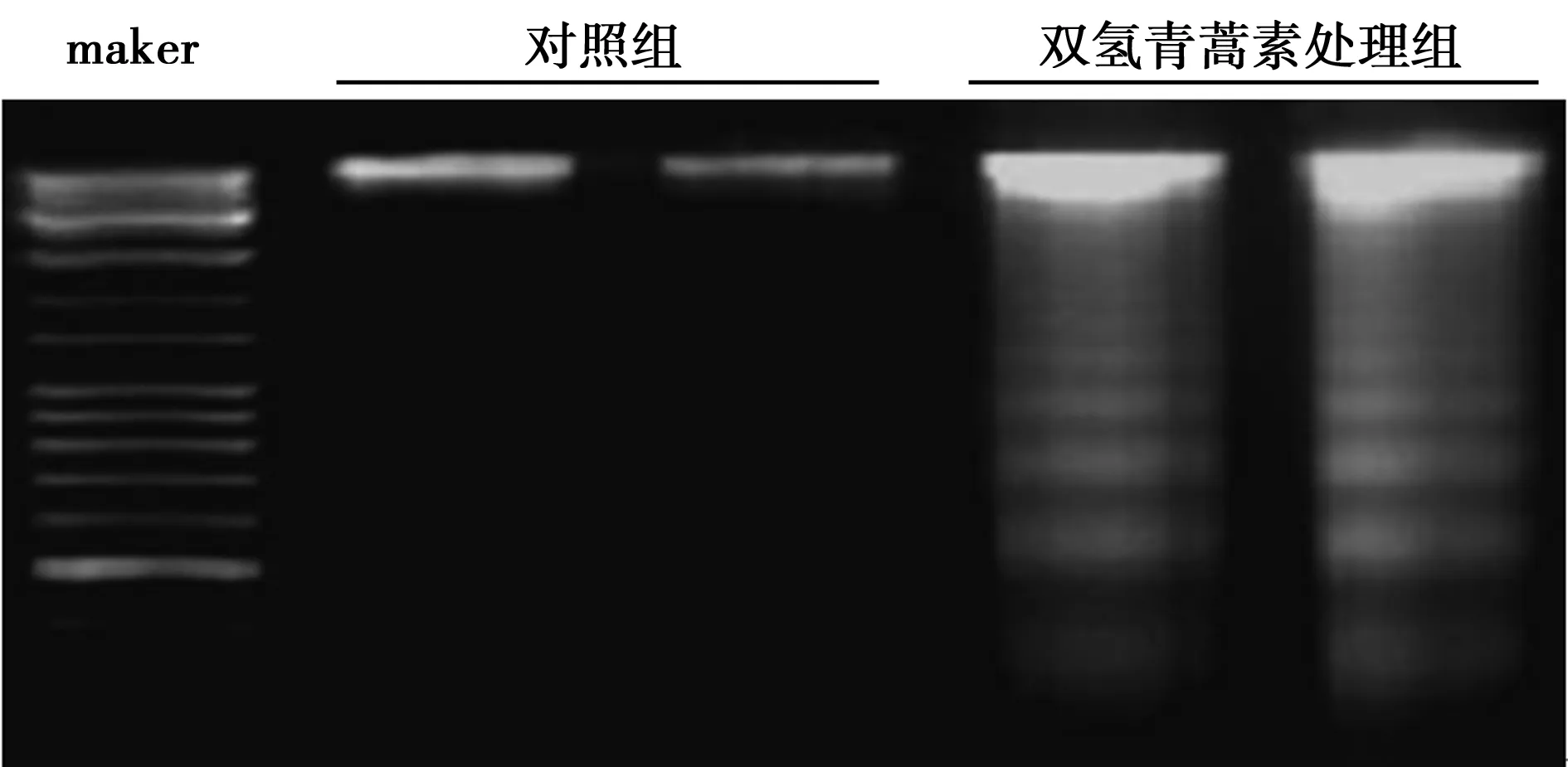
图2 经双氢青蒿素作用后的SPC-A-1细胞DNA ladder
3 讨 论
双氢青蒿素是由四氢硼钠还原青蒿素而产生的,其结构较为独特。双氢青蒿素具有抗肿瘤的作用,又因其安全无毒,成为近年来抗肿瘤药物的热点〔4〕。本研究结果表明,SPC-A-1、Calua-3、PC-14在双氢青蒿素的作用下细胞存活率都有明显的下降,随着双氢青蒿素浓度的增加。细胞凋亡是细胞为了维持内环境的稳定,在基因调控下发生的细胞死亡,细胞凋亡是主动的过程〔5~7〕。双氢青蒿素对肺癌细胞具有明显的抑制作用。细胞凋亡时,会形成非常多的DNA片段,这些DNA片段是由DNA核小体间断裂形成的,经琼脂糖凝胶电泳后会出现类似梯子一样的条带,是判断细胞凋亡的重要标准。本研究证明肺癌细胞经双青蒿素作用后出现了明显的细胞凋亡,进一步验证了双青蒿素可以诱导细胞凋亡。 Annexin-V是一种磷脂结合蛋白,与磷脂酰丝氨酸能亲和结合,在正常的细胞内,磷脂酰丝氨酸(PS)只存在于细胞膜脂质内侧,在细胞凋亡早期,PS通过脂质内侧逐渐向外侧翻,最终会暴露于细胞外侧,而Annexin-V会在细胞凋亡早期与暴露于细胞外侧的PS结合,因此其是一种检测细胞早期凋亡的非常灵敏的指标〔8~10〕。荧光标记的Annexin-V与PI双染色,经显微镜及流式细胞仪观察,可以观察细胞早期凋亡及晚期凋亡情况〔11〕。PC-A-1细胞与双氢青蒿素作用后,经Annexin-V与PI双染色,结果更有力的证明了双氢青蒿素主要通过诱导细胞凋亡而抑制细胞增殖。
1 Shen X,Zhuang Z,Zhang Y,etal.JARID1B modulates lung cancer cell proliferation and invasion by regulating p53 expression〔J〕.Tumour Biol,2015;36(9):7133-42.
2 齐 磊,段永刚,丁英奇,等.Notch-1下调对双氢青蒿素抗人骨肉瘤细胞株U-2OS存活率的影响〔J〕.中国病理生理杂志,2015;31(12):2120-5.
3 郑绍琴,宋健平,王 琪.青蒿素类药对A549和Hela细胞体外抗肿瘤活性的研究〔J〕.江西中医药,2014;45(2):22-4.
4 黄 琰,吴 隼,张 媛.双氢青蒿素诱导外周T细胞淋巴瘤Hut-78细胞凋亡及其可能的机制〔J〕.中国肿瘤生物治疗杂志,2016;23(1):57-61.
5 王焰斌,杨旭东,李 刚.体外循环心内直视手术患者心肌细胞凋亡基因表达的变化〔J〕.中华麻醉学杂志,2015;35(8):913-8.
6 姜福琼,王剑松,邓丹琪.植物药提取物影响肿瘤细胞凋亡信号通路的研究进展〔J〕.云南中医中药杂志,2015;36(3):87-91.
7 李胜男,李 伟,周冬梅.血糖波动对糖尿病大鼠小肠上皮细胞凋亡的影响及可能机制 〔J〕.中国老年学杂志,2016;36(7):1598-600.
8 汤颖俊,郭 青,智亚琴.CXCR4/STAT3在骨髓基质细胞介导的急性髓系白血病耐药中的作用研究〔J〕.中华血液学杂志,2016;37(2):119-23.
9 陈 亮.成人原代肝细胞培养及冻存复苏后细胞凋亡的Annexin V/PI检测及Fas表达〔D〕.长沙:湖南师范大学硕士论文,2015.
10 宋洪强,李雪芳,玄 燕.华半胱氨酰天冬氨酸特异性蛋白酶-3和β-连环蛋白、糖原合成激酶-3β在体外培养保存关节软骨组织中的表达及其相关性〔J〕.中华实验外科杂志,2016;33(1):151-3.
11 舒 娟,刘晓菊,褚 旭.细颗粒物对慢性阻塞性肺疾病小鼠肺泡巨噬细胞吞噬功能的影响〔J〕.中华医学杂志,2016;96(4):301-5.
〔2016-12-22修回〕
(编辑 袁左鸣/滕欣航)
湖北省自然科学基金资助(No.2012FKB04450)
周国运(1967-),男,副主任药师,主要从事中药材鉴别、炮制及中药制剂研发研究。
R734.2
A
1005-9202(2017)08-1874-03;
10.3969/j.issn.1005-9202.2017.08.022
1 武汉市中医医院肿瘤科
