RuO2-IrO2-SnO2/Ti电极电催化氧化降解苯酚废水
2017-05-07闫俊娟刘有智阴昊阳吴孟龙
闫俊娟, 高 璟, 刘有智, 阴昊阳, 吴孟龙
(1. 中北大学山西省超重力化工工程技术研究中心, 山西 太原 030051; 2. 中北大学超重力化工过程山西省重点实验室, 山西 太原 030051)
1 引 言
火炸药工业产生的含苯酚类废水排放量较大,所含主要污染物苯酚属原型质高毒类物质,难以降解,对生态环境及人类健康造成了严重的危害,在我国已被列为重点处理的有害废水之一[1-5]。目前,含苯酚类火炸药废水的处理方法有很多,如: 光催化氧化法,湿式催化氧化法,臭氧氧化法,Fenton氧化法,超临界水氧化法,超声波氧化法,电催化氧化法等。其中,电催化氧化法是利用具有良好催化活性的阳极产生羟基自由基(·OH)等强氧化剂,从而降解废水中酚类及有机物的方法。该法可有效降解污染物,不需添加任何氧化剂,无二次污染,设备相对简单,易于控制。因此,电催化氧化法被称为“环境友好型废水处理技术”,受到废水处理领域的广泛关注[6-8]。
电催化氧化法处理废水效率与催化电极性能密切相关。近年来,国内外研究者致力于各种良好电催化活性电极材料的研制,尤其在钛基催化电极的研制方面取得了一定的成果。李佳亮[9],朱福良[10]等采取增加中间层以阻碍溶液向基体扩散或增加另一种氧化物来提高电极表面的紧密度及其导电性。结果表明,在电极中掺杂一些特殊的金属或非金属元素,不仅可以提高电极的导电性和稳定性,而且可以改善电极的电催化活性,延长电极的使用寿命,降低成本。Chen等[11]以Ti/IrO2-Sb2O5-SnO2为阳极进行电化学行为研究,结果表明,常温下金属钌对氧化物还原有较好的电催化活性,金属铱在酸性条件下对氧化物还原的电催化活性较高、稳定性较好。Comninellis C[12-13]研究表明,SnO2具有良好的析氯、析氧选择性及优良的化学稳定性,还能够提升阳极涂层的耐蚀性,但具有很高的电阻,不能直接用作电极材料。范洪富[14],孙智权[15]等以钛电极为基体,将Sn与Sb,Nd按比例掺杂,结果表明,掺杂不仅可以提高SnO2的导电性,还可改善电极电催化活性层的微观结构,提高SnO2固有的电催化活性,延长其使用寿命。因此,说明RuO2-IrO2-SnO2/Ti类掺杂电极也具有良好的电催化活性和稳定性,目前此类掺杂阳极已被用于氯碱工业、电镀[16]等行业,但将其用于电催化氧化降解废水过程的研究鲜有报道。
基于此,本研究以苯酚为目标污染物,选用RuO2-IrO2-SnO2/Ti电极对模拟含苯酚火炸药废水进行了电催化氧化降解研究。考察氯化钠浓度、电流密度、pH值、苯酚废水初始浓度对苯酚、总有机碳(TOC)、化学需氧量(COD)去除率的影响,确定较优的工艺条件; 同时采用高效液相色谱法分析苯酚在该电极上降解的中间产物及过程,以期为电催化氧化技术在火炸药废水处理领域的应用提供理论支持。
2 实验部分
2.1 试剂与仪器
试剂: 苯酚(分析纯,天津市光复精细化工研究所)、氯化钠(分析纯,天津市光复科技发展有限公司)、盐酸(分析纯,洛阳市化学试剂厂)、氢氧化钠(分析纯,天津市大陆化学试剂厂)、重铬酸钾(分析纯,石家庄市有机化工厂)等。
仪器: pH计(雷磁PHS-3E),电子天平(TG328B),电源(SPWM20200),高效液相色谱仪(美国戴安Ultimate3000),TOC分析仪(美国OI-1030W),COD消解装置(XJ-I型)。
2.2 电催化氧化法降解苯酚废水原理及实验装置
电催化氧化法根据不同电极参与氧化反应机理的不同,可分为直接电催化氧化法和间接电催化氧化法。直接电催化氧化是指有机物在催化电极表面被直接氧化降解为低毒或无毒的小分子有机物; 间接电催化氧化是利用电催化反应过程中产生的ClO-、·OH等强氧化剂将有机物氧化降解为CO2和H2O等物质。
电催化氧化法降解苯酚的实验装置见图1,主要由电解池、电极板、直流稳压电源装置组成。电解池容积为1 L,阳极采用RuO2-IrO2-SnO2/Ti电极,阴极采用Ti电极,电极板规格为100 mm×100 mm×1 mm。

图1 电解装置示意图
1—铁架台, 2—电解池, 3—阳极, 4—阴极,
5—直流稳压电源
Fig.1 Schematic diagram of electrolysis equipment
1—iron support stand, 2—electrolytic cell, 3—anode,
4—cathode, 5—direct current regulated power supply
2.3 实验步骤
准确称取(1000±0.1) mg苯酚,加入200 mL去离子水溶解,待溶解后用去离子水稀释定容至1000 mL容量瓶中,摇匀备用。其余各浓度废水均由浓度为1000 mg·L-1的废水稀释定容。废水中加入一定量的氯化钠作为电解质,并使用0.1 mol·L-1稀盐酸和10%氢氧化钠调节pH值。将配制好的苯酚溶液倒入烧杯,固定电极板置于溶液中,连接反应装置,接通电源,进行实验。
2.4 分析方法
RuO2-IrO2-SnO2/Ti阳极电催化氧化降解模拟含苯酚火炸药废水的处理效果以苯酚、总有机碳(TOC)、化学需氧量(COD)的去除率衡量。
(1)苯酚去除率
废水中苯酚浓度采用高效液相色谱仪测定。检测波长: 270 nm; 色谱柱: C18反相柱(250 mm×4.6 mm×5 μm); 流动相: 甲醇/水(60∶40); 流速: 1 mL·min-1; 柱温: 25 ℃; 进样量20 μL。
苯酚去除率η1计算公式为:
(1)
式中,C0,phenol和Ct,phenol分别为废水处理前后的苯酚浓度,mg·L-1。
(2)TOC去除率
废水中TOC值采用燃烧法由TOC分析仪测定。TOC去除率η2的计算公式为:
(2)
式中,C0,TOC和Ct,TOC分别为废水处理前后的TOC浓度,mg·L-1。
(3)COD去除率
废水中COD值采用重铬酸钾法测定。COD去除率η3的计算公式为:
(3)
式中,C0,COD和Ct,COD分别为废水处理前后的COD浓度,mg·L-1。
3 结果与讨论
3.1 不同氯化钠浓度时苯酚去除率随时间的变化趋势
在电流密度为30 mA·cm-2,pH值为5,苯酚初始浓度为500 mg·L-1的条件下,考察不同氯化钠浓度时废水中苯酚去除率随时间的变化趋势,结果见图2。
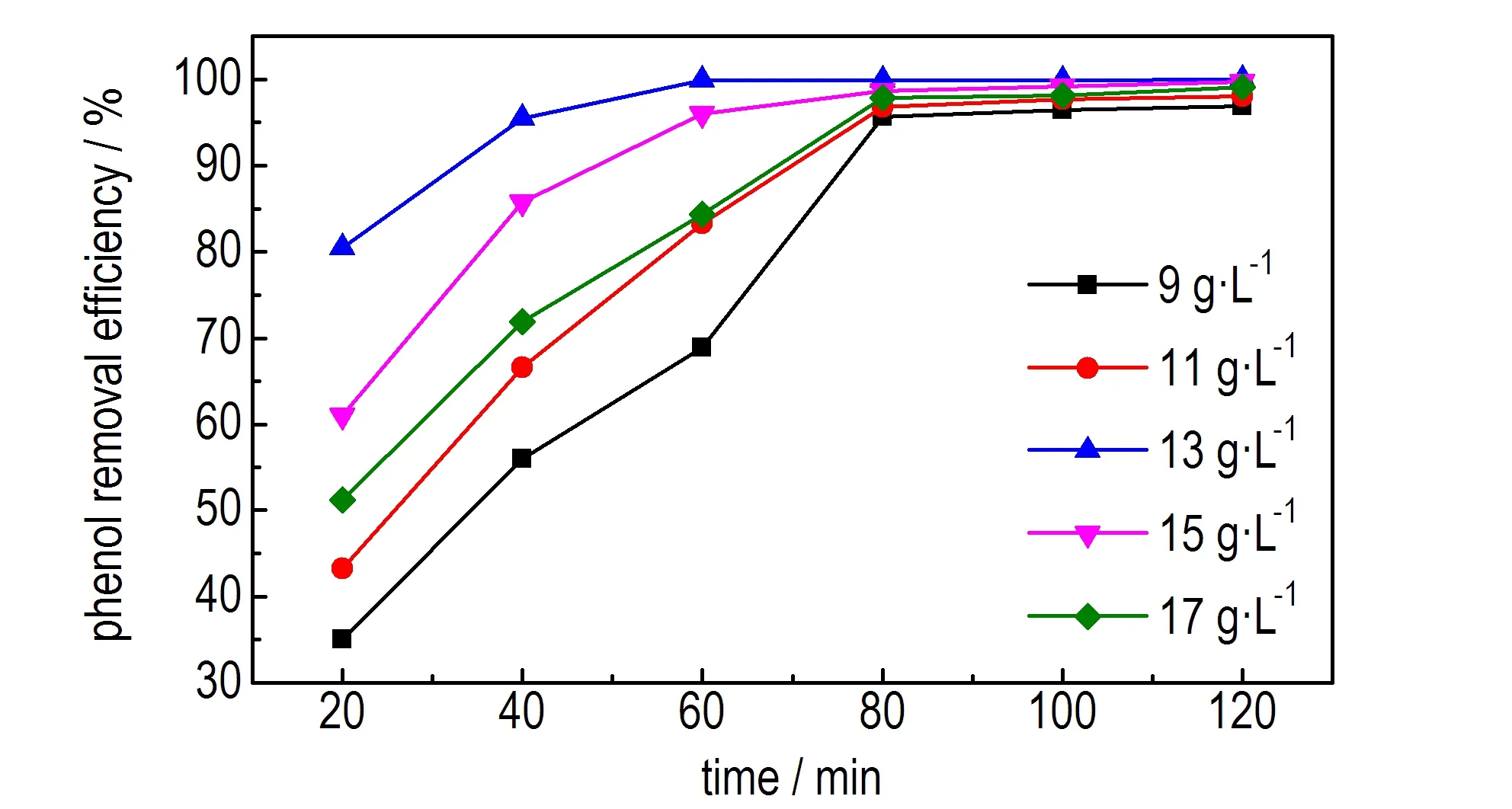
图2 不同氯化钠浓度时苯酚去除率随时间的变化趋势
Fig.2 The change trend of phenol removal efficiency with time under the different NaCl concentration
由图2可知,随着氯化钠浓度的增大,苯酚去除率呈先增大后减小的趋势。这是因为废水中存在的氯离子可在溶液中生成ClO-等其它活性组分,并通过间接电催化氧化反应有效降解目标污染物苯酚; 并且随着氯化钠浓度的增加,ClO-等的生成量增多,苯酚的去除率随之增大,见式(3)~(6)。但受到恒电流电量和苯酚废水浓度水平的限制,Cl-过多时,会导致副反应的发生,见式(7)[17]。副反应产生的Cl2会以气泡的形式附着于电极表面,使得电极活性面积减小、电极表面电位和电流密度分布不均,造成电极电导率下降,体系能耗增大; 且电极表面的气体也会以气泡形式分散于电解液中,使体系传质受阻,造成苯酚的去除率下降[18]。由图2可知,当电解质浓度为13 g·L-1时,苯酚的去除率最大,反应60 min可达99.85%,之后苯酚的去除率随时间变化不明显。因此,选取适宜的电解质浓度为13 g·L-1,适宜的反应时间为60 min。
2Cl-→Cl2aq+2e-
(3)
Cl2aq+H2O→HOCl+Cl-+H+
(4)
HOCl⟺ClO-+H+
(5)
R+ClO-→RO+Cl-→CO2+H2O+Cl-(R代表有机物)
(6)
Cl2(aq)⟺Cl2(g)
(7)
3.2 不同电流密度时苯酚去除率随时间的变化趋势
在氯化钠浓度为13 g·L-1,pH值为5,苯酚初始浓度为500 mg·L-1的条件下,考察不同电流密度时废水中苯酚去除率随时间的变化趋势,结果见图3。
由图3可知,当电流密度大于50 mA·cm-2时,随着电流密度的增大,苯酚去除率呈减小的趋势; 当电流密度小于50 mA·cm-2时,随着电流密度的增大,苯酚的去除率呈先急剧增大后缓慢增大的趋势。当电流密度为30 mA·cm-2时,苯酚去除率的增势最大,且反应60 min时,电流密度为30 mA·cm-2和50 mA·cm-2时苯酚的去除率接近。但电流密度过大时,单位时间产生的热量会增加,溶液放热温度升高,能耗增加,同时会加剧阴极的析氢副反应和阳极的析氧副反应,造成电能利用率下降[19-20]。因此,选取适宜的电流密度为30 mA·cm-2。
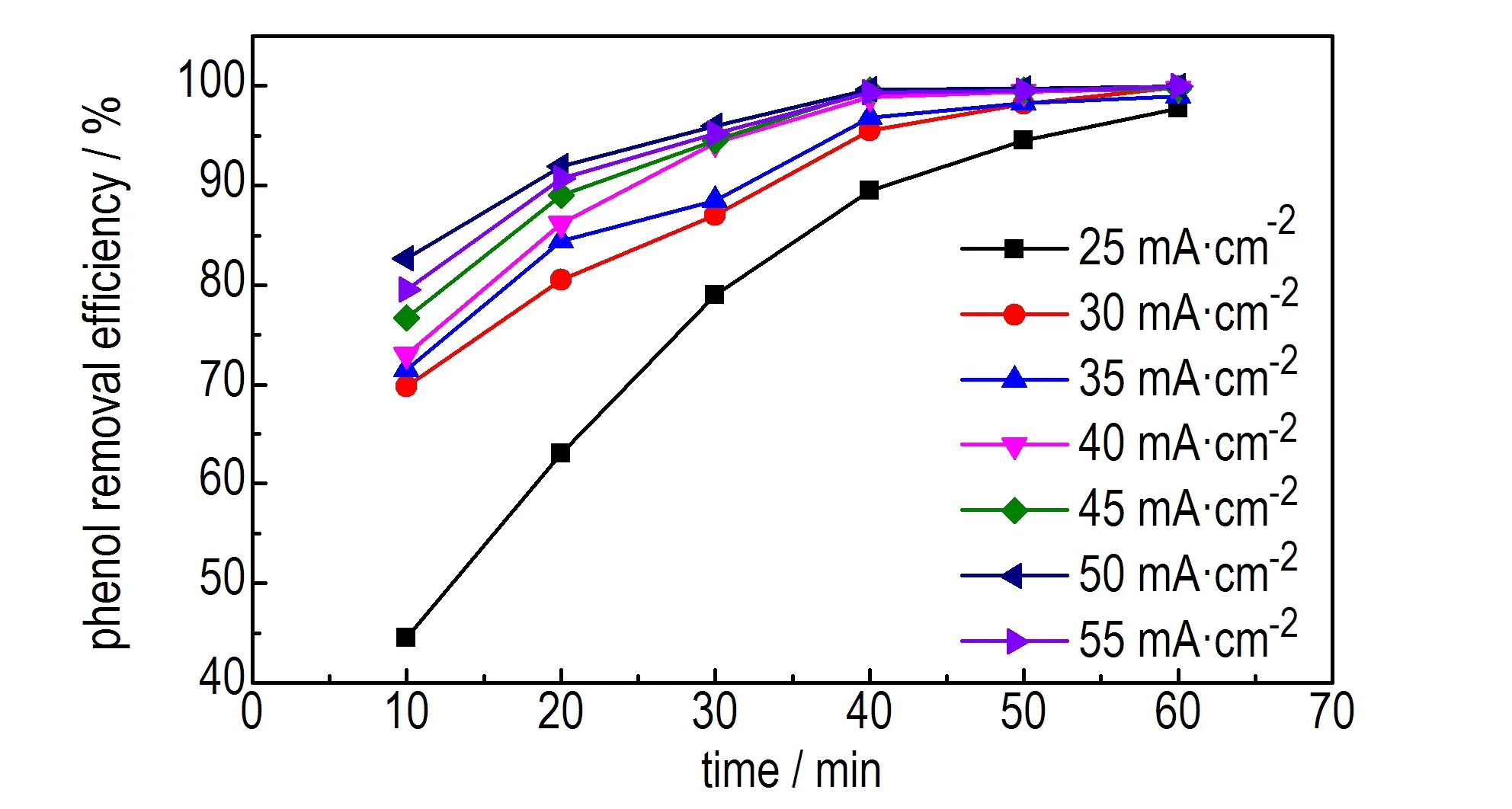
图3 不同电流密度时苯酚去除率随时间的变化趋势
Fig.3 The change trend of phenol removal efficiency with time under the different current density
3.3 不同pH值时苯酚去除率随时间的变化趋势
在氯化钠浓度为13 g·L-1,电流密度为30 mA·cm-2,苯酚初始浓度为500 mg·L-1的条件下,考察不同pH值时废水中苯酚去除率随时间的变化趋势,结果见图4。
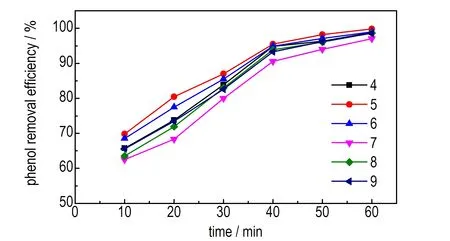
图4 不同pH值时苯酚去除率随时间的变化趋势
Fig.4 The change trend of phenol removal efficiency with time under the different pH value
由图4可知,pH值为7时苯酚的去除率最低,且酸性条件苯酚的去除率明显高于中性和碱性条件。这是因为电催化氧化反应主要包括两个过程[21]: 一是发生在电极表面的直接氧化过程,二是电极表面产生的羟基自由基等活性物质与废水中的有机物结合发生的间接氧化过程。酸性条件下直接氧化起主导作用,析氧电位高; 碱性条件下间接氧化发挥主要作用,虽利于ClO-、·OH等活性物质的生成,但析氧电位低,副反应较剧烈[22]。所以,酸性条件更有利于苯酚的降解。由图4可知,pH值为5时苯酚的去除率最高。因此,选取适宜的pH值为5。
3.4 不同苯酚初始浓度时苯酚去除率随时间的变化趋势
在氯化钠浓度为13 g·L-1,电流密度为30 mA·cm-2,pH值为5的条件下,考察不同苯酚初始浓度时废水中苯酚去除率随时间的变化趋势,结果见图5。
图5 不同废水初始浓度时苯酚去除率随时间的变化趋势
Fig.5 The change trend of phenol removal efficiency with time under the different wastewater initial concentration
由图5可知,随着苯酚废水浓度的增大,苯酚的去除率呈减小的趋势。这是由于当苯酚的浓度增大时,体系内参与反应的苯酚分子数目增加,电极板上吸附了大量苯酚,虽然一定程度上增大了苯酚与阳极表面产生的ClO-、·OH等活性物质的碰撞机率,但同时生成了大量中间产物,在相同的电流密度条件下,阳极表面产生的ClO-、·OH等活性物质的量是一定的,故苯酚的初始浓度超过一定值后,有限的ClO-、·OH等活性物质无法再降解更多的苯酚,所以苯酚的去除率会随之降低[23]。反应60 min时,苯酚初始浓度为500 mg·L-1苯酚去除率可达99.85%,与100 mg·L-1和300 mg·L-1浓度下达到的效果相当,且比750 mg·L-1,和1000 mg·L-1浓度下效果好。因此,选取苯酚废水初始浓度500 mg·L-1较为适宜。
3.5 苯酚去除率最佳条件下TOC、COD去除率随时间的变化趋势分析
在氯化钠浓度为13 g·L-1,电流密度为30 mA·cm-2,pH值为5,苯酚废水初始浓度为500 mg·L-1的最佳条件下,考察了废水中TOC、COD去除率随时间的变化趋势,结果如图6所示。
由图6可知,在苯酚去除率最佳的条件下,随着反应时间的延长,TOC和COD的去除率呈逐渐增大的趋势。当反应进行100 min时,TOC和COD的去除率增势变化不明显,这是因为该反应体系内用于降解苯酚和中间产物的ClO-、·OH等活性物质的量是有限的,此时,TOC和COD的去除率可分别达53.55%、59.37%。

图6 废水中TOC、COD去除率随时间的变化趋势
Fig.6 The change trend of TOC and COD removal efficiency with time in wastewater
3.6 电催化氧化降解苯酚过程分析
在氯化钠浓度为13 g·L-1,电流密度为30 mA·cm-2,pH值为5,苯酚初始浓度为500 mg·L-1的条件下,采用RuO2-IrO2-SnO2/Ti阳极电催化氧化降解含苯酚废水。对处理不同时间的苯酚废水进行高效液相色谱分析,见图7。利用该法降解苯酚废水过程中产生的各中间产物在色谱图中的保留时间来对物质组分定性分析,各标准物质的高效液相色谱图保留时间见表1。

图7 RuO2-IrO2-SnO2/Ti阳极电催化氧化法处理含酚废水不同时间的高效液相色谱图
Fig.7 The HPLC chromatograms of treating the wastewater with phenol at different reaction times by RuO2-IrO2-SnO2/Ti anode electrocatalytic oxidation method
表1 各标准物质的高效液相色谱图保留时间
Table 1 HPLC retention time for standard materials

intermediatesretentiontime/minsubstancenamecarboxylicacids2.553malonicacid2.681succinicacidphenol5.100phenol
据文献[24-26]报道,催化阳极材料及氧化方法不同时苯酚的降解路径也大不相同,表明其电催化氧化过程是一个极为复杂的过程。由图7可知,随着电解时间的延长,代表苯酚特征峰的峰面积逐渐减小,且反应20 min后,出现了新的色谱峰,通过对比标准物质的保留时间可知,生成的新物质中主要有脂肪族化合物丙二酸(保留时间2.553 min)、丁二酸(保留时间为2.681 min)等,但没有芳香族化合物的色谱峰出现,说明该催化电极倾向于电化学转化过程,易于催化ClO-、·OH等活性基团与苯环发生亲电加成反应,生成芳香族化合物,并迅速将其氧化降解为脂肪族化合物及CO2和H2O。
4 结 论
(1)选用RuO2-IrO2-SnO2/Ti电极为阳极,采用电催化氧化法对模拟含苯酚火炸药废水进行了研究,在氯化钠浓度为13 g·L-1,电流密度为30 mA·cm-2,pH值为5,苯酚废水初始浓度为500 mg·L-1,反应60 min,苯酚的去除率可达99.85%。同时,在苯酚去除率最佳的条件下,反应100 min,TOC和COD的去除率分别可达53.55%、59.37%。说明废水中目标污染物苯酚在直接电催化氧化和间接电催化氧化的共同作用下易于降解为小分子物质,但此类中间产物不易被完全矿化。
(2)RuO2-IrO2-SnO2/Ti阳极电催化氧化降解苯酚的反应倾向于电化学转化过程,易于催化ClO-、·OH等活性基团与苯环发生亲电加成反应,生成芳香族化合物,并迅速将其氧化降解为脂肪族化合物及CO2和H2O。
参考文献:
[1] Busca G, Berardinelli S, Resini C, et al. Technologies for the removal of phenol form fluid streams: A short review of recent development[J].JournalofHazardousMaterials, 2008, 160(2-3): 265-288.
[2] Feng Y J, Li X Y. Electro-catalytic of phenol on several mental-oxide electrodes in aqueous solution[J].WaterResraech, 2003, 37(10): 2399-2407.
[3]肖忠良, 胡双启, 吴晓青, 等. 火炸药的安全与环保技术[M]. 北京: 北京理工大学出版社, 2006: 260-278.
[4] 杨忠敏. 水环境中有毒污染物种类综述[J]. 环境研究与监测, 2014, 27(2): 70-76.
YANG Zhong-min. Types of toxic pulluants in water environment were reviewed[J].EnvirenmentalStudyandMonitoring, 2014, 27(2): 70-76.
[5] 于季红. 三维电极法处理苯酚废水影响因素研究[J]. 环境保护科学, 2010, 36(2): 53-56.
YU Ji-hong. Study on Effect factors of phenol wastewater treatment by three dimensional electrode[J].EnvironmentalProtectionscience. 2010, 36(2): 53-56.
[6] 余峰, 马香娟, 吴祖成. 电化学法处理含盐有机废水研究进展[J]. 水处理技术, 2010, 36(12): 6-10.
YU Feng, MA Xiang-juan, WU Zu-cheng. Electrochemical treatment of organic wastewater containing salt[J].TechnologyofWaterTreatment, 2010, 36(12): 6-10.
[7] GAO Jing, LIU You-zhi, CHANG Ling-fei. Treatment of phenol wastewater using high gravity electrochemical reactor with multi-concentric cylindrical electrodes[J].ChinaPetroleumProcessingandPetrochemicalTechnology, 2012, 14(2): 71-75.
[8] 李皓月, 高璟, 刘有智. 苯酚在Ti/IrO2-Ta2O5电极上的电化学反应[J]. 含能材料, 2016, 24(3): 289-294.
LI Hao-yue, GAO Jing, LIU You-zhi. Electrochemical reaction for phenol on Ti/IrO2-Ta2O5electrode[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2016, 24(3): 289-294.
[9] 李佳亮, 姜洪义, 牛金叶. 透明导电氧化物薄膜的研究现状及展望[J]. 现代技术陶瓷, 2006, 27(1): 19-23.
LI Jia-liang, JIANG Hong-yi, NIU Jin-ye. Present situation and prospect of transparent conductive oxide films[J].AdvancedCeramics, 2006, 27(1): 19-23.
[10] 朱福良, 秦瑞焕, 朱玉庆. Sm掺杂Ti/SnO2-Sb电极电催化氧化性能[J]. 兰州理工大学学报, 2012, 38(1): 16-19.
ZHU Fu-liang, QIN Rui-huan, ZHU Yu-qing. Electro-catalysis oxidation of Sm doped Ti/SnO2-Sb electrode[J].JournalofLanzhouUniversityofTechnology, 2012, 38(1): 16-19.
[11] 范荣桂, 董雪, 戴艺, 等. Ir-Ru-Sn掺杂电极电催化法处理苯酚废水的实验研究[J]. 化学研究与应用, 2016, 28(7): 942-946.
FAN Rong-gui, DONG Xue, DAI Yi, et al. Experimental research on the degradation of phenol containing wastewater with Ir-Ru-Sn droped electrode[J].ChemicalResearchandApplication, 2016, 28(7): 942-946.
[12] Comninellis C. Electrocatalysis in the electrochemical conversion/combustion of organic pollutants for waste water treatment[J].ElectrochimActa, 1994, 39(11-12): 1857-1862.
[13] Comninellis C, Pulgarin C. Electrochemical oxidation of phenol for wastewater treatment using SnO2anodes[J].JApplElectrichem, 1993, 23(2): 108-112.
[14] 范洪富, 王磊, 关杰, 等. 稀土掺杂PbO2电极的制备及催化性能研究[J]. 中国稀土学报, 2007, 25(3): 299-304.
FAN Hong-fu, WANG Lei, GUAN Jie, et al. Preparation of PbO2electrodes bearing rare earth metals and its catalytic property[J].JournaloftheChineserareEarthsociety, 2007, 25(3): 299-304.
[15] 孙智权, 路海彦, 任秀彬, 等. 刷涂热分解法制备Ti/SnO2-Sb2O5阳极及其性能[J]. 物理化学学报, 2009, 25(7): 1385-1390.
SUN Zhi-quan, LU Hai-yan, REN Xiu-bin, et al. Performance of Ti/SnO2-Sb2O5anodes prepared by brush coating thermal decomposition method[J].ActaPhys-ChimSin, 2009, 25(7): 1385-1390.
[16] 张招贤. 钛电极工学(第二版)[M]. 北京: 冶金工业出版社, 2003: 283-289.
[17] LI Xiao-liang, XU Hao, YAN Wei. Electrochemical oxidation of aniline by a novel Ti/TiOxHy/Sb-SnO2electrode[J].ChineseJournalofCatalysis, 2016, 37(11): 1960-1870.
[18] 高璟, 刘有智, 祁贵生, 等. 超重力环境下电化学反应过程中的气泡行为[J]. 化学工程, 2014, 42(4): 1-6.
GAO Jing, LIU You-zhi, QI Gui-sheng, et al. Bubbles behaviors in process of electrochemical reaction in high gravity fields[J].ChemicalEngineering, 2014, 42(4): 1-6.
[19] Ventura A, Jacquet G, Bermond A, et al. Electrochemical generation of Fenton′s reagent: application to atrazine degradation[J].WaterResearch, 2002, 36(14): 3517-3522.
[20] 冯壮壮, 王海东, 于建, 等. 电催化氧化深度处理焦化废水的效果及能耗研究[J]. 工业水处理, 2013, 33(4): 61-64.
FENG Zhuang-zhuang, WANG Hai-dong, YU Jian, et al. Study on the efficiency and energy consumption of the advanced treatment of coking wastewater by electro-catalytic oxidation[J].IndustrialWaterTreatment, 2013, 33(4): 61-64.
[21] 张勤, 周雪飞. 高级氧化技术去除水体中氯钡酸的研究进展[J]. 环境污染与防治, 2013, 35(4): 89-94.
ZHANG Qin, ZHOU Xue-fei. Research progress on the application of advanced oxidation processes for removing clofibric acid in aquatic environment[J].EnvironmentalPollutionandControl, 2013, 35(4): 89-94.
[22] 孙南南, 谢实涛, 李凯, 等. RuO2-IrO2-SnO2/Ti阳极电催化氧化苯酚的研究[J]. 环境污染与防治, 2015, 37(2): 38-41.
SUN Nan-nan, XIE Shi-tao, LI Kai,etal. Electro-catalytic oxidation of phenol with RuO2-IrO2-SnO2/Ti anode[J].EnvironmentalPollutionandControl, 2015, 37(2): 38-41.
[23] 周苗苗. 电氧化处理苯酚及苯胺废水的工艺研究[D]. 郑州: 郑州大学, 2009.
ZHOU Miao-miao. Study on electrochemical oxidation conditions of phenol and aniline wastewater[D]. Zhengzhou: Zhengzhou University, 2009.
[24] Makgae M E, Klink M J, Crouch A M. Performance of sol-gel titanium mixed mental oxide electrodes for electro-catalytic oxidation of phenol[J].ApplCatalB:Environ, 2008, 84(3-4): 659-666.
[25] Zeng Z Q, Zou H K, Li X, et al. Degradation of phenol by ozone in the presence of Fenton reagent in a rotating packed bed[J].ChemicalEngineeringJournal, 2013, 229(229): 404-411.
[26] Wang T, Zhao H P, Wang H, et al. Research on degradation product and reaction kinetics of membrane electri-bioreactor(MEBR) with catalytic electrodes for high concentration phenol wastewater treatment[J].Chemosphere, 2016, 155: 94-99.
