锆粉对高氯酸钾热分解反应的影响
2017-05-07孙亚伦焦清介
孙亚伦, 刘 璐,2, 任 慧, 焦清介
(1. 北京理工大学机电学院, 北京 100081; 2. 山东省产品质量检验研究院食品部, 山东 济南 250102)
1 引 言
含能材料的热分解机理研究在基础理论和性能评估方面都具有重要地位,是含能材料生产、运输和储存等方面安全技术评估及危险性、安定性、相容性和使用寿命评估的基础。在目前的含能材料研究中,高反应活性、高热值的金属粉末如铝粉、镁粉及锆粉等越来越多地用于复合型含能材料设计与制造[1],在点火药中加入高热值的金属粉末可以增大反应放热量,提高燃烧温度,保证点火药的可靠性,金属粉的粒度、活度[2]及形貌[3]等都会对点火药的性能造成很大影响。点火药的另一主要成分为氧化剂,主要有硝酸钾(KNO3)和高氯酸钾(KClO4)等,早期相关学者大量研究了B/KNO3[4-8]和含碳材料的硝酸钾点火药[9-11]的各项性能,但KNO3极易溶于水,在潮湿环境下会发生吸湿问题,导致点火失效,而KClO4吸湿性较小[12],且具有较好的热稳定性,安全性相对较好,密度、有效含氧量高[13],作为点火药的氧化剂受到了人们的关注[14-16]。
Zr/KClO4体系是一种典型的激光点火药,Lee S J等[17]曾研究了不同粒径KClO4的热分解,发现粒径越小的KClO4第一步热分解温度越低,计算得到KClO4第一步热分解活化能约在231~269 kJ·mol-1; 还研究了不同锆粉对Zr/KClO4点火药性能的影响[18],发现纯度、密度不同的锆粉加入KClO4后得到的点火药的5 s爆发点、爆热等参数均有一定差异; 后续研究又将质量分数49%的KClO4与质量分数2%的液态氟橡胶Viton A均匀混合,再加入质量分数49%的锆粉,研究了该点火药的热性能和点火性能[19],发现Viton A作为高分子粘合剂可大大加快Zr/KClO4体系的热分解,但该混合点火药体系仍可保持1 A/1 W,5 min不发火。严楠等[16]曾研究了Zr/KClO4混合点火药激光点火延迟时间与装药密度的关系,发现二者呈负指数相关并得到了拟合关系式。但前期研究中鲜有对该类点火药热分解动力学的探索,本课题组曾分析了锆粉粒径对该混合点火药热分解性能的影响[20],发现小粒径锆粉可降低KClO4热分解的活化能,而大粒径的锆粉却使其活化能升高,本研究在此基础上更加深入地研究了小粒径锆粉对KClO4热分解反应动力学的影响,利用热分析实验数据,通过经典热动力学公式求解了表观活化能、指前因子、最可几机理函数和热爆炸临界温度,获得了热分解动力学方程,研究结果将为Zr/KClO4点火药热稳定性预测、反应过程动力学历程的定性描述和机理推断等提供一定参考。
2 实验部分
2.1 试剂与仪器
实验仪器: 同步热分析仪(STA 449F3,德国耐驰仪器制造有限公司),箱式电阻炉(SX2-5-12型,上海雷韵试验仪器制造有限公司),扫描微区X射线光电子能谱仪(PHI QUANTERA-Ⅱ型,日本Ulvac-PHI,INC),扫描电子显微镜(S-4800型,日本日立公司),电子天平(AL104,梅特勒-托利多仪器有限公司),真空干燥箱(DZF-6020,巩义市英裕予华仪器厂),真空手套箱(LS800S,成都德利斯实业有限公司),筛网(200目,北京市通广精细化工公司)。
实验原料: KClO4,分析纯,纯度>99.5%,阿拉丁试剂公司; Zr,平均粒径为1 μm,纯度>99.95%,含痕量金属Hf,阿拉丁试剂公司; 无水丙酮,分析纯,北京通广精细化工公司。
2.2 实验过程
锆粉和KClO4样品在测试分析前需置于真空干燥箱中干燥4h。干燥后将KClO4研磨并过200目筛取筛下物备用,筛下物粒径小于74 μm。准确称取质量比为1∶1的锆粉和高氯酸钾粉末,置于烧杯中,加入无水丙酮,均匀搅拌后取出,置于真空烘箱烘干备用。实验发现,在丙酮中混合所得到的药品较为均匀,且微米锆粉不易团聚。
XPS技术可检测样品中元素的结合能,由结合能可反推样品中所含的物质。因此本研究采用XPS技术对纯KClO4和Zr/KClO4混合物的热分解最终产物成分进行了测试,过程如下: 取两份适量的纯KClO4和混合均匀的Zr/KClO4样品分别放入两个氧化铝坩埚,在箱式电阻炉中加热至1200 ℃后取出,将干燥的样品粉末均匀涂粘在基底上,即完成XPS检测样品制样。检测采用Mg KαX射线(1253.6 eV)作激发源,靶电压为10 kV,电流20 mA。
热分析实验在常压下进行,采用氩气动态气氛,吹扫气50 mL·min-1,保护气20 mL·min-1,升温速率分别为 5,10,15,20 ℃·min-1,样品量控制在2 mg左右,测试温度区间为室温~1000 ℃。
3 结果与讨论
3.1 Zr/KClO4体系热力学参数计算
利用熵最大的热力学原理,可计算非均相系统的平衡特性,很多学者在研究点火药、烟火药和燃烧剂等物质的配方时采用了该方法[21-23]。为确定Zr/KClO4混合物作为点火药的最佳配比,本研究对该体系进行了热力学计算,得到了不同质量比(MZr∶MKClO4)的Zr/KClO4点火药的热力学性质,结果如表1。
表1 不同配比Zr/KClO4点火药的热力学性质
Table 1 Thermodynamic properties of Zr/KClO4at different ratio

MZr∶MKClO4reactiontemperature/Kpressure/MPagasvolume/m3residueratiothermalconductivity/W·m-1·K-140∶6040052.130.160.540.3945∶5543962.130.160.600.3950∶5048062.110.160.620.3055∶4550231.990.160.590.2860∶4049541.790.160.520.18
为保证点火药的可靠性和良好的燃烧性能,点火药应有较高的燃烧温度,燃烧产物中有一定量的气态产物以使燃烧室迅速达到预定点火压力,同时燃烧产物中应含有较高比例的固态颗粒,用于冲刷装药表面,增加热传导和热辐射。综上考虑,在MZr∶MKClO4为50∶50(即1∶1)时得到的点火药性能最好。
3.2 微观形貌分析
为观察锆粉和KClO4的混合情况,本研究采用扫描电子显微镜对质量比50∶50的Zr/KClO4混合物进行了微观形貌的表征,结果如图1所示。

图1 1 μm Zr/ KClO4混合物(50∶50)的扫描电镜图片
Fig.1 SEM images of 1 μm Zr/ KClO4mixture (50∶50)
由于KClO4与锆粉的尺度相差很大,因此通过电镜图片可以清晰分辨出锆粉和KClO4,如图1中红色框内颜色较暗的大颗粒物质为KClO4,如图中黄色实线内附着在KClO4表面和散落在其周围具有一定金属光泽的小颗粒为锆粉。观察图1发现,小粒径锆粉由于比表面积较大,活性高,与KClO4混合后容易吸附在大粒径的KClO4周围,因此所得混合物较为均一,混合效果良好。
但小粒径锆粉易发生团聚,同时接触空气易被氧化。实验所用锆粉为液体水封装,取出时置于手套箱内,一旦取出立即与高氯酸钾混合,避免团聚成大颗粒。由图1可知,上述方法可以较为有效地避免团聚等现象的发生,图中观察到的锆粉粒径一般在5 μm以内,仅有少量散落在KClO4周围的锆粉发生了轻微团聚。
3.3 热分解产物成分分析
为研究锆粉的加入对KClO4热分解产物的影响,利用XPS技术对KClO4和Zr/ KClO4的热分解产物进行了表征。
早期[17]认为KClO4的热分解过程为KClO4先分解为KClO3,之后部分KClO3分解为KCl,另一部分重新转化为KClO4。然而进一步研究认为[24],KClO4分解为KClO3的反应为可逆反应,生成的KClO3在第二步热分解过程中分解生成KCl,反应过程如下:

(1)

(2)
实验发现[20],纯KClO4和Zr/KClO4的热分解均在1100 ℃前即可完成,因此将纯KClO4和Zr/KClO4混合物加热至1200 ℃,对产物进行XPS测试。
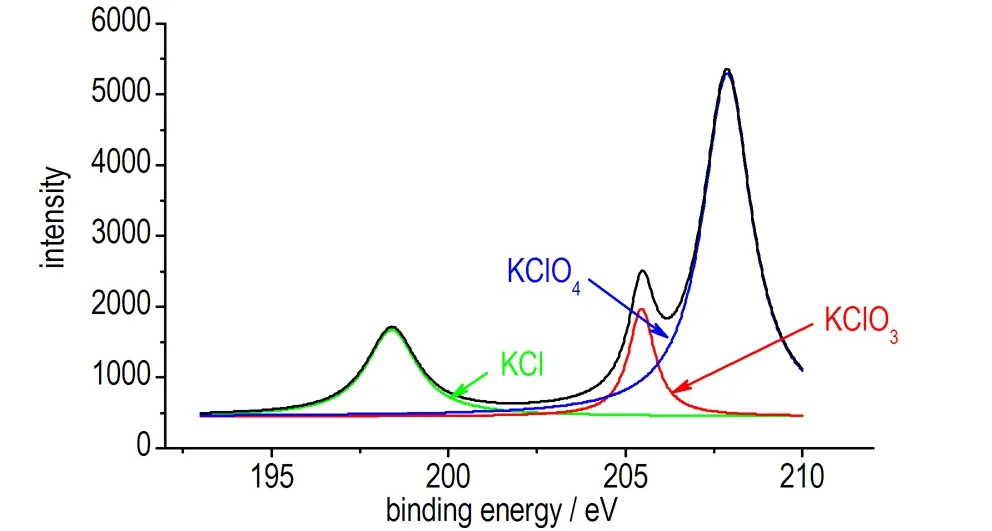
由于KClO3和KClO4中K和O元素的结合能均极为相近,差值小于0.2 eV,很难区分,而二者Cl元素的结合能相差约2 eV[25],因此通过比较两者中Cl元素的峰位区分样品中所含物质。对Cl元素进行窄扫描的结果如图2。
图2a中所示为加热至1200 ℃的KClO4中的Cl元素的XPS曲线,图2(b)中所示为加热至1200 ℃的Zr/KClO4中的Cl元素的XPS曲线,查XPS标准图谱,得出三个峰分别对应KCl (198.2 eV),KClO3(206.5 eV)和KClO4(208.8 eV)。
通过对XPS图谱进行峰分离可以得到各组分的单峰,分别对各单峰进行积分,通过峰面积可以对各组分的含量进行半定量分析[26]。由于Zr/KClO4中含有50%的Zr,导致其中Cl元素的峰强度仅有KClO4中Cl元素的一半左右,所以在此主要对各组分的相对含量进行分析,以KClO3的含量为参考值,得到纯KClO4的最终分解产物各组分的原子浓度之比为nKCl∶nKClO3∶nKClO4=1.1∶1.0∶1.9,而Zr/KClO4混合物的分解产物各组分的原子浓度之比为nKCl∶nKClO3∶nKClO4=0.8∶1.0∶0.9。
a. pure KClO4

b. Zr/KClO4 mixture (50∶50)
图2 加热至1200 ℃后样品中Cl元素的XPS曲线
Fig.2 XPS curves of Cl element in samples heated to 1200 ℃
通过XPS结果发现,纯KClO4的热分解最终产物中仍有近一半的KClO4,同时还有1/4的KClO3,这说明仅有50%左右的KClO3会分解成为KCl。加入锆粉后热分解最终产物中KClO4的比例明显下降,仅剩1/3,KCl的比例也有所下降,但降幅远小于KClO4,这说明锆粉的加入可以大大促进KClO4的热分解,但对KClO3的热分解有一定的抑制作用。分析其原因认为,这是由于小粒径锆粉性质活泼,极易被氧化,在第一步的KClO4热分解过程中与生成的O2快速反应,降低了反应环境中O2的浓度,导致KClO4分解生成KClO3的可逆反应平衡向右移动,但同时锆粉被氧化,不能与KClO3分解产生的O2继续反应,反而作为惰性物质附着于部分KClO3的表面,从而对其分解起到了一定的抑制作用。
3.4 热动力学参数计算
为研究锆粉的加入对混合点火药体系热分解反应机理产生的影响,本研究采用热分析方法,根据热动力学原理,对KClO4和Zr/KClO4两种体系的热分解反应动力学进行计算分析,求解了各步热分解过程的动力学三因子,得到了反应动力学方程,计算了热爆炸临界温度及热力学参数的变化。
研究表明[20],加入锆粉后KClO4第一步热分解对应的DSC曲线为KClO4的熔化吸热、分解放热和锆粉的氧化放热的叠加,第二步热分解的DSC曲线则对应KClO3的熔化、分解和KCl熔化等多个反应。为更加清晰地描述分解进程,获得分解过程的起始温度和峰值温度等信息,本文对实验得到的热重曲线(TG曲线)进行了一阶微分,得到DTG曲线,以DTG曲线的起始温度(To)和峰值温度(Tp)作为反应的起始温度和峰值温度,结果如图3所示。
对DTG曲线中两个失重过程的起始点和峰值温度进行计算,得到的数据如表2所示。
将表2中各步反应的DTG峰值温度代入Kissinger方程[27]和Ozawa方程[28-29]进行线性拟合,即可求得表观活化能E和指前因子A,由此解得的动力学参数列于表3。

a. pure KClO4

b. Zr/KClO4 mixture (50∶50)
图3 不同升温速率下样品的DTG曲线
Fig.3 DTG curves of samples at different heating rate
表2 纯KClO4和Zr/KClO4混合物DTG曲线的起始温度和峰值温度
Table 2 Onset and peak temperature of the DTG curves of pure KClO4and Zr/KClO4mixture
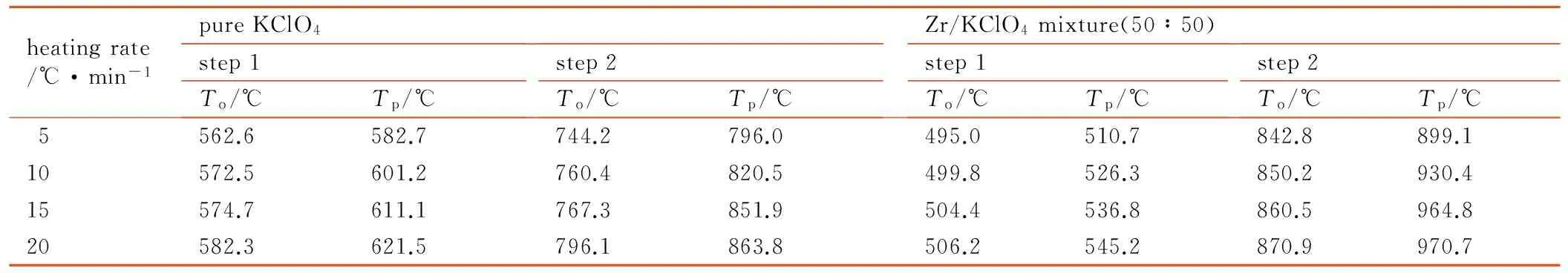
heatingrate/℃·min-1pureKClO4step1To/℃Tp/℃step2To/℃Tp/℃Zr/KClO4mixture(50∶50)step1To/℃Tp/℃step2To/℃Tp/℃5562.6582.7744.2796.0495.0510.7842.8899.110572.5601.2760.4820.5499.8526.3850.2930.415574.7611.1767.3851.9504.4536.8860.5964.820582.3621.5796.1863.8506.2545.2870.9970.7
Note:Tois the onset temperature.Tpis the peak temperature.
表3 不同升温速率下第一步热分解过程的动力学参数
Table 3 Kinetic parameters of the first decomposition heated in different rate

systemstageEK/kJ·mol-1lg(AK/s-1)rKEO/kJ·mol-1rOKClO41216.510.70.999219.70.998Zr/KClO41201.911.00.999204.60.999KClO42177.15.90.989185.80.985Zr/KClO42196.75.90.988206.10.985
Note: Subscript K, data obtained by Kissinger method; subscript O, data obtained by Ozawa method.
由表3发现,与纯KClO4相比,加入1 μm锆粉后,体系第一步热分解的活化能有所降低,分析原因认为,这是由于锆粉与O2的反应消耗了KClO4热分解的生成物,进而起到了促进KClO4热分解的作用,使得其反应更易进行。同时指前因子有所增大,说明加入锆粉使得反应的活性位点增多[30],对KClO4的热分解起到了一定的催化作用,但锆粉会很快被氧化,发生变质,不能继续起到催化作用。
在热分解第二步,锆粉的加入使活化能增加了约20 kJ·mol-1,这是由于在第一步分解过程中锆粉表面被氧化变为氧化锆,氧化锆覆盖在锆的表面,阻止了锆继续参与反应,表面覆盖了氧化锆的锆粉作为惰性物质掺杂于KClO4和KClO3之中,使得第二步热分解的表观活化能升高。由于锆粉被氧化失去了催化活性,在第二步热分解中不能再起到增加活性位点的作用,所以加入锆粉的体系第二步热分解反应的指前因子未发生变化。同时指前因子相对于第一步热分解过程大幅减小,且已低于含能材料指前因子值的正常范围[31],说明此时该物质反应活性较低。
通过热重数据可以获得不同反应深度α所对应的温度,选择一般积分法、Satava-Sestak法、Coats-Redfern法和Agrawal法四种积分方法[32-35],代入G(α),利用线性拟合的方法即可解得相关系数r,活化能E,指前因子A和偏差Q。通过最可几机理函数判断条件[31],找到活化能和指前因子与Kissinger和Ozawa方法解出的值相近、相关系数大于0.98且偏差较小的机理函数,则可认为该函数是此分解过程的最可几机理函数。
利用上述方法对加入锆粉前后KClO4热分解过程的最可几机理函数进行求解,发现加入锆粉前后KClO4的两步热分解为随机成核和随后成长过程,符合Avrami-Erofeev方程[35],但Avrami指数(即核成长因子)n有所不同。纯KClO4的第一步热分解n=3/4,机理函数为G(α)=[-ln(1-α)]3/4,微分形式为f(α)=(4/3)(1-α)[-ln(1-α)]1/4; 加入锆粉后n变为1,机理函数为G(α)=-ln(1-α),微分形式f(α)=(1-α)。纯KClO4和加入锆粉的KClO4第二步热分解的n均为1。将活化能、指前因子和机理函数代入非等温动力学方程dα/dt=A·f(α)·exp(-E/RT)[36-37]得到的各体系各步反应动力学方程如下:
KClO4-1:
dα/dt=1010.7(3/4)(1-α)[-ln(1-α)]1/4exp(-2.604×104/T)
(3)
Zr/KClO4-1:
dα/dt=1011.0·(1-α)·exp(-2.428×104/T)
(4)
KClO4-2:
dα/dt=105.9·(1-α)·exp(-2.130×104/T)
(5)
Zr/KClO4-2:
dα/dt=105.9·(1-α)·exp(-2.366×104/T)
(6)
Avrami指数是与成核机理和晶体生长方式有关的常数,其值为生长的空间维数和成核过程的时间维数之和。加入锆粉后第一步热分解的Avrami指数增大,表明在同一转化率α下G(α)值将增大,即反应速率将增大[38]。这进一步证明了锆粉的加入对KClO4的第一步热分解起到了促进作用,而在被氧化后不再参与KClO4的第二步热分解。
为衡量加入锆粉后点火药的安全性变化,利用热力学关系式(7)~(11)[36]对两体系第一步热分解的热爆炸临界温度、焓变、熵变等参数进行计算。
先计算升温速率趋于0时的Te和Tp值,记为Teo和Tpo
Tei or pi=Teo or po+b·βi+c·βi2
(7)
将得到的Teo和Tpo代入式(8)即可得到热爆炸临界温度Tbe和Tbp。
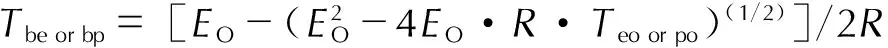
(8)
式中,Tbe or bp为热爆炸临界温度,K;EO为Ozawa法计算得到的活化能,J·mol-1;R为摩尔气体常数,8.314 J·mol·K-1;Teo or po为热分解起始温度或峰值温度,K。
求解活化自由能、活化焓和活化熵等参数,计算公式如下:
ΔS≠=Rln(Ah/kBT)
(9)
ΔH≠=Ea-RT
(10)
ΔG≠=ΔH≠-TΔS≠
每隔一段时间,团队会在如何才能更有效地工作方面进行反省,然后相应地对自己的行为进行调整。为了保持团队的敏捷性,必须随环境一起变化。
(11)
式中,kB为Boltzmann常数,1.3807×10-23J·K-1;H为Plank常数,6.626×10-34J·s。
考虑到第二步热分解发生的温度相对较高,在正常条件下很难达到,因此将第一步热分解可能导致热爆炸的临界温度作为评估其安全性的重要依据,将第一步热分解的峰值温度代入公式(7)~公式(11),得到各参数如表4所示。
表4 KClO4和Zr/ KClO4分解过程的热力学参数
Table 4 Thermodynamic parameters of KClO4and Zr/ KClO4decomposition

systemT/℃ΔS≠/J·mol-1·K-1ΔH≠/kJ·mol-1ΔG≠/kJ·mol-1KClO4587.7-5.85209.5214.5Zr/KClO4516.9-5.76210.1214.4
由表4可知,加入锆粉后热爆炸临界温度从587.7 ℃降至516.9 ℃,热稳定性下降,但该临界温度较一般含能材料的约300 ℃左右[18]要高,因此该混合体系仍具有较好的安全性,同时加入锆粉前后的热分解过程都具有负的ΔS≠值和正的ΔH≠和ΔG≠值,说明具有较好的对热抵抗能力[39]。
4 结 论
从热动力学角度研究了小粒径(1 μm)锆粉对高氯酸钾非等温热分解反应动力学的影响,得出以下结论:
(1) Zr/KClO4混合点火药的最佳配比为质量比50∶50,此时既能产生较高的燃烧温度,又能得到足够的气态和固态燃烧产物。
(2) 锆粉可吸收KClO4分解产生的O2发生氧化反应,因此可使KClO4分解为KClO3这一可逆反应的平衡向右移动,但同时被氧化失去反应活性,不再参与KClO3的热分解反应,导致最终产物中KClO3的比例大幅增加。
(3) 分析实验得到KClO4和Zr/KClO4两体系热分解的动力学三因子。热分解第一阶段,锆粉作为活性物质参与了反应,提高了反应活性,增加了反应的活性位点,又提高了反应速率。热分解第二阶段,加入锆粉的体系活化能增大了约20 kJ·mol-1,指前因子未发生变化。
(4) 加入锆粉后热爆炸临界温度大幅降低,安全性下降,但仍高于一般含能材料,加入锆粉前后的体系均具有较好的对热抵抗能力。
[1] 胥会祥, 李兴文, 赵凤起, 等. 纳米金属粉在火炸药中应用进展[J]. 含能材料, 2011, 19(2): 232-239.
XU Hui-xiang, LI Xing-wen, ZHAO Feng-qi, et al. The effect of nano metal powders on the thermal decomposition kinetics of ammonium perchlorate[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2011, 19(2): 232-239.
[2] 李华, 李振锋. Zr粒度及活度对其点火药作用时间的影响[C]∥中国工程物理研究院科技年报, 2004,(1): 429.
LI Hua, LI Zhen-feng. Influence of particle size and activity of Zr on function time[C]∥Annual Report of China Academy of Engineering Physics, 2004,(1): 429.
[3] 崔庆忠, 焦清介, 彭晨光. 铝粉形态学特征对Al/KClO4燃烧性能的影响[J]. 兵工学报, 2011, 32(11): 1327-1330.
CUI Qing-zhong, JIAO Qing-jie, PENG Chen-guang. The influence of morphology of Al powder on combustion performance of Al/KClO4composition[J].ActaArmamentarii, 2011, 32(11): 1327-1330.
[4] 蒋明, 龙新平, 严楠. B/KNO3点火药的热分解动力学参数计算[J]. 火炸药学报, 2005, 28(4): 80-82.
JIANG Ming, LONG Xin-ping, YAN Nan. Calculation of thermal decomposition kinetic parameters of B/KNO3[J].ChineseJournalofExplosives&Propellants, 2005, 28(4): 80-82.
[5] YE Ying-hua, SHEN Rui-qi, HU Yan. Experiment and photoacoustic simulation of secondary combustion phenomenon of B/KNO3mixture ignited by laser[J]ChineseJournalofExplosives&Propellants, 2008, 31(06): 60-64.
[6] 祝明水, 龙新平, 蒋小华, 等. B/KNO3燃烧性能参数计算[J]. 兵工学报, 2005, 26(3): 320-322.
ZHU Ming-shui, LONG Xin-ping, JIANG Xiao-hua, et al. The calculation of combustion characteristics of B/KNO3[J].ActaArmamentarii, 2005, 26(3): 320-322.
[7] 严楠, 曾雅琴, 魏继锋, 等. B/KNO3装药密度对激光点火延迟时间的影响[J]. 应用激光, 2009, 29(1): 50-53+60.
YAN Nan, ZENG Ya-qin, WEI Ji-feng, et al. The calculation of combustion characteristics of B/KNO3[J].AppliedLaser, 2009, 29(1): 50-53+60.
[8] 舒浪平, 沈美, 沈瑞琪, 等. 激光对B/KNO3药剂作用现象的研究[J]. 火工品, 2005(1): 22-24.
SHU Lang-ping, SHEN Mei, SHEN Rui-qi, et al. Study on the effect of ablation in the surface of B/KNO3powder in Laser Ignition[J].Initiators&Pyrotechnics, 2005(1): 22-24.
[9] 崔庆忠, 李满, 张夫明. C/KNO3点火药研究[J]. 火工品, 2001(2): 31-32.
CUI Qing-zhong, LI Man, ZHANG Fu-ming. Study on C/KNO3igniting composition[J].Initiators&Pyrotechnics, 2001(2): 31-32.
[10] 张步允, 焦清介, 任慧, 等. CNTs/KClO4复合材料的形貌特征及热行为[J]. 含能材料, 2011, 19(4): 401-404.
ZHANG Bu-yun, JIAO Qing-jie, REN Hui, et al. Morphology character and thermal behavior of CNTs/KCIO4[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2011, 19(4): 401-404.
[11] 钱新明, 魏思凡, 邓楠. CNTs/TMO复合催化剂对含高氯酸钾烟火药剂分解反应速率的影响[J]. 火炸药学报, 2009, 32(3): 87-90.
QIAN Xin-ming, WEI Si-fan, DENG Nan. Effect of carbon nanotubes supporting transition metal oxides on reaction rate of firework of potassium perchlorate[J].ChineseJournalofExplosives&Propellants, 2009, 32(3): 87-90.
[12] 曾陆平. 高氯酸钾在引火药中的应用[J]. 河南化工, 2011, 28(3): 42-44.
ZENG Lu-ping. Application of potassium perchlorate in ignition charge[J].HenanChemicalIndustry, 2011, 28(3): 42-44.
[13] 谭惠平, 薛金根. DSC法研究高氯酸钾的催化热分解反应[J]. 中南林业科技大学学报, 2007, 27(3): 114-116.
TAN Hui-ping, XUE Jin-gen. Catalyzed thermal decomposition of potassium perchlorate[J].JournalofCentralSouthUniversityofForestry&Technology, 2007, 27(3): 114-116.
[14] 李玲霞, 丁茂元, 白伟利, 等. Al/KClO4点火药爆热测定的影响因素[J]. 火工品, 2012(6): 40-43.
LI Ling-xia, DING Mao-yuan, BAI Wei-li, et al. Study on factors influencing on explosion heat test of Al/KClO4ignition powder[J].Initiators&Pyrotechnics, 2012(6): 40-43.
[15] 王寅, 史春红, 王丽霞, 等. TiHP/KClO4高能点火药研究[J]. 火工品, 2011(6): 34-36.
WANG Yin, SHI Chun-hong,WANG Li-xia, et al. Study on TiHP/KClO4high energy ignition powder[J].Initiators&Pyrotechnics, 2011(6): 34-36.
[16] 严楠, 曾雅琴, 傅宏. Zr/KClO4激光点火延迟时间与装药密度的关系[J]. 含能材料, 2008, 16(5): 487-489.
YAN Nan, ZENG Ya-qin, FU Hong. Relationship between laser ignition delay time and charge density of Zr/KClO4[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2008, 16(5): 487-489.
[17] Lee J S, Hsu C K, Jaw K-S. The thermal properties of KClO4with different particle size[J].ThermochimicaActa, 2001,367-368: 381-385.
[18] Lee J S, Hsu C K. The effect of different zirconium on thermal behaviors for Zr/KClO4priming composition[J].ThermochimicaActa, 2001,367~368: 375-379.
[19] Lee J S. Thermal properties and firing characteristics of the Zr/KClO4/Viton A priming compositions[J].ThermochimicaActa, 2002,392~393: 147-152.
[20] 孙亚伦, 刘璐, 任慧, 等. 锆粉粒径对锆/高氯酸钾混合点火药热分解性能的影响[J]. 火工品, 2015(4): 34-37.
SUN Ya-lun, LIU Lu, REN Hui, et al. The Effect of Zirconium particle size on thermal behaviors of Zr/KClO4ignition powder[J].Initiators&Pyrotechnics, 2015(4): 34-37.
[21] 贵大勇, 刘吉平, 代兰. 硼氢化钠(NaBH4)在燃烧剂中的应用研究[J]. 含能材料, 2007, 15(3): 231-234.
GUI Da-yong, LIU Ji-ping, DAI Lan. Application of sodium borohydride (NaBH4) in incendiary agent[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2007, 15(3): 231-234.
[22] 郝新红, 汪佩兰. 烟火药燃烧转爆轰研究[J]. 火工品, 1999(3): 16-21.
HAO Xin-hong, WANG Pei-lan. Study of the DDT process of pyrotechnic compositions[J].Initiators&Pyrotechnics, 1999(3): 16-21.
[23] 田春雷, 高俊国, 杜仕国, 等. 一种新型高能点火药的配方设计及性能[J]. 火炸药学报, 2006, 29(1): 75-80.
TIAN Chun-lei, GAO Jun-guo, DU Shi-guo, et al. Formulation design of a new ignition composition and its performances[J].ChineseJournalofExplosives&Propellants, 2006, 29(1): 75-80.
[24] Kurt H S. Mechanism of the isothermal decomposition of potassium perchlorate[J].JPhysChem, 1960,64(11).
[25] 王建祺, 吴文辉, 冯大明. 电子能谱学(XPS/XAES/UPS)引论[M]. 北京: 国防工业出版社, 1992.
WANG Jian-qi, WU Wen-hui, FENG Da-ming. An introduction to electron spectroscopy (XPS/XAES/UPS)[M] . Beijing: National Defense Industry Press, 1992.
[26] 文美兰. X射线光电子能谱的应用介绍[J]. 化工时刊, 2006, 20(8): 54-56.
WEN Mei-lan. Introduction of X-ray photoelectron spectroscopy application[J].ChemicalIndustryTimes, 2006, 20(8): 54-56.
[27] Kissinger H E. Reaction kinetics in differential thermal analysis[J].AnalyticalChemistry, 2002, 29(11): 1702-1706.
[28] Ozawa T. A new method of analyzing thermogravimetric data[J].BulletinoftheChemicalSocietyofJapan, 1965, 38(11): 1881-1886.
[29] Ozawa T. Kinetic analysis of derivative curves in thermal analysis[J].JournalofThermalAnalysis, 1970, 2(3): 301-324.
[30] XIE X, LI Y, LIU Z Q, et al. Low-temperature oxidation of CO catalysed by Co3O4nanorods[J].Nature, 2009, 458: 746-749.
[31] HU R Z, YANG Z Q, LIANG Y J. The determination of the most probable mechanism function and three kinetic parameters of exothermic decomposition reaction of energetic materials by a single non-isothermal DSC curve[J].ThermochimicaActa, 1988,123: 135-151.
[32] Agrawal R K. A new equation for modeling nonisothermal kinetics[J].JournalofThermalAnalysis, 1987, 34(1): 1495-1497.
[33] Coats A W, Redfern J P. Kinetic parameters from thermogravimetric data[J].Nature, 1964, 201: 68-69.
[35] 胡荣祖, 高胜利, 赵凤起, 等. 热分析动力学 [M]. 第二版. 北京: 科学出版社, 2008.
HU Rong-zu, GAO Sheng-li, Zhao Feng-qi, et al. Thermal analysis kinetics[M]. Second edition. Beijing: Science Press. 2008.
[36] PANG W, FAN X, YI J, et al. Thermal behavior and non-isothermal decomposition reaction kinetics of NEPE propellant with ammonium dinitramide[J].ChinJChem, 2010, 28.
[37] 宋秀铎, 赵凤起, 刘子如, 等. 柠檬酸铋的热分解机理、非等温反应动力学及其对双基推进剂燃烧的催化作用[J]. 高等学校化学学报, 2006, 27(1): 125-128.
SONG Xiu-duo, ZHAO Feng-qi, LIU Zi-ru, et al. Thermal decomposition mechanism, non-isothermal reaction kinetics of bismuth citrate and its catalytic effect on combustion of double-base propellant[J].ChemJChineseUniversities, 2006, 27(1): 125-128.
[38] 李疏芬, 江治, 赵凤起, 等. 纳米金属粉对高氯酸铵热分解动力学的影响[J]. 化学物理学报, 2004, 17(5): 623-628.
LI Shu-fen, JIANG Zhi, ZHAO Feng-qi, et al. The effect of nano metal powders on the thermal decomposition kinetics of ammonium perchlorate[J].ChineseJournalofChemicalPhysics, 2004, 17(5): 623-628.
[39] 胡荣祖, 马海霞, 严彪, 等. 从不同升温速率下的DSC曲线数据计算/确定含能材料放热分解反应Arrhenius/非Arrhenius动力学参数的方法[J]. 含能材料, 2013, 21(2): 180-193.
HU Rong-zu, MA Hai-xia, YAN Biao, et al. A method of computing/determining the Arrhenius/non-Arrhenius kinetic parameters of the exothermic decomposition reaction of energetic materials from data of DSC curves at different heating rate[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2013, 21(2): 180-193.
