动脉粥样硬化发病机制及治疗的研究进展
2017-05-02李春阳苏立平
王 新,李春阳,苏立平,周 阳
·前沿进展·
动脉粥样硬化发病机制及治疗的研究进展
王 新1,李春阳2,苏立平3,周 阳3
动脉粥样硬化是导致冠心病和缺血性脑卒中的主要原因,尽管研究已证实动脉粥样硬化是动脉壁炎性病变,但其确切发病机制尚不完全清楚。遗传易感性和环境危险因素(家族史、高胆固醇血症、吸烟、高血压、糖尿病、肥胖等)是动脉粥样硬化患者发生心脑血管事件的主要影响因素,也是目前动脉粥样硬化的防治重点。本文主要综述了动脉粥样硬化发病机制及治疗的研究进展。
动脉粥样硬化;发病机制;治疗;综述
动脉粥样硬化(atherosclerosis)是心脑血管疾病共同的病理学基础,也是导致患者死亡的重要原因。病理学研究表明,动脉粥样硬化的发生发展包括脂质浸润、血小板活化、血栓形成、内膜损伤、炎性反应、氧化应激、血管平滑肌细胞(VSMC)激活等。虽然许多学者曾提出关于AS发病机制的不同学说,如脂质渗入学说、巨噬细胞受体缺失学说、致平滑肌突变学说、损伤应答学说、炎性反应学说、血流动力学学说及免疫学说等,但任何一种学说均不能单独全面地解释AS的发生发展。本文主要从AS的发病机制、治疗的研究进展进行综述。
1 动脉粥样硬化发病机制的研究进展
1.1 炎症 动脉粥样硬化最初被认为是动脉壁脂质堆积[1],后来被认为是一种慢性炎性疾病[2]。动脉粥样硬化是病理状态下固有免疫和适应性免疫介导的炎性疾病,血管炎症、泡沫细胞及其产生的细胞因子可导致动脉粥样硬化或粥样斑块形成,斑块在金属蛋白酶作用下破裂而引发缺血性卒中或心肌梗死。有研究显示,炎性细胞因子可介导动脉粥样硬化的所有阶段,其中肿瘤坏死因子α(TNF-α)能有效上调低密度脂蛋白(LDL)跨内皮细胞的细胞转运,并促进LDL在血管壁滞留,进而加速动脉粥样硬化的发生发展,且该过程是由核因子κB(NF-κB)和过氧化物酶体增殖物激活受体γ(PPAR-γ)相互作用的结果[3]。
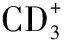
1.2.1 巨噬细胞 免疫细胞参与斑块形成的不同阶段,部分细胞可通过炎症机制直接影响斑块稳定性并导致斑块破裂,其中巨噬细胞发挥着重要作用。动脉粥样硬化斑块局部存在3种(M1、M2、M4)巨噬细胞亚型。M1型巨噬细胞主要由脂多糖和干扰素γ(IFN-γ)刺激分泌,M2型巨噬细胞主要由白介素4刺激分泌,M4型巨噬细胞主要由趋化因子4刺激分泌[7]。临床研究显示,在炎性部位的巨噬细胞表型并不一致,其可以根据微环境改变而分化成不同亚型[3]。M1型巨噬细胞具有促炎性作用,早期动脉粥样硬化主要含有M2型巨噬细胞,而动脉粥样硬化进展期主要含有M1型巨噬细胞[8]。在动脉粥样硬化斑块的发展过程中M1型和M2型巨噬细胞持续存在;在斑块肩部最容易破裂的部位,主要成分是M1型巨噬细胞,而纤维帽部分无差异。研究人员还发现,粥样硬化附近血管外膜的巨噬细胞亚型主要为M2型,其数量是M1型巨噬细胞的2~3倍。在动脉粥样硬化晚期阶段中,M1型巨噬细胞促进坏死核心和不稳定性斑块形成,从而导致血栓事件。M2型巨噬细胞在动脉粥样硬化发生中的作用仍存在争议,有研究显示,M2型巨噬细胞既能促进又能抑制动脉粥样硬化的发生[9]。
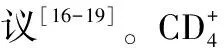
1.2.3 肥大细胞 有动物实验结果显示,给敲除了白介素6(IL-6)、INF-γ基因的小鼠移植野生型小鼠的肥大细胞,结果发现肥大细胞分泌的IL-6、INF-γ均能促进内皮细胞分泌黏附分子,如细胞间黏附分子1、血管间黏附分子1、E选择素、P选择素,且黏附分子的DNA和mRNA均有上调,这在动脉粥样硬化发生过程中具有重要作用[27]。
1.3 感染 除了充分记载的遗传和环境因素外,有证据表明,微生物感染在动脉粥样硬化的发生发展中具有重要作用[28]。感染性病原体直接或间接引起动脉粥样硬化:肺炎衣原体和人类巨细胞病毒直接作用于动脉壁,导致内皮功能障碍和泡沫细胞形成;而其他生物体(如幽门螺杆菌和流感病毒)可通过间接作用诱导慢性全身炎性反应,或启动具有与人类抗原相似的分子模式的致病抗原的免疫应答反应[29]。肺炎衣原体通过感染的外周血单核细胞从肺组织扩散到脉管系统,从而到达动脉粥样硬化病灶[30-31]。研究者还发现,体外单核细胞/巨噬细胞的感染周期通常为3 d,在此期间肺炎衣原体可导致与动脉粥样硬化发展相关的部分基因的表达上调,进而分泌大量炎性细胞因子,并增加内皮细胞黏附分子的表达[32-33]。此外,感染还可改变胆固醇稳态[34]、激活LDL受体[35]、诱导ApoE基因敲除小鼠的动脉粥样硬化[19]。以上结果表明,肺炎衣原体感染引起的宿主细胞生理改变可能导致动脉粥样硬化的发展。EVANI等[36]认为,感染引起的物理变化改变了单核细胞与内皮细胞的相互作用,这是动脉粥样硬化发展的第一步。
2 动脉粥样硬化诱发因素的研究进展
虽然识别动脉粥样硬化的内皮细胞活化和炎性细胞趋化机制已取得极大进步,但很少有人知道抑制这些事件的内在途径。BRIOT等[37]研究发现,NOTCH1是内皮细胞活化的拮抗剂,其表达于成年人动脉内皮细胞,但在高脂饮食下会明显减少;此外,活化STAT3可以治疗有炎性脂质和促炎性细胞因子堆积的主动脉内皮细胞,其可以降低NOTCH1的表达。相反,一些由炎性脂质介导的效应可因NOTCH1增加而缓解,表明炎性脂质介导的炎症和NOTCH1有关。值得注意的是,人主动脉内皮细胞中炎性脂质减少NOTCH1的表达与高密度脂蛋白相关的遗传变异体有关。基于以上研究,BRIOT等[37]提出NOTCH1减少是动脉粥样硬化中血管炎症的诱发因素。
3 动脉粥样硬化治疗的研究进展
3.1 纳米材料 目前,治疗动脉粥样硬化主要依靠他汀类药物、抗血栓形成药物及手术干预等,其治疗目的是降低血清LDL水平。目前,仍缺乏细胞介导的抗炎治疗。ALLEN等[38]研究发现,纳米材料可以靶向治疗炎性细胞群;此外,具有高度细胞吞噬性的APC是一个启动免疫反应和炎症的细胞群中心,而它们特别适合于由纳米颗粒靶向调制。因此,纳米材料已成为炎性疾病(如自身免疫性疾病及心血管疾病)的免疫治疗。未来采用纳米材料评估和治疗动脉粥样硬化势在必行。
3.2 烟酸 烟酸是治疗动脉粥样硬化的广谱脂质调节药物,但目前通过烟酸改善动脉粥样硬化的作用机制尚未完全清楚。SU等[39]研究证实烟酸通过抑制血清黏附分子和炎性细胞因子表达而改善动脉粥样硬化,且烟酸的抗炎作用是通过下调NF-κB信号通路而实现的,但烟酸缓解动脉粥样硬化的具体分子机制仍需进一步研究探讨。
3.3 抑制NF-κB信号 动脉粥样硬化是载脂蛋白长期沉积于动脉壁而导致的慢性炎性疾病,该病涉及多种类型细胞及细胞因子间的相互作用。炎性反应存在于动脉粥样硬化的各个阶段,从血管内膜的脂质积累、斑块形成到斑块破裂,而调节炎症的最重要转录因子是NF-κB。NF-κB涉及动脉粥样硬化过程中的多个病理过程,包括泡沫细胞形成、血管炎症、VSMC增值、动脉钙化及斑块形成。因此,抑制NF-κB信号可以缓解动脉粥样硬化形成[40]。
3.4 表观遗传修饰 动脉粥样硬化是遗传因素与环境因素相互作用所致的疾病,表观遗传修饰可能是连接遗传因素与环境因素的桥梁。表观遗传修饰涉及DNA甲基化、组蛋白修饰和微小RNA,均增强了我们对动脉粥样硬化病理过程的理解,且表观遗传修饰的可逆可能成为动脉粥样硬化治疗的新靶点。
4 小结
近年来,动脉粥样硬化发病过程中涉及的免疫机制越来越受到研究者重视,且越来越多的证据显示,免疫系统组分改变会影响动脉粥样硬化过程中的脂质积累、黏附分子表达、单核细胞分化及巨噬细胞吞噬等。目前,治疗动脉粥样硬化的药物主要是降脂、抗凝及溶栓药物,但治疗效果均不够理想,故需要继续从基因及分子领域探索动脉粥样硬化新的治疗方法。
[1]VIRCHOW R.Die cellularpathologie in ihrer begründung auf physiologische und pathologische gewebelehre[M].Hirschwald,1966:364-365.
[2]ROSS R.The pathogenesis of atherosclerosis-an update[J].New Engl J Med,1998,314(8):488-500.
[3]ZHANQ Y,YANG X,BIAN F,et al.TNF-alpha promotes early atherosclerosis by increasing transcytosis of LDL across endothelial cells:Crosstalk between NF-kappa B and PPAR-gamma[J].Mol Cell Cardiol,2014,72:85-94.
[4]HANSSON G K,JONASSON L,HOLM J,et al.ClassⅡ MHC antigen expression in the atherosclerotic plaque:smooth muscle cells express HLA-DR,HLA-DQ and the invariant gamma chain[J].Clin Exp Immunol,1986,64(2):261-268.
[5]KIMURA T,TSE K,SETTE A,et al.Vaccination to modulate atherosclerosis[J].Autoimmunity,2015,48(3):152-160.
[6]JONASSON L,HOLM J,SKALLI O,et al.Regional accumulations of T cells,macrophages,and smooth muscle cells in the human atherosclerotic plaque[J].Arteriosclerosis,1986,6(2):131-138.
[7]GLEISSNER C A.Macrophage phenotype modulation by CXCL4 in atherosclerosisl[J].Front Phvsiol,2012,3:1.
[8]DA ROCHA R F,DE BASTIANI M A,KIAMT F.Bioinformatics approach to evaluate differential qene expression of M1/M2 macrophage phenotypes and antioxidant genes in atherosclerosis[J].Cell Biochem Biophys,2014,27(2):831-839.
[9]LIU Y C,ZOU X B,CHAI Y F,et al.Macrophage polarization in inflammatory diseases[J].Int J Biol Sci,2014,10(5):520-529.
[10]GALKINA E,KADL A,SANDERS J,et al.Lymphocyte recruitment into the aortic wall before and during development of atherosclerosis is partially L-selectin dependent[J].J Exp Med,2006,203(5):1273-1282.
[11]TSE K,TSE H,SIDNEY J,et al.T cells in atherosclerosis[J].Int Immunol,2013,25(11):615-622.
[12]ROBERTSON A K,HANSSON G K.T cells in atherogenesis:for better or for worse?[J].Arterioscler Thromb Vasc Biol,2006,26(11):2421-2432.
[13]BUONO C,BINDER C J,STAVRAKIS G,et al.T-bet deficiency reduces atherosclerosis and alters plaque antigen-specific immune responses[J].Proc Natl Acad Sci U S A,2005,102(5):1596-1601.
[14]BUONO C,COME C E,STAVRAKIS G,et al.Influence of interferon-gamma on the extent and phenotype of diet-induced atherosclerosis in the LDLR-deficient mouse[J].Arterioscler Thromb Vasc Biol,2003,23(3):454-460.
[15]GUPTA S,PABLO A M,JIANG X,et al.IFN-gamma potentiates atherosclerosis in ApoE knock-out mice[J].J Clin Invest,1997,99(11):2752-2761.
[16]ERBEL C,AKHAVANPOOR M,OKUYUCU D,et al.IL-17A influences essential functions of the monocyte/macrophage lineage and is involved in advanced murine and human atherosclerosis[J].J Immunol,2014,193(9):4344-4355.
[17]CHENG X,TALEB S,WANG J,et al.Inhibition of IL-17A in atherosclerosis[J].Atherosclerosis,2011,215(2):471-474.
[18]DANZAKI K,MATSUI Y,IKESUE M,et al.Interleukin-17A deficiency accelerates unstable atherosclerotic plaque formation in apolipoprotein E-deficient mice[J].Arterioscler Thromb Vasc Biol,2011,32(2):273-280.
[19]BUTCHER M J,GJURICH B N,PHILLIPS T,et al.The IL-17A/IL-17RA axis plays a proatherogenic role via the regulation of aortic myeloid cell recruitment[J].Circ Res,2012,110(5):675-687.
[20]DE PALMA R,DEL GALDO F,ABBATE G,et al.Patients with acute coronary syndrome show oligoclonal T-cell recruitment within unstable plaque:evidence for a local,intracoronary immunologic mechanism[J].Circulation,2006,113(5):640-646.
[21]PAULSSON G,ZHOU X,TÖRNQUIST E,et al.Oligoclonal T cell expansions in atherosclerotic lesions of apolipoprotein E-deficient mice[J].Arterioscler Thromb Vasc Biol,2000,20(1):10-17.
[22]KETELHUTH D F,HANSSON G K.Cellular immunity,lowdensity lipoprotein and atherosclerosis:break of tolerance in the artery wall[J].Thromb Haemost,2011,106(5):779-786.
[23]SHAH P K,CHYU K Y,DIMAYUGA P C,et al.Vaccine for atherosclerosis[J].J Am Coll Cardiol,2014,64(25):2779-2791.
[24]STEMME S,FABER B,HOLM J,et al.T lymphocytes from human atherosclerotic plaques recognize oxidized low density lipoprotein[J].Proc Natl Acad Sci,1995,92(9):3893-3897.
[26]HERMANSSON A,KETELHUTH D F,STRODTHOFF D,et al.Inhibition of T cell response to native low-density lipoprotein reduces atherosclerosis[J].J Exp Med,2010,207(5):1081-1093.
[27]ZHANG J,ALCAIDE P,LIU L,et al.Regulation of endothelial cell adhesion molecule expression by mast cells,macrophages,and neutrophils[J].PLoS One,2011,6(1):e14525.
[28]CAMPBELL L A,LEE A W,ROSENFELD M E,et al.Chlamydia pneumoniae induces expression of pro-atherogenic factors through activation of the lectin-like oxidized LDL receptor-1[J].Pathog Dis,2013,69(1):1-6.
[29]SESSA R,PIETRO M D,FILARDO S,et al.Infectious burden and atherosclerosis:A clinical issue[J].World J Clin Cases,2014,2(7):240-249.
[30]GIEFFERS J,VAN ZANDBERGEN G,RUPP J,et al.Phagocytes transmit Chlamydia pneumoniae from the lungs to the vasculature[J].Eur Respir J,2004,23(4):506-510.
[31]MOAZED T C,KUO C C,GRAYSTON J T,et al.Evidence for systemic dissemination of Chlamydia pneumoniae via macrophages in the mouse[J].J Infect Dis,1998,177(5):1322-1325.
[32]NETEA M G,SELZMAN C H,KULLBERG B J,et al.Acellular components of Chlamydia pneumoniae stimulate cytokine production in human blood mononuclear cells[J].Eur J Immunol,2000,30(2):541-549.
[33]Virok D,Loboda A,Kari L,et al.Infection of U937 monocytic cells with Chlamydia pneumoniae induces extensive changes in host cell gene expression[J].J Infect Dis,2003,188(9):1310-1321.
[34]TUOMAINEN A M,HYVRINEN K,EHLERS P I,et al.The effect of proatherogenic microbes on macrophage cholesterol homeostasis in apoE-deficient mice[J].Microb Pathog,2011,51(3):217-224.
[35]CAMPBELL L A,LEE A M,ROSENFELD M E,et al.Chlamydia pneumoniae induces expression of pro-atherogenic factors through activation of the lectin-like oxidized LDL receptor-1[J].Pathog Dis,2013,69(1):1-6.
[36]EVANI S J,RAMASUBRAMANIAN A K.Biophysical regulation of Chlamydia pneumoniae-infected monocyte recruitment to atherosclerotic foci[J].Sci Rep,2016,6:19058.DOI:10.1038/srep19058.
[37]BRIOT A,CIVELEK M,SEKI A,et al.Endothelial NOTCH1 is suppressed by circulating lipids and antagonizes inflammation during atherosclerosis[J].J Exp Med,2015,212(12):2147-2163.
[38]ALLEN S,LIU Y G,SCOTT E.Engineering nanomaterials to address cell-mediated inflammation in atherosclerosis[J].Regen Eng Transl Med,2016,2(1):37-50.
[39]SU G,SUN G,LIU H,et al.Niacin Suppresses Progression of Atherosclerosis by Inhibiting Vascular Inflammation and Apoptosis of Vascular Smooth Muscle Cells[J].Med Sci Monit,2015,21:4081-4089.DOI:10.12659/MSM.895547.
[40]YU X H,ZHENG X L,TANG C K.Nuclear Factor-κB Activation as a Pathological Mechanism of Lipid Metabolism and Atherosclerosis[J].Adv Clin Chem,2015,70:1-30.
(本文编辑:谢武英)
·指南·共识·标准·
Progress on Pathogenesis and Treatment of Atherosclerosis
WANGXin1,LIChun-yang2,SULi-ping3,ZHOUYang3
1.InnerMongoliaMedicalUniversity,Hohhot010030,China2.DepartmentofNeurology,theAffiliatedHospitalofInnerMongoliaMedicalUniversity,Hohhot010030,China3.BasicMedicalLaboratory,XinhuaBranch,BasicMedicalCollegeofInnerMongoliaMedicalUniversity,Hohhot010030,ChinaCorrespondingauthor:LIChun-yang,E-mail:lichunyang770905@163.com
Atherosclerosis is the leading cause of coronary heart disease and ischemic stroke,although it is confirmed that atherosclerosis is one of inflammatory lesion of arterial wall,but the definite mechanism is still no very unclear so far.Genetic susceptibility and environmental risk factors(family history,hypercholesterolemia,smoking,hypertension,diabetes and obesity,etc.)are major influencing factors of cardiovascular and cerebrovascular events,prevention and treatment emphasis in patients with atherosclerosis.This paper reviewed the progress on pathogenesis and treatment of atherosclerosis.
Atherosclerosis;Pathogenesis;Therapy;Review
国家自然科学基金资助项目(81360213)
李春阳,E-mail:lichunyang770905@163.com
R 543.5
A
10.3969/j.issn.1008-5971.2017.02.001
2016-10-16;
2017-01-18)
王新,李春阳,苏立平,等.动脉粥样硬化发病机制及治疗的研究进展[J].实用心脑肺血管病杂志,2017,25(2):1-4.[www.syxnf.net]
WANG X,LI C Y,SU L P,et al.Progress on pathogenesis and treatment of atherosclerosis[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2017,25(2):1-4.
1.010030内蒙古呼和浩特市,内蒙古医科大学
2.010030内蒙古呼和浩特市,内蒙古医科大学附属医院神经内科
3.010030内蒙古呼和浩特市,内蒙古医科大学基础医学院新华校区基础医学实验室
