利用FecB多胎基因导入培育哈萨克羊多羔类型的研究
2017-05-02罗生金
罗生金
利用FecB多胎基因导入培育哈萨克羊多羔类型的研究
罗生金
(新疆哈密地区畜牧工作站,新疆 哈密 839000)
以小尾寒羊和湖羊及寒哈F1羊、湖哈F1羊、横交F2羊共计296只,用FecB基因为候选基因,采用PCR-RFLP方法检测湖(寒)哈杂交F1及横交F2羊群中存在3种基因型:BB型、B+型、++型。杂交F1代166只含等位基因B频率为0.58,含等位基因+频率为0.42;横交F2代检测64只含等位基因B频率为0.41,含等位基因+频率为0.59。对FecB 基因在 4 个不同类型绵羊中分布差异的卡方独立性检验,结果表明:小尾寒羊、湖羊与湖(寒)哈杂交F1及横交F2两个类型绵羊相互之间分布差异极显著(P0.01),湖羊与小尾寒羊之间分布差异不显著(P>0.05)。 湖(寒)哈杂交及横交F2羊基因型频率差异不显著(P>0.05)。说明含FecB基因羊与哈萨克母羊杂交后,FecB基因显性效果好,遗传性能较为稳定。对F1羊跟踪调查,41只母羊产羔率为159%(64/41),繁殖成活率为146%(60/41),其中BB基因型1只产羔2只,产羔率为200%;B+基因型29只产羔50只,产羔率为172%;++基因型11只产羔12只,产羔率为109%;B+基因型与野生型(++)相比较提高了63个百分点,差异极显著(P0.01)。进一步说明FecB基因是高繁殖率主效基因,可有效提高F1羊产羔数。
绵羊;FecB基因;PCR- RFLP;产羔数
在国外采用分子标记育种技术开展新品种(品系)培育已取得突破性进展。1919年澳大利亚的B Seear从新南威尔士州毛用型美利奴羊群中选出一只高繁殖力母羊,到1959年B Seear的羊群已经具有很高的繁殖力,平均产羔1.94只,育成了多胎的Booroola Merino高产群[1]。Wilion等[2]发现骨形态发生BMPR-IB基因编码区发生一处突变(A746G),导致了该受体激酶结构域的第249位氨基酸由谷氨酰胺突变为精氨酸(Q→R),揭示了Booroola Merino绵羊排卵数增加的原因。1989年该基因被绵、山羊遗传命名委员会正式定名为FecB 基因。在我国,王根林等[3]利用限制性酶切片段长度多态性PCR 技术首次发现湖羊和小尾寒羊存在FecB 基因,与Booroola Merino绵羊的多胎主效基因FecB的表现型基本相同。两者产羔率分别为228.92%和270.00%。柳淑芳等[4]利用FecB基因对国内多胎品种进行基因型与产羔数的关联分析,进一步确认了我国的湖羊、小尾寒羊等少数品种携带有多胎性能主基因。
自2012年实施的自治区高技术项目“新疆
1 材料和方法
1.1 试验材料
绵羊血样、1.5 mL离心管、采用酚-氯仿法提取绵羊基因组DNA、超纯水、PCR引物、限制性内切酶AvaⅡ、琼脂糖、高速离心机、恒温摇床、PCR仪、电泳槽、电泳仪、凝胶自动成像仪、自动灭菌锅、电子天平、干热灭菌箱、移液枪。
1.2 试验步骤
绵羊多胎主效基因FecB基因,通过PCRRFLP法进行检测。分为3步:第1步,提取绵羊基因组DNA,通过酚-氯仿法从绵羊全血或者组织提取DNA;第2步,进行PCR扩增FecB基因特异片段,通过PCR方法扩增包含突变位点的片段;第3步,PCR产物进行酶切和结果判定。根据突变位点选择特异性限制性内切酶对PCR产物进行酶切,酶切产物进行电泳,根据电泳凝胶上DNA片段大小不同判定结果。检测过程中,需要添加阴阳性对照以保证检测结果的准确性。
1.2.1 绵羊DNA提取
将1ml抗凝血转移至1.5 ml Eppendorf管;10 000 r/min离心10 min;弃去上清。加入1 ml红细胞裂解液;充分混匀,弃去上清液;10 000 r/min离心10 min,重复上述步骤至上清液透明、沉淀呈淡白色。加入白细胞裂解液500 μl,加蛋白酶 κ至12μL(20 mg/ml)并混匀;RNase A 12μl(2mg/ ml)55 ℃过夜,颠倒混匀2次。将反应液冷却至室温;加 Tris-饱和酚 600μL;温和摇动离心管10 min使其充分混匀; 10 000 r/min离心 10 min;将上清液转入另一1.5 ml离心管中。加1∶1的Tris-饱和酚/氯仿 600μL;充分混匀 10 min;10 000 r/min 离心 10 min;将上清液转入另一1.5 ml离心管中。加氯仿600μL ;充分混匀10 min;10 000 r/min离心10 min;将上清液转入另一1.5 ml离心管中。加 2倍体积的冰冷的无水乙醇,混合转动离心管直至白色的絮状沉淀析出;-20 ℃保存 20 min。13 000 r/min 离心10 min;弃去上清液,用70%的冰冷乙醇漂洗DNA沉淀1次。3 000 r/min离心2 min;弃去上清液,室温下使乙醇挥发干净。干燥后的DNA溶于50~100μL的水中;4℃保存直至DNA完全溶解, -20 ℃保存。
1.2.2 FecB基因的PCR扩增
20μl反应体系组成:TAQ DNA聚合酶(5 u/μl)0.12μl,10×PCR缓冲液2μl,MgCl2(25 mmol/L)2μl,DNTP(2.5mmoL/L)2μl,基因组DNA(稀释后)1μl(50 ng左右),上游引物(10 pmol/ml)1.0μl,下游引物(10 pmol/ml)1.0μl,加水至 20μl。
1.2.3 PCR产物的检测
用1×TAE电泳缓冲液配制2%的琼脂糖凝胶(含0.5μg/ml EB)。取PCR产物4μl,混合1μl 5×Loading Buffer上样,以50 bp PCR Maker进行分子量对照。以1×TAE电泳缓冲液,电泳55 V(5V/cm)40 min。
凝胶自动成像仪或紫外透射仪下观察结果,检测目的条带纯度及亮度。
1.2.4 酶切反应体系
AvaⅡ0.4μl,10×M Buffer 2μl,灭菌水10μl,PCR产物 8μl,总量 20μl,37℃水浴4 h。
1.2.5 酶切产物的检测
用1×TAE电泳缓冲液配制3.3%的琼脂糖凝胶(含0.5μg/ml EB)。取酶切产物10μl,混合1μl 5×Loading Buffer上样,以50 bp PCR Maker进行分子量对照。以1×TAE电泳缓冲液,电泳55 V(5V/cm)40 min。
凝胶自动成像仪或紫外透射仪下观察结果,检测目的条带纯度及亮度。
1.3 分析
1.3.1 PCR产物分析
对绵羊基因组DNA进行PCR扩增,得到长140 bp 的特异性条带。

图1 绵羊FecB基因PCR结果(1-21为PCR扩增条带,M为50 bp的DNA Marker)
1.3.2 酶切产物分析
用AvaⅡ内切酶对BMPR突变引物所扩增的PCR产物(140 bp)进行酶切,用琼脂糖凝胶电泳的方法对产物进行检测。电泳后显色结果清晰,突变纯合子只有110 bp带,突变杂合子有两条带(140 bp、110 bp),野生型的只有140 bp的带。

图2 绵羊FecB基因PCR-RFLP结果
1.4 育种技术方案
含FecB纯合子小尾寒羊(湖羊)种公羊10只与 哈萨克羊500只,进行杂交选配。按一定比例对母羔采血进行多胎基因测定,初步建立了F1代、F2代公、母后备羊群,做好数据整理。
1.5 数据统计分析
数据采用SPSS19.0、Excel软件进行统计分析,用单因子方差分析进行平均数与标准差计算,并进行Duncan氏多重比较检验。结果用平均值(X)±标准差(S)表示。
2 结果与分析
2.1 FecB基因在杂交类群中分布统计分析
在湖(寒)哈杂交F1及横交F2羊群中存在3种基因型:BB型、B+型、++型。杂交F1代166只含等位基因B频率为0.58,含等位基因+频率为0.42;横交F2代检测64只含等位基因B频率为0.41,含等位基因+频率为0.59。对FecB基因在 4 个不同类型绵羊中分布差异的卡方独立性检验结果见(表 2)。由表2可知,小尾寒羊、湖羊与湖(寒)哈杂交F1及横交F2两个类型绵羊相互之间分布差异极显著(P0.01);湖羊与小尾寒羊之间分布差异不显著(P>0.05);湖(寒)哈杂交及横交F2羊基因型频率差异不显著(P>0.05)。说明含FecB基因羊与哈萨克母羊杂交后,FecB基因显性效果好,遗传性能较为稳定。
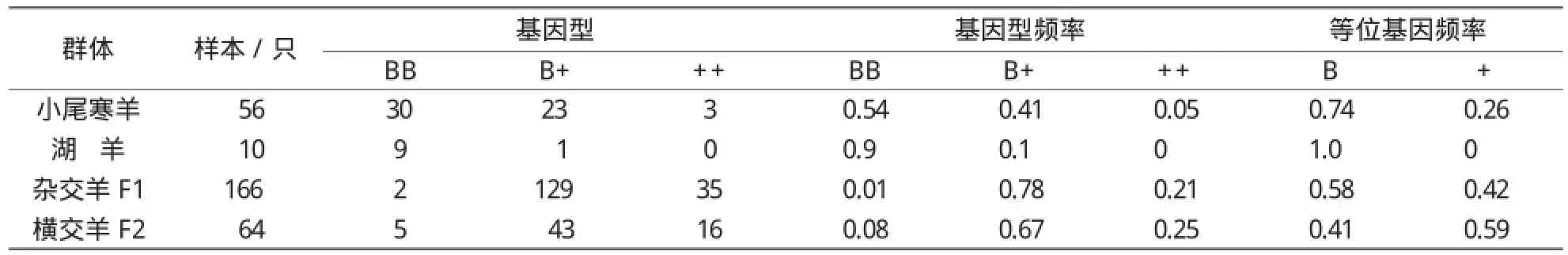
表1 成羊及杂交羔羊FecB基因频率和基因型频率分布

表2 不同绵羊群体之间基因型分布差异检验
2.2 横交固定FecB基因对初产母羊产羔数的影响
应用FecB基因标记技术提高产羔率,选择5只F1代理想型B+基因型公羊与无亲缘关系的携带不同基因型母羊136只配种,对41只母羊产羔情况跟踪观察。由表3可知,41只母羊产羔64只,产羔率为156%,其中BB基因型1只产羔2只,产羔率为200%;B+基因型29只产羔50只,产羔率为172%;++基因型11只产羔12只,产羔率为109%;B+基因型与野生型(++)相比较提高了63个百分点,差异极显著(P0.01)。以上研究表明,多胎基因FecB分子标记技术,可有效提高绵羊产羔数。因此,在开展横交固定及选育过程中,应优先选择携带多胎基因的公、母羊配种,以利于增加哈萨克羊新类型的多胎型。
2.3 哈萨克羊新类型繁殖性能

表3 横交组合FecB基因型对初产母羊产羔率的影响

表4 横交组合F1代羔羊成活情况
3 讨论与小结
3.1 据文献记载,绵羊多胎基因(FecB)的位点被定位在第6号染色体上,FecB基因是绵羊高繁殖力BMPR-IB基因突变的结果,具有提高排卵和产羔的生物学作用。本实验选用10只FecB中基因突变BB基因公羊与本地哈萨克母羊配种。检测结果表明:含FecB基因羊与哈萨克母羊杂交后,FecB基因显性效果好,遗传性能较为稳定,导入效果十分显著。
3.2 哈萨克多胎新类型创制项目采用小尾寒羊或湖羊种公羊与哈萨克羊杂交选育。研究数据表明:不同基因型羔羊初生重、6月龄体重、育成羊体尺差异不显著(P>0.05)[9]。在体型外貌、生长发育、繁殖性能等方面有了不同的提高。建立在较好的营养条件下,精细管理才能充分发挥各个方面的性能,而在低营养及粗放管理状态常常表现为生长速度缓慢、异食癖从而导致抗病力差等问题,选育时值得注意。
3.3 采用多胎基因FecB分子标记技术与常规育种技术,组建理想型育种群。通过选育选配、横交固定,初步培育出了哈萨克羊多胎新类型。数据显示该类型羊具有较高繁殖力,在今后的新类型培育中值得推广。
哈萨克羊属季节性发情。对湖(寒)哈杂交羊F1母羊跟踪调查,41只F1母羊在春季发情配种,秋季正常产羔,产羔率为159%(64/41),繁殖成活率为146%(60/41)。初产母羊配种年龄较小,存在奶水不足等问题,导致羔羊死亡,繁殖成活率有所下降。
[ 1 ]Souza C J, Macdougall C, Campbell B K, et al.The Booroola (FecB)phenotype is associated with a mutationin Bone morpho genetic receptor typeIB(BMPR1B)gene[ J] .En Docrinol, 2001, 169(2):1-6.
[ 2 ]Wilson T,Wu J L,et al.Highly prolific Booroola sheep have a mutation in the intracellular kinasedomain of bone morphogenetic protein IB receptor(ALK-6)that is expressed in both oocyes and granuloss cells [J] Biology of Reproduction,2001,64:1225-1235.
[ 3 ]王根林, 毛鑫智, Davis GH,等.DNA 分析发现我国湖羊和小尾寒羊存在Booroola(FecB)多胎基因[J] . 南京农业大学学报, 2003, 26(1):104-106.
[ 4 ]柳淑芳,姜运良,杜立新.BM PR-IB 和BM P15 基因作为小尾寒羊多胎性能候选基因的研究[ J] .遗传学报, 2003, 30(8):755-760.
[ 5 ]储明星,狄冉,叶素成,等.绵羊多胎主效基因FecB分子检测方法的建立与应用[J].农业生物技术学报.2009,17(1):52-58.
[ 6 ]王钧. 5个绵羊品种BMPR-IB基因多态性的研究[D].兰州:甘肃农业大学硕士学位论文,2013.
[ 7 ]李达,孙伟,倪荣,等.绵羊FecB基因遗传多样性及其产羔数的关联分析[J].畜牧兽医杂志.2012,31(2):1-8.
[ 8 ]陈晓勇,敦伟涛,田树军,等.FecB基因对绵羊生产性能影响的研究进展[J].中国草食动物科学.2012,32(4):59-63.
[ 9 ]马春江,罗生金.绵羊BMPR-IB基因标记导入哈萨克羊生长状态研究[J].畜牧与兽医.2015,47(6):52-58.
[10]钟发刚,王新华,李辉,等.BMPR-IB基因作为多胎性能的候选基因在肉羊多胎品种培育中的应用研究[J].中国草食动物.2005,25(4):6-7.
S826.3
A
1005-2739(2017)02-0007-05地方绵羊品种多胎性类型创制”的子课题“哈萨克羊多胎新类型创制”,育种方法是用含FecB基因纯合子的湖(寒)羊公羊与本地哈萨克母羊杂交,采用PCR-RFLP方法对BMPR-BI基因进行检测,选育哈萨克羊多胎新类型。本课题研究FecB基因对产羔数的影响,旨在寻找与产羔相关的遗传标记,为选育哈萨克羊多胎新类型提供理论依据。
2016-11-03
新疆维吾尔自治区科技厅高技术项目(新疆地方绵羊品种多胎类型创制,项目编号:2013110101)
罗生金(1973-),男,硕士,高级兽医师,执业兽医师。
E-mail:1491693158@qq.com
