3D腹腔镜联合胃镜手术治疗贲门失弛缓症疗效分析
2017-05-02张葆勋伍冀湘蒋俭于涛于磊李建业
张葆勋 伍冀湘 蒋俭 于涛 于磊 李建业
·论著·
3D腹腔镜联合胃镜手术治疗贲门失弛缓症疗效分析
张葆勋 伍冀湘 蒋俭 于涛 于磊 李建业
目的 评估3D腹腔镜联合胃镜食管Heller肌层切开+Dor胃底折叠术治疗贲门失弛缓症的临床价值。方法 回顾性总结从2013年11月至2015年7月北京同仁医院胸外科进行的16例3D腹腔镜联合胃镜食管Heller肌层切开+Dor胃底折叠术治疗16例贲门失弛缓症的临床资料。结果 所有患者均顺利完成手术,手术时间40~100 min,平均手术时间60 min,术中出血量均小于30 ml,无严重术后并发症,全部治愈出院,术后住院时间6~12 d。术后1个月行上消化道造影,食管最大直径均较术前明显减少。术后1个月复查24 h食管压力测定及pH值监测,无反流性食管炎发生。随访时间10~30个月,16例临床症状均完全消失,无明确复发病例。结论 3D腹腔镜联合胃镜食管Heller肌层切开+Dor胃底折叠术治疗贲门失弛缓症是一种安全易行且有效的外科治疗手段,临床上具有广泛的推广价值。
贲门失弛缓症;食管肌层切开;胃底折叠术;腹腔镜
贲门失弛缓症(achalasia,AC)是一种相对罕见的原发性食管动力障碍性疾病,最早是在1672 年由William描述[1]。由于食管贲门部的神经肌肉功能障碍导致食管下端括约肌弛缓不全,食物无法顺利通过而滞留。该病以吞咽困难、食物反流、胸骨后疼痛为主要临床表现,亦表现为和因食物反流误吸入气管导致的肺部感染等相关症状。贲门失弛缓症的发病率较低,在欧美等西方国家的发生率每年为1/10万,在国内占食管疾病的1.9%~5.5%,男女发病率相似,约为1∶1.5,20~50岁的青壮年多见,儿童发病少见,病程较长[2-4]。目前尚不明确贲门失弛缓症的病因和发病机制,推测可能与神经、精神、免疫、病毒感染、遗传等因素相关。目前多考虑其为神经原性疾病,运动障碍由食管胆碱能神经支配缺陷导致,本病的基本损伤由食管壁内肌间神经丛即Auerbach丛神经节细胞和迷走神经运动核细胞变性引起[3]。Mittal 等[4]认为本病引起胸骨后疼痛的主要原因是食管纵行肌的收缩延长。腹腔镜食管Heller肌层切开治疗是目前治疗贲门失弛缓症的主流手术。我院自2013年开始应用3D腹腔镜联合胃镜食管Heller肌层切开+Dor胃底折叠术治疗贲门失弛缓症,已成功实施手术16例,报道如下。
1 资料与方法
1.1 一般资料 从2013年11月至2015年7月期间采用3D腹腔镜联合胃镜食管Heller肌层切开+Dor胃底折叠术共治疗贲门失弛缓症患者16例。其中男6例,女10例;年龄21~78岁,平均年龄48.2 岁。患者的临床症状表现为吞咽困难、食物反流、呕吐宿食。7例患者曾经内科治疗,效果欠佳。其中按Henderson分级,Ⅰ级1例,Ⅱ级12例, Ⅲ级3例。患者术前完善上消化道钡餐造影、胃镜、24 h食管压力测定及pH值监测,明确诊断为贲门失弛缓症。术后对患者随访。
1.2 方法
1.2.1 手术前准备:①术前常规检查,了解患者一般情况。②上消化道钡餐和胃镜检查,如需要行活检除外肿瘤;24 h食管压力测定及pH值监测。③胃肠道准备:术前禁食水1~3 d,给予静脉营养,清洁消化道。④术前留置胃管,贲门失弛缓症患者一般胃管置入困难,不强求将胃管置入胃内,置入食管没有打折即可,术中可在胃镜下置入胃中。
1.2.2 手术方法:所有16例患者均采用单腔气管插管,静脉复合全身麻醉方法。采用仰卧位,头高脚低,双腿分开外展,呈“人”字形,术者位于患者两腿之间。经脐穿刺,建CO2气腹,气腹压力12~14 mm Hg后,经脐置入Trocar,置入腹腔镜;双侧锁骨中线与肋弓交点偏下约两横指处分别放置10 mm(左为主操作孔)和5 mm(右)Trocar;左侧腋前线与肋弓交点偏下约两横指处放置1个5 mm Trocar;于剑突下略偏右经穿刺孔置入“M”型肝脏拉勾,将肝左叶右翻,显露胃贲门部及食管裂孔,辨认贲门前静脉,超声刀逐层切开食管及贲门部肌层至黏膜层,食管肌层切开5.0~7.0 cm,贲门部肌层切开约1.0 cm,将黏膜向两侧剥离,超过食管周径的一半。经口置入胃镜,查看食管肌层切开是否充分及食管黏膜有无破损,如有破损及时缝合修补,根据胃镜所见决定是否继续切开食管肌层。然后行Dor胃底折叠术,将胃底分别与切开的食管下段肌层两边行对边间断缝合,左侧缝合3针,右侧缝合5针,锐化His角并将胃底180°折叠,同时覆盖已经肌层切开的食管前壁。彻底止血,核对纱布、器械无误,经辅助孔置腹腔引流管1根,关腹,术毕。术中缝合打结时改气腹为腹壁悬吊,缝合打结时间较气腹下明显缩短。见图1~4。


图1图2图3图4
1.2.3 术后处理:术后常规给予胃肠减压,静脉营养,排气后拔除胃管,经口进食。视腹腔引流情况酌情拔除腹腔引流管。7~9 d腹部伤口拆线后即可出院。
1.3 随访 随访方式:术后1个月行上消化道造影、24 h食管压力测定及pH值监测,对术后的近期疗效进行评价。随访时间10~30个月,对术后的远期效果进行评价。
2 结果
2.1 手术时间和术中出血量 所有患者均顺利完成3D腹腔镜联合胃镜食管Heller肌层切开+Dor胃底折叠术,无中转开腹,手术时间40~100 min,平均手术时间60 min,术中出血量均小于30 ml,平均20 ml。
2.2 术后并发症 术后均未发生胃食管穿孔、大出血、气胸、食管狭窄等严重术后并发症。
2.3 住院时间 全部患者治愈出院,术后平均住院时间6~12 d,平均住院时间9 d。见表2。

表2 手术情况汇总
2.4 术后近期疗效 所有16例患者吞咽困难症状完全消失,无术后反酸。术后1月均行上消化道造影,食管最大直径均较术前明显减少。术后1月复查24 h食管压力测定及pH值监测,无反流性食管炎发生。见表3。
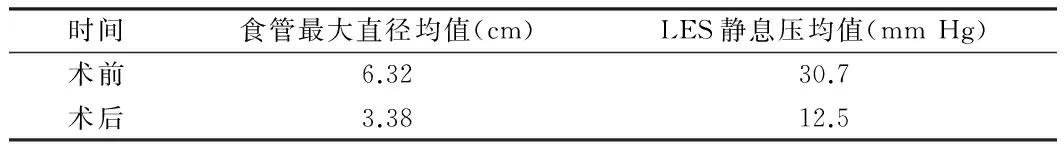
表3 术前术后食管最大直径和测压
2.5 远期效果 随访时间10~30个月,16例患者临床症状完全消失且无明显反流症状。
3 讨论
3.1 贲门失弛缓症的诊断 根据临床表现怀疑患有贲门失弛缓症的患者,可行上消化道钡餐造影、胃镜及24 h食管压力测定及pH值监测。食管钡餐造影显示上段食管呈现出扩张、延长与弯曲,蠕动波消失;食管下段扩张,末端变细,食管下端括约肌(LES)处呈“鸟嘴”征是钡餐上消化道造影的主要特征[5],同时需要行胃镜检查以除外器质性狭窄或肿瘤。内镜下大部分患者食管内见残留有积食,食管体部明显扩张甚至扭曲变形;食管下括约肌松弛不全,贲门狭窄程度不等,甚至完全闭锁不能通过。24 h食管压力测定及pH值监测也是一项重要的检查手段,本病患者的食管测压显示为:(1)食管蠕动收缩消失;(2)吞咽动作时食管下括约肌松弛障碍;(3)食管下括约肌基础压升高;(4)食管体部静息压高于胃内压[6]。其中(1)和(2)是必需的。贲门失弛缓症患者食管下括约肌压力、食管体部静息压升高者约50%[7],也可正常或减低;食管测压还能鉴别诊断弥漫性食管痉挛、食管下括约肌高压、胡桃夹食管等其他食管动力性疾病[8]。结合临床表现及上消化道钡餐造影、胃镜及食管测压检查结果,贲门失弛缓症可确诊。
3.2 治疗
3.2.1 药物治疗:治疗本病的有效药物,如钙离子拮抗剂、硝酸盐类、β肾上腺素能激动剂、普鲁卡因等药物。但是口服药物作用轻微且作用时间短暂,应用范围有限。
3.2.2 内镜下治疗
3.2.2.1 肉毒杆菌毒素注射治疗(endoscopic botulinum toxin injection,EBTI):肉毒杆菌毒素注射治疗能产生短期疗效,但对于食管排空无效,价格较高。
3.2.2.2 球囊扩张术(endoscopic pneumatic dilation,EPD):球囊扩张术是强行使用外力扩张食管下括约肌,使部分肌纤维断裂而实现扩张食管的目的。有3%的患者可能发生食管穿孔。近期效果及远期效果差强人意。
3.2.2.3 支架植入术:当支架植入并扩张至预定直径后,支架会对食管下括约肌产生持续性的压迫,引发部分食管下括约肌环行肌慢性的断裂,以达到降低食管下括约肌压力的目的。但食管支架价格昂贵,其远期疗效大多有限。
3.2.2.4 经口内镜下食管肌层切开术(POEM):经口内镜下食管肌层切开术是一种内镜微创新技术,它通过隧道内镜技术进行食管肌层的切开。在2010年首次报道了经口内镜下肌切开术用于贲门失弛缓症的临床治疗[9,10]。建立黏膜下隧道是POEM 术的关键步骤,而其中黏膜下剥离过程,对操作者要求非常高。POEM 术近期缓解率较高,是一项难度较大的内镜手术。与其他手术一样,POEM也存在发生并发症的可能性,食管穿孔是POEM中主要并发症,其他常见并发症还包括出血,感染,胃食管反流等。POEM目前尚处于初期阶段,在不久的将来也许会在贲门失弛缓症的治疗中占据越来越重要的地位,但其长期疗效还待进一步随访评估,
3.2.3 手术治疗
3.2.3.1 概述 Heller[11]于1913年最初报道了贲门失弛缓症的外科手术治疗,当时是应用食管贲门部黏膜外肌层切开手术治疗贲门失弛缓症,取得良好效果。迄今Heller术仍为治疗贲门失弛缓症的最主要的术式。随着腔镜技术近些年的广泛应用,贲门失弛缓症的手术治疗中开始应用胸腔镜或腹腔镜。在20 世纪末,国内外由经胸或经腹开放手术向经胸或经腹微创手术转变的趋势已经显现[12-16]。目前认为应用胸腔镜或腹腔镜行改良Heller术与开胸或开腹Heller术治疗效果相同[17-20]。
3.2.3.2 加做抗反流手术的必要性:Heller术临床上缓解症状的有效率已得到公认,但是术后的有相当的胃食管反流发生率。目前认为在腹腔镜下食管肌层切开术后加做抗反流术,可使胃食管反流症状的发生率显著下降,约从30%降低到10%[21,22]。单纯经胸或经腹行改良Heller术来治疗贲门失弛缓症有10%~46% 的术后食管反流的发生率[23,24]。针对这种情况,多数医生选择加做抗反流术式。而反对者的理由主要是术后反流的患者占少数,仅为了预防少数人术后可能发生的反流而让多数患者去接受抗反流手术,得不偿失。食管肌层切开后的吞咽困难反而是由加做抗反流手术引起的[14]。为了防止上述医源性吞咽困难的发生,应注意无论何种术式均不能造成术后梗阻的发生。Madurdrt等[25]选用较为“温和”的Dor手术,认为它有效、操作简单、容易掌握,可减少术后由于胃底折叠压迫食管造成吞咽困难的发生率,同时覆盖已经肌层切开的食管前壁降低严重并发症的发生;而Nissen抗反流手术受术者的经验限制,常常导致缝合过紧,患者术后吞咽困难,不宜作为首选。
3.2.4 3D腹腔镜联合胃镜食管Heller肌层切开+Dor胃底折叠术治疗贲门失弛缓症的优势:3D摄像系统使用方法与现有的内窥镜摄像系统接近,并不需要改变术者的手术习惯和操作步骤。其优势在于:一方面3D手术为术者还原了真实视觉中的立体手术视野缝合打结等精细操作比2D环境下变得更加便利,另一方面,相比与2D效果,3D效果具有更明显的解剖优势,组织之间的间隙清晰,方便精细地解剖,以更好地保护重要结构。
从解剖结构来讲,食管下段括约肌大部分位于腹段食管,应用3D腹腔镜容易观察;从操作层面来讲,麻醉简单,不需要单侧通气, 不需要放置胸腔闭式引流。但是腹腔镜入路破坏了贲门的结构, 术后胃食管反流的发生率会高于经胸组[26],一般经腹食管下段肌层切开术需要附加抗反流手术。本文中16例患者均加作Dor胃底折叠术,术后无反酸表现,24 h食管pH值测定基本正常。
Heller 术治疗贲门失弛缓症的相关临床研究显示,食管肌层全层切开能够保证食管下括约肌压力长期稳定下降[27,28]。曾有报道食管肌层全层切开可加快术后食管蠕动功能的修复。3D腹腔镜下可充分切开食管下段及贲门部肌层。胃镜的联合应用,更容易掌握手术中的进展情况明确食管下段狭窄的部位及程度,并可以及时发现食管黏膜有无破损,及时缝合修补。Dor胃底折叠术在抗反流的同时加固保护了破损处以及暴露的食管粘膜,降低了穿孔的发生率,食管下段及贲门部的肌层切开更加充分,而不会畏手畏脚。
3D腹腔镜联合胃镜食管Heller肌层切开+Dor胃底折叠术治疗贲门失弛缓症除能长期有效地降低贲门失弛缓症患者的食管下括约肌压力,并且能够有效的防止术后的胃食管反流。其操作简单、容易掌握、创伤小而且并发症少,适合临床推广。
1 Williams VA,Peters JH.Achalasia of the esophagus: a surgical disease.J Am Coll Surg,2009,208: 151-162.
2 李家德,李科锦,何易.食管贲门失弛缓症X线检查价值的再探讨.当代医学,2012,18:102-103.
3 王肖琴,夏国园,付文安.超声诊断贲门失弛缓症的价值.中国医学影像学杂志,2004,12:313-314.
4 Mittal RK, Hong SJ, Bhargave V. Longitudinal Muscle Dysfunction in Achalasia Esophagus and Relevance.J Neurongastroenterol Motil,2013,19:126-136.
5 Howard PJ, Maher L, Pryde A, et al. Five year propective study of the incidance, clinical features, and diagosis in Edinburgh. Gut,1992,33:1011-1015.
6 Specher SJ, Castell DO. Classifacation of oesophageal motility abnormalities.Gut,2001,49:145-151.
7 Pandolfino JE, Kahrlas PJ. AGA technical review on the clinical use of esophageal manometry. Gastroenterology,2005,128:209-224.
8 De Meester TR. Surgery for oesophageal motor disorders. Ann Thorac Surg,1982,34:225-229.
9 Inoue H,Minami H,Kobayashi Y,et al.Peroral endoscopic myotoroy(POEM)for esophageal achalasia.Endoscopy,2010,42:265-271.
10 Von Renteln D,Inoue H,Minami H,et al.Peroral endoscopic myotomy for the treatment of achalasia:a prospective single center study.Am J Gastroenterol,2012,107:411-417.
11 Heller E. Extramucose cardioplastie beim chronischen cardiospasmus mit dilatation des- oesophagus. Mitt Grengeb Med Chir,1913,2:141-149.
12 Zaninotto G,Costantini M,Rizzetto C,et al. Four hundred laparoscopic myotomies for esophageal achalasia:a single centre experience. Ann Surg,2008,248:986-993.
13 Campos GM, Vittinghoff E, Rabl C,et al. Endoscopic and surgical treatments for achalasia:a systematic review and meta-analysis. Ann Surg,2009,249:45-57.
14 Dughera L, Chiaverina M, Cacciotella L, et al. Management of achalasia. Clin Exp Gastroenterol,2011,25:33-41.
15 Pantanali CA, Herbella FA, Henry MA, et al. Laparoscopic heller myotomy and fundoplication in patients with chagas’ disease achalasia and massively dilated esophagus. Am Surg,2013,79:72-75.
16 Rohof WO, Boeckxstaens GE. Treatment of the patient with achalasia.Curr Opin Gastroenterol, 2012, 28:389-394.
17 Iqbal A,Haider M,Desai K,et al.Technique and follow-up of minimally invasive Heller myotomy for achalasia.Surg Endosc,2006,20:394-401.
18 Zaninotto G,Costantini M,Molena D,et al.Minimally invasive surgery for esophageal achalasia.J Laparoendosc Adv Surg Teoh A,2001,11:351-359.
19 Bleoraston M,Seralini F,Rosemurgy AS.Videoscopie heller myotomy as first-line thempy for scvel'e achalasia.Am Surg,2001,67:1105-1109.
20 Shai SE,Chert CY,Hsu CP,et al.Transthoracie oesophagomyoIomy in the treatment of achalasia-a 15-year experience.Seand Cardiovase J,1999,33:333-336.
21 Kung AH.Heller’s cardiomyotomy with augmented Toupet’S fundopl ication immediate and long-term outcome.J Med Assoc Thai,2010,93:1385-1390.
22 Hurez BJ.Endoscopic and surgical treatments for achalasia:a systematic review and meta-analysis.Ann Surg,2009,249:45-57.
23 Yu L,Li J,Wang T,et al.Functional analysis oflong-tenn outcome after myotomyof Heller for achalasia.Dis E sophagus,2009,10:233-237.
24 Ellis FH,Crozier RE,Watkins E.Operation for esophageal achalasia:results of esophagomyotomy without an antireflux operation.Thorac Cardiovas Surg,1984,88:344.351.
25 Madurdrt FA,Loss AB,Madureira D,et al.Quality of life after Heller-Dor’s cadiomyotomy.Surg,2009,36:193-198.
26 Andreollo NA,Earlam RJ. Heller’s myotomy for achalasia: is an added anti - refux procedure necessary? Br J Surg,1987,74:765-769.
27 Campos GM,Vittinghoff E,Rabl C,et al. Endoscopic and surgical treatments for achalasia:a systematic review and meta-analysis. Ann Surg,2009,249: 45-57.
28 Costantini M,Zaninotto G,Guirroli E,et al. The laparoscopic Heller-Dor operation remains an effective treatment for esophageal achalasia at a minimum 6-year follow-up.Surg Endosc,2005,19: 345-351.
10.3969/j.issn.1002-7386.2017.08.024
100730 北京市,首都医科大学附属北京同仁医院胸外科
伍冀湘,100730 北京市,首都医科大学附属北京同仁医院胸外科;
E-mail:zhangbx28@sina.com
R 571.4
A
1002-7386(2017)08-1205-04
2016-10-13)
