国内近10年青钱柳多糖研究进展
2017-04-28汪荣斌秦亚东周娟娟
汪荣斌,秦亚东,周娟娟
1.安徽中医药高等专科学校,安徽 芜湖 241002;2.芜湖市中医医院,安徽 芜湖 241000
国内近10年青钱柳多糖研究进展
汪荣斌1,秦亚东1,周娟娟2
1.安徽中医药高等专科学校,安徽 芜湖 241002;2.芜湖市中医医院,安徽 芜湖 241000
青钱柳多糖在降血脂、降血糖、抗氧化、抗肿瘤、免疫调节等方面表现出较强的生物学活性,其中降血脂和降血糖作用已成为近年来研究热点。本文对国内近10年报道的青钱柳多糖提取纯化、含量测定及生物学活性研究进行综述,以期为青钱柳多糖深入研究及产业开发提供参考。
青钱柳;多糖;综述
青钱柳Cyclocarya paliurus(Batal.)Iljinsk.为胡桃科Juglandaceae青钱柳属落叶乔木,又名青钱李、摇钱树、甜茶树等,系双子叶植物纲胡桃科植物。青钱柳叶有祛风止痒、清热消渴、解毒等功效。中医临床用于治疗糖尿病,具有较好的降血糖、降尿糖、降血脂效果。目前已知青钱柳化学成分主要有黄酮、三萜、酚、多糖等[1-4]。
安全性较高是多糖成分的优点,一些中药多糖已在临床上广泛使用,如灵芝多糖、香菇多糖、黄芪多糖等。但由于多糖是生物大分子,其提取分离、纯化工艺、结构解析等比小分子有机化合物困难得多[5],这给研究带来阻碍,因此青钱柳多糖的相关报道较少。近年来,青钱柳多糖因其抗肿瘤、抗氧化、免疫调节,尤其是降血糖、降血脂方面的作用使其逐渐受到研究者重视,成为研究热点[6]。因此,笔者就国内近10年来青钱柳多糖的提取、纯化、含量测定及生物学活性角度进行综述,以期为青钱柳多糖深入研究提供参考。
1 工艺研究
1.1 含量测定
利用显色原理测定是目前多糖含量测定主要方法,如硫酸-苯酚法或蒽酮-硫酸法,利用强酸水解多糖成单糖,形成糠醛化合物后与苯酚或蒽酮形成有色物质,然后利用其在可见光区的最大吸收波长作为检测波长进行含量测定。而苯酚或蒽酮可与糠醛化合物成色,为获得更接近真实的多糖含量,须去除供试多糖样品中单糖、寡糖,否则测定的含量就是供试品中单糖、寡糖及多糖的含量之和,将导致含量测定结果偏高[7]。目前,青钱柳多糖含量测定文献报道多以葡萄糖为对照品,采用紫外-可见分光光度法进行含量测定,检测波长若用硫酸-苯酚法显色是490 nm,硫酸-蒽酮法显色是580 nm,结果较满意。样品的前处理多以石油醚、乙醇等有机溶剂进行脱脂处理,然后利用多糖溶解于水而难溶解于有机溶剂的原理进行水提纯沉处理。文献报道的青钱柳多糖的紫外-可见分光光度法含量测定条件见表1。
1.2 提取和纯化
大多数植物多糖存在于细胞壁内(又称胞内多糖),因此为了使多糖从细胞壁内更好溶出,首先须将植物体粉碎处理,再用有机溶剂破坏包围细胞壁的脂质层。不同的提取方式,如微波提取、热水提取、超声提取的原理和特点各不相同,其提取效果亦存在差异。上官新晨等[12]使用微波提取法提取青钱柳多糖,并采用单因素及正交试验优化了提取工艺,在最佳提取工艺条件下提取率为2.55%,其优点是时间短、提取率高。谢建华等[13]采用传统水提醇沉法,并通过单因素及正交试验确定了最佳提取工艺,获得青钱柳多糖提取率为6.54%。超声波法也被应用于青钱柳多糖的提取,文献报道超声功率和超声时间对多糖提取的影响较大,也有缩短提取时间、提高得率的优点[14]。
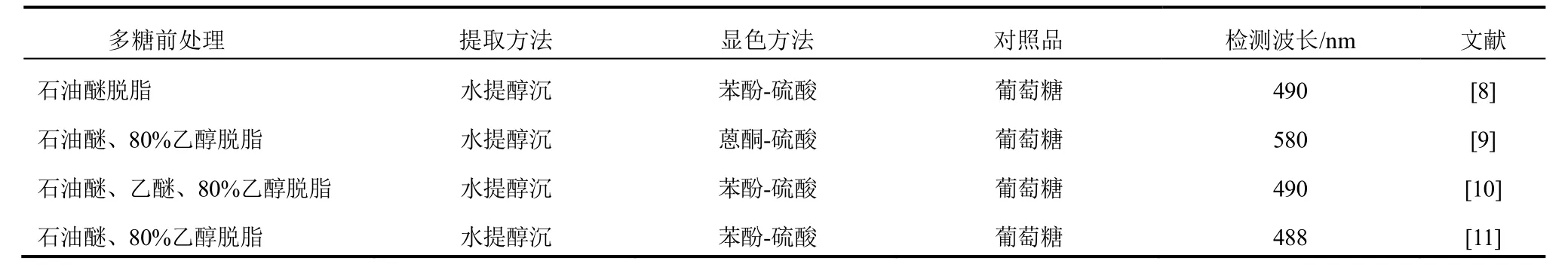
表1 青钱柳多糖的含量测定方法
目前关于青钱柳提取工艺的文献报道较少,且因试验所用青钱柳样品产地不同、前处理有差异,因此其结果直接比较可信度不高。另外,衡量提取效果的指标较为单一,可从多糖得率、多糖纯度等方面进行更全面考察。
本文所述纯化工艺是指从多糖样品中除去杂质的过程。这些杂质包括单糖、寡糖、蛋白质、色素、无机盐等,而非为获得均一多糖所采用的各种分离技术和手段。陈木森等[15]使用8种树脂对青钱柳多糖的静态吸附做了研究,发现 D301R型树脂对青钱柳多糖吸附量最大,在30 ℃、pH=7、浓度为4 mg/mL、吸附流速为1.5 mL/min时吸附较强;0.4 mol/L氯化钠洗脱效果较好,洗脱率可达 82.12%。谢建华等[16]报道了青钱柳多糖的活性炭脱色研究,以脱色率和保留率为指标,采用单因素和正交试验优化脱色工艺,在温度40 ℃、时间40 min、活性炭用量1%、pH=3.5时脱色率可达80.3%、保留率为55.6%。
目前,青钱柳去除杂质的研究文献较少,如脱蛋白质的研究尚未见报道。纯化工艺手段可以脱色率、脱蛋白率、多糖纯度等为指标,使用方法可对树脂、化学试剂(过氧化氢、次氯酸钠)、物理吸附(活性炭等)进行考察,目前尚未见文献报道。
2 生物学活性研究
2.1 免疫调节
T淋巴细胞在机体细胞免疫、体液免疫过程中起着重要作用,通过T免疫细胞的激活,可以增加机体免疫细胞的吞噬能力,从而增强机体免疫功能。树突状细胞是功能最强的专职抗原提呈细胞,能有效刺激初始型 T细胞的增殖,提高机体免疫应答。黄丹菲等[17]研究了青钱柳多糖对小鼠骨髓来源的树突状细胞的细胞形态及表面分子表达的影响,表明青钱柳多糖能显著促进树突状细胞表面 MHCⅡ表达,且在一定范围呈现浓度依赖,说明青钱柳多糖可促进树突状细胞的成熟。
2.2 抗肿瘤
多糖对肿瘤细胞的抑制作用可以直接抑制肿瘤细胞的生长、提高机体免疫功能而发挥间接抗肿瘤作用(如激活吞噬细胞、促进细胞因子分泌等)等途径实现对肿瘤细胞的抑制作用。刘昕等[18]研究发现,不同浓度、不同制备方法所得青钱柳多糖对人宫颈癌HeLa细胞生长有显著抑制作用,而对人脐带内皮细胞的生长抑制率较低。韩澄等[19]报道了青钱柳多糖在一定浓度下对人胃癌MGC-803细胞生长抑制率可达65.07%,细胞凋亡率达 25.44%。推测其机制可能是使细胞在S期发生阻滞,同时引起细胞p21、bax的基因表达量增多,细胞bcl-2的基因表达量建设有关。
2.3 抗氧化
研究多糖抗氧化作用可分为体内抗氧化和体外抗氧化2种模式。体外抗氧化多以模拟的化学自由基环境,如对二苯代苦味酰基自由基(DPPH自由基)、过氧化氢与催化剂Fe2+构成的氧化体系(Fenton体系)等对多糖抗氧化能力进行评价;体内抗氧化作用多在氧化模型小鼠或大鼠体内进行,并以氧化产物丙二醛(MDA)等或清除体内自由基的各种酶如超氧歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的活性作为指标[20-21]。青钱柳多糖浓度为 0.4 mg/mL时对DPPH自由基的清除率可达71.8%,浓度为1.2 mg/mL时对羟基自由基的清除率可达68.1%,表明青钱柳多糖对DPPH自由基的清除率较高[22]。葛霞等[22]以高脂小鼠为指标,采用青钱柳多糖进行干预,发现能显著降低肝脏MDA、游离脂肪酸的含量,提高肝脏SOD、GSH-Px的活性。段小群等[23]研究发现,青钱柳多糖可减轻小鼠肝组织自发性及四氯化碳、过氧化氢、亚铁离子-维生素C所诱导小鼠肝脏脂质过氧化的程度,且呈一定的浓度依赖。上述研究表明,青钱柳多糖对体外、体内均体现出一定的抗氧化作用。
半数清除率(IC50)是衡量物质对某一抗氧化体系能力评价的重要指标,关于青钱柳多糖IC50的研究尚未见文献报道。多糖属于大分子物质,进入体内后机体对大分子物质的吸收情况迄今罕见报道;另外,关于体内、体外抗氧化作用也应属于相关研究重点。
2.4 降血糖
中药降血糖机制主要从提高胰岛素含量、增加胰岛素敏感性、抑制葡萄糖的吸收、对受体后糖代谢的影响及提高机体自由基清除能力和抗脂质过氧化等方面实现。目前有关青钱柳多糖降血糖作用研究均采用尾静脉或腹腔注射四氧嘧啶建立糖尿病模型小鼠,以格列本脲或二甲双胍为阳性对照组,灌胃给药一段时间后测定血清中血糖(Glu)、胰岛素(Ins)、C肽、血浆胰高血糖素(Gln)及胰岛组织形态为考察指标评价青钱柳多糖的降血糖效果。青钱柳多糖不同剂量组均可显著降低模型组小鼠的Glu[24-26]、Ins、C肽、Gln,且高剂量组效果更优[24];青钱柳多糖可显著提高小鼠对葡萄糖、淀粉的糖耐量,对蔗糖影响不显著[25];有文献报道HE染色显示,青钱柳多糖对四氧嘧啶引发的胰岛组织损伤有一定的保护作用[26]。
从上述文献可以发现,青钱柳多糖降血糖作用显著,但其降糖作用机制研究未见文献报道。上官新晨等[25]通过预实验发现,青钱柳多糖对α-D-葡糖糖苷酶活性具有显著的抑制作用,进而抑制机体对葡糖糖的吸收,这极有可能是青钱柳多糖降糖作用实现的途径。需要进一步说明的是,通过多糖预先给药模型,有学者提出多糖给药时间至少需要20 d以上,否则多糖在动物体内的效果可能尚未体现出来[5],应引起足够重视。
2.5 降血脂
高血脂症及其所发生的脂质过氧化反应与与心脑血管系统疾病的发生有密切关系。血清总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、中密度脂蛋白(MDL)、低密度脂蛋白(LDL)常作为高脂血症判断的重要指标;SOD、过氧化氢酶(CAT)、GSH-Px及MDA水平常作为判断体内发生脂质过氧化及抗氧化能力的重要指标。研究表明,青钱柳多糖可显著降低高脂血症大鼠血清TC、TG、LDL、MDA含量,提高血清HDL、SOD、GSH-Px、总抗氧化能力[27-28],提示青钱柳多糖具有降脂和抗脂质氧化作用,但不同文献报道最佳给药剂量不同。也有报道青钱柳多糖对脂肪酶的活性体现出抑制作用[28]。
青钱柳多糖可降低四环素建立的人肝 L-02细胞变性模型细胞内TG含量,且呈现浓度依赖[29]。脂肪细胞的增殖分化失常可致脂肪组织堆积、细胞内分泌紊乱等,3T3-L1前脂肪细胞在脂肪细胞功能性评价中占有重要作用。研究表明,青钱柳多糖经 D301-R、DEAE树脂纯化后能够降低3T3-L1脂肪细胞对葡萄糖的消耗,降低 3T3-L1脂肪细胞细胞外甘油的含量[30],提示青钱柳多糖能够促进脂肪细胞的增殖,促进细胞分化的作用。研究表明,促进过氧化物酶体增殖剂激活受体(PPAR)γ和C/EBPα mRNA与蛋白质表达是多糖或蒲黄总黄酮促进3T3-L1前脂肪细胞增殖和分化的机制[31]。但青钱柳多糖是否也通过该途径实现促进脂肪细胞增殖、促进细胞分化尚待深入研究。
脂肪酶合成酶(FAS)、激素敏感脂肪酶(HSL)是细胞脂肪代谢过程中重要的调控酶。HSL是脂肪组织分解代谢的重要限速酶,其活性与 FAS、HLS mRNA表达密切相关;PPARα是脂质代谢过程中关键的转录调节因子,对肝脏线粒体、过氧化物酶及微粒体的脂肪酸β氧化中关键酶起到关键的基因调控作用,其活性大小受PPARα mRNA表达影响;葡萄糖作为体内重要的能量来源,葡萄糖转运蛋白 4(GLUT4)是最主要的葡萄糖转载体,其转运是由葡萄糖转运蛋白(GLUTs)介导完成,GLUT4 mRNA的表达将严重影响脂肪组织对葡萄糖的摄取。研究显示,青钱柳多糖能抑制小鼠肝脏组织FAS mRNA和FAS蛋白表达,而对脂肪FAS mRNA表达的影响不明显,青钱柳多糖不同剂量组均可提高 PPARα、GLUT4、HSL mRNA的表达[32-33]。提示青钱柳多糖能抑制肝脏脂质氧化。通过对高脂血症小鼠肝脏 HE染色不同组间的对比研究,发现青钱柳多糖可改善高脂血症小鼠肝组织受损。研究结果表明,在脂肪代谢过程中一些重要调控酶FAS、HSL、PPARα、GLUT4等基因表达可能是青钱柳多糖作用的主要途径[34]。
3 展望
综上所述,青钱柳作是我国特有的濒临灭绝的珍稀树种,其多方面的显著功效,尤其降血糖、降血脂引起了广泛关注。但也存在一些问题,如迄今有关青钱柳多糖的单糖组成方面报道仅有1篇[35],而关于青钱柳多糖的空间结构方面研究鲜有报道;另外,青钱柳多糖的有效部位仍未确定。有效部位的确认是进行生物活性研究的首要条件。多糖的纯度也要确认,若多糖纯度不够,起效成分可能是非糖成分[7]。在活性研究方面,涉及分子水平的机制研究较少。因此,今后应深入研究青钱柳多糖结构、阐明构效关系、明确作用机制,为开发疗效明确的青钱柳多糖产品奠定基础。
参考文献:
[1] 李俊,黄锡山,陆园园,等.青钱柳化学成分的研究[J].中成药,2008, 30(2):238-240.
[2] 易醒,石建功,周光雄,等.青钱柳化学成分研究[J].中国中药杂志, 2002,27(1):43-45.
[3] 舒任庚,舒积成.青钱柳中的酚类化学成分[J].中草药,2007,38(4):507-508.
[4] 张娟,路金才,肖凯,等.青钱柳水溶性成分的研究[J].药学实践杂志, 2007,25(2):82-84.
[5] 方积年,丁侃.天然药物——多糖的主要生物活性剂分离纯化方法[J].中国天然药物,2007,5(5):338-347.
[6] 刘娟,王存琴.青钱柳化学成分及药理活性研究进展[J].包头医学院学报,2015,31(8):144-145.
[7] 方积年,丁侃.多糖的研究开发中值得注意的一些问题[J].食品与药品,2007,9(12):1-4.
[8] 陈木森,洪艳平,上官新晨.青钱柳多糖的提取及含量测定[J].西北农业学报,2007,16(3):192-195.
[9] 谢建华,谢明勇,聂少平,等.青钱柳中多糖的测定[J].分析试验室, 2007,26(8):33-36.
[10] 舒任庚,舒积成,刘玉凤.青钱柳嫩叶中多糖的含量测定[J].中国中医药信息杂志,2005,12(3):45-46.
[11] 谢建华,谢明勇,聂少平,等.苯酚-硫酸法测定青钱柳中多糖含量[J].食品工业,2010,37(4):93-95.
[12] 上官新晨,陈木森,蒋艳,等.微波提取青钱柳多糖的研究[J].食品与生物技术学报,2007,26(5):6-9.
[13] 谢建华,谢明勇,聂少平,等.青钱柳多糖提取工艺的研究[J].食品科学,2007,28(10):188-191.
[14] 上官新晨,陈木森,徐睿庸,等.超声波法提取青钱柳多糖[J].江西农业大学学报,2006,28(6):809-812.
[15] 陈木森,上官新晨,徐睿庸,等.大孔树脂纯化青钱柳多糖的研究[J].西北农业学报,2007,16(4):275-278.
[16] 谢建华,申明月,聂少平,等.青钱柳多糖活性炭脱色工艺[J].南昌大学学报:理科版,2013,37(4):382-385.
[17] 黄丹菲,聂少平,谢建华,等.青钱柳多糖对小鼠骨髓来源树突状细胞表面分子表达的影响[J].天然产物研究与开发,2009,21(5):771-775.
[18] 刘昕,王顺启,谢明勇,等.青钱柳多糖对人宫颈癌HeLa细胞和人脐带内皮细胞生长的影响[J].食品科学,2007,28(10):520-522.
[19] 韩澄,聂少平,黄丹菲,等.青钱柳多糖对人胃癌 MGC-803细胞生长的影响[J].天然产物研究与开发,2009,21(6):952-955.
[20] 秦亚东,周娟娟.不同制备工艺对白芍多糖含量及体外抗氧化作用影响[J].安徽科技学院学报,2015,29(4):63-66.
[21] 秦亚东,汪荣斌,周娟娟,等.白芍醇提物及不同极性部位体外抗氧化作用研究[J].中国药房,2015,26(28):3920-3922.
[22] 葛霞,陈婷婷,蔡教英,等.青钱柳多糖抗氧化活性的研究[J].中国食品学报,2011,11(5):59-64.
[23] 段小群,张小芳,卢曦,等.青钱柳多糖体外抗脂质过氧化作用研究[J].中药材,2010,33(10):1618-1621.
[24] 施利仙,上官新晨,王文君,等.青钱柳多糖对四氧嘧啶糖尿病小鼠的降血糖作用[J].营养学报,2009,31(3):263-266.
[25] 上官新晨,陈木森,蒋艳,等.青钱柳多糖降血糖活性的研究[J].食品科技,2010,35(3):82-84.
[26] 张小芳,段小群,卢曦,等.青钱柳多糖对糖尿病小鼠血糖水平和胰腺组织形态的影响[J].华夏医学,2010,23(1):15-17.
[27] 叶振南,李楠,盛丹丹,等.青钱柳多糖对高脂血症大鼠血脂及抗脂质过氧化作用的影响[J].现代食品科技,2014,30(4):1-5.
[28] 黄明圈,上官新晨,徐明生,等.青钱柳多糖降血脂作用的研究[J].江西农业大学学报,2011,33(1):157-161.
[29] 段小群,刘永明,卢曦,等.青钱柳多糖对体外诱导肝细胞脂肪变性的影响[J].中国现代医学杂志,2010,20(18):2779-2782.
[30] 刘姚,傅凌韵,叶振南,等.青钱柳多糖对3T3-L1前脂肪细胞增殖分化的影响[J].食品科学,2013,34(23):291-295.
[31] 傅晓东,何燕铭,陈伟华,等.蒲黄总黄酮对3T3-L1前脂肪细胞增殖分化及相关基因表达的影响[J].医学研究生学报,2010,23(5):456-459.
[32] 刘姚,陈婷婷,傅凌韵,等.青钱柳多糖对高脂血症小鼠脂肪酸合成酶(FAS)表达影响[J].江西农业大学学报,2013,35(2):392-397.
[33] 李楠,赵静,吴茹,等.青钱柳多糖对高脂血症大鼠脂代谢及对PPARα、FAS、GLUT4基因mRNA表达的影响[J].现代食品科技,2015,31(4):29-35.
[34] 胡文兵,赵静,陈婷婷,等.青钱柳多糖对高脂血症小鼠降血脂作用和机制初探[J].现代食品科技,2015,31(11):39-44.
[35] 舒任庚,蔡永红.微波辅助水解青钱柳多糖的工艺研究[J].中草药, 2011,42(8):1547-1549.
Research Progress in Cyclocarya paliurus (Batal.) Iljinsk. Polysaccharide in China in the Latest Dacade
WANG Rong-bin1, QIN Ya-dong1, ZHOU Juan-juan2
(1. Anhui College of Traditional Chinese Medicine, Wuhu 241002, China; 2. Wuhu Hospital of Traditional Chinese Medicine, Wuhu 241000, China)
s: Cyclocarya paliurus (Batal.) Iljinsk. polysaccharide (CPPC) has various biological activities including hypolipemic effect, hypoglycemic effect, anti-oxidant effect, anti-tumor effect and immunomodulatiry; especially that hypolipemic effect and hypoglycemic effect have become the research hotspots in recent years. This article reviewed extraction, purification, content determination and biological activity of CPPC in the latest decade, with a purpose to provide references for the deep research and industrial development CPPC.
Cyclocarya paliurus (Batal.) Iljinsk.; polysaccharide; review
10.3969/j.issn.1005-5304.2017.05.033
R284.2;R285.5
:A
:1005-5304(2017)05-0133-04
2015-12-26)
(
2016-03-24;编辑:向宇雁)
安徽省卫生计生委中医药科研课题(2014zy45);安徽高校自然科学研究重点项目(KJ2015A343);安徽省高校学科(专业)拔尖人才学术资助重点项目(gxbjZD2016106)
