低温胁迫对蓖麻种子萌发过程中生理生化影响
2017-04-28郑根昌李旭新张春兰贾爱民
白 雪,李 兴,刘 鹏,2,3,4,郑根昌,李旭新,张春兰,贾爱民
(1内蒙古民族大学农学院,内蒙古通辽028043;2内蒙古自治区高校蓖麻产业工程技术中心,内蒙古通辽028043;3内蒙古自治区蓖麻育种重点实验室,内蒙古通辽028043;4内蒙古自治区蓖麻产业协同创新培育中心,内蒙古通辽028043;5内蒙古民族大学生命科学学院,内蒙古通辽028043;6内蒙古自治区国营免渡河农场,内蒙古牙克石022176)
低温胁迫对蓖麻种子萌发过程中生理生化影响
白 雪1,李 兴1,刘 鹏1,2,3,4,郑根昌1,李旭新1,张春兰5,贾爱民6
(1内蒙古民族大学农学院,内蒙古通辽028043;2内蒙古自治区高校蓖麻产业工程技术中心,内蒙古通辽028043;3内蒙古自治区蓖麻育种重点实验室,内蒙古通辽028043;4内蒙古自治区蓖麻产业协同创新培育中心,内蒙古通辽028043;5内蒙古民族大学生命科学学院,内蒙古通辽028043;6内蒙古自治区国营免渡河农场,内蒙古牙克石022176)
旨在探索蓖麻种子在低温下萌发的调控机制,为选育优质抗逆蓖麻新品种做准备。笔者以3个蓖麻品种为材料,采用完全随机设计,重复3次,设置低温15℃、常温25℃(CK),进行种子萌发试验,确定品种活力后,待胚根生长至2 cm时,进行取样测定相关生理指标。结果表明:低温显著阻碍蓖麻种子萌发。低温胁迫下可溶性糖含量和可溶性蛋白含量显著低于对照,而丙二醛含量显著高于对照;低温胁迫下供试蓖麻品种各酶活性表现差异较大,胚根SOD活性均极显著低于对照;除‘通蓖6号’外,其余供试品种POD活性也极显著低于对照;CAT活性表现不显著,且不同温度条件下活性基本一致。通过试验得出‘通蓖5号’在低温胁迫下表现良好,可进行下一步基因测序。
蓖麻;低温胁迫;种子萌发;生理生化
0 引言
在作物发育过程中,温度作为环境因子起到重要的作用,它可控制种子休眠的深度[1],影响植物伸长生长和通过春化途径控制开花时间等[2-5]。在实际栽培过程中,温度变化对作物产量、品质等影响较大,低温或高温可能引发减产或绝收,因此,研究作物在温度胁迫下生理生化变化,对提高产量和选育良种等方面具有重要的意义[6]。蓖麻(Ricinus communis L.)俗称草麻、大麻子等,大戟科蓖麻属植物,其籽粒含油量高达50%~60%,是大豆的2~3倍[7],居油料作物之首。由于蓖麻油的用途广泛[8],全球市场需求呈现稳定增长的趋势。此外,在生产上,蓖麻耐瘠薄,其生产不与粮争地,因此,蓖麻研究日益受到重视。内蒙古通辽市(属干旱地区)为中国蓖麻的主产区之一,20世纪80年代,蓖麻总产量占世界蓖麻产量的四分之一。然而,21世纪以来,由于蓖麻单产水平低,通辽地区蓖麻播种面积锐减,当地蓖麻企业原材料缺口显著增大,向国际市场的供应量也急剧减少。在通辽地区蓖麻播种后由于低温出苗缓慢,致使生育期不够,在秋季早霜到来之时,二级分枝甚至一级分枝上的果穗成熟度不够或不能成熟。因此,了解蓖麻种子在低温下萌发的调控机制对蓖麻高产栽培和育种具有重要的意义。
1 材料与方法
1.1 供试材料
供试材料为3个蓖麻品种(‘通蓖5号’、‘通蓖6号’、‘通蓖11号’),均由内蒙古通辽市农业科学研究院提供,其中‘通蓖5号’为常规高秆品种、‘通蓖6号’为高秆蓖麻杂交种、‘通蓖11号’为矮秆蓖麻杂交种。
1.2 试验设计及方法
试验于2016年3月—5月于内蒙古民族大学农学院实验室内完成,采用完全随机区组设计,设置2个温度处理,即低温15℃和常温25℃(对照),于恒温培养箱(RXZ智能型)中进行温度控制,选择3个蓖麻品种,按照GB/T3543.4-1995标准进行发芽试验,统计发芽势和发芽率。确认各品种种子均为活力正常的种子后,再进行萌发生理研究。待培养皿中蓖麻种子胚根生长至2 cm左右时,分别在各个处理中随机选择萌发种子数粒,将所取样品混合后,立即切碎,称取0.5 g,加入磷酸缓冲液并置于SCIENTZ-48高通量组织研磨器中进行冰浴研磨,可一次性提取SOD、POD、CAT待测液;同时称取0.3 g和0.5 g分别加入蒸馏水和5%三氯乙酸(TCA)制备可溶性糖、可溶性蛋白质及丙二醛待测液,所有待测液保存于4℃冰箱中,试验均重复3次,将所得数据运用Excel进行统计整理,于DPS 14.50系统中进行数据处理。
1.3 生理指标测定方法
生理指标的测定见表1。
表1 生理指标测定方法
2 结果与分析
2.1 各供试品种发芽力
各供试蓖麻品种不同温度条件下发芽力结果如表2所示,低温条件对蓖麻种子发芽力影响显著,均低于25℃条件下发芽力,各品种发芽力降幅由大到小依次为‘通蓖11号’、‘通蓖6号’、‘通蓖5号’;低温条件下蓖麻种子萌发所需时间延长,最高可达16天。
2.2 低温胁迫下对萌发时期胚根物质含量和生理指标影响
供试蓖麻品种胚根于两个温度处理下,各项指标通过温度和品种双因子方差分析表明,温度处理下F值达极显著水平,为重要影响因子,品种效应也达显著水平,表明不同蓖麻品种其低温萌发能力具有差异性。
由表3可知,在低温胁迫下供试蓖麻品种各物质含量变化不同,低温条件下供试品种可溶性糖含量均低于对照,除‘通蓖11号’外,其余达极显著水平;可溶性蛋白含量在低温胁迫下‘通蓖5号’达极显著水平,其余均达显著水平,且含量均低于对照;丙二醛含量在低温条件下均显著或极显著高于对照。

表2 各供试蓖麻品种种子不同温度条件下发芽力
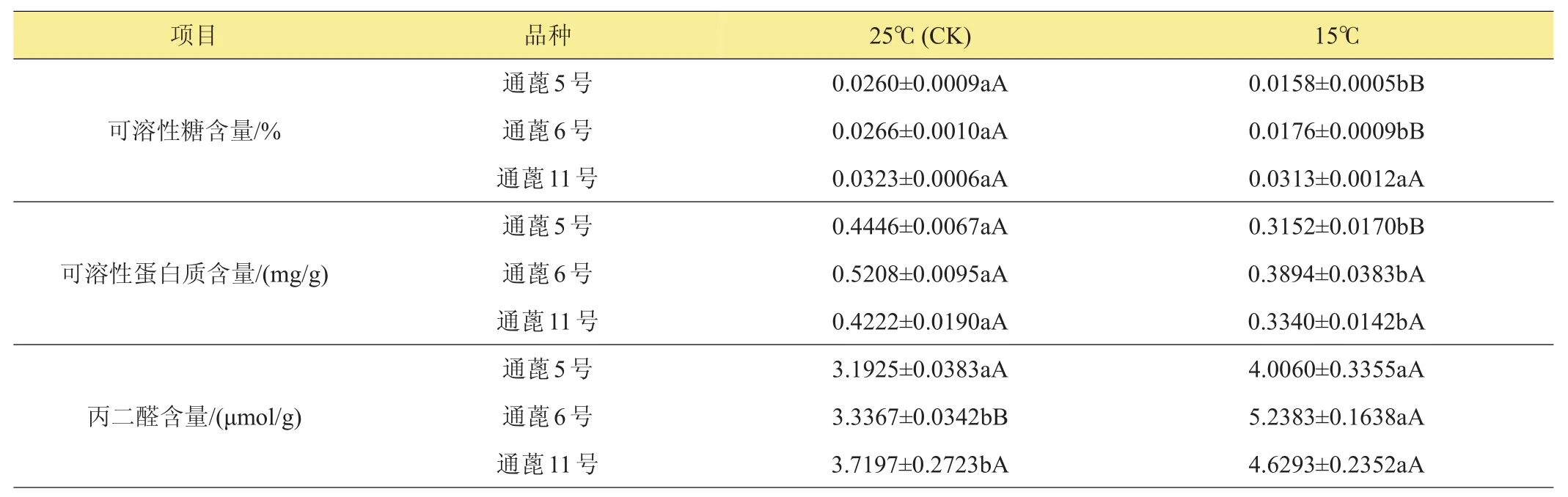
表3 温度胁迫下各供试蓖麻品种胚根物质含量变化及显著性检验
2.3 低温胁迫下对萌发时期胚根生理指标影响
由表4可知在低温胁迫下供试蓖麻品种各酶活性表现差异较大,低温条件下SOD活性均低于对照,且全部达极显著水平;POD活性也均达极显著水平,但除‘通蓖6号’外,其余供试品种POD活性低温条件下低于对照;CAT活性表现不显著,且不同温度条件下活性基本一致。
3 结论与讨论
研究认为[10-12]可溶性蛋白含量与作物抗寒性相关联,其含量高低决定作物抵御低温的能力,呈现正相关,但刘大永等[13]研究表明低温胁迫下水稻可溶性蛋白含量下降,高分子蛋白迅速减少,低分子蛋白迅速增加,试验结果与后者一致,由于细胞内自由基产生和消除难以平衡,积累的自由基对生物膜造成较高的伤害,使生物膜中的结构蛋白和酶聚合交联而空间构型改变,从而导致细胞膜损伤和可溶性蛋白含量降低[14-15],或由于低温胁迫下基因表达的不同所造成,针对蓖麻呈现的此种反映应继续深入研究。
作物在低温条件下,糖含量增高是一个普遍现象,其作为渗透保护物质,可提高细胞间浓度,增加细胞持水组织中的非结冰水,从而降低细胞质冰点,缓冲细胞质过度脱水,保证细胞质胶体不致遇冷凝固,其与抗寒性呈正相关。但并非完全一致,简令成等的研究结果表明,在冬小麦抗寒锻炼的早中期,含糖量与抗寒力的发展成平行关系,但在后期不成正相关,有些很抗寒的植物,其细胞内的含糖量却很低[16-17];本试验结果符合后者,说明供试蓖麻品种在低温胁迫具有一定的抗寒性。

表4 温度胁迫下各供试蓖麻品种胚根生理指标变化及显著性检验 (U/g)
在低温条件下,细胞膜为首先受害部位,抗性强的品种其细胞膜透性增大程度缓慢,抗性弱的品种其细胞膜遭到严重损伤,植物体内O2-、OH-等自由基增加从而使膜质过氧化作用加强,导致膜损伤和破坏[18],其受到损伤程度越大,MDA含量越高,细胞膜透性越强,本实验结果表明在低温条件下,胚根MDA含量升高,与前人研究结果一致,但不同品种所受伤害程度不同,MDA含量增幅不同。
POD、SOD、和CAT均为保护酶,属于酶促防御系统,对作物幼苗在冷害胁迫下清除活性氧,防止膜质过氧化及抗低温伤害具有重要作用,保护酶活性剧烈下降是作物自根幼苗诱发冷害的重要原因[19-21],在一定的低温范围内,保护酶系的含量或活性上升有利于保持植物体内自由基的产生和清除之间的平衡,不致造成膜脂过氧化;但当温度继续下降或低温持续时间长,则活性氧、自由基就会明显增加,而清除剂含量下降,导致自由基积累,造成膜脂过氧化。王燕等[22]把紫花芒果放在2℃中15天,发现冷害发生时,SOD活性略有上升后下降,CAT活性持续下降,说明冷害可降低CAT和SOD活性。朱其杰等[23]研究表明,常温和低温下生长的黄瓜,耐低温能力强的品种POD活性都低,同工酶酶带都少。POD活性及同工酶酶带数与黄瓜的耐冷性表现为负相关。本研究结果与其基本一致,但‘通蓖6号’POD活性在低温胁迫下呈现升高,供试品种CAT活性变化与常温比较无差异,其变化可能是蓖麻在低温环境下的一种应激反应,因此还需要深入研究。
经温度胁迫后,蓖麻品种各项生理指标变化趋势不同,不同品种间也有一定差异。在所供试品种中‘通蓖5号’表现最优,抗性较好。适当的低温胁迫可以诱发抗氧化剂酶系统的活力,增强品种的抗逆性,故在播种时如遇低温冷害,应增加保温、增温的措施,适当的进行炼苗以提高品种的抗寒性,从而减轻低温对其的影响,同时注意选择耐低温性强的品种,并进行转录组测序,筛选耐低温的功能基因,以培育新品种适应通辽当地气候环境,结合良好栽培措施,克服萌发障碍保证出苗。
[1]Koornneef M,Bentsink L,Hilhorst H.Seed dormancy and germination[J].Current Opinion in Plant Biology,2002,5(1):33-36.
[2]Henderson I R,Dean C.Control of arabidopsis flowering:the chill before the bloom[J].Development,2004,131(16):3829-3838.
[3]Gray W M,Qstin A,Sandberg G,et al.High temperature promotes auxin-mediated hypocotyl elongation in Arabidopsis[J].Proceedings of the National Academy of Sciences,1998,95(12):7197-7202.
[4]Mazzella M A, Bertero D, Casal J J. Temperaturedependentinternode elongation in vegetative plants of Arabidopsis thaliana lacking phytochrome B and cryptochrome 1[J].Planta,2000, 210(3):497-501.
[5]Penfield S.Temperature perception and signal transduction in plants [J].New Phytologist,2008,179(3):615-628.
[6]魏乐,杜军华.高温和零上低温对小麦根系含糖量及细胞透性的影响[J].青海师范大学学报:自然科学版,1999(1):36-39.
[7]Baldw in B S,Cossar R D.Castor yield in response to planting date at four locations in the south-central United States[J].Industrial Crops and Products,2009,29:316-319.
[8]Ogunniyi D S.Castor oil:a vital industrial rawmaterial[J]. Bioresource Technol,2006,97:1086-1091.
[9]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000(7):184,164-167.
[10]马艳青,戴雄泽.低温胁迫对辣椒抗寒性相关生理指标的影响[J].湖南农业大学学报:自然科学版,2000,26(6):461-462.
[11]Gao Y,Qi X H,Yang J H,et al.The response mechanism of cold stress in higher plants[J].Northern Horticulture,2007(10):58-61.
[12]Lu M H,Chen J F.Genetic engineering of plant for cold tolerance [J].Acta Botanica Boreali-Occidentalia Sinica,2004,24(10):1953-1958.
[13]刘大永,王维香.过氧化氢对水稻幼苗中CAT和POD活性的影响[J].作物学报,1998,24(3):320-324.
[14]Susan W,Atul M,Vaidaya G B,et al.High specific activity of whole cells in an aqueousorganic two phasemem brane bioreactor [J].Enzyme and Technology,1998(22):575-577.
[15]潘晓云.膜脂过氧化作为扁桃品种抗寒性鉴定指标研究[J].生态学报,2002(11):1902-1911.
[16]简令成,吴素萱.植物抗寒性的细胞学研究-小麦越冬过程中细胞内物质的变化[J].植物学报,1965,13:1-16.
[17]Levitt J.Responses of Plant to Environmental Stress[M].New York: Academic Press,1980:365-488.
[18]王爱国,邵从本,罗广华,等.大豆下胚轴线粒体的衰老与膜脂的过氧化作用[J].植物生理学报,1988,14(3):269.
[19]李明玉,曹辰兴,于喜艳.低温锻炼对冷胁迫下黄瓜幼苗保护性酶的影响[J].西北农业学报,2006,15(1):160-164.
[20]张自坤,刘世琦,王忠全,等.低温胁迫对不同砧木黄瓜嫁接苗生理生化指标的影响[J].山东农业科学,2009,5:36-40.
[21]徐心诚.低温弱光对黄瓜幼苗过氧化物酶同工酶和丙二醛含量的影响[J].河南农业科学,2012,14(1):113-116.
[22]王燕,李雪平,季作梁.芒果冷害对两种自由基清除剂的影响[J].园艺学报,1995,22(3):235-239.
[23]朱其杰,高守云,蔡洙湖.等.黄瓜耐冷性鉴定及遗传规律的研究[M].见:李树德主编:中国主要菜抗病育种进展[M].北京:科学出版社,1995:457-462.
Effects of Low Temperature Stress on Physiology and Biochemistry in Seed Germination of Castor Bean
Bai Xue1,Li Xing1,Liu Peng1,2,3,4,Zheng Genchang1,Li Xuxin1,Zhang Chunlan5,Jia Aimin6
(1College of Agriculture,Inner Mongolia University for Nationalities,Tongliao 028043,Inner Mongolia,China;2Inner Mongolia Industrial Engineering Research Center of Universities for Castor,Tongliao 028043,Inner Mongolia,China;3Inner Mongolia Key Laboratory of Castor Breeding,Tongliao 028043,Inner Mongolia,China;4Inner Mongolia Collaborative Innovation Cultivate Center for Castor,Tongliao 028043,Inner Mongolia,China;5Collage of Life Science,Inner Mongolia University for Nationalities,Tongliao 028043,Inner Mongolia,China;6State-owned Farms in Inner Mongolia Mianduhe,Yakeshi 022176,Inner Mongolia,China)
The purpose of the study is to explore the regulation mechanism of castor seed germination under low temperature,in order to select and breed new varieties with high quality and resistance.In this study,three castor cultivars were used as materials.A complete randomized design was adopted with 3 duplicates.The low temperature of 15℃and normal temperature of 25℃(CK)were set up and the seeds germination experiments were conducted.After determining the vitality of cultivars,the physiological index was determined by taking samples when the radicles were 2 cm long.The results indicated that seeds germination of castor was significantly hindered by low temperature stress.The sugar content and TSP were less than that of the control in radicles under low temperature,but the MDA content was significantly higher than that of the control under the low temperature.The performance of enzyme activity in castor was quite different under low temperature, SOD activity in radicles was less than that of the control under low temperature.Excepting‘Tongbi No.6’,other varieties’POD activity was significantly lower than that of the control;the CAT activity performance was not significant,and the activities were basically coincident under different temperature conditions.It concluded that‘Tongbi No.5’performed well under low temperature stress,and it could take gene sequencing for the next step.
Castor;Low Temperature Stress;Seed Germination;Physiology and Biochemistry
S565.6
:A论文编号:cjas16100008
内蒙古自治区高校蓖麻产业工程技术中心、内蒙古自治区蓖麻育种重点实验室科研项目“低温抑制蓖麻种子萌发的生理生化基础研究”(BMYJ2015-06);市校合作项目“利用EMS优质抗逆蓖麻新品种的研究诱变选育”(SXYB2012050)。
白雪,女,1991年生人,内蒙古赤峰人,硕士,研究方向:蓖麻生理生化及生物技术研究。通信地址:028000内蒙古通辽市科尔沁区内蒙古民族大学农学院北区农学楼207室,E-mail:1243940967@qq.com。
刘鹏,男,1973年生人,内蒙古赤峰人,教授,博士,主要从事作物遗传育种研究。通信地址:028000内蒙古通辽市科尔沁区内蒙古民族大学北区农学楼208室内蒙古民族大学农学院,E-mail:mindaliupeng@126.com。
2016-10-10,
:2016-12-12。
