曲妥珠单抗联合新辅助化疗对乳腺癌患者术后临床疗效及相关指标的影响
2017-04-28耿凤勇金克敏中国医科大学航空总医院普外乳腺科北京10001北京大学肿瘤医院肝胆胰外1科北京10014
耿凤勇,金克敏(1.中国医科大学航空总医院普外乳腺科,北京 10001;.北京大学肿瘤医院肝胆胰外1科,北京 10014)
曲妥珠单抗联合新辅助化疗对乳腺癌患者术后临床疗效及相关指标的影响
耿凤勇1*,金克敏2(1.中国医科大学航空总医院普外乳腺科,北京 100012;2.北京大学肿瘤医院肝胆胰外1科,北京 100142)
目的:探讨曲妥珠单抗联合新辅助化疗对乳腺癌患者术后临床疗效及血清中血管新生因子、乳腺组织中凋亡分子的影响。方法:选择2012年1月-2014年12年在我院接受住院治疗的乳腺癌患者116例作为研究对象,按照随机数表法分为对照组和观察组,各58例。对照组术前给予注射用卡铂100 mg(加入5%葡萄糖注射液稀释至10 mg/mL,再加入500 mL葡萄糖注射液中),于每个化疗周期的第1天ivgtt,200~400 mg/m2;多西他赛注射液于每个化疗周期的第1天ivgtt,75 mg/m2。观察组在对照组基础上加用注射用曲妥珠单抗,第1周剂量4 mg/kg,第2~18周剂量为2 mg/kg,每周1次,ivgtt。3周为1个周期,两组患者均持续治疗6个周期,治疗结束2周后行乳腺癌改良根治术。观察两组患者治疗前后血清血管新生因子水平和乳腺组织凋亡分子水平,并比较两组患者治疗结束后1年时的临床疗效及不良反应发生情况。结果:治疗前,两组患者血清血管新生因子和乳腺组织凋亡分子水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者血清血管新生因子和乳腺组织凋亡分子水平显著降低,且观察组显著低于对照组,差异均有统计学意义(P<0.05)。观察组患者临床有效率为82.76%,显著高于对照组的56.90%,差异有统计学意义(P<0.05)。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。结论:曲妥珠单抗联合新辅助化疗有助于提高乳腺癌治疗效果、防止复发,降低血清中血管新生因子及乳腺组织凋亡分子表达水平,且安全性较好。
乳腺癌;曲妥珠单抗;新辅助化疗;血管新生因子;凋亡相关分子
乳腺癌是女性最常见的恶性肿瘤,新辅助化疗是局部晚期乳腺癌患者常用的治疗方式。新辅助化疗又称术前化疗,是指在应用局部治疗(手术或放疗)恶性肿瘤前进行全身性、系统性的细胞毒性药物治疗,可以降低肿瘤细胞活力,减少播散,利于消除全身微小转移灶,延长患者生存期,并可使原发病灶降期,为手术创造有利条件[1]。曲妥珠单抗是一种人源性抗人类表皮生长因子受体2(HER2)单克隆抗体,对非靶细胞杀伤性小、副作用少[2]。有学者认为在手术局部切除病灶前,联合使用曲妥珠单抗和新辅助化疗可以有效优化病情,故本次研究主要分析术前应用曲妥珠单抗联合新辅助化疗对乳腺癌患者血清中血管新生因子及乳腺组织中凋亡分子的影响,现报道如下。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)近1个月内未使用其他免疫调节剂;(2)年龄18~75岁;(3)卡氏(KPS)评分>60分,预计生存期>6个月;(4)骨髓、肝、肾、心、肺功能无明显异常;(5)病理及免疫组化明确为HER2阳性。排除标准:(1)有脑转移症状且未控制者;(2)过敏体质或对多种药物过敏者:(3)患有精神障碍疾病者;(4)合并其他严重疾病,如活动性结核、未控制的活动性感染、严重的电解质紊乱者;(5)有严重的出血倾向或内脏出血者;(6)妊娠期或哺乳期妇女;(7)依从性差者。
1.2 研究对象
选择2012年1月-2014年12月在我院接受住院治疗的乳腺癌患者116例作为研究对象,按随机数表法分为对照组和观察组,各58例。其中,对照组患者年龄32~71岁,平均年龄(59.27±6.33)岁;乳腺癌TNM分期为Ⅱ期28例、Ⅲ期30例;KPS评分(88.6±6.32)分。观察组患者年龄33~70岁,平均年龄(58.79±6.05)岁;乳腺癌TNM分期为Ⅱ期25例、Ⅲ期33例;KPS评分(86.5±7.18)分。两组患者的一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经医院医学伦理委员会批准,患者知情同意并签署知情同意书。
1.3 治疗方法
对照组患者术前给予注射用卡铂(扬子江药业集团有限公司,批准文号:国药准字H20044616,规格:100 mg)100 mg(加入5%葡萄糖注射液稀释至10 mg/mL,再加入500 mL葡萄糖注射液中),于每个化疗周期的第1天ivgtt,200~400 mg/m2;多西他赛注射液(江苏恒瑞医药股份有限公司,批准文号:国药准字H20020543,规格:0.5 mL∶20 mg)于每个化疗周期的第1天ivgtt,75 mg/m2。观察组在对照组基础上加用注射用曲妥珠单抗(Genentech Inc.,注册证号:S20110007,规格:440 mg),第1周剂量4 mg/kg,第2~18周剂量为2 mg/kg,每周1次,ivgtt。3周为1个周期,两组患者均持续治疗6个周期。治疗结束2周后行乳腺癌改良根治术[3]。
1.4 观察指标
(1)观察两组患者治疗后1年的临床疗效[3]——完全缓解(CR):目标病灶完全消失;部分缓解(PR):治疗后目标病灶的最大直径及最大垂直径乘积缩小>50%;疾病稳定(SD):病灶长径之和缩小但未达PR,或者增加未达PD;疾病进展(PD):治疗后目标病灶的最大直径及最大垂直径乘积增加≥25%,或者出现新病灶。总有效率(RR)=(CR例数+PR例数)/总例数×100%。(2)观察两组患者治疗前后血清血管新生因子(VEGF)水平,包括VEGFA、VEGFB、VEGFC。(3)观察两组患者乳腺组织凋亡分子水平,包括胱天蛋白酶3(Caspase-3)、捕获受体3(DcR3)、Livin、Survivin、环氧合酶2(COX-2)。(4)观察两组患者不良反应发生情况。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料以例数或率表示,采用χ2检验,其中等级资料采用非参数秩和U检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
观察组患者RR为82.76%,显著高于对照组的56.90%,差异有统计学意义(P<0.05),详见表1。

表1 两组患者临床疗效比较Tab 1 Comparison of clinical efficacies between 2 groups
2.2 两组患者治疗前后血清VEGF水平比较
治疗前,两组患者VEGF水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者血清VEGFA、VEGFB和VEGFC水平均显著降低,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表2。
表2 两组患者治疗前后血清VEGF水平比较(±s,pg/mL)Tab 2 Comparison of the levels of serum angiogenic factors between 2 groups before and after treatment(±s,pg/mL)

表2 两组患者治疗前后血清VEGF水平比较(±s,pg/mL)Tab 2 Comparison of the levels of serum angiogenic factors between 2 groups before and after treatment(±s,pg/mL)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别V E G F C n 时期V E G F A V E G F B观察组2 0 3.6 4 ± 1 9.6 1 8 7.4 1 ± 1 0.2 1*#2 0 1.3 6 ± 2 2.1 1 1 5 8.6 4 ± 2 5.3 1*5 8对照组5 8治疗前治疗后治疗前治疗后2 2 6.3 8 ± 1 2.1 5 9 1.5 4 ± 1 0.1 5*#2 2 5.1 1 ± 1 5.2 2 1 7 5.3 0 ± 1 0.2 3*3 1 1.4 7 ± 2 0.6 2 1 3 6.9 2 ± 1 8.4 5*#3 1 5.7 8 ± 2 3.2 6 2 5 9.4 6 ± 2 0.2 4*
2.3 两组患者治疗前后乳腺组织凋亡分子水平比较
治疗前,两组患者乳腺组织凋亡分子水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者乳腺癌组织Caspase-3、DcR3、Livin、Survivin和COX-2水平均显著降低,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表3。
2.4 不良反应
两组患者不良反应主要为肝功能损伤、肾功能异常、红血细胞减少、血小板降低、白细胞减少、恶心/呕吐等。两组患者上述不良反应发生率比较,差异均无统计学意义(P>0.05),详见表4。
表3 两组患者治疗前后乳腺组织凋亡分子水平比较(±s)Tab 3 Comparison of the levels of apoptosis factors in breast tissue between 2 groups before and after treatment(±s)
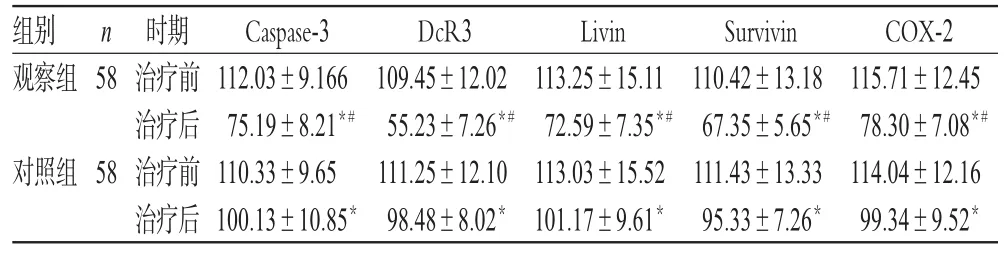
表3 两组患者治疗前后乳腺组织凋亡分子水平比较(±s)Tab 3 Comparison of the levels of apoptosis factors in breast tissue between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别观察组58 COX-2 115.71±12.45 78.30±7.08*#114.04±12.16 99.34±9.52*n对照组58时期治疗前治疗后治疗前治疗后Caspase-3 112.03±9.166 75.19±8.21*#110.33±9.65 100.13±10.85*DcR3 109.45±12.02 55.23±7.26*#111.25±12.10 98.48±8.02*Livin 113.25±15.11 72.59±7.35*#113.03±15.52 101.17±9.61*Survivin 110.42±13.18 67.35±5.65*#111.43±13.33 95.33±7.26*
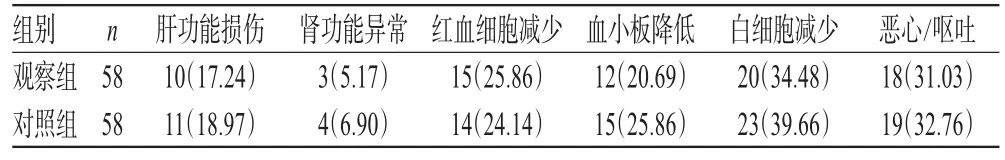
表4 两组患者不良反应发生率比较[例(%%)]Tab 4 Comparison of the incidence of ADR between 2 groups[case(%%)]
3 讨论
新辅助化疗于20世纪70年代首次应用于局部晚期乳腺癌的治疗,具有使肿瘤降期、增加肿瘤体内化疗敏感性等优势,使不能手术的乳腺癌患者后期可以接受根治性手术治疗,现已经成为局部晚期乳腺癌的标准治疗方式[4]。HER2在20%~25%的乳腺癌患者中表达水平较高,在乳腺癌的进展过程中起到极为重要的作用。曲妥珠单抗可以有效杀灭乳腺癌肿瘤细胞,同时对正常细胞的损伤性较小,相对于其他化疗药物具有明显优势[5]。本研究重点探讨了曲妥珠单抗联合新辅助化疗对乳腺癌患者血清中血管新生因子和乳腺组织中凋亡分子表达水平的影响[6-7],以期为临床治疗提供参考。
VEGF是促血管新生能力最有效的细胞因子,可以结合对应受体激活信号通路、促进血管内皮细胞迁移增殖,并形成新的血管[4]。VEGF包括VEGFA、VEGFB、VEGFC等多种亚型,恶性肿瘤生存及增殖的基础为其促发的新生血管。研究显示恶性肿瘤患者血清中VEGF水平显著升高,成为肿瘤治疗失败或复发的重要标志[8]。本研究结果显示,治疗后,两组患者血清VEGFA、VEGFB和VEGFC水平均明显降低,且观察组明显低于对照组患者,差异均有统计学意义(P<0.05),提示曲妥珠单抗联合新辅助化疗能大幅降低肿瘤细胞血管新生活性,有助于降低肿瘤患者治疗后复发率。肿瘤组织中凋亡分子的表达异常是导致肿瘤进展的关键因素,Caspase是含半胱氨酸的天冬氨酸特异水解酶,有启动型、效应型和炎症型,其中效应型Caspase-3是哺乳动物细胞凋亡的关键蛋白酶,在细胞凋亡蛋白酶级联反应中处于核心地位[2]。在正常生理情况下Caspase-3在细胞质中以无活性形式存在,当细胞凋亡时被激活为活性形式。近年研究发现,Caspase-3参与了肿瘤细胞的异常凋亡过程,其高度表达促进了肿瘤细胞的增殖[9]。DcR3是存在于多种恶性肿瘤组织中的肿瘤坏死因子受体,其表达产物可与相关受体结合阻断细胞凋亡过程。有研究显示,DcR3的高表达可以抑制肿瘤组织中的癌细胞凋亡。Livin与Survivin主要通过拮抗死亡受体来抑制细胞凋亡发生,有研究发现Livin和Survivin在乳腺癌患者中存在过度表达情况[6]。COX-2是前列腺素合成过程中的重要限速酶,在乳腺癌组织中存在COX-2表达,且与乳腺癌的发展关系密切,其在多种恶性肿瘤中均呈高表达状态[8]。本研究结果显示,治疗后,两组患者乳腺癌组织中Caspase-3、DcR3、Livin、Survivin、COX-2表达水平均显著降低,且观察组显著低于对照组,提示曲妥珠单抗联合新辅助化疗有助于促进肿瘤细胞凋亡、抑制肿瘤细胞增殖。治疗1年后,观察组患者RR显著高于对照组,提示术前应用曲妥珠单抗联合新辅助化疗在杀灭肿瘤细胞以及抑制治疗后复发方面具有显著优势。
综上所述,曲妥珠单抗联合新辅助化疗有助于提高乳腺癌患者术后的临床疗效,降低血清中血管新生因子及乳腺组织中凋亡分子表达水平,且不增加不良反应发生率。但本研究样本小,其远期生存率、生存时间还需扩大样本进一步观察。
[1] 张国淳,吕海通,温灵珠,等.HER2阳性乳腺癌患者曲妥珠单抗辅助治疗的回顾性生存分析[J].中华普通外科杂志,2016,31(1):27-31.
[2] 殷科,曹永晋.曲妥珠单抗新辅助化疗表皮生长因子受体2阳性乳腺癌的临床疗效及安全性评价[J].中国临床药理学杂志,2015,31(9):725-727.
[3] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范:2011版[J].中国癌症杂志,2011,17(5):367-417.
[4] 王永南,王颀,张安秦.ER、PR、HER2和Ki-67在乳腺癌新辅助化疗前后表达变化的临床意义[J].岭南现代临床外科,2013,13(4):308-310.
[5] Koziel JE,Herbert BS.The telomerase inhibitor imetelstatalone,and in combination with trastuzumab,decreases thecancerstem cell population and self-renewal of HER2(+)breast cancercells[J].Breast Cancer Res Treat,2015,149(3):607-618.
[6] 闫海山,张冰雁.曲妥珠单抗联合新辅助化疗用于HER2过度表达乳腺癌的临床观察[J].中国药房,2016,27(29):4127-4130.
[7] Hurvitz SA,Kalous O,Conklin D,et al.In vitro activity of the mTOR inhibitor everolimus,in a large panel of breastcancer cell lines and analysis for predictors of response[J].Breast Cancer Res Treat,2015,149(3):669-680.
[8] 魏娜,倪青,戴民.术前应用曲妥珠单抗联合新辅助化疗对乳腺癌患者血清中血管新生因子及乳腺组织中凋亡相关分子的影响[J].中国现代医学杂志,2015,25(22):46-49.
[9] 宋子正,李靖华,臧爱民,等.曲妥珠单抗联合化疗对HER2阳性晚期胃癌患者疗效及血清肿瘤标志物的影响[J].中国药房,2016,27(23):3249-3251.
(编辑:黄 欢)
Effects of Trastuzumab Combined with Neoadjuvant Chemotherapy on Clinical Efficacy and Related Indexes of Breast Cancer Patients after Surgery
GENG Fengyong1,JIN Kemin2(1.Dept.of Breast Surgery,Aviation General Hospital of China Medical University,Beijing 100012,China;2.Dept.of Hepatopancreatobiliary Surgery,Cancer Hospital,100142,China)
OBJECTIVE:To investigate the effects of trastuzumab combined with neoadjuvant chemotherapy on clinical efficacy of breast cancer patients,serum angiogenic factors and apoptosis factors of breast tissue.METHODS:A total of 116 breast cancer in patients were selected from our hospital during Jan.2012-Dec.2014 as research object,and then divided into control group and observation group according to random number table,with 58 cases in each group.Control group was given Carboplatin for injection 100 mg(added into 500 mL 5%Glucose injection after diluted into 10 mg/mL),ivgtt,200-400 mg/m2on the first day of each chemotherapy cycle;Docetaxel injection ivgtt,75 mg/m2on the first day of each chemotherapy cycle.On the basis of control group,observation group was additionally given Trastuzumab for injection,4 mg/kg in the first week,2 mg/kg in the 2nd-8th week,once a week,ivgtt.A treatment course lasted for 3 weeks,and both groups received 6 courses of treatment.Both groups received modified radical mastectomy 2 weeks after treatment.The levels of serum angiogenic factors and apoptosis factors of breast tissue were observed in 2 groups before and after treatment.Clinical efficacies and the occurrence of ADR were compared between 2 groups 1 year after treatment.RESULTS:Before treatment,there was no statistical significance in the levels of serum angiogenic factors and apoptosis factors of breast tissue between 2 groups(P>0.05).After treatment,the levels of serum angiogenic factors and apoptosis factors of breast tissue were decreased significantly in 2 groups,and the observation group was significantly lower than the control group,with statistical significance(P<0.05).Clinical response rate of observation group was 82.76%,which was significantly higher than 56.90%of control group,with statistical significance(P<0.05).There was no statistical significance in the incidence of ADR between 2 groups(P>0.05).CONCLUSIONS:Trastuzumab combined with neoadjuvant chemotherapy is helpful to improve the therapeutic effect with breast cancer,prevent recnrence,and reduce the expression of serum angiogenic factors and apoptosis factors of breast tissue with good safety.
Breast cancer;Trastuzumab;Neoadjuvant chemotherapy;Angiogenic factors;Apoptosis factors
R737.9
A
1001-0408(2017)11-1532-03
2016-08-21
2016-12-09)
*副主任医师,硕士。研究方向:乳腺疾病。电话:010-59520241。E-mail:Gengfyl@163.com
DOI10.6039/j.issn.1001-0408.2017.11.27
