对氯吡格雷不同反应的冠状动脉疾病患者基因型差异研究
2017-04-28曾安宁熊德高余吉西陈荣兴蔡冰冰黔南州人民医院心内科贵州都匀558000
曾安宁,熊德高,石 建,余吉西,陈荣兴,蔡冰冰(黔南州人民医院心内科,贵州都匀 558000)
对氯吡格雷不同反应的冠状动脉疾病患者基因型差异研究
曾安宁*,熊德高#,石 建,余吉西,陈荣兴,蔡冰冰(黔南州人民医院心内科,贵州都匀 558000)
目的:探讨对氯吡格雷不同反应的冠状动脉疾病(CAD)患者基因型的差异。方法:选取2013年3月-2015年11月于我院心内科就诊的CAD患者159例,予氯吡格雷+阿司匹林双联抗血小板治疗至少1年。采用光比浊法测定各患者治疗前后经腺苷二磷酸(ADP)、花生四烯酸(AA)诱导的血小板聚集百分率,采用聚合酶链反应-限制性片段长度多态性分析法检测其细胞色素P450(CYP)2C19、CYP3A5、野生型亮氨酸33等位基因(PLA1)/脯氨酸33等位基因(PLA2)的多态性。结果:共检出CYP2C19基因型3种(*2/*2、*2/*1、*1/*1)、CYP3A5基因型3种(*3/*3、*3/*1、*1/*1)、PLA1/PLA2基因型3种(A1/A2、A2/A2、A1/A1),各基因型频率均符合Hardy-Weinberg平衡(P>0.05)。159例患者中,有81例为氯吡格雷“半反应”,占50.9%;有78例为氯吡格雷“反应”,占49.1%。氯吡格雷“半反应”患者CYP2C19基因缺失(*2/*2或*2/*1基因型)和*2等位基因的频率均显著高于氯吡格雷“反应”患者,差异均有统计学意义(P<0.05);氯吡格雷“半反应”患者PLA1/PLA2基因缺失(A2/A2或A1/A2基因型)和A2等位基因的频率均显著高于氯吡格雷“反应”患者,差异均有统计学意义(P<0.05);而氯吡格雷“半反应”患者CYP3A5基因缺失(*3/*3或*3/*1基因型)和*3等位基因的频率虽略高于氯吡格雷“反应”患者,但差异均无统计学意义(P>0.05)。治疗后,各基因型患者经ADP、AA诱导的血小板聚集百分率均较治疗前显著降低,但CYP2C19基因缺失型、CYP3A5基因缺失型患者的血小板聚集百分率均显著高于其基因表达型(*1/*1基因型),差异均有统计学意义(P<0.05);PLA1/PLA2基因缺失型与其基因表达型(A1/A1基因型)患者的血小板聚集百分率比较,差异无统计学意义(P>0.05)。结论:氯吡格雷“半反应”在CAD患者中的发生率较高。CYP2C19、PLA1/ PLA2基因多态性可能与氯吡格雷“半反应”有关,而CYP3A5基因多态性可能与之无关。CYP2C19、CYP3A5基因缺失可能会降低氯吡格雷对CAD患者血小板聚集的抑制作用。
CYP2C19;CYP3A5;PLA1/PLA2;基因多态性;氯吡格雷;抵抗
氯吡格雷抗血小板治疗是目前冠状动脉疾病(Coronary artery disease,CAD)的常规治疗方案[1]。尽管采用抗血小板治疗,CAD患者主要心血管不良事件(如心肌梗死、脑梗死或死亡)的发生率仍可达5%~20%[2],其中部分原因是由于患者对氯吡格雷治疗的不同反应及潜在的遗传多样性[3]。由于检测技术和研究人员对药物“抵抗”的定义不同,相关文献报道的发生率有较大的差异;此外,药动学特征、患者并发症及遗传学因素均可对其产生影响[4-5]。目前,个体间遗传多样性[尤其是细胞色素P450(Cytochrome P450,CYP)酶系和血小板受体相关基因的多态性]可解释绝大多数患者对药物的“半抵抗”和“抵抗”,例如CYP2C19基因功能缺失可降低氯吡格雷对患者血小板聚集的影响,CYP3A5基因多态性与血栓形成的风险增加密切相关,野生型亮氨酸33等位基因(PLA1)/脯氨酸33等位基因(PLA2)的多态性也与对抗血小板药物的低反应性有关[6-8]。因此,本研究在已有文献的基础上,以我院心内科CAD患者为研究对象,检测其CYP2C19、CYP3A5和PLA1/PLA2的基因分型,初步探讨对氯吡格雷不同反应的CAD患者基因型的差异,为临床精准用药提供参考。
1 资料与方法
1.1 材料
ABI 7500型荧光定量聚合酶链反应(PCR)仪(美国Applied Biosystems公司);TYXN-91型血小板聚集仪(上海通用医疗仪器公司);Micro CL21R型离心机(美国赛默飞世尔科技公司);α-1900S型分光光度计(厦门安达兴电气集团有限公司);CYP2C19基因检测芯片试剂盒(艾美捷科技有限公司);10 μmol/L腺苷二磷酸(Adenosine diphosphat,ADP)试剂和0.50 mmol/L花生四烯酸(Arachidonic acid,AA)试剂均由美国Cayman公司提供。
1.2 研究对象
纳入标准:(1)经冠脉造影确诊为CAD者;(2)长期应用氯吡格雷+阿司匹林双联抗血小板治疗;(3)未发生明显不良反应。排除标准:(1)有凝血功能障碍或出血性疾病家族史的患者;(2)生存期低于1年的患者;(3)严重贫血的患者。本研究共纳入2013年3月-2015年11月于我院心内科就诊的CAD患者159例。本研究方案经医院医学伦理委员会批准,所有患者或其家属均知情同意并签署知情同意书。
1.3 治疗方法
所有患者均口服硫酸氢氯吡格雷片[深圳信立泰药业股份有限公司,批准文号:国药准字H20000542,规格:25 mg(以C16H16ClNO2S计)]负荷剂量300 mg/d,维持剂量75 mg/d+阿司匹林肠溶片(德国Bayer Vital GmbH,注册证号:H20130340,规格:100 mg)100 mg/d进行双联抗血小板治疗,治疗时间至少1年。
1.4 血小板聚集试验
采用光比浊法。所有患者分别于氯吡格雷治疗前与氯吡格雷维持剂量治疗的第7天空腹抽取静脉血4.5 mL,置于常规检测采血管、含3.2%枸缘酸钠抗凝管、含枸橼酸钠+茶碱+腺苷+双嘧达莫的抗凝管(CTAD抗凝管)中,以离心半径15 cm、转速1 000 r/min离心5 min,提取富含血小板的血浆;再以离心半径10 cm、转速3 000 r/min离心20 min,提取贫血小板血浆(Platelet-poor plasma,PPP)。采用血小板聚集仪分别进行以ADP、AA诱导的血小板聚集试验,结果以血小板聚集百分率表示。
1.5 基因型检测与分析
所有患者均抽取静脉血2 mL至乙二胺四乙酸(EDTA)抗凝管中,采用液-液萃取法[萃取溶剂为苯酚-氯仿-异戊醇(25∶24∶1,V/V/V)]提取DNA,采用分光光度计检测DNA浓度。患者DNA经稀释、分装后,于-80℃保存。采用PCR法对上述样品进行扩增,CYP2C19、CYP3A5和PLA1/PLA2基因的扩增引物见表1。PCR反应体系包括无核糖核酸(RNA)酶水1.54 μL、DNA模板0.66 μL和引物0.25 μL。CYP2C19基因的扩增条件为:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,共35个循环,72℃再延伸7 min;CYP3A5基因的扩增条件为:94℃预变性3 min,94℃变性40 s,51.5℃退火40 s,72℃延伸40 s,共35个循环,72℃再延伸7 min;PLA1/PLA2基因的扩增条件为:94℃预变性5 min,94℃变性30 s,58℃退火30 s,72℃延伸30 s,共35个循环,72℃再延伸10 min。采用聚合酶链反应-限制性片段长度多态性分析(PCR-RFLP)法、应用荧光定量PCR仪确定各患者的基因型。

表1 CYP2C19、CYP3A5和PLA1/PLA2基因的扩增引物Tab 1 Amplification primer of CYP2C19、CYP3A5 and PLA1/PLA2
1.6 判断标准
在10µmol/LADP的诱导下,患者血小板聚集百分率较基线水平降低<10%为氯吡格雷“抵抗”;降低<30%则为氯吡格雷“半抵抗”[9]。“抵抗”与“半抵抗”为“半反应”,反之为“反应”。
1.7 统计学方法
应用SPSS 17.0软件对所得数据进行统计分析。计量资料以±s表示,组间比较采用Student’s t检验;计数资料以率表示,组间比较采用χ2检验和Fisher’s精确检验;采用χ2检验分析患者各基因型频率是否符合Hardy-Weinberg平衡。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料
159例CAD患者中,男性132例(83.0%),女性27例(17.0%);平均年龄为(57.1±9.5)岁;血红蛋白为(133.5±13.1)g/L,血小板计数为(243.2±86.5)×10-9L-1,血小板体积为(9.2±1.4)fL,10 μmol/L ADP和0.50 mmol/L AA诱导的血小板聚集百分率分别为(46.6± 12.7)%、(36.8±11.2)%。其中,急性心肌梗死77例(48.4%),不稳定型心绞痛65例(40.9%),稳定型心绞痛17例(10.7%);合并高血压143例(89.9%),合并糖尿病37例(23.3%),合并血脂异常85例(53.5%);经皮冠脉介入治疗的147例(92.5%),经冠脉旁路移植术治疗的8例(5.0%),未经干预的4例(2.5%);经他汀类药物治疗的159例(100%),经质子泵抑制剂治疗的115例(72.3%)。
2.2 患者基因型分布
共检出CYP2C19基因型3种,分别为*2/*2(11.3%)、*2/*1(42.8%)和*1/*1(45.9%);CYP3A5基因型3种,分别为*3/*3(47.2%)、*3/*1(41.5%)和*1/*1(11.3%);PLA1/PLA2基因型3种,分别为A1/A2(3.1%)、A2/A2(23.9%)和A1/A1(73.0%)。χ2检验结果显示,患者CYP2C19、CYP3A5与PLA1/PLA2各基因型频率均符合Hardy-Weinberg平衡(P>0.05),详见表2。

表2 159例CAD患者的基因型分布Tab 2 Distribution of genotype in 159 CAD patients
2.3 患者对氯吡格雷的反应性
159例患者中,有79例患者为氯吡格雷“半抵抗”,占49.7%;2例患者为氯吡格雷“抵抗”,占1.2%,81例患者为氯吡格雷“半反应”,占50.9%;78例患者为氯吡格雷“反应”,占49.1%。
2.4 氯吡格雷“半反应”与“反应”患者一般资料比较
氯吡格雷“半反应”与“反应”患者性别、年龄、并发症、CAD类型和治疗等一般资料比较,差异均无统计学意义(P>0.05),详见表3。

表3 氯吡格雷“半反应”与“反应”患者一般资料比较Tab 3 Comparison of general data between clopidogrel“semi-response”and“response”patients
2.5 氯吡格雷“半反应”与“反应”患者血小板聚集百分率比较
治疗前,氯吡格雷“半反应”与“反应”患者经ADP、AA诱导的血小板聚集百分率比较,差异均无统计学意义(P>0.05)。治疗后,氯吡格雷“半反应”患者经ADP、AA诱导的血小板聚集百分率虽较治疗前有所下降,但差异均无统计学意义(P>0.05);氯吡格雷“反应”患者经ADP、AA诱导的血小板聚集率均较治疗前显著降低,且显著低于氯吡格雷“半反应”患者,差异均有统计学意义(P<0.05),详见表4。
2.6 氯吡格雷“半反应”与“反应”患者基因型与等位基因频率比较
氯吡格雷“半反应”患者CYP2C19基因缺失(*2/*2或*2/*1基因型)的频率(72.8%)和*2等位基因的频率(43.2%)均显著高于氯吡格雷“反应”患者(34.6%和21.2%),差异均有统计学意义(P<0.05);氯吡格雷“半反应”患者PLA1/PLA2基因缺失(A2/A2或A1/A2基因型)的频率(38.3%)和A2等位基因的频率(21.6%)均显著高于氯吡格雷“反应”患者(15.4%和7.1%),差异均有统计学意义(P<0.05);而氯吡格雷“半反应”患者CYP3A5基因缺失(*3/*3或*3/*1基因型)和*3等位基因的频率虽略高于氯吡格雷“反应”患者,但差异均无统计学意义(P>0.05),详见表5。
表4 氯吡格雷“半反应”与“反应”患者血小板聚集百分率比较(±s,%%)Tab 4 Comparison of the percentage of platelet aggregation between clopidogrel“semi-response”and“response”patients(±s,%%)

表4 氯吡格雷“半反应”与“反应”患者血小板聚集百分率比较(±s,%%)Tab 4 Comparison of the percentage of platelet aggregation between clopidogrel“semi-response”and“response”patients(±s,%%)
注:与治疗前比较,*P<0.05;与“半反应”患者比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.“semi-response”patients,#P<0.05
反应类别“半反应”“反应”治疗后35.7±7.6 24.1±6.2*#n 81 78经ADP诱导的血小板聚集百分率治疗前47.4±13.2 45.8±12.2治疗后43.4±10.9 39.5±9.8*#经AA诱导的血小板聚集百分率治疗前37.4±11.6 36.2±10.8
2.7 不同基因型患者血小板聚集百分率比较
治疗前,各基因型患者经ADP、AA诱导的血小板聚集百分率比较,差异均无统计学意义(P>0.05)。治疗后,各基因型患者经ADP、AA诱导的血小板聚集百分率均较治疗前显著降低,但CYP2C19基因缺失型、CYP3A5基因缺失型患者的血小板聚集百分率均显著高于其基因表达型(*1/*1型),差异均有统计学意义(P<0.05),表明氯吡格雷对CYP2C19和CYP3A5基因缺失型患者血小板的抑制作用明显降低。PLA1/PLA2基因缺失型与其基因表达型(A1/A1基因型)患者经ADP、AA诱导的血小板聚集百分率比较,差异均无统计学意义(P>0.05),表明氯吡格雷对PLA1/PLA2各基因型患者血小板的抑制作用无明显差异,详见表6。
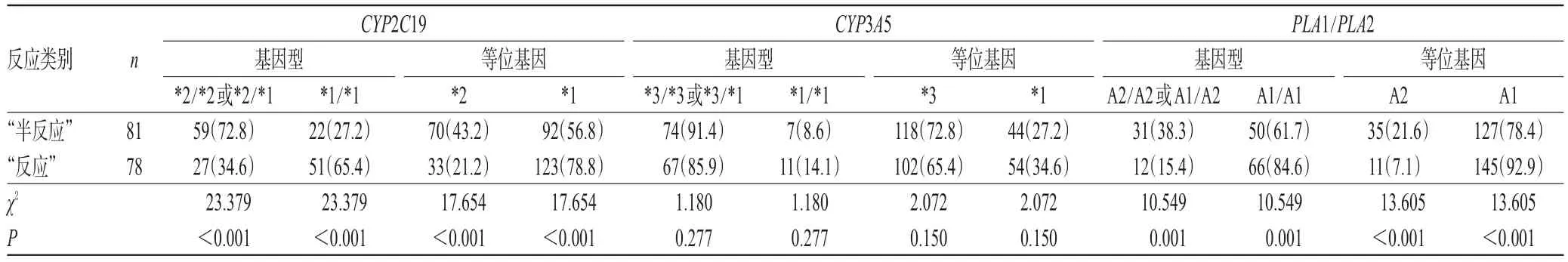
表5 氯吡格雷“半反应”与“反应”患者基因型与等位基因频率比较[例(%%)]Tab 5 Comparison of genotype and allele frequency between clopidogrel“semi-response”and“response”patients [case(%%)]
表6 不同基因型患者血小板聚集百分率比较(x± s,%%)Tab 6 Comparison of the percentage of platelet aggregation among patients with different genotypes(±s,%%)

表6 不同基因型患者血小板聚集百分率比较(x± s,%%)Tab 6 Comparison of the percentage of platelet aggregation among patients with different genotypes(±s,%%)
注:与治疗前比较,*P<0.05;与基因表达型比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.gene expression type,#P<0.05
基因分型CYP2C19 *2/*2或*2/*1 *1/*1 CYP3A5 *3/*3或*3/*1 *1/*1 PLA1/PLA2 A2/A2或A1/A2 A1/A1 n 经ADP诱导的血小板聚集百分率治疗前 治疗后经AA诱导的血小板聚集百分率治疗前 治疗后86 73 46.1±12.4 47.2±13.1 42.7±10.9*#40.1±9.9*37.6±11.7 36.0±10.3 33.5±8.2*#25.4±7.9*141 18 46.8±12.9 45.2±11.2 42.6±10.3*#32.5±8.7*36.9±11.4 35.8±9.2 31.7±8.3*#21.5±9.4*30.5±7.1*29.8±9.2*43 116 47.8±14.3 46.2±12.1 39.3±8.4*38.8±9.2*35.8±9.2 37.2±11.9
3 讨论
本研究主要评价了应用双联抗血小板治疗的CAD患者氯吡格雷“抵抗”的发生率,以及与患者基因型差异的相关性。在159例CAD患者中,有1.2%的患者发生氯吡格雷“抵抗”,而49.7%的患者为氯吡格雷“半抵抗”,与文献[10]有一定的差异。其原因可能是由于血小板聚集百分率的检测方法不一致、研究对象来自不同国家和种族等因素有关:Petterson AA等[6]采用血管舒张因子刺激酸磷蛋白血小板反应性指数(VASP-PRI)法测得的氯吡格雷抵抗率为29.0%,而采用VerifyNow抗血小板治疗检测仪测得的氯吡格雷抵抗率为31.6%。Neubauer H等[11]以欧洲CAD患者504例为对象,研究发现,30.8%的患者为氯吡格雷“半反应”。因此,氯吡格雷对不同患者的抗血小板作用是有所差异的[12]。
虽然对氯吡格雷“抵抗”的机制尚不完全清楚,但其可能受到多方面因素的影响。越来越多的证据表明,药动学变量(如肠道吸收、肝药酶代谢等)可影响患者对氯吡格雷的反应,而这些变量又会受转运体、代谢酶等相关基因多态性的影响。氯吡格雷口服后经十二指肠吸收,肝羧酸酯酶1(CES1)将进入体循环85%的药物代谢为无活性的酸性代谢产物,肝脏内CYP酶系则将剩余15%的氯吡格雷经过2步反应氧化代谢为活性代谢物,参与的代谢酶包括CYP2C9、CYP3A4/5、CYP2B6、CYP2C19和氧磷脂酶1(PON1)。本研究结果显示,CYP2C19*2等位基因在氯吡格雷“半反应”患者中的分布频率较高,为43.2%,而在氯吡格雷“反应”患者中仅为21.2%;氯吡格雷“半反应”患者中,*2/*2或*2/*1基因型频率为72.8%,显著高于氯吡格雷“反应”患者的34.6%,差异均有统计学意义(P<0.05),与Petterson AA等[6]的研究结果基本一致;此外,*2/*2或*2/*1基因型患者血小板聚集百分率显著高于*1/*1基因型患者,差异有统计学意义(P<0.05),提示CYP2C19基因多态性可能与氯吡格雷“半反应”相关。氯吡格雷“半反应”患者中CYP3A5*3/*3或*3/*1基因型频率为91.4%,而氯吡格雷“反应”患者的该基因型频率为85.9%,两者比较差异无统计学意义(P>0.05)。这一结果与Hokimoto S等[7]的研究结果类似,提示CYP3A5基因多态性可能与氯吡格雷“半反应”不相关。氯吡格雷“半反应”患者PLA1/ PLA2中A2/A2或A2/A1基因型频率为38.3%,显著高于氯吡格雷“反应”患者的15.4%,差异有统计学意义(P<0.05),提示PLA1/PLA2基因多态性可能与氯吡格雷“半反应”相关。目前,关于GPⅡb/Ⅲa基因多态性与氯吡格雷抵抗的相关机制的研究较少,常见的GPⅢa多态性是第1 565位点的氨基酸突变,即T1565C(Leu33Pro),编码Leu的基因即为PLA1,编码Pro的即为PLA2。有研究认为,纤维蛋白原结合活化的GPⅡb/Ⅲa是血小板聚集最后通路,若患者的GPⅡb/Ⅲa基因发生变异,则可能影响血小板的聚集、黏附,最终影响血栓的形成[6,8]。
综上所述,氯吡格雷“半反应”在CAD患者中发生率较高,CYP2C19、PLA1/PLA2基因多态性可能与氯吡格雷“半反应”有关,而CYP3A5基因多态性可能与之无关。CYP2C19、CYP3A5基因缺失可能会降低氯吡格雷对CAD患者血小板聚集的抑制作用。但由于本研究样本量较小,因此下一步还需要进行大样本量的多因素分析,以评价氯吡格雷“抵抗”与相关基因多态性的相关性。
[1] Cuisset T,Morange PE,Alessi MC.Recent advances in the pharmacogenetics of clopidogrel[J].Hum Genet,2012,131(5):653-664.
[2] Samoš M,Šimonová R,Kovář F,et al.Clopidogrel response in diabetic patient with acute myocardial infarction due to stent thrombosis[J].Am J Emerg Med,2014,32(5):461-465.
[3] Gasparyan AY.Aspirin and clopidogrel response:methodological challenges and opportunities[J].Vasc Health Risk Manag,2010,24(6):109-112.
[4] Kar R,Meena A,Yadav BK,et al.Clopidogrel response in North Indian patients of coronary artery disease and lack of its association with plateletb ADP receptors P2Y1 and P2Y12 gene polymorphisms[J].Platelets,2013,24(4):297-302.
[5] Karaźniewicz-Łada M,Danielak D,Główka F.Genetic and non-genetic factors affecting the response to clopidogrel therapy[J].Expert Opin Pharmacother,2012,13(5):663-683.
[6] Pettersen AA,Arnesen H,Opstad TB,et al.The influence of CYP2C19*2 polymorphism on platelet function testing during single antiplatelet treatment with clopidogrel[J]. Thromb J,2011,doi:10.1186/1477-9560-9-4.
[7]Hokimoto S,Chitose T,Mizobe M,et al.Impact of CYP3A5 polymorphism on platelet reactivity at percutaneous coronary intervention and after 9 months of aspirin and clopidogrel therapy in Japanese patients with coronary artery disease[J].Eur J Clin Pharmacol,2014,70(6):667-673.
[8] Floyd CN,Ferro A.The PlA1/A2 polymorphism of glycoproteinⅢa in relation to efficacy of antiplatelet drugs:a systematic review and meta-analysis[J].Br J Clin Pharmacol,2014,77(3):446-457.
[9] 刘芳,刘加春,王大明.症状性颈动脉和椎-基底动脉狭窄患者的阿司匹林和氯吡格雷抵抗现象[J].中国脑血管病杂志,2008,5(1):15-18.
[10] Angiolillo DJ,Fernandez-Ortiz A,Bernardo E,et al.Variability in individual responsiveness to clopidogrel:clinical implications,management,and future perspectives[J]. J Am Coll Cardiol,2007,49(14):1505-1516.
[11] Neubauer H,Kaiser AF,Endres HG,et al.Tailored antiplatelet therapy can overcome clopidogrel and aspirin response the BOchum Clopidogrel and Aspirin Plan(BOCLA-Plan)to improve antiplatelet therapy[J].BMC Med,2011,doi:10.1186/1741-7015-9-3.
[12] Mostowik M,Siniarski A,Gołębiowska-Wiatrak R,et al. Prolonged CRP increase after percutaneous coronary intervention is associated with high thrombin concentrations and low platelet’response to clopidogrel in patients with stable angina[J].Adv Clin Exp Med,2015,24(6):979-985.
(编辑:张元媛)
Study on Difference of Genotypes of Patients with Coronary Artery Disease and Different Responses to Clopidogrel
ZENG Anning,XIONG Degao,SHI Jian,YU Jixi,CHEN Rongxing,CAI Bingbing(Dept.of Cardiology,Qiannan Prefecture People’s Hospital,Guizhou Duyun 558000,China)
OBJECTIVE:To explore the difference of genotypes in patients with coronary artery disease(CAD)and different responses to clopidogrel.METHODS:Totally 159 CAD patients were selected from cardiology department of our hospital during Mar.2013-Nov.2015.They were given clopidogrel+aspirin for dual antiplatelet therapy for at least 1 year.Turbidimetry method was used to detect the percentage of platelet aggregation induced by adenosine diphosphate(ADP)and arachidonic acid(AA)before and after treatment.The polymorphism of cytochrome P450(CYP)2C19,CYP3A5,wild type leucine 33 allele(PLA1)/proline 33 allele(PLA2)were detected by PCR-RFLP.RESULTS:There were 3 kinds of CYP2C19 genotypes(*2/*2,*2/*1,*1/*1),3 kinds of CYP3A5 genotypes(*3/*3,*3/*1,*1/*1)and 3 kinds of PLA1/PLA2 genotypes(A1/A2,A2/A2,A1/A1);the frequency of each genotype was in line with Hardy-Weinberg balance(P>0.05).Among 159 cases,there were 81 cases of clopidogrel“semi-response”,accounting for 50.9%;78 cases of clopidogrel“response”,accounting for 49.1%.The frequencies of CYP2C19 gene deletion(*2/*2 or*2/*1 genotype)and*2 allele in clopidogrel“semi-response”patients were significantly higher than clopidogrel“response”patients,with statistical significance(P<0.05).The frequencies of PLA1/PLA2 gene deletion(A2/A2 or A1/A2 genotype)and A2 allele in clopidogrel“semi-response”patients were significantly higher than clopidogrel“response”patients,with statistical significance(P<0.05).The frequencies of CYP3A5 gene deletion(*3/*3 or*3/*1 genotype)and*3 allele in clopidogrel“semi-response”patients were slightly higher than clopidogrel“response”patients,without statistical significance(P>0.05).After treatment,the percentage of ADP or AA-induced platelet aggregation in different genotypes patients were significantly lowered,compared to before treatment;but the percentage of platelet aggregation in CYP2C19 gene deletion and CYP3A5 gene deletion patients were significantly higher than gene expression patients(*1/*1 genotype),with statistical significance(P<0.05).There was no statistical significance in the percentage of platelet aggregation between PLA1/PLA2 gene deletion patients and gene expression patients(P>0.05).CONCLUSIONS:The incidence of clopidogrel“semi-response”in CAD patients is high.CYP2C19 and PLA1/PLA2 gene polymorphism may be related to clopidogrel“semi-response”,while CYP3A5 gene polymorphism has no relationship with it.CYP2C19 and CYP3A5 gene deletion may weaken inhibitory effects of clopidogrel on platelet aggregation ofCAD patients.
CYP2C19;CYP3A5;PLA1/PLA2;Gene polymorphisms;Clopidogrel;Resistance
R543.3
A
1001-0408(2017)11-1448-05
2016-11-01
2017-02-16)
*副主任医师。研究方向:心血管介入。电话:0854-8261152。E-mail:zanndj@163.com
#通信作者:主任医师。研究方向:心血管介入。电话:0854-8261152。E-mail:zangzqn@sina.com
DOI10.6039/j.issn.1001-0408.2017.11.03
