注射用脂溶性维生素(Ⅱ)/水溶性维生素与常用电解质配伍的稳定性考察
2017-04-28李相成刘丽洁青岛大学附属医院药学部山东青岛266003
范 静,李相成,李 飞,潘 东,刘丽洁,李 静,孙 伟(青岛大学附属医院药学部,山东青岛 266003)
注射用脂溶性维生素(Ⅱ)/水溶性维生素与常用电解质配伍的稳定性考察
范 静*,李相成,李 飞,潘 东,刘丽洁,李 静,孙 伟#(青岛大学附属医院药学部,山东青岛 266003)
目的:考察注射用脂溶性维生素(Ⅱ)/水溶性维生素与常用电解质的配伍稳定性。方法:参考临床常用剂量,取注射用脂溶性维生素(Ⅱ)/水溶性维生素组合包装[含注射用脂溶性维生素(Ⅱ)2瓶和注射用水溶性维生素1瓶]分别与葡萄糖注射液、氯化钾注射液、浓氯化钠注射液、碳酸氢钠注射液、门冬氨酸钾注射液、门冬氨酸钾镁注射液、甘油磷酸钠注射液、多种微量元素注射液(Ⅱ)配伍,得配伍液A~H。在室温(25℃)下,分别于0、1、2、3、4 h时考察各配伍液的外观、pH值、渗透压摩尔浓度和不溶性微粒数,并于0、4 h时检查其细菌内毒素含量。结果:配制后4 h内,各配伍液外观无明显变化;配伍液H的pH值变化较大(RSD=5.13%,n=5),配伍液D和配伍液G的pH值明显升高;各配伍液的渗透压摩尔浓度均无明显变化(RSD<2%,n=5),且小于600 mOsmol/kg;各配伍液细菌内毒素检查结果均为阴性。配制后2、4 h时,配伍液B中≥10 μm的微粒数明显增加;配制后2、3、4 h时,配伍液E、F、H中≥10 μm的微粒数明显增加;配制后0、1、2、3、4 h时,配伍液G中≥10 μm的微粒数明显增加;上述配伍液中≥10 μm的微粒数与同时间点的配伍液A比较,差异均有统计学意义(P<0.05),但均符合2015年版药典标准。配制后1、2、3、4 h时,配伍液D中≥10 μm的微粒数明显增加,与同时间点的配伍液A比较,差异均有统计学意义(P<0.05);且配制后2、3、4 h时≥10 μm的微粒数均超出药典规定范围。配制后4 h内,配伍液C中≥10 μm的微粒数和各配伍液中≥25 μm的微粒数均无明显变化,且符合药典标准。结论:由于pH值和不溶性微粒数变化较大,注射用脂溶性维生素(Ⅱ)/水溶性维生素不宜与多种微量元素注射液(Ⅱ)、甘油磷酸钠注射液或碳酸氢钠注射液配伍使用。
注射用脂溶性维生素(Ⅱ);注射用水溶性维生素;电解质;配伍;稳定性
维生素是机体有效利用葡萄糖、脂肪酸进行供能及合成蛋白质的基础,其体内不能自行合成或合成量极微。虽然人体所需量甚微,但维生素不足会导致多种复杂问题的发生[1]。在临床上,围术期有营养风险或存在营养不良、危重症、烧伤和炎性肠病等患者都需要通过静脉输液补充维生素[2-6]。同时,在对临床医嘱进行观察时还发现,患者经常需要同时静脉补充维生素和电解质。为方便临床工作、减少输液次数,医师处方常将含钠、钾和镁离子等强电解质的药品与各种注射用复方维生素混合于同一静脉输液袋中进行滴注。强电解质的加入可产生同离子效应、盐析和电位中和等作用,从而可能降低其有机酸盐和有机碱盐等成分的溶解度,导致不溶性微粒增加;此外,各种注射用复方维生素的药品说明书也并未明确规定其可否与各种强电解质配伍使用。因此,为了临床能够更加安全、有效地使用注射用复方维生素,笔者选择维生素所含种类较多的注射用脂溶性维生素(Ⅱ)/水溶性维生素为研究对象,从外观、pH值、渗透压摩尔浓度、不溶性微粒和内毒素等多个方面考察其与常用电解质的配伍稳定性,现报道如下。
1 材料
1.1 仪器
GWF-5JA型微粒分析仪、SMC-30C型渗透压摩尔浓度测定仪(天河医疗仪器有限公司);BSC-1300ⅡA2型生物安全柜(昆明苏净科技有限公司);pHS-3C型pH计(上海仪电科学仪器股份有限公司)。
1.2 药品与试剂
注射用脂溶性维生素(Ⅱ)/水溶性维生素组合包装[复方制剂,成都天台山制药有限公司,批号:150116,含注射用脂溶性维生素(Ⅱ)2瓶(批准文号:国药准字H20052572,规格:每瓶含维生素A 445.0~595.0 μg、维生素D22.25~3.00 μg、维生素E 4.10~5.00 mg和维生素K167.5~90.0 μg)和注射用水溶性维生素1瓶(批准文号:国药准字H20059032)];2种规格的葡萄糖注射液(华仁药业股份有限公司,批准文号分别为国药准字H20023196、国 药 准 字 H20023198,批 号 分 别 为H1510018、Q1510009,规格分别为250 mL∶12.5 g、500 mL∶25 g);氯化钾注射液(中国大冢制药有限公司,批准文号:国药准字H20053710,批号:4K92K2,规格:10 mL∶1.0 g);浓氯化钠注射液(国药集团容生制药股份有限公司,批准文号:国药准字H20013006,批号:1507612-A11,规格:10 mL∶1 g);碳酸氢钠注射液[华润双鹤利民药业(济南)有限公司,批准文号:国药准字H20044251,批号:14120564-1,规格:10 mL∶0.5 g];门冬氨酸钾注射液(辽宁药联制药有限公司,批准文号:国药准字H20110032,批号:150414,规格:10 mL∶1.712 g);门冬氨酸钾镁注射液(匈牙利Gedeon Richter Plc.,注册证号:H20130590,批号:A46004A,规格:10 mL∶400 mg无水门冬氨酸镁和452 mg无水门冬氨酸钾);甘油磷酸钠注射液(批准文号:国药准字H10950042,批号:80IH560,规格:10 mL∶2.16 g)和多种微量元素注射液(Ⅱ)(批准文号:国药准字H32023907,批号:80IH541,规格:10 mL)均购自华瑞制药有限公司;鲎试剂(批号:1508192)、细菌内毒素工作标准品(批号:1509090)和细菌内毒素检测用水(批号:1510230)均由湛江安度斯生物有限公司提供。
2 方法
2.1 配伍液的配制
在静脉用药调配中心(PIVAS)万级洁净度环境、百级洁净度生物安全柜中,由护理人员按照无菌操作规程进行配制。
2.1.1 注射用脂溶性维生素(Ⅱ)/水溶性维生素的溶解
将组合包装的注射用脂溶性维生素(Ⅱ)(2瓶)和注射用水溶性维生素(1瓶)分别经注射用水2、10 mL溶解后,充分混匀,得药液1。
2.1.2 葡萄糖配伍液和常用电解质配伍液的配制 将药液1加至葡萄糖注射液250 mL中,混合均匀,得配伍液A;将药液1加至葡萄糖注射液250 mL中,混合均匀,加入氯化钾注射液7.5 mL,再次混匀,得配伍液B;其他配伍液(C~H)均按上述方法配制。各配伍液平行配制5份。配伍液组成见表1。

表1 配伍液组成Tab 1 The composition of mixture
2.2 外观、pH值、渗透压摩尔浓度、不溶性微粒和内毒素的检查
在室温(25℃)下,观察并记录配制后4 h内各配伍液的外观是否变化,并于0、1、2、3、4 h时使用pH计和渗透压摩尔浓度测定仪分别测定其pH值和渗透压摩尔浓度(各配伍液重复测定3次)[7]。使用微粒分析仪、参照2015年版《中国药典》(四部)通则中“不溶性微粒检测法”,采用光阻法[7]检查上述各时间点各配伍液中的不溶性微粒数(各配伍液重复测定3次)。参照2015年版《中国药典》(四部)通则中“细菌内毒素检测法”,采用凝胶法[7]分别于0、4 h检查各配伍液的细菌内毒素含量。上述试验均在生物安全柜中操作。
2.3 判断标准
2.3.1 渗透压摩尔浓度 人体血液的正常渗透压摩尔浓度为285~310 mOsmol/kg,外周静脉输注总渗透压摩尔浓度不宜超过600 mOsmol/kg[8]。
2.3.2 不溶性微粒 按照2015年版《中国药典》要求(光阻法检查),标示装量为100 mL及以上的静脉用注射液除另有规定外,每1 mL中含10 μm及10 μm以上(≥10 μm)的微粒数不得过超25粒,含25 μm及25 μm以上(≥25 μm)的微粒数不得超过3粒[7]。
2.3.3 内毒素 各配伍液中细菌内毒素含量应以0.5 EU/mL为限[9]。
2.4 统计学方法
应用SPSS 17.0软件对数据进行统计分析。计量资料以±s表示,组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
3 结果
3.1 外观检查结果
在室温(25℃)条件下,4 h内各配伍液均澄清透明,且无颜色变化,无沉淀和气体产生,无结晶析出。
3.2 pH值的测定结果
配制后4 h内,配伍液H的pH值变化相对较大(RSD=5.13%,n=5);配伍液D和配伍液G的pH值较配伍前明显升高,但配伍后4 h内并无明显变化(RSD<1%,n=5);其他配伍液pH值为6.3~6.8,4 h内无明显变化(RSD<1%,n=5),详见表2。

表2 配伍液pH值测定结果Tab 2 The pH value of mixture
3.3 渗透压摩尔浓度的测定结果
配制后4 h内,各配伍液的渗透压摩尔浓度均未见明显变化,且小于600 mOsmol/kg(RSD<2%),详见表3。

表3 配伍液渗透压摩尔浓度的测定结果(n=3)Tab 3 The osmotic pressure molar concentration of mixture(n=3)
3.4 不溶性微粒的检查结果
各配伍液中不溶性微粒的检查结果见表4。
由表4可见,配制后2、4 h时,配伍液B中≥10 μm的微粒数明显增加,与同时间点的配伍液A比较,差异均有统计学意义(P<0.05);配制后2、3、4 h时,配伍液E、F、H中≥10 μm的微粒数明显增加,与同时间点的配伍液A比较,差异均有统计学意义(P<0.05);配制后0、1、2、3、4 h时,配伍液G中≥10 μm的微粒数明显增加,与同时间点的配伍液A比较,差异均有统计学意义(P<0.05);配制后4 h内,配伍液C中≥10 μm的微粒数无明显变化,与同时间点的配伍液A比较,差异均无统计学意义(P>0.05)。上述配伍液中≥10 μm的微粒数均符合2015年版的药典标准。
配制后1、2、3、4 h时,配伍液D中≥10 μm的微粒数明显增加,与同时间点的配伍液A比较,差异均有统计学意义(P<0.05);且配制后2、3、4 h时,≥10 μm的微粒数超出2015年版药典规定的范围。
配制后4 h内,各配伍液中≥25 μm的微粒数无明显变化,且均符合2015年版的药典标准。
表4 配伍液中不溶性微粒的检查结果(±s,n=3,粒/mL)Tab 4 The insoluble particles of mixture(±s,n=3,grain/mL)
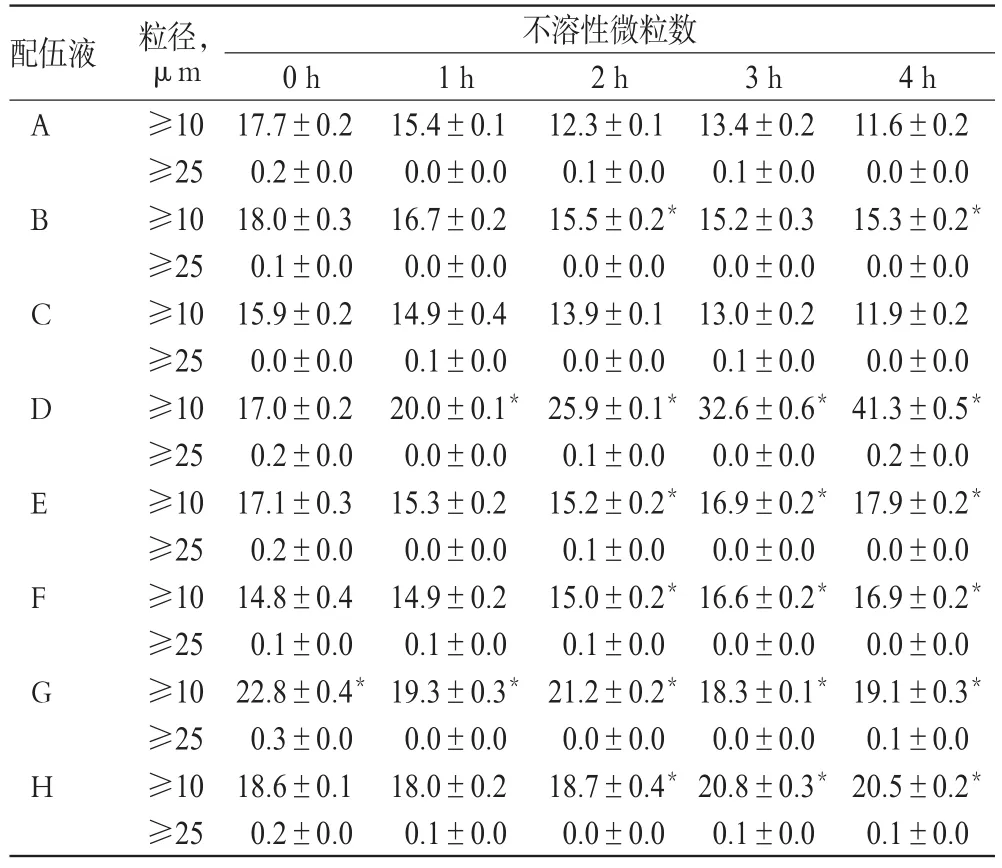
表4 配伍液中不溶性微粒的检查结果(±s,n=3,粒/mL)Tab 4 The insoluble particles of mixture(±s,n=3,grain/mL)
注:与同时间点配伍液A比较,*P<0.05Note:vs.mixtureAat the same time point,*P<0.05
配伍液 不溶性微粒数A B C D E F G H 4 h 11.6±0.2 0.0±0.0 15.3±0.2*0.0±0.0 11.9±0.2 0.0±0.0 41.3±0.5*0.2±0.0 17.9±0.2*0.0±0.0 16.9±0.2*0.0±0.0 19.1±0.3*0.1±0.0 20.5±0.2*0.1±0.0粒径,μm≥10≥25≥10≥25≥10≥25≥10≥25≥10≥25≥10≥25≥10≥25≥10≥25 0 h 17.7±0.2 0.2±0.0 18.0±0.3 0.1±0.0 15.9±0.2 0.0±0.0 17.0±0.2 0.2±0.0 17.1±0.3 0.2±0.0 14.8±0.4 0.1±0.0 22.8±0.4*0.3±0.0 18.6±0.1 0.2±0.0 1 h 15.4±0.1 0.0±0.0 16.7±0.2 0.0±0.0 14.9±0.4 0.1±0.0 20.0±0.1*0.0±0.0 15.3±0.2 0.0±0.0 14.9±0.2 0.1±0.0 19.3±0.3*0.0±0.0 18.0±0.2 0.1±0.0 2 h 12.3±0.1 0.1±0.0 15.5±0.2*0.0±0.0 13.9±0.1 0.0±0.0 25.9±0.1*0.1±0.0 15.2±0.2*0.1±0.0 15.0±0.2*0.1±0.0 21.2±0.2*0.0±0.0 18.7±0.4*0.0±0.0 3 h 13.4±0.2 0.1±0.0 15.2±0.3 0.0±0.0 13.0±0.2 0.1±0.0 32.6±0.6*0.0±0.0 16.9±0.2*0.0±0.0 16.6±0.2*0.0±0.0 18.3±0.1*0.0±0.0 20.8±0.3*0.1±0.0
3.5 内毒素检查结果
配制后0、4 h时,各配伍液内毒素检查结果显示均为阴性。
4 讨论
由于该复方制剂中含有维生素C等稳定性较差的维生素,无法长期放置,故为保证治疗效果,临床上一般应在4 h内完成输注[10]。因此,本研究考察了注射用脂溶性维生素(Ⅱ)/水溶性维生素与常用电解质配伍后4 h内的外观、pH值、渗透压摩尔浓度、不溶性微粒数和内毒素等稳定性指标。通过临床调研发现,注射用脂溶性维生素(Ⅱ)/水溶性维生素常与浓氯化钠、氯化钾、碳酸氢钠、门冬氨酸钾、门冬氨酸钾镁和多种微量元素等电解质配伍使用,故本研究以上述注射液为溶剂,参考临床常用剂量,考察各配伍液的稳定性。此外,按照该组合包装药品说明书要求,氯化钾浓度一般要求不得高于0.3%(即250 mL静脉输液中最多加入10%氯化钾注射液7.5 mL)。
本研究结果显示,配制后4 h内,各配伍液的外观和渗透压摩尔浓度均无明显变化,内毒素检查结果均为阴性。碳酸氢钠和甘油磷酸钠注射液由于自身pH值较高,与注射用脂溶性维生素(Ⅱ)/水溶性维生素配伍后,配伍液D、G的pH值较配伍前明显升高,但配伍后4 h内无明显变化(RSD<1%,n=5)。注射用脂溶性维生素(Ⅱ)/水溶性维生素与多种微量元素注射液(Ⅱ)配伍后,pH值变化相对较大(RSD=5.13%,n=5)。其原因可能为:多种微量元素具有较强酸性(pH=3),且含有铬、铜、锰、钼、氟、碘和硒等多种微量元素;同时,注射用脂溶性维生素(Ⅱ)/水溶性维生素中含有还原性物质,可与多种微量元素注射液中的成分发生氧化还原反应,使得两者配伍后pH值发生变化。值得注意的是,多种微量元素注射液(Ⅱ)的药品说明书明确规定,该药不能与其他药品配伍,但临床仍会在同一肠外营养液中使用这2种药品[11]。本研究结果进一步提示,注射用脂溶性维生素(Ⅱ)/水溶性维生素不宜与多种微量元素注射液(Ⅱ)配伍使用。
不溶性微粒检查结果显示,注射用脂溶性维生素(Ⅱ)/水溶性维生素与碳酸氢钠注射液配伍后1~4 h内,≥10 μm的微粒数明显增加,且配伍后2~4 h内≥10 μm的微粒数超出了药典规定范围,提示两者不宜配伍使用。注射用脂溶性维生素(Ⅱ)/水溶性维生素与氯化钾、门冬氨酸钾、门冬氨酸钾镁、甘油磷酸钠和多种微粒元素注射液(Ⅱ)配伍液后,≥10 μm的微粒数虽有不同程度的变化,但均符合药典标准。这可能是由于随着放置时间的延长,水对不溶性微粒的渗透、膨胀等作用,使其溶解;而电解质的加入阻碍了此过程,使配伍液中的不溶性微粒数发生了变化。该组合包装中的脂溶性维生素在葡萄糖注射液中的溶解度较低,辅料中含有聚山梨酯80作为其增溶剂。碳酸氢钠和甘油磷酸钠注射液的加入显著增高了配伍液的pH值,造成了聚山梨酯80的碱水解,降低了脂溶性维生素的溶解度[12],这有可能是导致配伍液D和配伍液G不溶性微粒数增加的原因。
静脉输液配制过程中不溶性微粒的污染可能受环境、不可见玻璃屑、一次性耗材、无菌粉末(抗菌药物)或中药注射剂配伍、多种药品配伍、放置时间不当等因素的影响[13-15]。在规范化管理前,静脉输液的配制多在治疗室等非洁净区域完成,由于环境中微粒数量多,每次调配过程都会增加静脉输液中的不溶性微粒数[16-18]。操作过程中引入的不溶性微粒干扰了静脉输液药品配伍稳定性的研究。而本研究中,各配伍液的配制均在PIVAS洁净工作区域内进行,保证了环境的洁净度、湿度和温度等条件,有效降低或排除了环境和调配过程对配伍液中不溶性微粒数的影响。
本研究首次在洁净环境中对注射用脂溶性维生素(Ⅱ)/水溶性维生素与常用电解质的配伍稳定性进行了考察。结果显示,注射用脂溶性维生素(Ⅱ)/水溶性维生素不宜与多种微量元素或碳酸氢钠配伍使用;与甘油酸钠的配伍液中不溶性微粒数虽未超过药典标准,但有大幅增加,且配伍后pH值明显升高,故也不建议临床配伍使用;尚未发现其与氯化钾注射液、氯化钠注射液、门冬氨酸钾注射液和门冬氨酸钾镁注射液存在配伍禁忌。由于本研究仅对各配伍液的外观、pH值、渗透压摩尔浓度、不溶性微粒和内毒素进行了测定,而未对相关化学成分的含量变化进行研究,故注射用脂溶性维生素(Ⅱ)/水溶性维生素与上述注射液的配伍稳定性还有待进一步确证。
[1] 刘艳波.大剂量维生素C在改善重症感染患者器官损害中的临床效果分析[J].现代养生,2016(12):34.
[2] Braga M,Ljungqvist O,Soeters P,et al.ESPEN guidelines on parenteral nutrition:surgery[J].Clin Nutr,2009,28(4):378-386.
[3] RousseauAF,LosserMR,IchaiC,et al.ESPEN endorsed recommendations:nutritional therapy in major burns[J]. Clin Nutr,2013,32(4):497-502.
[4] 中华医学会.维生素矿物质补充剂在炎症性肠病防治中的临床应用:专家共识[J].中华临床营养杂志,2013,21(4):252-256.
[5] 贾鑫磊,钱素云,曾健生,等.危重症患儿血清维生素A水平变化及意义[J].山东医药,2016,56(20):36-38.
[6] Gaby AR.Nutritional treatments for acute myocardial infarction[J].Altern Med Rev,2010,15(2):113-123.
[7] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:77-78、114-115、154-157.
[8] 钟华荪,张振路.静脉输液治疗护理学[M].3版.北京:人民军医出版社,2014:4、71-72、379.
[9] 梁光荣,唐巧金,刘莉萍,等.注射用水溶性维生素在输液中及与常用药物配伍的稳定性考察[J].中国药房,2010,21(26):2456-2458.
[10] 姜文清,金鹏飞,朱峰,等.HPLC同时测定多维元素片中维生素B1、维生素C、维生素B6和烟酰胺的含量[J].中国药学杂志,2011,46(14):1122-1125.
[11] 徐丽华,卞晓洁.安达美在不同溶液中的稳定性研究[J].护理学杂志,2010,25(13):90-92.
[12] Hewitt D,Alvarez M,Robinson K,et al.Mixed-mode and reversed-phase liquid chromatography-tandem mass spectrometry methodologies to study composition and base hydrolysis of polysorbate 20 and 80[J].J Chromatogr A,2011,1218(15):2138-2145.
[13] 盛巧云.静脉炎的相关因素和临床干预[J].大家健康(学术版),2016,10(3):290-291.
[14] 王冰,张梅英.防范静脉输液中不溶性微粒危害的研究进展[J].上海护理,2009,9(1):63-66.
[15] 侯鹏高,吕长淮.静脉输液不溶性微粒污染途径及控制方法研究进展[J].医学信息,2011,24(9):1236-1237.
[16] 徐学君,徐德琴,汪滢,等.加药环境与加药器具对输液不溶性微粒污染的影响[J].中国药事,2007,21(11):888-890.
[17] 刘兴,李世东.静脉输液调配中心环境与自然环境输液调配后不溶性微粒数量对比研究[J].药学研究,2014,33(3):176-178.
[18] 陈秋云,何锦文,黄赛玲.不同静脉药物配置环境药液质量的对比研究[J].海峡药学,2010,22(1):30-32.
(编辑:张元媛)
Compatibility Stability Investigation of Fat-soluble Vitamin(Ⅱ)/Water-soluble Vitamin for Injection with Common Electrolytes
FAN Jing,LI Xiangcheng,LI Fei,PAN Dong,LIU Lijie,LI Jing,SUN Wei(Dept.of Pharmacy,the Affiliated Hospital of Qingdao University,Shandong Qingdao 266003,China)
OBJECTIVE:To investigate the compatibility stability of Fat-soluble vitamin(Ⅱ)/Water-soluble vitamin for injection with common electrolytes.METHODS:Referring to clinical common dose,Fat-soluble vitamin(Ⅱ)for injection/Water-soluble vitamin for injection collective packing[containing Fat-soluble vitamin(Ⅱ)for injection 2 ampoules and Water-soluble for injection 1 ampoule]were respectively mixed with Glucose injection,Potassium chloride injection,Concentrated sodium chloride injection,Sodium bicarbonate injection,Potassium aspartate injection,Potassium aspartate and magnesium aspartate injection,Sodium glycerophosphate injection,Multi-trace elements injection(Ⅱ)to obtain mixture A-H.At room temperature(25℃),these mixtures were investigated in terms of appearance,pH value,osmotic pressure molar concentration and the number of insoluble particles at 0,1,2,3,4 h.The contents of bacterial endotoxin were tested at 0,4 h.RESULTS:Within 4 h after mixing,there was no significant change in appearance of those mixtures;pH value of mixture H changed greatly(RSD=5.13%,n=5),and that of mixture D and G increased significantly.The osmotic pressure molar concentration of those mixtures had no significantly change(RSD<2%,n=5)and lower than 600 mOsmol/kg.The bacterial endotoxin tests of those mixtures were negative.Two and four hours after mixing,the number of insoluble particles≥10 μm in mixture B was increased significantly;2,3,4 h after mixing,the number of insoluble particles≥10 μm in mixture E,F,H were increased significantly;0,1,2,3,4 h after mixing,the number of insoluble particles≥10 μm in mixture G was increased significantly.There was statistical significance in the number of insoluble particle≥10 μm in above mixtures compared to mixture A at the same time point(P<0.05),but it was in line with the standard of 2015 pharmacopeia.One,two,three and four hours after mixing,the number of insoluble particle≥10 μm in mixture D was increased significantly,there was statistical significance compared to mixture A at the same time point(P<0.05);the number of insoluble particle≥10 μm in mixture D was beyond prescribed scope of pharmacopeia at 2,3,4 h after mixing.Within 4 h after mixing,both the number of insoluble particle≥10 μm in mixture C and the number of insoluble particle≥25 μm in edch mixture had no significant change,in accordance with pharmacopeia standard.CONCLUSIONS:Fat-soluble vitamin(Ⅱ)/Water-soluble vitamin for injection is not suitable for mixing with Multi-trace elements injection(Ⅱ),Sodium glycerophosphate injection or Sodium bicarbonate injection due to great change of pH value and the number of insoluble particles.
Fat-soluble vitamin for injection(Ⅱ);Water-soluble vitamin for injection;Electrolyte;Compatibility;Stability
R969.3
A
1001-0408(2017)11-1478-05
2016-04-06
2017-02-11)
*副主任护师。研究方向:静脉用药调配。电话:0532-82911729。E-mail:1977324276@qq.com
#通信作者:主任药师。研究方向:医院药学。电话:0532-82911599。E-mail:sunwei266@medmail.com.cn
DOI10.6039/j.issn.1001-0408.2017.11.11
