肝动脉化疗栓塞术后应用奥沙利铂联合替吉奥治疗晚期原发性肝癌的临床观察
2017-04-28王海存王萌萌郑州市第三人民医院肿瘤内科郑州450099
王海存,王萌萌,曹 旸(郑州市第三人民医院肿瘤内科,郑州 450099)
肝动脉化疗栓塞术后应用奥沙利铂联合替吉奥治疗晚期原发性肝癌的临床观察
王海存*,王萌萌,曹 旸(郑州市第三人民医院肿瘤内科,郑州 450099)
目的:观察肝动脉化疗栓塞术后应用奥沙利铂联合替吉奥治疗晚期原发性肝癌的疗效和安全性。方法:选取我院2011年4月-2013年4月的晚期原发性肝癌患者120例,按照随机数字表法分为对照组和观察组,各60例。两组患者均行肝动脉化疗栓塞术。对照组患者术后给予奥沙利铂注射液0.08 g/m2,经导管动脉泵注,4 h内泵注完毕;观察组患者在对照组基础上给予替吉奥胶囊40 mg/m2,po,bid。两组患者均治疗4个月。观察两组患者临床疗效、肝功能指标[丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)和直接胆红素(DBIL)]和甲胎蛋白(AFP)水平,记录治疗过程中不良反应发生情况以及随访1、2、3年的生存率。结果:治疗前,两组患者肝功能指标、AFP水平比较,差异均无统计学意义(P>0.05)。治疗后,观察组患者的疾病控制率(78.33%)和临床受益率(93.33%)均明显高于对照组(48.33%和71.67%),差异均有统计学意义(P<0.05);两组患者ALT、AST、TBIL和DBIL水平均明显升高,但观察组明显低于对照组,差异均有统计学意义(P<0.05);两组患者AFP水平明显降低,且观察组明显低于对照组,差异均有统计学意义(P<0.05)。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。观察组患者随访1、2、3年的生存率均明显高于对照组,差异均有统计学意义(P<0.05)。结论:肝动脉化疗栓塞术后应用奥沙利铂联合替吉奥治疗晚期原发性肝癌患者疗效较好,且安全性好。
联合化疗;肝动脉化疗栓塞术;原发性肝癌;替吉奥;奥沙利铂;疗效
原发性肝癌是我国常见的恶性肿瘤,其发病率居恶性肿瘤第5位,病死率居第1位[1]。原发性肝癌早期症状较为隐匿,约60%~80%的患者初诊时已失去手术机会。晚期原发性肝癌患者动脉化疗栓塞术后的中位生存时间较常规化疗可延长3~5个月[2],但是,动脉化疗栓塞术的疗效个体差异较大,在消除肿瘤病灶和控制病情进展方面仍不能满足临床需求[3]。原发性肝癌患者动脉化疗栓塞术后辅助化疗逐渐得到临床认可,但具体化疗方案尚无指南进行推荐。本研究观察了肝动脉化疗栓塞术后应用奥沙利铂联合替吉奥治疗晚期原发性肝癌的疗效和安全性,以其为临床用药提供参考。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)符合《原发性肝癌规范化诊治的专家共识》诊断标准[4]者;(2)符合《2010年美国肝病年会(AASLD)肝细胞癌诊疗指南》中无法行手术切除的患者[5];(3)Karnofsky(KPS)评分≥70分;(4)预测生存时间>3个月;(5)年龄为40~70岁。
排除标准:(1)接受过放化疗者;(2)丙氨酸转氨酶(ALT)>80 U/L,且无法改善者;(3)严重感染且无法控制者;(4)肝外转移者;(5)合并其他系统恶性肿瘤者;(6)存在动脉栓塞术禁忌证者;(7)临床资料不全者。
1.2 研究对象
选取我院2011年4月-2013年4月的晚期原发性肝癌患者120例,按照随机数字法分为对照组和观察组,各60例。两组患者的一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究方案经医院医学伦理委员会审核通过,患者均知情同意并签署知情同意书。
1.3 治疗方法
两组患者均行肝动脉化疗栓塞术,经右侧股动脉穿刺插管至肠系膜上动脉,造影观察有无门静脉狭窄或阻塞,判断瘤栓形成情况。通过腹腔动脉造影明确肿瘤供血动脉情况和肿瘤的大小、位置、数量和染色情况,选择肿瘤供血动脉行化疗药物灌注,染色明显肿瘤组织采用碘化油进行栓塞。化疗药物方案为氟尿嘧啶注射液(沈阳药大雷允上药业有限责任公司,批准文号:国药准字H21021858,规格:10 mL∶0.25 g)0.5 mg/m2+注射用盐酸表柔比星[辉瑞制药(无锡)有限公司,批准文号:国药准字H20000496,规格:10 mg]40 mg/m2。对照组患者术后给予奥沙利铂注射液(江苏恒瑞医药股份有限公司,批准文号:国药准字H20050962,规格:100 mL∶0.1 g)0.08 g/m2,经导管动脉泵注,4 h内泵注完毕;观察组患者在对照组基础上给予替吉奥胶囊(齐鲁制药有限公司,批准文号:国药准字H20100150,规格:每粒含替加氟20 mg、吉美嘧啶5.8 mg与奥替拉西钾19.6 mg)40 mg/m2, po,bid(餐后),连用14 d后停药7 d再进行下一疗程。两组患者均治疗4个月。
1.4 观察指标及疗效评价标准
(1)观察两组患者临床疗效。疗效评价标准[5]——完全缓解(CR):肿瘤病灶消失并维持4周以上;部分缓解(PR):肿瘤病灶缩小≥50%但未消失,并维持4周以上;稳定(SD):肿瘤病灶缩小<50%或增大≤25%;进展(PD):肿瘤病灶增大>25%或出现新病灶。疾病控制率=(CR例数+PR例数)/总例数×100%;临床受益率=(CR例数+ PR例数+SD例数)/总例数×100%。(2)测定两组患者治疗前后肝功能指标[ALT、天冬氨酸转氨酶(AST)、总胆红素(TBIL)和直接胆红素(DBIL)]和甲胎蛋白(AFP)水平。分别于术前和术后3个月抽取患者空腹静脉血检测,检测仪器采用美国Beckman Coulter公司AU5800全自动生化分析仪。(3)记录两组患者治疗过程中不良反应发生情况。(4)随访3年,记录两组患者术后随访1、2、3年的生存率。
1.5 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料以例数或率表示,采用χ2检验;等级资料采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
观察组患者的疾病控制率(78.33%)和临床受益率(93.33%)均明显高于对照组(48.33%和71.67%),差异均有统计学意义(P<0.05),详见表2。

表2 两组患者临床疗效比较Tab 2 Comparison of clinical efficacies between 2 groups
2.2 两组患者治疗前后肝功能指标比较
治疗前,两组患者ALT、AST、TBIL和DBIL水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者上述指标水平均明显升高,但观察组明显低于对照组,差异均有统计学意义(P<0.05)。两组患者治疗前后肝功能指标比较见表3。
表3 两组患者治疗前后肝功能指标比较(±s)Tab 3 Comparison of liver function indexes between 2 groups before and after treatment(±s)

表3 两组患者治疗前后肝功能指标比较(±s)Tab 3 Comparison of liver function indexes between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
组别对照组观察组治疗后8.12±3.04*7.05±2.16*#n 60 60 ALT,U/L治疗前46.38±3.44 46.57±3.49治疗后55.15±4.51*52.40±3.64*#AST,U/L治疗前42.55±5.32 42.70±5.40治疗后65.10±9.48*57.37±7.92*#TBIL,μmol/L治疗前19.03±1.21 19.12±1.25治疗后22.33±1.97*20.81±2.44*#DBIL,μmol/L治疗前5.34±1.71 5.18±1.63
2.3 两组患者治疗前后AFP水平比较
治疗前,两组患者AFP水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者AFP水平明显降低,且观察组明显低于对照组,差异均有统计学意义(P<0.05)。两组患者治疗前后AFP水平比较见表4。
表4 两组患者治疗前后AFP水平比较(±s,μg/L)Tab 4 Comparison of AFP level between 2 groups before and after treatment(±s,μg/L)
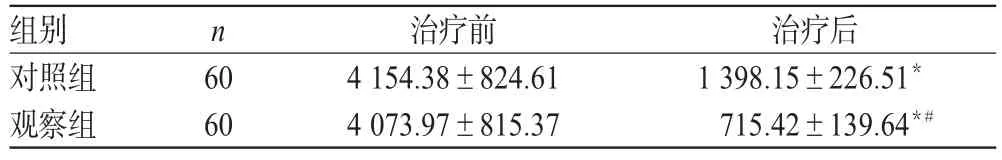
表4 两组患者治疗前后AFP水平比较(±s,μg/L)Tab 4 Comparison of AFP level between 2 groups before and after treatment(±s,μg/L)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
治疗后1 398.15±226.51*715.42±139.64*#组别对照组观察组n 60 60治疗前4 154.38±824.61 4 073.97±815.37
2.4 不良反应
两组患者治疗过程中的不良反应主要为骨髓抑制、恶心呕吐、口腔黏膜炎、周围神经炎和手足综合征等。两组患者不良反应发生率比较,差异均无统计学意义(P>0.05),详见表5。

表5 两组患者不良反应发生情况比较[例(%%)]Tab 5 Comparison of the occurrence of ADR between 2 groups[case(%%)]
2.5 两组患者随访期生存率比较
观察组患者随访1、2、3年的生存率均明显高于对照组,差异均有统计学意义(P<0.05),详见表6。

表6 两组患者随访期生存率比较[例(%%)]Tab 6 Comparison of survival rate between 2 groups [case(%%)]
3 讨论
原发性肝癌患者早期手术治疗是临床首选的治疗方案,但仅有20%~40%的患者符合手术切除指征[6],且原发性肝癌患者行全身化疗疾病控制效果较差。动脉化疗栓塞术通过选择性阻断肝癌病灶血流供应,使肿瘤细胞缺血凋亡,且对周围正常肝组织无明显影响;且化疗药物同期注入还可加强对肿瘤细胞的抑杀效应,在促进肿瘤病灶清除和降低复发和转移风险方面具有优势[7]。朱川等[8]的研究显示,中晚期原发性肝癌患者接受动脉化疗栓塞术治疗后总生存时间可延长7~11个月。但是,肝动脉存在较高的解剖变异率,以及受到门静脉供血和病灶侧支循环形成等因素影响,单纯动脉化疗栓塞术无法彻底清除肿瘤组织,同时局部缺血缺氧刺激还可导致机体血管内皮生长因子合成释放增多,加快病灶新生血管形成,严重影响疗效[9]。重复行动脉化疗栓塞术可在一定程度上提高肿瘤组织清除效果,但远期肝功能衰竭风险使其临床使用受限[10]。
中晚期原发性肝癌患者动脉栓塞术后辅助化疗对于控制病情进展、延长生存时间具有重要意义[11]。奥沙利铂属于第三代铂类抗肿瘤药物,可高效结合肿瘤细胞DNA形成异常复合体,干扰遗传物质复制和必需蛋白质合成进程,进而发挥抗肿瘤效应[12]。但Jeong Y等[13]的研究认为,动脉栓塞术后单药化疗降低晚期肝癌患者复发率、转移风险的效果欠佳,患者生存时间较单纯动脉栓塞术并未见明显延长,联合方案是否可使晚期肝癌患者获得更佳的临床受益尚缺乏相关证据。本研究在奥沙利铂基础上给予替吉奥,替吉奥作为新型氟尿嘧啶类口服化疗药物,其主要成分为替加氟、吉美斯特和奥替拉西钾。其中,替加氟经肝药酶转化为5-氟尿嘧啶(5-FU)发挥肿瘤抑杀作用;吉美嘧啶可降低二氢嘧啶脱氢酶(DPD)分解酶活性,提高血浆5-FU浓度;奥替拉西钾可与乳清酸磷酸核糖基转移酶结合,阻断5-FU转为5-FUMP,在提高体内5-FU浓度和延长药物作用时间方面效果确切[14-16]。
本研究结果显示,观察组患者的疾病控制率和临床受益率均明显高于对照组,且观察组患者随访1、2、3年生存率均明显高于对照组,提示联合化疗方案辅助用于晚期原发性肝癌患者肝动脉化疗栓塞术后在消除肿瘤病灶、控制病情进展和延长生存时间等方面优势明显。观察组患者治疗后肝功能指标水平、AFP水平均明显低于对照组,提示奥沙利铂联合替吉奥化疗方案有助于改善晚期原发性肝癌患者的肝脏功能,下调AFP水平,这可能是该方案具有更佳临床疗效的重要机制之一。两组患者不良反应发生率差异无统计学意义(P>0.05),提示该方案并未导致不良反应风险的上升,安全性好。
综上所述,肝动脉化疗栓塞术后应用奥沙利铂联合替吉奥治疗晚期原发性肝癌患者疗效较好,且安全性好。但本研究纳入样本量较小,仍需进一步进行大样本、多中心研究加以证实。
[1] Chen KW,Ou TM,Hsu CW,et al.Current systemic treatment of hepatocellular carcinoma:a review of the literature[J].World J Hepatol,2015,7(10):1412-1420.
[2] 张呈,陈昌南,林云笑,等.替吉奥联合经肝动脉化疗栓塞治疗中晚期肝细胞癌的疗效观察[J].临床肝胆病杂志,2014,30(1):55-57.
[3] Seki A,Hori S.Transcatheter arterial chemoembolization with docetaxel-loaded microspheres controls heavily pretreated unresectable liver metastases from colorectal cancer:a case study[J].Int J Clin Oncol,2011,16(5):613-616.
[4] 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤
学协作专业委员会,中华医学会肝病学分会肝癌组.原发性肝癌规范化诊治的专家共识[J].肿瘤,2009,29(4):295-304.
[5]王莉琳,张永宏,陈新月.2010年美国肝病年会(AASLD)肝细胞癌诊疗指南[J].北京医学,2011,33(3):236-251.
[6] 毕民平,杨定华,李湘竑,等.C-IAP2在肝细胞肝癌中的表达及与临床预后的关系[J].南方医科大学学报,2012,32(7):1020-1025、1030.
[7] Wang YY,Zhang W,Qian S,et al.The effect of locoregional transarterial infusion chemotherapy on liver metastasis after gastric cancer resection[J].J Int Med Res,2012,40(3):1141-1148.
[8] 朱川,熊德明,李湘宜,等.简化调强放疗联合肝动脉化疗栓塞治疗原发性肝癌的临床研究[J].重庆医学,2015,44(12):1626-1628、1632.
[9] 乔彬彬,虞希祥,王舒婷.TACE术中灌注氟尿嘧啶、奥沙利铂及吡柔比星治疗原发性肝癌的临床效果分析[J].介入放射学杂志,2015,24(4):349-353.
[10] 刘玉金,张秀美,张家兴,等.动脉化疗栓塞辅助手术切除对肝癌患者长期生存的研究[J].中华放射学杂志,2010,44(8):847-851.
[11] Kim HY,Park JW.Clinical trials of combined molecular targeted therapy and locoregional therapy in hepatocellular carcinoma:past,present,and future[J].Liver Cancer, 2014,3(1):9-17.
[12] 潘雪峰,郑国宝,邢红雨,等.肝动脉化疗栓塞联合伽玛刀治疗原发性肝癌的临床观察[J].肿瘤学杂志,2015,21(4):311-315.
[13] Jeong Y,Yoon SM,Han S,et al.Propensity score matching analysis of changes in alpha-fetoprotein levels after combined radiotherapy and transarterial chemoembolization for hepatocellular carcinoma with portal vein tumor thrombus[J].PLoS One,2015,10(8):e0135298.
[14] Park JW,Koh YH,Kim HB,et al.PhaseⅡstudy of concurrent transarterial chemoembolization and sorafenib in patients with unresectable hepatocellular carcinoma[J].J Hepatol,2012,56(6):1336-1342.
[15] Shoji T.A case of gastric cancer with peritoneal dissemination successfully treated by S-1/paclitaxel combination chemotherapy[J].Gan To Kagaku Ryoho,2011,38(2):297-300.
[16] Chung YH,Han G,Yoon JH,et al.Interim analysis of START:study in Asia of the combination of TACE(transcatheter arterial chemoembolization)with sorafenib in patients with hepatocellular carcinoma trial[J].Int J Cancer,2013,132(10):2448-2458.
(编辑:陶婷婷)
Clinical Observation of Oxaliplatin Combined with Tegafur in the Treatment of Advanced Primary Hepatic Carcinoma after Transcatheter Arterial Chemoembolization
WANG Haicun,WANG Mengmeng,CAO Yang(Dept.of Medical Oncology,Zhengzhou Third People’s Hospital,Zhengzhou 450099,China)
OBJECTIVE:To observe therapeutic efficacy and safety of oxaliplatin combined with tegafur in the treatment of advanced primary hepatic carcinoma after transcatheter arterial chemoembolization(TACE).METHODS:120 patients with advanced primary hepatic carcinoma were selected from our hospital during Apr.2011-Apr.2013,and then divided into control group and observation group according to random number table,with 60 cases in each group.Both groups received TACE.Control group was given Oxaliplatin injection 0.08 g/m2after surgery via catheter arterial puming,within 4 h;observation group was additionally given Tegafur capsules 40 mg/m2,po,bid,on the basis of control group.Both group received treatment for 4 months.Clinical efficacy,hepatic function indexes[ALT,AST,TBIL,DBIL]and alpha-fetoprotein(AFP)level were observed in 2 groups;the occurrence of ADR during treatment was recorded as well as 1-year,2-year,3-year follow-up survival rates.RESULTS:Before treatment,there was no statistical significance in hepatic function indexes and AFP(P>0.05).After treatment,disease control rate(78.33%)and clinical benefit rate(93.33%)of observation group were significantly higher than those of control group(48.335,71.67%),with statistical significance(P<0.05).The levels of ALT,AST,TBIL and DBIL in 2 groups were increased significantly,while the observation group was significantly lower than the control group,with statistical significance(P<0.05).AFP level of 2 groups were decreased significantly,and the observation group was significantly lower than the control group,with statistical significance(P<0.05).There was no statistical significance in the incidence of ADR between 2 groups(P>0.05).1-year,2-year,3-year follow-up survival rates of observation group were significant higher than control group,with statistical significance(P<0.05).CONCLUSIONS:Oxaliplatin combined with tegafur is effective for advanced primary hepatic carcinoma after TACE with good safety.
Combined chemotherapy;Transcatheter arterial chemoembolization;Primary hepatic carcinoma;Tegafur;Oxaliplatin;Therapeutic efficacy
R735.7
A
1001-0408(2017)11-1555-04
2016-09-01
2017-02-06)
*副主任医师。研究方向:肿瘤内科。电话:0371-66905457。E-mail:46613975@qq.com
DOI10.6039/j.issn.1001-0408.2017.11.34
