依达拉奉对1-溴丙烷诱导大鼠中枢神经系统损伤的保护作用
2017-04-28陈婧祎王增金索金宁姜路路邱晓菲许琳赵秀兰
陈婧祎,王增金,索金宁,姜路路,邱晓菲,许琳,赵秀兰
(山东大学公共卫生学院毒理系,山东济南250012)
依达拉奉对1-溴丙烷诱导大鼠中枢神经系统损伤的保护作用
陈婧祎,王增金,索金宁,姜路路,邱晓菲,许琳,赵秀兰
(山东大学公共卫生学院毒理系,山东济南250012)
目的观察1-溴丙烷(BP)的中枢神经毒性,从神经炎症角度探索依达拉奉(Edv)的保护机制。方法成年雄性Wistar大鼠每天ig给予BP 800 mg·kg-1制备模型,4 h后分别ip给予Edv 1,3和5 mg·kg-1,连续12 d。自给药第7天采用Morris水迷宫首先进行连续5 d的定位航行实验,检测大鼠的逃避潜伏期和游泳总距离;第6天进行空间探索实验,测定大鼠穿越原平台位置的次数,评价空间记忆能力。行为学实验结束后,每组随机取4只大鼠制作全脑冰冻切片,进行尼氏染色和免疫组化染色,另8只大鼠分别采用ELISA和硝酸还原酶法检测大鼠大脑前额叶皮质肿瘤坏死因子α(TNF-α)和一氧化氮(NO)含量。结果Morris水迷宫实验结果显示,定位航行实验第2~5天BP 800 mg·kg-1组大鼠的逃避潜伏期分别比正常对照组增加了60.8%,81.9%,124.0%和323.3%,游泳总距离增加47.0%,66.4%,106.0%和277.6%(P<0.05,P<0.01);空间探索实验中,BP组大鼠穿越平台次数也较正常对照组明显减少(P<0.01);病理形态学观察发现,BP组大鼠大脑前额叶皮质小胶质细胞激活明显,神经元丢失;大脑组织中NO和TNF-α含量分别比正常对照组增加147.6%(P<0.05)和18.7%(P<0.01)。给予BP同时给予不同剂量的Edv,其中Edv 5 mg·kg-1组大鼠第4天和第5天的逃避潜伏期分别比BP组减少38.4%和44.3%(P<0.01),游泳总距离减少34.5%和43.3%(P<0.05,P<0.01);同时给予Edv组大鼠大脑前额叶皮质小胶质细胞活化和神经元丢失明显减轻,NO及TNF-α含量也明显降低,Edv 1,3和5 mg·kg-1组NO分别降低53.8%,55.4%和59.8%,TNF-α分别降低12.2%,15.8%和22.2%(P<0.05,P<0.01)。结论Edv可能通过抑制脑内炎症减轻BP的中枢神经毒性。
1-溴丙烷;依达拉奉;认知功能;小胶质细胞;肿瘤坏死因子α
1-溴丙烷(1-bromopropane,BP)是一种挥发性有机溶剂,半衰期短,对臭氧层几乎无破坏,是氟氯烃类臭氧层破坏物质的替代剂,广泛用于精密仪器清洗,目前也常用于干洗行业,作为有潜在致癌危险的干洗剂的替代品[1]。随着BP的使用量和生产量日益增多,暴露人群逐渐扩大,近年来国内外不断有BP神经中毒的病例报道。中毒者一般首先表现出中枢神经系统(central nervous system,CNS)受损症状,如头痛、头晕、记忆障碍和焦虑或抑郁等,并逐渐出现外周神经系统损伤症状,如四肢麻木、下肢振动觉减弱,严重者表现为共济失调,甚至瘫痪[2]。由于BP神经毒性的确切机制尚不明确,临床上缺乏特异有效的治疗措施。与其他有机溶剂神经中毒不同,人体和实验室研究资料均显示,BP中毒CNS损伤表现明显;中毒者的体征及腓肠神经活检也提示,BP的初始毒作用靶点可能位于CNS[1,3]。认知功能是反映中毒性CNS损伤敏感且较客观的指标[4]。研究显示,大脑前额叶皮质(prefrontal cortex,PFC)是学习和记忆通路中的关键部位,由PFC、内侧颞叶皮质、后顶叶皮质和其他结构构成的神经网络是空间工作记忆的基础[5]。
近年来,小胶质细胞在人类神经退行性疾病发生发展中的关键作用逐渐受到重视[6]。小胶质细胞是脑内常驻免疫细胞,从形态及生理学功能上归类为CNS的巨噬细胞,对脑组织发挥免疫监视及神经营养作用。小胶质细胞是CNS的第一道防线,能对CNS紊乱做出迅速反应,脑内任何病理刺激均易使其异常激活,过度活化的小胶质细胞呈现阿米巴样变形,特异蛋白质如抗离子化钙接头分子蛋白1(ionized calcium binding adapter molecule 1,Iba1)表达明显升高,同时释放大量神经炎症介质;炎症介质又进一步激活和扩大脑内炎症变化,导致神经元死亡和病理状态的进一步发展[6-7]。活化的小胶质细胞也是升高脑内一氧化氮(nitric oxide,NO)含量的关键因素[8]。NO本身活性不高,但NO过多可与超氧阴离子反应转化为毒性极高的过氧亚硝酸阴离子(ONOO-),导致蛋白质的酪氨酸残基发生硝基化,使神经元产生不可逆损伤[9-10]。
依达拉奉(edaravone,Edv)为3-甲基-1-苯基-2-吡唑啉-5-酮,自2001年起因其具有较强的抗炎作用和清除自由基作用,广泛用于临床上缺血性脑血管病再灌注引起的氧化损伤治疗[11]。本研究采用Edv作为干预剂,通过Morris水迷宫实验检测大鼠认知功能的变化,观察BP的CNS毒性和Edv的保护作用,从神经炎症角度探讨BP的神经毒性机制并寻找有效干预靶点。
1 材料与方法
1.1 药品、试剂和仪器
BP(纯度为99.99%)(中国上海国药集团化学试剂有限公司);Edv和硫堇(美国Sigma-Aldrich公司);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(美国R&D Systems公司);NO检测试剂盒(硝酸还原酶法)(中国南京建成生物工程研究所);Pierce®BCA蛋白定量分析试剂盒(美国Thermo Fisher公司);Iba1多克隆抗体(日本Wako公司);生物素标记山羊抗兔IgG抗体(美国Santa Cruz公司);其余试剂均为进口或国产分析纯。
1.2 实验动物及处理
72只体质量为220~240 g的SPF级雄性Wistar大鼠(北京维通利华动物技术有限公司),动物合格证号为SCXK(京)2012-0036,环境温度22~24℃,相对湿度40%~60%,保持12/12 h昼夜节律。参照前期研究给予BP染毒[12]。大鼠适应性饲养3 d后,随机分为正常对照组、Edv 5 mg·kg-1对照组、BP 800 mg·kg-1(ig)模型组、BP+Edv1,3和5 mg·kg-1(ip)组(BP染毒4 h后给予Edv),每组12只。BP用玉米油稀释,Edv先用微量乙醇溶解,再用生理盐水稀释。BP和Edv每日给予1次,连续12 d。实验期间大鼠自由摄食及饮水。
1.3 Morris水迷宫实验检测大鼠逃避潜伏期、游泳总距离及穿越平台次数
自给药第7天采用Morris水迷宫进行连续5 d的定位航行实验和1 d的空间探索实验,分别评价大鼠的学习能力和空间记忆能力。水迷宫水池直径1.8 m,高0.6 m,用不同形状的白色标记将水池等分为4个象限,将直径为12 cm的黑色圆形平台放置第Ⅲ象限内。水池注水高度漫过平台1~2 cm,水温20~24℃。图像自动采集分析装置记录大鼠运动轨迹并进行数据处理。定位航行实验连续5 d,每天训练4次,每次从不同象限将大鼠面向池壁轻轻投入水中,记录其在120 s内寻找并爬上平台时所需时间(逃避潜伏期)(爬上平台以在平台上持续停留5 s为准),如在120 s内未找到平台,则将其引上平台并停留25 s,计逃避潜伏期为120 s,期间游泳距离为游泳总距离(m)。以逃避潜伏期和游泳总距离反映大鼠的学习能力。测试第6天进行空间探索实验,撤除水下平台,记录大鼠在90 s内穿越原平台位置的次数,以穿越平台次数评价大鼠的空间记忆能力。
1.4 大脑冷冻切片制备及组织学检测
水迷宫实验结束后次日,每组随机选取4只大鼠采用20%乌拉坦腹腔麻醉,4%多聚甲醛经心脏进行体内灌流固定,取出大脑放入多聚甲醛后固定48 h,转移至30%蔗糖溶液至沉底后,采用冷冻切片机以冠状方向切成40 μm厚的连续全脑组织切片。
1.4.1 尼氏染色
根据大鼠大脑立体定位图谱,每组选取位置相同的大脑前额叶区域,采用硫堇染液染色,经水洗、梯度乙醇脱水、脱色,二甲苯透明后,树脂封片,置于显微镜下观察神经元内尼氏体的变化情况。
1.4.2 免疫组化染色
根据大鼠大脑立体定位图谱,每组选取位置相同的大脑前额叶区域,采用1%H2O2消除内源性过氧化物酶,并经4%动物血清封闭后,加入抗Iba1抗体4°C过夜,与生物素标记的二抗反应后,加入卵白素-生物素-酶复合物(ABC复合物),采用二氨基联苯胺法(DAB)显色,经乙醇梯度脱水、二甲苯透明后封片,光镜下观察小胶质细胞的活化情况。每只大鼠取一张大脑切片,在200×下选取相同位置拍照,采用Image J软件进行图像分析,以Iba1表达总面积代表小胶质细胞活化情况。
1.5 ELISA和硝酸还原酶法分别检测大脑皮质中TNF-α和NO含量
每组剩余8只大鼠处死,迅速剥离大脑,并分离PFC,液氮速冻后置于-80℃冰箱内存放。根据试剂盒说明书,将大脑PFC按照1∶9(m/V)比例加入生理盐水用电动匀浆仪制备匀浆,4℃,15 000×g离心15 min后取上清液,采用硝酸还原酶法测定组织中NO含量。另取部分组织采用RIPA裂解液制备1∶5的组织匀浆,冰浴中静置30 min,4℃,15 000×g离心30 min后取上清液,按ELISA试剂盒说明书测定TNF-α含量;检测用组织匀浆蛋白质浓度均采用BCA试剂盒测定。
1.6 统计学分析
2 结果
2.1 依达拉奉对1-溴丙烷诱导的大鼠学习记忆障碍的影响
Morris水迷宫定位航行实验结果(图1A和图1B)显示,第1天实验各组间大鼠逃避潜伏期和游泳总距离差异无统计学意义;自第2天BP模型组大鼠逃避潜伏期和游泳总距离明显增加;第2~5天逃避潜伏期分别比正常对照组增加60.8%,81.9%,124.0%和323.3%(P<0.01);游泳总距离分别增加47.0%,66.4%,106.0%和277.6%(P<0.05,P<0.01)。与BP模型组相比,给予Edv1和3 mg·kg-1组逃避潜伏期和游泳总距离均无显著性差异;给予Edv 5 mg·kg-1组第4天和第5天逃避潜伏期分别减少38.4%和44.3%(P<0.01),游泳总距离分别减少34.5%和43.3%(P<0.05,P<0.01)。空间探索实验(表1)结果显示,与正常对照组比,BP模型组大鼠穿越平台次数明显减少(P<0.01),与BP模型组比较,给予Edv 1,3和5 mg·kg-1组大鼠穿越平台次数均无明显差异。实验期间,各组大鼠平均游泳速度无明显差异(数据略)。
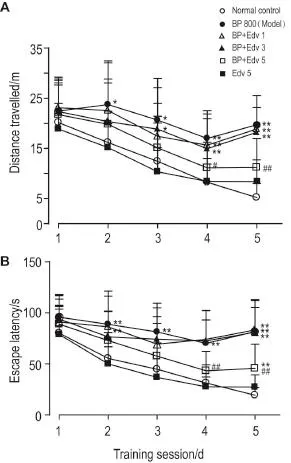
Fig.1 Effect of edaravone(Edv)on distance travelled and escape latency of rats treated with 1-bromopropane(BP).Wistar rats were ig given BP 800 mg·kg-1and followed by Edv 1,3 and 5 mg·kg-1ip treatment,respectively,4 h later for continuous 12 d.From the 7thday,all rats were subjected to the consecutive 5 d place navigation in Morris water maze.x±s,n= 10.*P<0.05,**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with BP group.

Tab.1 Effect of edaravon on crossing times of rats treated with BP
2.2 依达拉奉对1-溴丙烷诱导的大鼠大脑皮质小胶质细胞活化的影响
图2A示出,正常对照组大鼠大脑小胶质细胞基本处于静息状态;BP组大鼠大脑小胶质细胞激活明显,表现为胞体明显增大,分枝增粗,呈阿米巴样变形;Edv能明显减轻小胶质细胞的活化。图像分析表明(图2B),BP组大鼠大脑Iba1蛋白表达比对照组明显增高(P<0.05);与BP组相比,Edv各剂量组Iba1蛋白表达均显著降低(P<0.05,P<0.01)。
2.3 依达拉奉对1-溴丙烷诱导的大鼠大脑前额叶皮质神经元丢失的影响
正常对照组和Edv对照组大鼠大脑皮质神经元排列密集,神经元的细胞体较大,胞质着色均匀。BP染毒组大鼠皮质排列紊乱,有的胞体收缩呈多边形或呈不规则改变,有的神经元空泡化,部分区域出现神经元丢失;给予Edv各组大鼠大脑皮质神经元形态、以及神经元丢失现象明显得到改善(图3)。
2.4 依达拉奉对1-溴丙烷诱导的大鼠大脑组织NO及TNF-α 含量增加的影响
BP染毒能增加大鼠大脑组织中NO含量,BP染毒组比正常对照组增加147.6%(P<0.05)。与BP模型组相比,给予Edv 1,3和5 mg·kg-1组NO分别降低53.8%,55.8%和59.6%(P<0.05,P<0.01)。
与正常对照组相比,BP模型组TNF-α含量增加18.7%(P<0.01)。与BP模型组相比,给予Edv 1,3和5 mg·kg-1组TNF-α分别降低12.1%,15.8%和16.5%(P<0.01)(表2)。

Fig.2 Effect of edaravone on activation of microglia in rat brains treated with BP(200×,scale bar 20μm).See Fig.1 for the rat treatment.A:morphology of microglia;B:the total area of microglia.White arrows show the resting microglia,while black ones the activated microglia.x±s,n=4.*P<0.05,compared with normal control group;#P<0.05,##P<0.01,com⁃pared with BP group.

Fig.3 Effect of edaravone on morphology of neuron in rat brains treated with BP(200×,scale bar 20μm).See Fig.1 for the rat treatment.Black arrows show the vacuoliza⁃tion of neuronal cytoplasm,while white ones the neuronal loss.

Tab.2 Effects of edaravone on levels of nitrite oxide(NO)and tumor necrosis factor-α (TNF-α )in rat brains treated with BP
3 讨论
本研究观察到BP导致大鼠认知功能损伤,并伴随着脑内小胶质细胞的过度活化和大脑组织中NO和TNF-α含量的明显升高。小胶质细胞是CNS受到损伤或毒性刺激后最早发生反应的细胞类型,可在1 h内开始动员并不断聚积长达月余[13-14]。小胶质细胞的激活存在M1型和M2型2种极化形式。M2状态下的小胶质细胞可通过释放抗炎因子和吞噬作用促进组织修复,是维持内环境动态平衡的一种重要自我保护机制,过度刺激下会转向M1状态,导致大量促炎症因子的生成和释放,同时细胞内诱导型一氧化氮合酶(inducible nitric ox⁃ide synthase,iNOS)合成及活性升高,iNOS的大量表达也是小胶质细胞M1极化状态的特征性标志[15]。iNOS分解精氨酸生成瓜氨酸和NO。M1极化状态的小胶质细胞可通过增高iNOS使脑内NO大量产生,由此导致大脑氧化/氮化应激,损伤神经元[16-17]。升高的NO也可引起线粒体功能障碍,并可通过N-甲基-D-天冬氨酸受体介导谷氨酸盐的兴奋性毒性,导致神经元损伤[18]。活化的小胶质细胞内NADPH氧化酶也被广泛激活,导致ROS大量产生。脑内增高的NO和ROS共存时,可形成毒性高的ONOO-导致神经元损伤[9-10]。
TNF-α也是M1极化小胶质细胞释放的主要前炎症因子,是导致组织炎症反应的重要介质,释放的TNF-α反过来又能刺激小胶质细胞的激活[19],并可诱导小胶质细胞谷氨酰胺酶释放谷氨酸盐,导致兴奋性毒性,使神经元死亡[20]。本研究观察到大鼠给予BP处理后,大脑组织NO及TNF-α明显升高,提示BP导致小胶质细胞M1极化。
研究显示,小胶质细胞M1/M2状态的相对平衡受氧化还原状态调节[15]。BP是一种脂溶性神经毒物,极易通过血脑屏障进入脑内。进入脑内的BP可导致脑组织氧化应激,并与其神经毒性密切相关[12]。因此,推测BP可使脑内小胶质细胞向促炎态M1型极化,破坏M1/M2的相对平衡,产生大量的NO,ROS和TNF-α等神经毒物,形成持续不断、自我促进的慢性炎症反应,逐渐引起神经元的不断丧失。神经元为有丝分裂后细胞,再生能力极差,故当大脑功能区域的神经元数量减少后,可产生神经功能障碍。
NF-κB是介导细胞内多种效应信号通路的关键起始分子,也被认为是环境神经毒物刺激和细胞损伤启动脑内小胶质细胞M1极化的中心调节因子,NF-κB的活化介导了iNOS的诱导和前炎症因子的释放[21]。已知NF-κB是细胞内氧化应激感受器,对组织中的氧化还原状态敏感。我们前期研究显示,BP可导致CNS氧化应激,并激活动物脑内NF-κB,导致脑内炎症反应[22]。因此,通过抗氧化作用钝化促炎态M1型小胶质细胞,减少NO和ROS等神经毒物释放及促炎因子生成,从而减轻神经毒物的神经毒性。Edv是一种兼具水溶和脂溶性的小分子药物,血脑屏障通透率高,分子中携带3个抗氧化基团能特异清除细胞毒性高的羟自由基[23]。有研究显示,Edv能有效抑制NF-κB的激活,降低下游炎症因子的含量[24]。本研究观察到给予Edv后,大鼠大脑组织中NO和TNF-α含量均明显降低,小胶质细胞活化减轻、神经元损伤和丢失情况明显改善。同时,Edv组大鼠的逃避潜伏期和游泳总路程呈现降低趋势,穿越平台次数也呈增多趋势,提示Edv能明显拮抗BP诱导的神经炎症反应和神经毒性。但本研究结果显示,给予Edv 1和3 mg·kg-1保护效果不明显,仅Edv 5 mg·kg-1组与BP模型组差异显著,提示Edv的保护作用与剂量相关。
此外,BP是一种挥发性有机溶剂,呼吸道吸入是职业环境中人体主要的暴露途径。但在研究BP神经毒性的动物实验中,吸入染毒的结果不完全一致,如Sohn等[25]采用BP 6864 mg·m-3经吸入途径给予SD大鼠,6 h·d-1,每周5 d,连续13周,染毒组大鼠神经行为学表现正常,大脑、脊髓和外周神经中未观察到任何病理学改变。而在另外的实验中,Yu等[26]采用BP 5491 mg·m-3给大鼠吸入染毒,8 h·d-1,第5周可观察到明显的外周神经毒性症状,但此剂量下大鼠体质量明显下降,大鼠因衰竭无法持续实验。本研究采用经胃途径染毒,尽管与人的主要暴露方式不同,但BP染毒大鼠可出现与人中毒类似的毒性表现,是比较理想的BP中毒模型。
[1]Ichihara G,Kitoh J,Li WH,Ding XC,Ichihara S,Takeuchi Y.Neurotoxicity of 1-bromopropane:evidence from animal experiments and human studies[J].J Adv Res,2012,3(2):91-98.
[2]Samukawa M,Ichihara G,Oka N,Kusunoki S.A case of severe neurotoxicity associated with expo⁃sure to 1-bromopropane,an alternative to ozonedepleting or global-warming solvents[J].Arch Intern Med,2012,172(16):1257-1260.
[3]Meyer-Baron M,Kim EA,Nuwayhid I,Ichihara G,Kang SK.Occupational exposure to neurotoxic substances in Asian countries-challenges and approaches[J].Neurotoxicology,2012,33(4):853-861.
[4]White RF,Proctor SP.Solvents and neurotoxicity[J].Lancet,1997,349(9060):1239-1243.
[5]Wang GW,Cai JX.Disconnection of the hippo⁃campal-prefrontal cortical circuits impairs spatial working memory performance in rats[J].Behav Brain Res,2006,175(2):329-336.
[6]Lim HW,Park JI,More SV,Park JY,Kim BW,Jeon SB,et al.Anti-neuroinflammatory effects of DPTP,a novel synthetic clovamide derivative in invitro and in vivo model of neuroinflammation[J]. Brain Res Bull,2015,112:25-34.
[7]Imai K,Kotani T,Tsuda H,Mano Y,Nakano T,Ushida T,et al.Neuroprotective potential of molecular hydrogen against perinatal brain injury via suppres⁃sion of activated microglia[J].Free Radic Biol Med,2016,91:154-163.
[8]Zhao W,Xie W,Le W,Beers DR,He Y,Henkel JS,et al.Activated microglia initiate motor neuron injury by a nitric oxide and glutamatemediated mechanism[J].J Neuropathol Exp Neurol,2004,63(9):964-977.
[9]Bradley SA,Steinert JR.Nitric oxide-m ediated posttranslational modifications:impacts at the synapse[J].Oxid Med Cell Longev,2016,2016:5681036.
[10]Nakamura T,Prikhodko OA,Pirie E,Nagar S,Akhtar MW,Oh CK,et al.Aberrant protein S-nitro⁃sylation contributes to the pathophysiology of neuro⁃degenerative diseases[J].Neurobiol Dis,2015,84:99-108.
[11]Zhang N,Komine-Kobayashi M,Tanaka R,Liu M,Mizuno Y,Urabe T.Edaravone reduces early accumulation of oxidative products and sequential inflammatory responses after transient focal ischemia in mice brain[J].Stroke,2005,36(10):2220-2225.
[12]Guo Y,Yuan H,Jiang L,Yang J,Zeng T,Xie K,et al.Involvement of decreased neuroglobin protein level in cognitive dysfunction induced by 1-bromo⁃propane in rats[J].Brain Res,2015,1600:1-16.
[13]Davalos D,Grutzendler J,Yang G,Kim JV,Zuo Y,Jung S,et al.ATP mediates rapid microglial response to local brain injury in vivo[J].Nat Neurosci,2005,8(6):752-758.
[14]Thiel A,Heiss WD.Imaging of microglia activation in stroke[J].Stroke,2011,42(2):507-512.
[15]Rojo AI,McBean G,Cindric M,Egea J,López MG,Rada P,et al.Redox control of microglial function:molecular mechanisms and functional significance[J].Antioxid Redox Signal,2014,21(12):1766-1801.
[16]Chang CC,Wang YH,Chern CM,Liou KT,Hou YC,Peng YT,et al.Prodigiosin inhibits gp91(phox)and iNOS expression to protect mice against the oxidative/nitrosative brain injury induced by hypoxia-ischemia[J].Toxicol Appl Pharmacol,2011,257(1):137-147.
[17]Sawicka E,Długosz A,Rembacz KP,Guzik A. The effects of coenzyme Q10 and baicalin in cisplatininduced lipid peroxidation and nitrosative stress[J].Acta Pol Pharm,2013,70(6):977-985.
[18]Stewart VC,Heslegrave AJ,Brown GC,Clark JB,Heales SJ.Nitric oxide-dependent damage to neuronal mitochondria involves the NMDA receptor[J].Eur J Neurosci,2002,15(3):458-464.
[19]Kim YS,Joh TH.Microglia,major player in the brain inflammation:their roles in the pathogenesis of Parkinson′s disease[J].Exp Mol Med,2006,38(4):333-347.
[20]Takeuchi H,Jin S,Wang J,Zhang G,Kawanokuchi J,Kuno R,et al.Tumor necrosis factor-alpha induc⁃es neurotoxicity via glutamate release from hemi⁃channels of activated microglia in an autocrine manner[J].J Biol Chem,2006,281(30):21362-21368.
[21]Von Bernhardi R,Eugenín J.Alzheimer′s disease:redox dysregulation as a common denominator for diverse pathogenic mechanisms[J].Antioxid Redox Signal,2012,16(9):974-1031.
[22]Wang ZJ,Yuan H,Yang JL,Xie KQ,Zhao XL. DHA Attenuated central neurotoxicity of 1-bromo⁃propane by activating NF-κB and Nrf2[J].J Shandong Univ(Health Sci)山东大学学报(医学版),2016,54(4):84-88,93.
[23]Yoshida H,Yanai H,Namiki Y,Fukatsu-Sasaki K,Furutani N,Tada N.Neuroprotective effects of edaravone:a novel free radical scavenger in cere⁃brovascular injury[J].CNS Drug Rev,2006,12(1):9-20.
[24]Jangra A,Kwatra M,Singh T,Pant R,Kushwah P,Ahmed S,et al.Edaravone alleviates cisplatininduced neurobehavioral deficits via modulation of oxidative stress and inflammatory mediators in the rat hippocampus[J].Eur J Pharmacol,2016,791:51-61.
[25]Sohn YK,Suh JS,Kim JW,Seo HH,Kim JY,Kim HY,et al.A histopathologic study of the nervous system after inhalation exposure of 1-bromo⁃propane in rat[J].Toxicol Lett,2002,131(3):195-201.
[26]Yu X,Ichihara G,Kitoh J,Xie Z,Shibata E,Kamijima M,et al.Neurotoxicity of 2-bromopro⁃pane and 1-bromopropane,alternative solvents for chlorofluorocarbons[J].Environ Res,2001,85(1):48-52.
Protective effect of edaravone on central nervous system damage induced by 1-bromopropane in rats
CHEN Jing-yi,WANG Zeng-jin,SUO Jin-ning,JIANG Lu-lu,QIU Xiao-fei,XU Lin,ZHAO Xiu-lan
(Institute of Toxicology,School of Public Health,Shandong University,Jinan 250012,China)
OBJECTIVETo observe the neurotoxicity of 1-bromopropane(BP)and investigate the protective effects of edaravone(Edv)against BP-induced deficits of spatial learning and memory ability in rats by its anti-inflammatory mechanism.METHODSAdult male Wistar rats were ig given BP 800 mg·kg-1to develop the model,followed by Edv 1,3 and 5 mg·kg-1ip treatment respectively 4 h later for consecutive 12 d.From the 7thday(d 7),all rats were subjected to the five-day place navigation in Morris water maze(MWM)to measure the escape latency and the total swimming distance.On d 6 of MWM,spatial probe test was performed and the crossing times of rats were recorded to evaluate the spatial memory ability.At the end of the behavioral experiment,four rats in each group were randomly selected and the frozen section of the whole brain was sliced for thionin staining and immunohisto⁃chemistry.The other eight sacrifced rat brains from each group were harvested for the determination of the tumor necrosis factor-α(TNF-α)and nitric oxide(NO)by ELISA and nitrate reductase method, respectively.RESULTSThe results of MWM test showed that compared with control rats the escape latencies of rats in BP group were increased by 60.8%,81.9%,124.0%and 323.3%,respectively,during the d 2-d 5 of MWM,and the total swimming distance increased by 47.0%,66.4%,106.0%and 277.6%,respectirely.All the differences between BP group and control group were significant(P<0.05, P<0.01).In the spatial probe trial,the crossing times of rats in BP group were significantly decreased, compared with the control rats(P<0.01).Morphologically,thionin staining and immunohistochemistry revealed significant microglia activation and neuron loss in the rat forebrains,accompanied by a 147.6%and 18.7%increase in NO and TNF-α levels in rats treated with BP respectively compared with control values(P<0.05,P<0.01).After co-treatment at different dosages of Edv with BP,the escape latencies of rats in BP+Edv 5 mg·kg-1group were decreased by 38.4%and 44.3%(P<0.01),and the total swimming distance decreased 34.5%and 43.3%(P<0.05,P<0.01),respectively,compared with the BP treated rats on the d 4 and d 5 of MWM test.The microglia activation and neuron damage in the brain of rats induced by BP treatment were significantly alleviated in BP+Edv groups.In addition,the contents of NO and TNF-α were decreased in BP+Edv 1,3 and 5 mg·kg-1groups,with a decrease of 53.8%, 55.4%and 59.8%in NO,and 12.2%,15.8%and 22.2%in TNF-α(P<0.05,P<0.01),respectively.CONCLUSIONEdv could effectively protect against central neurotoxicity induced by BP via anti-neuro⁃inflammation.
1-bromopropane;edaravone;cognitive function;microglia;tumor necrosis factor-α
ZHAO Xiu-lan,E-mail:zhao.xl@sdu.edu.cn,Tel:(0531)88382132
R964
:A
:1000-3002-(2017)02-0237-07
10.3867/j.issn.1000-3002.2017.03.006
Foundation item:The project supported by National Natural Science Foundation of China(81172708);and Interdisci⁃plinary Breeding Project of Shandong University(2016JC020)
2016-10-08接受日期:2017-01-17)
(本文编辑:乔虹)
国家自然科学基金(81172708);2016山东大学交叉学科培育项目(2016JC020)
陈婧祎,女,硕士研究生,从事神经毒理学研究。E-mail:528258683@qq.com,Tel:13153182317
赵秀兰,E-mail:zhao.xl@sdu.edu.cn,Tel:(0531)88382132
