超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速精准测定粮食中多种真菌毒素
2017-04-27辛媛媛周明慧王松雪
叶 金,吴 宇,辛媛媛,周明慧,谢 刚,王松雪
(国家粮食局科学研究院,北京 100037)
超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速精准测定粮食中多种真菌毒素
叶 金,吴 宇,辛媛媛,周明慧,谢 刚,王松雪*
(国家粮食局科学研究院,北京 100037)
采用直接提取稀释的快速前处理方法,结合稳定同位素稀释技术,利用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱,建立了粮食中16种真菌毒素的快速精准分析方法。样品采用乙腈-水-乙酸溶液(70∶29∶1,体积比)提取,以C18色谱柱进行色谱分离,通过全扫描模式进行定量检测,并采用稳定同位素稀释以减少基质效应对定量分析的影响。结果表明,16种真菌毒素在一定浓度范围内均具有良好的线性关系,相关系数(r2)均大于0.999,4种常见粮食基质(小麦、玉米、大米、大麦)的限量浓度水平的加标回收率(n=6)为75.3%~123.5%,相对标准偏差为0.41%~14.7%。该方法简单、准确,适用于粮食中真菌毒素的检测,可满足日常监测工作的需要。
真菌毒素;高分辨质谱;粮食;稳定同位素稀释
真菌毒素是由真菌产生的次级代谢产物,常见的真菌毒素包括黄曲霉毒素(Aflatoxin,AF)、呕吐毒素(Deoxynivalenol,DON)、赭曲霉毒素A(Ochratoxin A,OTA)、伏马毒素(Fumonisin,FB)、玉米赤霉烯酮(Zearalenone,ZEN)、T-2毒素(T-2 toxin,T2)和HT-2毒素(HT-2 toxin,HT-2),广泛存在于各种粮油及其制品中。据联合国粮农组织估计,全世界谷物供应链的25%受到真菌毒素的污染,对人体和动物的健康具有极大危害。全世界已有100多个国家规定了粮食中主要真菌毒素的限量[1],其中欧盟已制定了DON,ZEN,AF,FB,OTA,T2和HT-2等真菌毒素的法规限量和推荐限量[2-3],我国食品安全国家标准规定谷物的DON限量为1 000 μg/kg,ZEN限量为60 μg/kg,黄曲霉毒素B1(AFB1)限量为5~20 μg/kg,OTA限量为5 μg/kg[4]。为了更好地加强对粮食中真菌毒素的监测,保障人畜健康,开发快速、高通量、前处理简单、准确的真菌毒素检测方法具有非常重要的意义。
目前,真菌毒素的检测方法主要包括酶联免疫试剂盒法[5]、胶体金试纸条法[6-7]、免疫亲和柱净化液相色谱法[8-9]和高效液相色谱-质谱联用法[10-13]。其中酶联免疫试剂盒和胶体金试纸条法均属于快速检测方法,其优势在于方法简单、便捷、快速,对实验人员与实验条件要求不高,可用于样品的快速筛查及现场检测,但方法的准确度及重现性相对较差。基于免疫亲和柱净化的液相色谱法是目前真菌毒素检测的主流方法,该方法具有特异性强,灵敏度高,定量准确,稳定性好的优点,但由于需使用免疫亲和柱净化,对于多目标毒素的检测能力有限,还存在着免疫亲和柱费用较高,结果假阳性等缺点[14]。高效液相色谱-质谱联用法具有灵敏度高和抗干扰能力较强等特点,因此可以采用较为简单的前处理方法。常用的前处理净化方法有固相萃取法[15-17]和QuEChERS法[18-19],随着仪器特异性和灵敏度的不断提高,无需净化的方法也开始出现[20-21],进一步降低了样品前处理时间和成本。
四极杆/静电场轨道阱高分辨质谱仪(Q-Exactive)具有分辨率高及定量能力好的优点,不同于三重四极杆低分辨质谱使用多反应监测模式通过目标物的离子对进行定量分析,高分辨质谱可以利用目标物母离子的精确分子量直接定量,无需对目标物逐个优化子离子及相关参数,对于多目标物分析可以极大地降低检测方法的时间,同时又能很好地避免低分辨质谱易受基质干扰而产生假阳性的现象[22]。目前基于Q-Exactive的检测方法已在多个领域中得到快速发展和应用[23-27]。
本研究利用无需净化的直接提取稀释前处理方法,有效避免了净化过程中目标物的损失,减少了前处理时间及成本,通过高分辨质谱很大程度上降低了检测结果的假阳性,并利用稳定同位素稀释技术降低了基质效应对定量分析的影响。本文通过优化仪器条件,建立了快速检测粮食中16种真菌毒素的方法,为有效监测粮食中真菌毒素种类和含量提供了有力的技术支持。
1 实验部分
1.1 材料与试剂
雪腐镰刀菌烯醇(NIV)、脱氧雪腐镰刀菌烯醇(DON)、3-乙酰基脱氧雪腐镰刀菌烯醇(3-AcDON)、15-乙酰基脱氧雪腐镰刀菌烯醇(15-AcDON)、脱氧雪腐镰刀菌烯醇-3-葡萄糖苷(DON-3G)、T-2毒素(T-2)、HT-2毒素(HT-2)、玉米赤霉烯酮(ZEN)、赭曲霉毒素A(OTA)、伏马毒素B1(FB1)、伏马毒素B2(FB2)、杂色曲霉毒素(ST)标准溶液(浓度为0.2~20 μg/mL,Romer公司);黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)标准溶液(浓度为0.03~1.0 μg/mL,Sigma-Aldrich公司);13C标记的黄曲霉毒素(B1,B2,G1,G2)、脱氧雪腐镰刀菌烯醇、雪腐镰刀菌烯醇、3-乙酰基脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、赭曲霉毒素A、伏马毒素(B1,B2)、T-2毒素、HT-2毒素、杂色曲霉毒素的14种稳定同位素标准溶液(浓度为0.01~2.5 μg/mL,Romer公司);甲醇、乙腈(HPLC级,Fisher公司);乙酸铵、甲酸、乙酸(HPLC级,美国Sigma公司);0.2 μm PTFE膜针头过滤器(PALL公司);实验用水为Milli-Q超纯水。
1.2 仪器与设备
四极杆/静电场轨道阱高分辨质谱仪Q-Exactive(ThermoFisher Scientific公司);UltiMate 3000快速液相色谱仪(ThermoFisher Scientific公司);3-30K离心机(美国Sigma公司);GT10-1 高速台式离心机(北京时代北利离心机有限公司);Roto-Shake Genie 多用途旋转摇床(美国Scientific Industries公司);Milli-Q超纯水纯化系统(美国Millipore公司),涡旋振荡器(德国IKA公司)。
1.3 标准溶液配制
分别移取一定体积的16种真菌毒素标准溶液于10 mL容量瓶中,用水定容至刻度,得到16种真菌毒素的混标储备液,于-20 ℃保存,浓度详见表1。
稳定同位素内标混合工作液:根据表1相应的稳定同位素混合溶液的浓度,分别移取一定体积的14种真菌毒素稳定同位素单标溶液于4 mL储液瓶中,用水稀释至2 mL配制稳定同位素混合标准溶液,充分混匀后于-20 ℃避光保存。准确移取混合标准中间液适量,用乙腈-水-乙酸溶液(35∶64.5∶0.5)逐级稀释,配制成不同浓度系列的混合标准工作液。向400 μL内插管中加入20 μL 14种稳定同位素混合工作液,再分别吸取180 μL系列标准工作液于内插管中,涡旋混匀后准备上机检测。
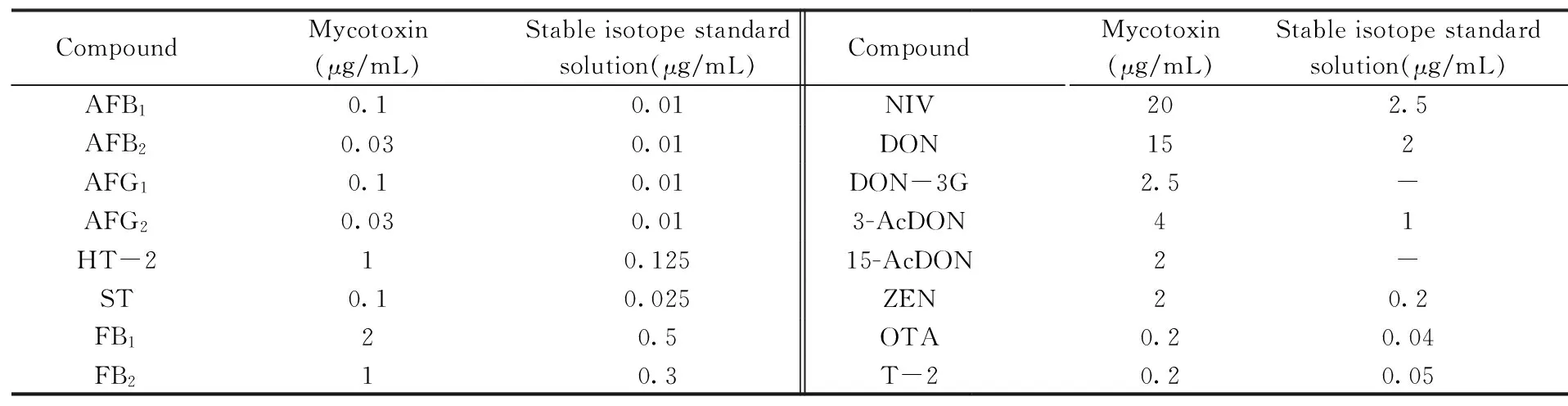
表1 真菌毒素混合标准储备液的浓度及相应的稳定同位素混合溶液Table 1 Concentrations of the standard stock solutions of mycotoxins and related stable isotope standard solutions
-:no data
1.4 样品处理
样品经粉碎(90%通过40目筛)混匀后,准确称取5.00 g,加入20 mL乙腈-水-乙酸(70∶29∶1)混合溶剂,涡旋混匀1 min,振荡30 min后,以4 000 r/min离心10 min使固液分离。准确转移0.5 mL上清液于1.5 mL离心管中,加入0.5 mL水稀释,涡旋混匀1 min,然后于12 000 r/min离心10 min,取上清液用0.22 μm的PTFE滤膜过滤,吸取20 μL预先涡旋混匀的稳定同位素混合溶液于400 μL内插管中,再加入180 μL的样品滤液,混合后待测。
1.5 仪器条件
液相色谱条件:Waters 公司CORTECSTM UPLC C18柱(100 mm×2.1 mm,1.6 μm);柱温40 ℃;进样量2 μL。流动相:A为甲醇,B为含0.1%(体积分数)的甲酸和1 mmol/L乙酸铵的水溶液,流速:0.3 mL/min。梯度洗脱条件:0~2 min,90% B;2~3 min,90% ~80% B;3~4 min,80%~79% B;4~5 min,79%~74% B;5~7 min,74% B;7~10.5 min,74% ~40% B;10.5~13.5 min,40% B;13.5~14.5 min,40%~5% B;14.5~17 min,5% B;17~18 min,5% ~90% B;18~21 min,90% B。
质谱条件:加热电喷雾离子源(HESI)温度为300 ℃;毛细管电压为3.2 kV;离子传输管温度为320 ℃;鞘气为35 unit,辅助气为10 unit。full scan/ddms2扫描模式:采集范围为200~800 Da,正离子采集;一级质谱分辨率为70 000 FWHM,二级质谱分辨率为17 500 FWHM;碰撞池能量(NCE)为35 eV。
2 结果与讨论
2.1 真菌毒素的选择
本研究选择的16种真菌毒素目标物涵盖了我国食品安全限量标准规定及欧盟已制定限量法规的真菌毒素及其相关的衍生物。

图1 直接提取稀释方法与商品化的多毒素净化方法(MycoSpin 400)对于目标毒素回收率(n=3)结果Fig.1 Recoveries of mycotoxins purified with direct extract and MycoSpin 400 methods
2.2 前处理方法的选择
由于真菌毒素的理化性质相差较大,常见的净化方法容易造成毒素的损失。郑翠梅等[15]在研究中发现使用MycoSep 226多功能净化柱时,会吸附FBs,DON糖苷化衍生物和OTA等毒素。此外,由于净化方法步骤较多,不利于大批量样品的快速处理。近年来随着质谱仪器抗干扰能力及灵敏度的不断提升,直接提取且无需净化的方法被越来越多的使用。图1为直接提取稀释法与商品化的多毒素净化填料(MycoSpin 400)净化方法对16种目标毒素的回收率,MycoSpin 400前处理方法按照其产品说明书进行。结果显示,MycoSpin 400对于DON-3G,FB1,FB2,OTA 4种真菌毒素的回收率不高,主要由于该净化填料对于这些毒素有一定的吸附,会导致净化过程中目标毒素的损失,影响定量结果的准确性,而直接提取稀释法由于无需净化步骤,避免了该过程中目标物的损失,对于所有目标毒素的回收率均在91%~113%之间。因此,直接提取稀释法更适合于多种真菌毒素的快检前处理,而且处理过程更加简单、快捷。
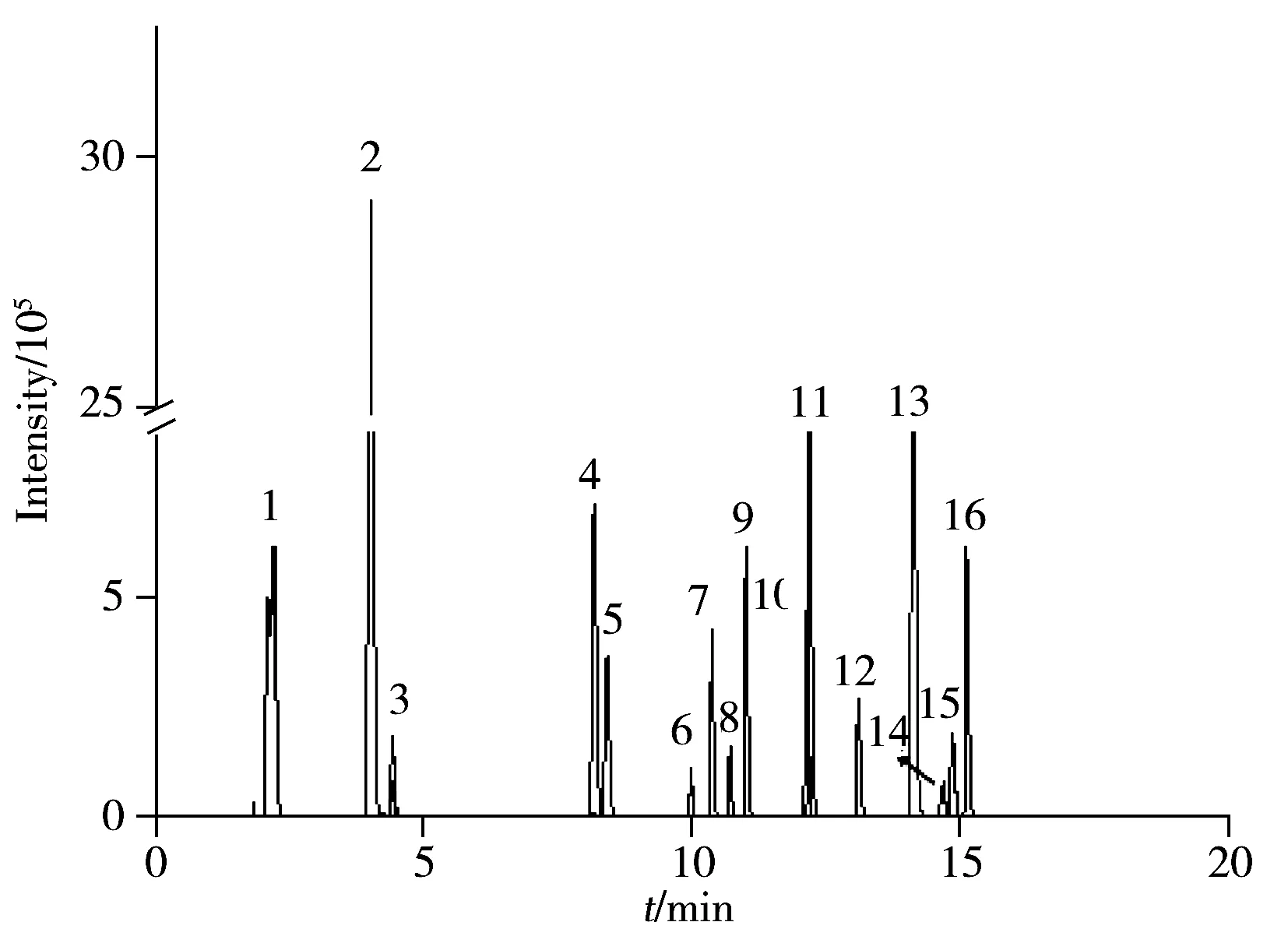
图2 16种真菌毒素标准混合溶液的色谱图Fig.2 Chromatogram of 16 mycotoxins mixed standard solution 1.NIV,2.DON,3.DON-3G,4.3-AcDON,5.15-AcDON,6.AFG2,7.AFG1,8.AFB2,9.AFB1,10.HT-2,11.FB1,12.T-2,13.ZEN,14.OTA,15.ST,16.FB2
2.3 基质效应
由于本方法前处理采用直接提取稀释法,样品中会存在一定的基质效应干扰。本实验对常见的4种粮食基质进行了考察,并以目标物在空白基质液中的峰面积与溶剂中峰面积的百分比来评估基质效应,当结果接近100%时,表明无明显的基质效应,而高于100%说明有基质增强效应,低于100%则说明有基质抑制效应。16种真菌毒素在4种常见粮食基质中的基质效应结果显示,16种真菌毒素的基质效应为61.0%~118.4%,说明在这几种常见的基质中存在一定的基质增强或抑制效应。如玉米基质中的黄曲霉毒素,基质抑制作用明显(61.0%~84.4%)。基质匹配标准曲线是一种常见的减少基质效应的方法,但是由于真菌毒素污染的普遍性,16种毒素均不含的空白基质不易获得,特别是完全匹配的基质难以获得,而代表性基质的普适性面临挑战,具有较大的不确定性,导致基质匹配定量在标准化检测中的应用受到局限。因此,为了更好消除基质效应的影响,本实验采用稳定同位素稀释法进行定量,以确保结果的准确可靠。
2.4 检测条件的优化
对比含不同比例盐和酸的弱洗脱流动相对16种真菌毒素质谱响应的影响,结果显示,以水为流动相时,大部分的离子响应不高,加盐后大多数毒素的响应明显提高,其中乙酸铵的增强效果比甲酸铵明显,同时低浓度(1 mmol/L)盐比高浓度(2 mmol/L及5 mmol/L)盐的响应信号更强。而FB1和FB2需要在0.1%甲酸存在时才有明显的质谱响应,因此,最终选择含有0.1%甲酸和1 mmol/L NH4Ac的水相作为弱洗脱流动相。
2.5 目标离子的选择
基于三重四极杆质谱仪的检测需要对离子对及相关参数进行优化,以选择最佳的母离子、子离子。对于多目标化合物的同时检测方法,需花费大量的时间对质谱条件进行优化。而利用Q-Exactive高分辨质谱以母离子的精确质量数直接定量,无需优化子离子及相关参数,可简化质谱条件的优化过程,有效提高实验效率。本实验采用全扫描模式对目标物的不同加合离子进行选择,采用响应最高的加合离子作为检测离子。实验中观察到HT-2等目标毒素的加钠峰信号较强,但考虑到加钠离子不易碎裂,难以进行二级定性分析,因此选择加氢(M+H)和加铵(M+NH4)进行比较。在当前流动相梯度下,DON-3G,HT-2,T-2的加铵峰的信号更强,而其他毒素均为加氢峰信号更强,选择上述最佳的加合离子作为检测离子进行分析。16种真菌毒素的色谱图见图2。
2.6 方法学验证
2.6.1 线性范围、检出限及定量下限 配制16种真菌毒素的系列混合标准溶液进行分析,以稳定同位素稀释法进行定量,相关信息见表2。结果表明,在各自的线性范围内,16种真菌毒素线性关系良好,相关系数(r2)均大于0.999。对混合标准溶液进行逐级稀释,以3倍信噪比(S/N=3)计算检出限(LOD),S/N=10计算定量下限(LOQ),结果见表3。16种真菌毒素的LOQ均低于我国和欧盟规定的粮食中真菌毒素限量,说明本方法可以满足日常检测的需要。
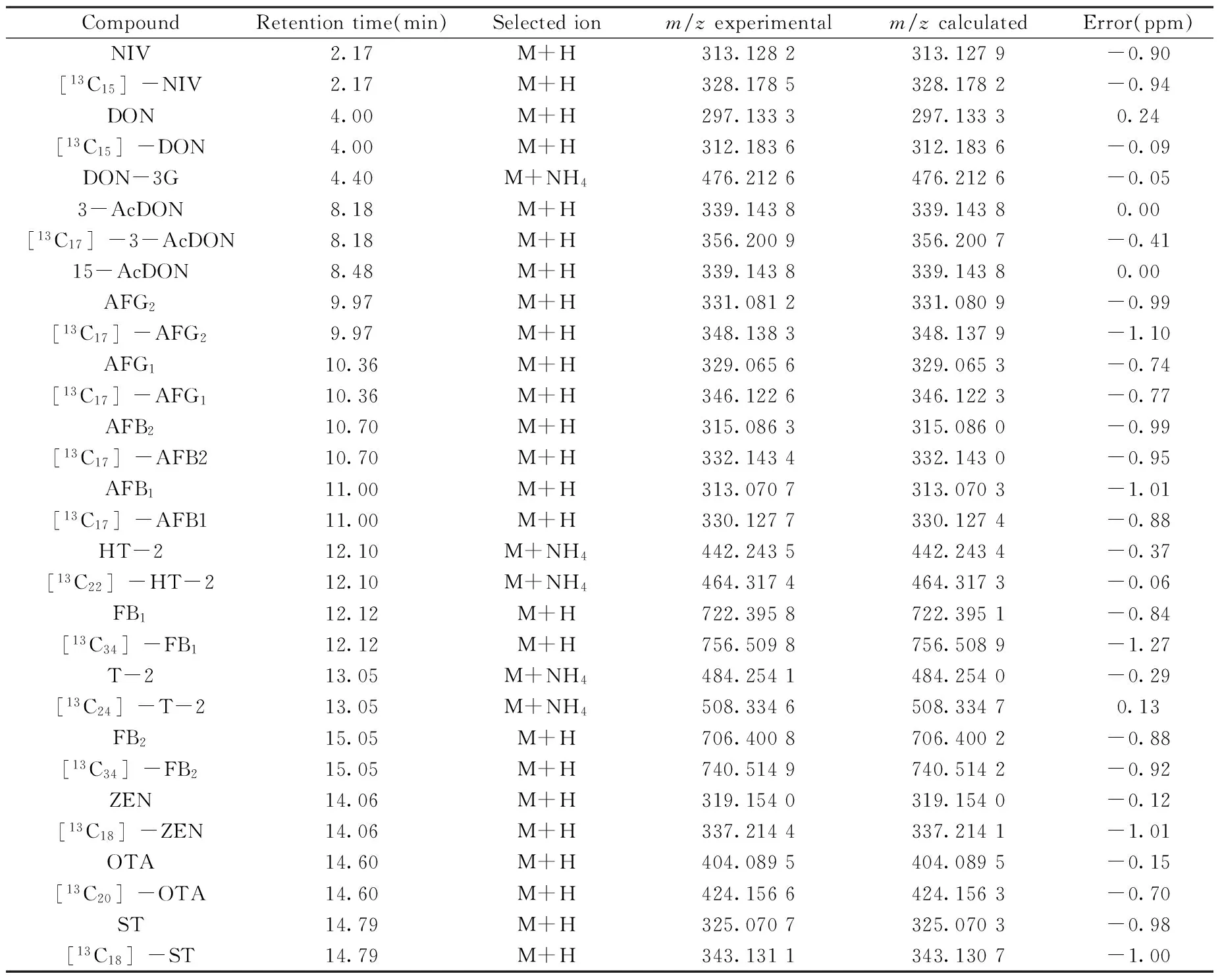
表2 相关毒素的保留时间和选择离子的精确分子量Table 2 Retention times and accurate masses of selected ions

表3 16种真菌毒素的线性范围、检出限及定量下限Table 3 Linear ranges,LODs and LOQs of 16 mycotoxins
2.6.2 准确度与精密度 取空白玉米、小麦、大麦、大米样品,分别添加高、中、低3个浓度水平的混合标准溶液,按“1.4”方法进行处理,每个加标水平进行6次重复实验,加标浓度、回收率及相对标准偏差(RSD)见表4。16种真菌毒素的回收率均在75.3%~123.5%之间,RSD为0.41%~14.7%,符合欧盟法规[28]对于真菌毒素检测方法回收率和RSD的要求。
2.6.3 质控样品的考察 为了进一步验证本方法的准确性和适用性,使用本方法测定了FAPAS能力测试玉米样品(FAPAS T04246QC)。结果如表5所示,证书标示的8种真菌毒素的检测值均在范围内,且接近标示中值,表明本方法准确可靠。相比于基于三重四极杆(QQQ,TSQ QUANTUM ULTRA)的检测方法[18],两种方法的相对平均偏差均不大于5.8%,结果无显著性差异。但高分辨质谱方法(HRMS)的定量更加简单,且无需对目标物逐个优化母离子、子离子和碰撞能量,对多目标物分析时可以有效减少建立仪器方法的难度与时间,便于实验室快速建立准确可靠的定量方法。
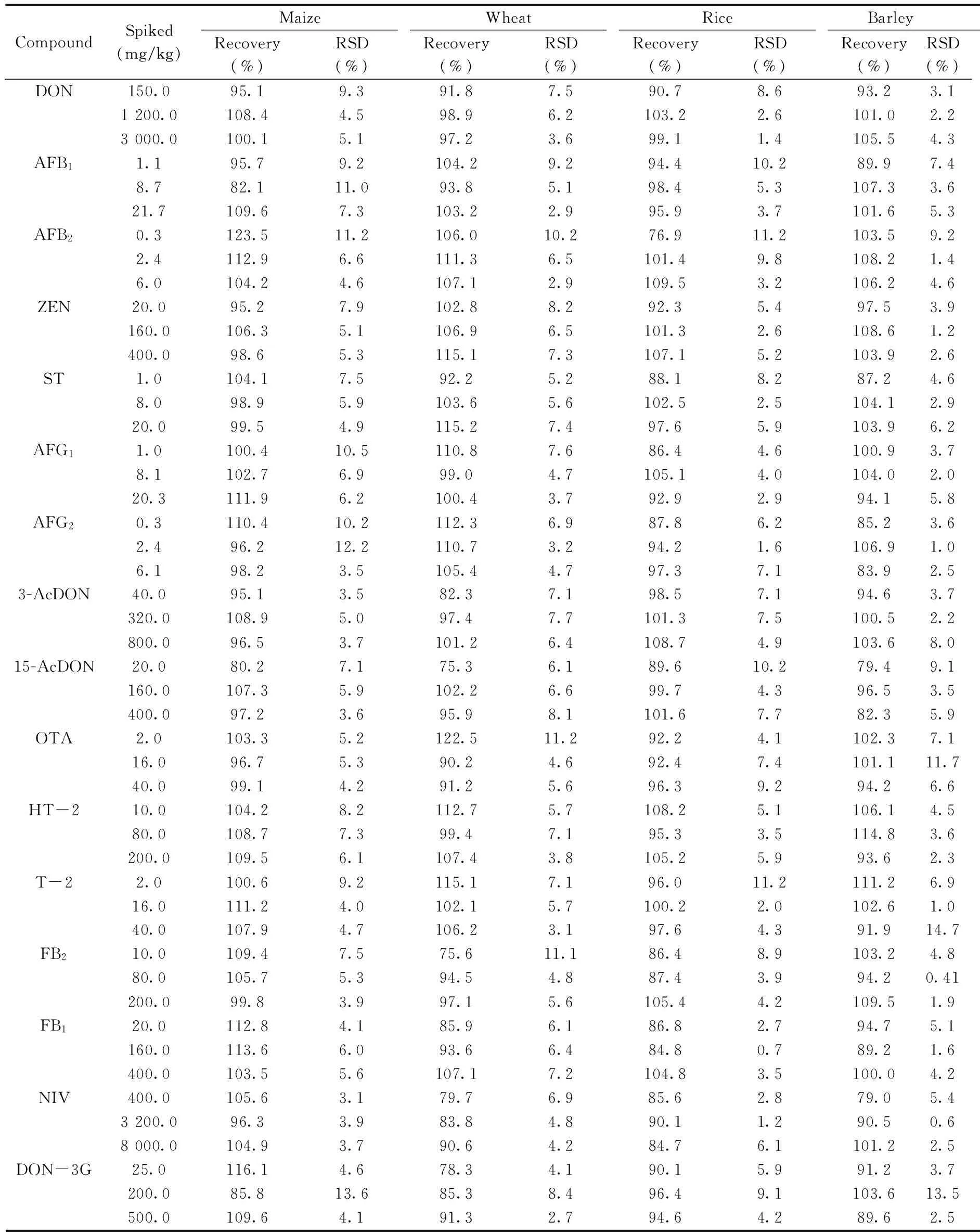
表4 16种真菌毒素的回收率与相对标准偏差(n=6)Table 4 Recoveries and relative standard deviations(RSDs) of 16 mycotoxins(n=6)
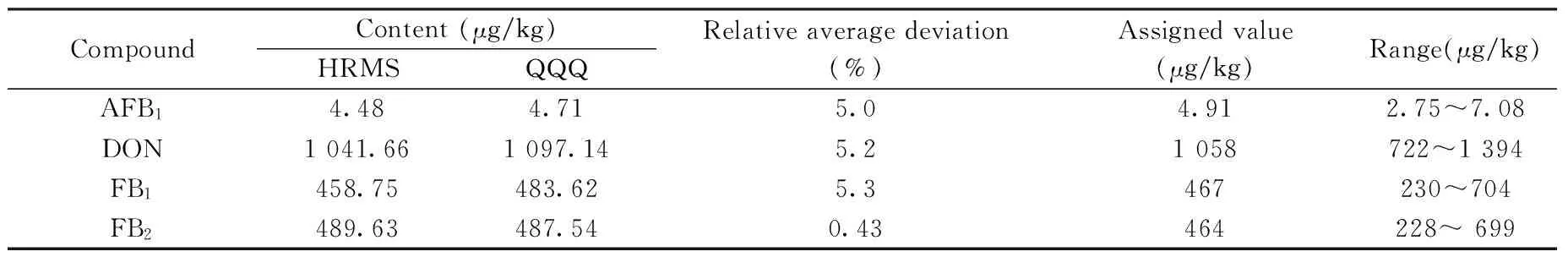
表5 FAPAS能力测试样品的检测结果Table 5 Results of FAPAS proficiency test sample
(续表5)
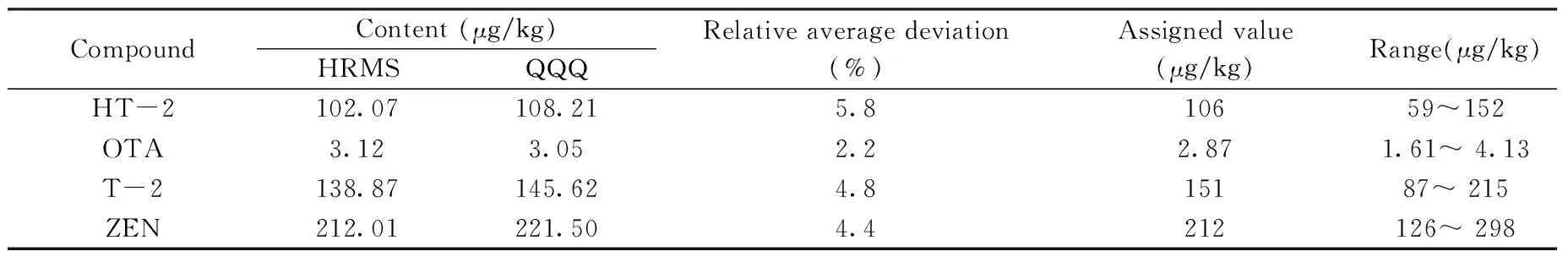
CompoundContent(μg/kg)HRMSQQQRelativeaveragedeviation(%)Assignedvalue(μg/kg)Range(μg/kg)HT-2102.07108.215.810659~152OTA3.123.052.22.871.61~4.13T-2138.87145.624.815187~215ZEN212.01221.504.4212126~298
2.7 实际样品的测定
采用本方法对某地区的10份小麦样品进行检测,共检出NIV,DON,DON-3G,15-AcDON,3-AcDON,AFB1,AFB2,ZEN,ST 9种真菌毒素,其他7种真菌毒素均未检出,结果如表6所示。部分检出毒素的定性结果如图3所示。近年来由于异常气候的原因,导致我国部分地区真菌毒素的污染较为严重,因此加强日常监测尤为重要。本方法可以适用于大量粮食样品中真菌毒素的快速准确定量分析。
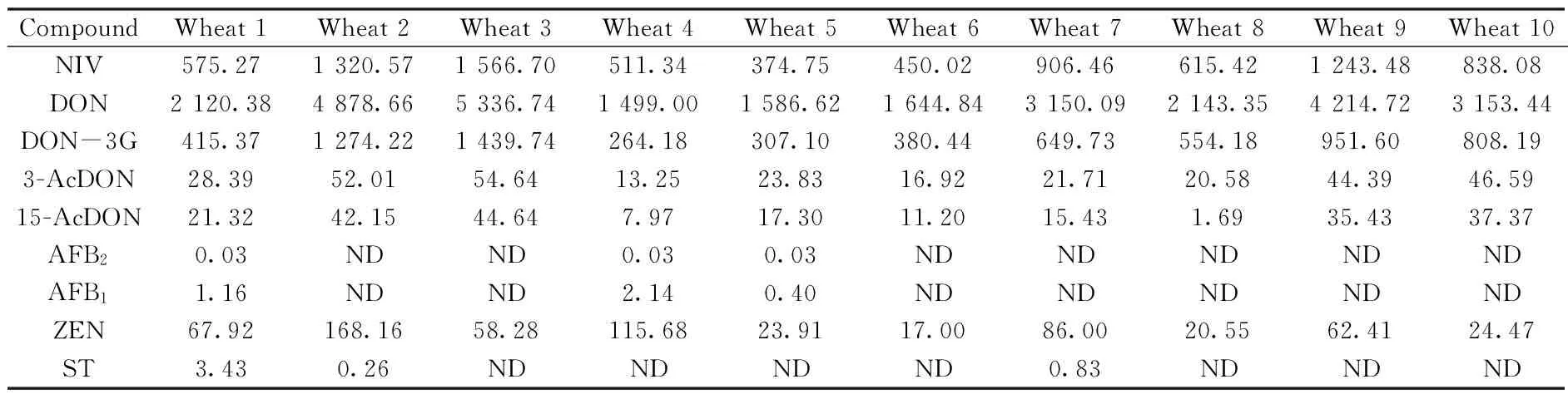
表6 10份小麦样品中真菌毒素毒素的含量Table 6 Contents of mycotoxins in 10 wheat samples w/(μg·kg-1)


图3 实际样品(A)和标准溶液(B)中黄曲霉毒素B1的二级质谱图Fig.3 MS2 spectra of AFB1 in real sample(A) and standard solution(B)
3 结 论
基于Q-Exactive高分辨质谱技术,结合稳定同位素,建立了粮食中16种真菌毒素的快速准确检测方法。样品只需简单的提取、稀释、离心和过滤,即可直接上机检测。采用加标回收法和测定基体标准物质验证了方法的准确度和精密度,方法的定量下限可满足国内外对粮食中真菌毒素限量的要求。本方法前处理快速,无需净化,避免了净化过程中的损失与误差,且利用稳定同位素稀释法定值,避免了基质效应的影响,可满足大量粮食样品中真菌毒素快速、准确定量分析的需要。
[1] Van Egmond H,Schothorst R,Jonker M A.Anal.Bioanal.Chem.,2007,389(1):147-157.
[2] Commission Regulation(EC) No 1881/2006,Setting Maximum Levels for Certain Contaminants in Food Stuffs.
[3] Commission Recommendation of 27 March 2013 on the Presence of T-2 and HT-2 Toxin in Cereals and Cereal Products.
[4] GB 2761-2011.National Food Safety Standards Maximum Levels of Mycotoxins in Foods.National Standards of the People's Republic of China(食品中真菌毒素限量.中华人民共和国国家标准).
[5] GB/T 17480-2008.Determination of Aflatoxin B1in Animal Feeding Stuffs-Enzyme-Linked Immunosorbent Assay.National Standards of the People's Republic of China(饲料中黄曲霉毒素B1的测定 酶联免疫吸附法.中华人民共和国国家标准).
[6] LS/T 6111-2015.Inspection of Grain and Oils-Detection of Aflatoxin B1 in Grain-Rapid Quantitative Method of Colloidal Gold Technique.Grain Industry Standard of the People's Republic of China(粮油检测粮食中黄曲霉毒素B1测定胶体金快速定量法.中华人民共和国粮食行业标准).
[7] LS/T 6114-2015.Inspection of Grain and Oils-Detection of Ochratoxin A in Grain-Rapid Quantitative Method of Colloidal Gold Technique.Grain Industry Standard of the People's Republic of China(粮油检测 粮食中赭曲霉毒素A测定 胶体金快速定量法.中华人民共和国粮食行业标准).
[8] Xie G,Wang S X,Zhang Y.Chin.J.Anal.Chem.(谢刚,王松雪,张艳.分析化学),2013,41(2):223-228.
[9] GB/T 25220-2010.Inspection of Grain and Oils-Detection of Ochratoxin A in Grain by High Performance Liquid Chromatography and Fluorometer.National Standards of the People's Republic of China(粮油检测 粮食中赭曲霉毒素A的测定 高效液相色谱法和荧光光度法.中华人民共和国国家标准).
[10] GB/T 5009.240-2016.NationalFoodSafetyStandardsDeterminationofFumonisioninFoods.National Standards of the People's Republic of China(食品中真菌毒素限量.中华人民共和国国家标准).
[11] Sulyok M,Krska R,Schuhmacher R.Anal.Bioanal.Chem.,2007,389(5):1505-1523.
[12] Varga E,Glauner T,Berthiller F,Krska R,Schuhmacher R,Sulyok M.Anal.Bioanal.Chem.,2013,405(15):5087-5104.
[13] Zachariasova M,Lacina O,Malachova A,Kostelanska M,Poustka J,Godula M,Hajslova J.Anal.Chim.Acta,2010,662(1):51-61.[14] Li R,Huang Y S,Wang Y,Gao Y Q,Tan G L,Li X L.Chin.J.HealthLab.Technol.(李蓉,黄莹偲,王勇,高永清,谭国良,李向丽.中国卫生检验杂志),2015,25(18):3195-3198.
[15] Zheng C M,Zhang Y,Wang S X,Xie G,Zhang G M.J.Instrum.Anal.(郑翠梅,张艳,王松雪,谢刚,张广民.分析测试学报),2012,31(4):383-389.
[16] Meng J,Zhang J,Zhang N,Shi J C,Shao B.Chin.J.Chromatogr.(孟娟,张晶,张楠,施嘉琛,邵兵.色谱),2010,28(6):601-607.
[17] Ren Y P,Zhang Y,Shao S L,Cai Z X,Feng L,Pan H F,Wang Z G.J.Chromatogr.A,2007,1143(1):48-64.
[18] Hu W,Xu L,Yang J,Ling R.Chin.J.Chromatogr.(胡文彦,许磊,杨军,凌睿.色谱),2014,32(2):133-138.
[19] Koesukwiwat U,Sanguankaew K,Leepipatpiboon N.FoodChem.,2014,153:44-51.
[20] Varga E,Glauner T,Köppen R,Mayer K,Sulyok M,Schuhmacher R,Krska R,Berthiller F.Anal.Bioanal.Chem.,2012,402(9):2675-2686.[21] Xin Y Y,Zhang Y,Wang S X,Wu Y,He X W.J.Chin.CerealsOilsAssoc.(辛媛媛,张艳,王松雪,吴宇,贺小蔚.中国粮油学报),2016,30(12):126-130.
[22] Kaufmann A.TrAC,TrendsAnal.Chem.,2014,63:113-128.
[23] Wu B,Ding T,Liu H,Chen H L,Zhao Z Y,Zhang R,Shen C Y.Chin.J.Chromatogr.(吴斌,丁涛,柳菡,陈惠兰,赵增运,张睿,沈崇钰.色谱),2012,30(12):1246-1252.
[24] Wang J,Chow W,Leung D,Chang J.J.Agric.FoodChem.,2012,60(49):12088-12104.
[25] Gómez-Ramos M M,Rajski,Heinzen H R,Fernández-Alba A.Anal.Bioanal.Chem.,2015,407(21):6317-6326.[26] Ferrer I,García-Reyes J F,Fernandez-Alba A.TrAC,TrendsAnal.Chem.,2005,24(7):671-682.
[27] Gómez-Pérez M L,Romero-González R,Vidal J L M,Frenich A G.Talanta,2015,131:1-7.
[28] Commission Regulation(EU) No 519/2014 Amending Regulation(EC) No 401/2006 as Regards Methods of Sampling of Large Lots,Spices and Food Supplements,Performance Criteria for T-2,HT-2 Toxin and Citrinin and Screening Methods of Analysis.
Determination of Mycotoxins in Cereals by UPLC-Quadrupole/Orbitrap High Resolution Mass Spectrometry
YE Jin,WU Yu,XIN Yuan-yuan,ZHOU Ming-hui,XIE Gang,WANG Song-xue*
(Academy of State Administration of Grain,Beijing 100037,China)
A UPLC-Quadrupole/Orbitrap high-resolution mass spectrometric(HRMS) method with stable isotope dilution technique was established for the determination of 16 mycotoxins in cereals.The sample was extracted with acetonitrile-water-acetic acid(70∶29∶1,by volume).The mycotoxins were separated on a C18column,and quantified in full scan mode.The method showed good linearities(r2>0.999) in a certain concentration range.The average recoveries and RSDs of mycotoxins in 4 kinds of cereals(wheat,maize,rice and barley) were in the range of 75.3%-123.5% and 0.41%-14.7%,respectively.The method was simple and accurate,and was suitable for the daily monitoring of mycotoxins.
mycotoxins;high resolution mass spectrometry(HRMS);cereals;stable isotope dilution
10.3969/j.issn.1004-4957.2017.04.002
2016-09-26;
2016-11-25
国家重点研发计划(2016YFE0113000)
O657.63;S852.44
A
1004-4957(2017)04-0449-08
*通讯作者:王松雪,博士,研究员,研究方向:粮油分析和质量控制,Tel:010-58523708,E-mail:wsx@chinagrain.org
