6个树种1年生枝木质部的水力特征及与栓塞修复能力的关系*
2017-04-27姜在民张硕新
党 维 姜在民 李 荣 张硕新,3 蔡 靖,3
(1. 西北农林科技大学林学院 杨凌 712100; 2. 西北农林科技大学生命科学学院 杨凌 712100;3. 陕西秦岭森林生态系统国家野外科学观测研究站 杨凌 712100)
6个树种1年生枝木质部的水力特征及与栓塞修复能力的关系*
党 维1姜在民2李 荣1张硕新1,3蔡 靖1,3
(1. 西北农林科技大学林学院 杨凌 712100; 2. 西北农林科技大学生命科学学院 杨凌 712100;3. 陕西秦岭森林生态系统国家野外科学观测研究站 杨凌 712100)
【目的】植物木质部栓塞修复能力已成为植物抗旱性研究的热点。本研究探讨6个耐旱树种木质部水力特征及与栓塞修复能力之间的关系,以及决定栓塞修复能力的主要影响因子,为筛选抗旱树种提供理论依据。【方法】以西北农林科技大学博览园内生长良好的6个耐旱树种(刺槐、沙棘、榆树、元宝枫、旱柳、榛)的1年生枝为研究对象,采用Cochard Cavitron离心机诱导木质部栓塞,构建6个树种的木质部栓塞脆弱曲线,得到其栓塞脆弱性(P50)值,同时测定枝条的木质部水力直径(Dh)、黎明前木质部水势及自然状态下栓塞程度(NPLC),利用低压液流计及染色法测定已栓塞枝条不同时段(20,40,60,80,100 min)的栓塞修复程度(1-PLC),进而探究不同树种木质部栓塞修复能力与栓塞脆弱性、水力直径、黎明前水势和NPLC间的关系。【结果】 1) 6个树种栓塞脆弱性大小依次为刺槐 > 榆树 > 沙棘 > 旱柳 > 榛 > 元宝枫,其中元宝枫的抗栓塞能力最强; 水力直径依次为刺槐 > 榆树 > 榛 > 沙棘 > 旱柳 > 元宝枫。2) 用染色法测得的木质部栓塞修复程度与低压液流计测得的木质部栓塞修复程度相一致(回归方程是y=1.047x-7.567,R2=0.863); 低压液流计法测定的值完全可以反映在不同时间段栓塞枝条的修复状况。3)6个树种1年生枝木质部栓塞修复能力依次为刺槐 > 榆树 > 沙棘 > 旱柳 > 榛 > 元宝枫,植物重新供水后,木质部栓塞修复能力强的树种能迅速恢复栓塞导管的输水功能; 栓塞修复能力与栓塞脆弱性大小顺序完全一致,呈显著的正相关(R2=0.980),即木质部栓塞脆弱性大的树种,其栓塞修复能力也越强; 回归分析表明,6个树种木质部水力直径、黎明前水势和NPLC与栓塞修复能力有很强的相关性(R2分别为0.868,0.740,0.741)。 【结论】植物木质部水力特征与栓塞修复能力密切相关,特别是木质部栓塞脆弱性(P50)和水力直径与栓塞修复能力有很强烈的正相关,是决定栓塞修复能力的主要影响因子。
栓塞修复; 木质部水力特性; 栓塞脆弱性; 水力直径
干旱是引起植物产生水分亏缺的一个环境因子,水分亏缺导致的减产超过其他所有自然灾害的总和(李吉跃, 1991)。植物的正常生命活动只有在一定量的水分条件下才能进行,否则就会受到阻碍,甚至死亡(Caietal., 2010b; Martreetal., 2002; Quigleyetal., 2002)。在水分较为匮乏的地区,木质部空穴化在木本植物体上普遍存在(张硕新等, 2000)。自20世纪80年代,木质部空穴化和栓塞在植物抗旱方面的研究不断增多(Tyreeetal., 2003; Cochardetal., 2008),研究表明: 植物木质部空穴化和栓塞引起的植物输水功能障碍可影响植物的气孔运动及耐旱能力,导致植物死亡(Salleoetal., 2000; Nardinietal., 2013)。此外,栓塞的积累会影响植物对生物攻击的防御能力(McDowelletal., 2011)。很多学者认为: 树木的抗旱性在一定程度上可以由其抵抗栓塞发生的能力或者栓塞后的修复能力所决定(Cochardetal., 2008; Awadetal., 2010;Schoonmakeretal., 2010)。近几年,对木质部栓塞修复的研究成为该领域的热点问题(Zwienieckietal., 2009; Nardinietal., 2011; Ogasaetal., 2013; Rollandetal., 2015)。植物重新供水后,木质部水势升高,栓塞导管内的空气泡逐渐坍塌,导水率恢复,即为木质部栓塞后的恢复过程。越来越多的研究认为,木质部空穴化和栓塞是植物正常生长过程中的“平常事件”(申卫军等, 1999; McCullohetal., 2015)。然而,目前对于木质部栓塞和修复过程的频繁发生颇有争议(Wheeleretal., 2013; Cochardetal., 2013; McCullohetal., 2015)。Wheeler等(2013)研究认为,这种有规律的栓塞与修复过程是由于水下切割样本而人为诱导木质部空穴化,从而低估了植物的抗空穴化能力,因而应采取释放张力切割样本的措施。但Wang等(2014)对刺槐(Robiniapseudoacacia)研究发现冲洗和未冲洗的枝条对导水率损失没有影响; Venturas等(2015)对5个树种采用这2种方法进行比较,结果表明不存在张力诱导木质部栓塞的人为影响。早期观点认为,木质部水势只有达到正压或稍负时木质部栓塞才能修复(Milburn, 1979; Tyreeetal., 2002),而在干旱期间或生长季节是不可能修复的(Tyreeetal., 1988)。正的根压能够驱动草本、灌木和低矮树木木质部栓塞的修复,却不能很好地解释高大乔木的栓塞修复现象(Tyreeetal., 2002)。随着栓塞修复研究的不断深入,有学者发现当木质部处于负压下时,栓塞也能修复。Salleo等(1996)报道了木质部水势为-0.101 MPa时,栓塞的木质部在一夜间可恢复其输水能力; 张硕新(1996)发现在自然状况下欧洲红豆杉(Taxusbaccata)已栓塞的木质部在-1.62 MPa的水势条件下2 h即可恢复; 申卫军等(2000)对3个耐旱树种的研究结果支持负压下木质部栓塞修复的观点。近年来,负压下木质部栓塞修复得到越来越多学者的支持,据此提出了“新颖再充水”(novel refilling)栓塞修复机制(Salleoetal., 2009; Nardinietal., 2011)。Salleo等(1996)对月桂(Laurusnobilis)栓塞修复过程研究发现,导管周围木薄壁细胞的盐分分泌到管腔内,从而产生渗透压驱动栓塞导管重新恢复其输水功能; Brodersen等(2010)利用高分辨率CT技术直接观察到负压下葡萄(Vitis)木质部栓塞修复过程,发现栓塞引起导管周围的薄壁细胞分泌可溶性物质进入栓塞导管,从而产生水势差促使更多的水分进入栓塞导管; Perrone等(2012)对葡萄叶柄栓塞修复的研究也有类似的结论。冷华妮(2012)发现84K杨(Populusalba×P.glandulosa)木质部栓塞修复是根压和导管周围薄壁细胞中水通道蛋白共同作用的结果。越来越多的试验支持“新颖再充水”栓塞修复机制(Francescaetal., 2012; Brodersenetal., 2013; Rollandetal., 2015)。栓塞修复过程依赖于通过渗透机制产生的正压,促使溶质从周围的薄壁组织细胞进入栓塞的导管,水分进入栓塞导管是由水通道蛋白的促进或韧皮部驱动充水,使木质部栓塞修复。因而,木质部薄壁细胞和韧皮部在栓塞修复过程中溶质或水的有效性上发挥着重要作用。植物木质部栓塞修复的发生可能与解剖结构有关(Ogasaetal., 2013; Trifilòetal., 2015)。但对木本植物木质部水力特征,水力特征与栓塞修复是否有关,有何种关系,目前尚未见报道。为此本研究选取北方常见的6个耐旱树种,用Cochard Cavitron离心机诱导木质部栓塞,观察并测定6个树种栓塞修复能力及其与木质部水力特征的关系,通过木质部水力特征对木质部栓塞修复能力的影响,探究影响栓塞修复能力的主要因子,这有利于评价不同功能型植物对干旱胁迫的响应,为预测气候变化背景下植物的分布、筛选抗旱树种提供理论依据。
1 试验区概况与研究方法
1.1 试验区概况
试验区在西北农林科技大学博览园内(34°16′N,108°07′E),海拔457 m,地处关中平原腹地,属半湿润地区,主要土壤类型为塿土。暖温带季风大陆性气候,年均气温12.9 ℃,极端最高气温42 ℃,极端最低气温-19.4 ℃,无霜期221天,年均蒸发量884 mm,年均降水量651 mm,生长季节(4—9月)降水量占全年降水量的79%,因此春秋季节干旱严重。
1.2 试验材料
试验材料为西北农林科技大学博览园内正常生长的6个耐旱树种: 刺槐、沙棘(Hippophaerhamnoides)、榆树(Ulmuspumila)、元宝枫(Acertruncatum)、旱柳(Salixmatsudana)、榛(Corylusheterophylla)。各树种选取基部直径6~8 mm、长度60~70 cm的1年生枝条作为试验材料,因1年生枝条木质部结构已基本稳定,且对栓塞的反应比较敏感。每树种选取来自不同植株的5根枝条诱导其栓塞,测定栓塞后5个不同时间段(见1.4节)木质部的恢复状况,每个时间段测5个重复值。
1.3 木质部水力特征测定
1.3.1 黎明前的水势与自然状态下栓塞程度的测定 2015年7—8月期间,于清晨5:30日出之前,剪取1年生枝装入事先放有湿毛巾的黑塑料袋内,以防止水分散失和外界空气进入切开的导管。立即带回实验室测定其黎明前水势(pre-dawn water potential,以下简称水势)。采用“压力室法”测定1年生枝水势(model 1515D; PMS Instruments Co., Corvallis, OR, USA),用锡纸袋将待测小枝或叶片包裹平衡1 h后进行测量,使叶片水势等于枝条水势(Wangetal., 2014)。每个枝条测3片叶片的水势值,其平均值即为该枝条黎明前水势。
同时,将测定完水势的枝条上部套在黑色塑料袋内,底部置于水中浸泡,在枝条的基部切取(切取过程在水下进行,以防空气泡进入导管瞬时形成栓塞)5个连续的2 cm茎段,测定小枝的导水率(Kh)及黎明前自然状态下导水率损失值(NPLC,以下简称栓塞程度)。导水率的测定选用“多通道低压液流计”技术(Low Pressure Flow Meter with multi-channels, LPFM)(Tyreeetal., 1988),测定所用的冲洗液为真空抽滤泵除气2 h并经由0.2 μm微孔过滤的0.1 mol·L-1的KCl溶液,在0.13 MPa压力下冲洗茎段2 min,除去茎段内所有的栓塞(预试验表明2 min可冲掉全部栓塞)。用导水率损失百分数表示1年生枝的栓塞程度,自然状态下栓塞程度计算公式为
(1)
式中:Kh为冲洗前切段的初始导水率值,Kmax为切段在0.13 MPa高压下反复冲洗后获得的最大导水率值(方法详见Tyreeetal., 1988)。5个2 cm茎段的相应测定值平均值,即为该枝条的导水率和自然状态下栓塞程度。
1.3.2 木质部栓塞脆弱性测定 将测定过栓塞程度的枝条剩余部分,浸入水中,在水下用锋利的单面刀片去除叶片,截取中间长度为27.4 cm的枝段(剩余茎段用于水力直径的测量,保证水势、栓塞程度、水力直径与栓塞脆弱性测定的是同一根枝条),注意基部一端带皮直径为6~8 mm。用0.1 mol·L-1除气的KCl溶液在0.13 MPa的压力下冲洗30 min,以除去枝条自然状态下及采样时人为诱导产生的栓塞。然后迅速放入Cochard Cavitron离心机内(Model C 4·11; Jouan, Saint Nazaire, France)(Cochard, 2002; Cochardetal., 2005),在0.03 MPa的起始压力下离心30 min,从而获得一个稳定的最大导水率(Kmax),通过控制离心的速度形成从低到高的一系列压力(T, MPa),记录在不同压力下枝条的导水率值(Kh)。不同压力下导水率损失百分数(PLC)的计算公式为
(2)
式中:Kmax为压力最小(通常为T=-0.5 MPa)时的导水率值,即最大导水率值。根据不同压力及其对应的导水率损失值,建立植物木质部栓塞脆弱曲线(vulnerability curves,简称“VC”)(Cochard, 2002; Cochardetal., 2005),其通常能用Weibull累积分布函数(CDF)f(T;b,c) 较好地拟合(Caietal., 2010b),即
(3)
式中:b和c是符合Weibull累计分布函数的常量。导水率损失百分数(PLC)为
(4)
植物栓塞脆弱性的大小通常用引起导水率损失50%时对应的压力值(P50)来表示。曲线拟合后能够得到最适的b和c值,根据公式
(5)
即可计算出每个枝条的P50值。每个树种测定来自不同植株的6根枝条,其平均值为该树种的P50值。
通过Cochard离心机技术诱导1年生枝的导水率损失值(PLC)达到95%以上,以此作为人为诱导木质部栓塞的枝条,取出平置于水下,等待不同时间段后,进行栓塞后恢复程度的测定。
1.3.3 水力直径的测定 用Leica RM2235 轮转式切片机在每个枝条剩余枝段的横切面上切取厚度为20 μm的薄片,每个树种切取5个完整的横切面。用0.1%(W/V)的碱性品红溶液(含有0.1 mol·L-1KCl溶液)对切片进行染色,数秒后将切片放入清水中漂洗浮色,再用不同浓度酒精(30%,50%,75%,90%)进行4 s的脱水处理,放置于滴有甘油的载玻片上,盖上盖玻片。将制好的切片放置在Leica DM4000B正置荧光显微镜下,进行100×或200×观察并拍照。在图像处理系统(WINCELL 2007软件)所得到的原始数据基础上计算水力直径(Dh, μm)。用WINCELL 2007软件分析时,每个切片选取均匀分布的3个楔形,每个楔形沿射线细胞由木质部外侧向髓心方向划取。水力直径(Dh)能够提供木质部导管(或管胞)对样品水分导度贡献率方面的信息,计算公式(Ogasaetal., 2013)为
(6)
式中:d为所测量的每个导管的直径。不同枝条的水力直径平均值即为该树种的水力直径。
1.4 木质部栓塞修复状况
1.4.1 栓塞修复导管的可视化测定——染色法 对于在水下恢复40 min和100 min 2个时间段的枝条,在靠顶部一侧中心处截取2 cm茎段,用碱性品红染料在0.3 kPa压力(染液高度约为30 cm)下染色(预试验表明,5 min能够使栓塞修复的导管完全染色),再用0.1 mol·L-1KCl溶液在0.13 MPa压力下将染色茎段冲洗5 min,以冲洗掉多余的染料(Caietal., 2010b)。用切片机在染色茎段的中部切取20 μm厚的薄片,切片要保持整个横切面的完整性,然后用不同浓度梯度的酒精进行脱水处理并制片。将制好的切片放置在显微镜下观察并拍照(具体方法见1.3.3)。在通过WINCELL 2007软件所得到的原始数据的基础上计算出每个导管的直径。根据染色和未染色导管的直径,计算出理论上导水率损失百分数(PLCtheory)为
(7)
式中:Dstain是染色(传导)导管的直径,Dunstain是未染色(栓塞)导管的直径。将染色法计算出的导水率损失值(PLCtheory)与低压液流计(LPFM)测得的相对应的导水率损失百分数进行比较。
1.4.2 栓塞修复程度的测定 将人为诱导木质部栓塞的枝条平置于水下,每个树种诱导5个枝条,分别修复20,40,60,80,100 min后,在靠近基部一侧从中心处切取5个连续的2 cm截段(枝条的切取要在水下进行),用低压液流计(LPFM)测其导水率损失百分数(PLC)。用导水率修复百分数来量化表示木质部栓塞修复能力,计算公式为
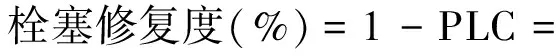
(8)
式中:Kh为冲洗前切段的初始导水率值,Kmax为截段在0.13MPa下反复冲洗后的最大导水率值。每个树种每个时间段做5个重复,其平均值即为该树种木质部栓塞修复程度。
1.5 数据处理
用Microsoft Office Excel 2003软件进行数据整理分析,采用SPSS 19.0分析软件进行统计分析。采用单因素方差分析(One-way ANOVA)比较不同树种间的差异性,P< 0.05表示差异性显著。
2 结果与分析
2.1 木质部水力特征
2.1.1 6个树种木质部栓塞脆弱性 刺槐、沙棘、榆树的1年生枝对木质部栓塞十分敏感,在木质部压力刚出现负值的初始阶段,木质部导水率损失迅速增大,随着水势的不断降低,木质部栓塞化程度呈迅速增大的趋势,用Weibull函数能够很好地拟合这3个树种的栓塞脆弱曲线,呈典型的“r”形(图1)。与此不同的是,元宝枫、榛、旱柳1年生枝的栓塞脆弱性较小,当木质部压力在一定范围内减小时,导水率损失几乎维持不变,只有压力达到一定程度后导水率损失值才开始增大,木质部发生栓塞,木质部栓塞脆弱曲线用Weibull函数进行拟合,呈典型的“s”形(图1)。6个树种木质部栓塞脆弱性依次为刺槐 > 榆树 > 沙棘 > 旱柳 > 榛 > 元宝枫。对6个树种的P50值进行差异显著性分析,结果表明: “r”形脆弱曲线的刺槐、榆树与“s”形脆弱曲线的元宝枫、榛差异显著,但沙棘和旱柳差异不显著(表1)。植物木质部的P50值越大,说明其栓塞脆弱性越大,在水分运输过程中导管越易发生栓塞。
2.1.2 木质部水力特征参数 由表1可知,6个树种1年生枝水力直径排序为刺槐 > 榆树 > 榛 > 沙棘 > 旱柳 > 元宝枫。差异性分析表明: “r”形脆弱曲线的刺槐、榆树与“s”形脆弱曲线的元宝枫、旱柳的水力直径差异显著(P<0.05),沙棘与榛的水力直径差异不显著。
6个树种导水率值排序为刺槐 > 榆树 > 沙棘 > 榛 > 旱柳 > 元宝枫,除沙棘和榛位置置换外,其顺序基本与导管直径排序一致; 从表1可看出,尽管沙棘的导水率值比榛稍大,但二者差异不显著,这也符合Hagen-Poiseuille方程理论(Tyreeetal., 2002)。木质部导管直径越大,其导水力越强。
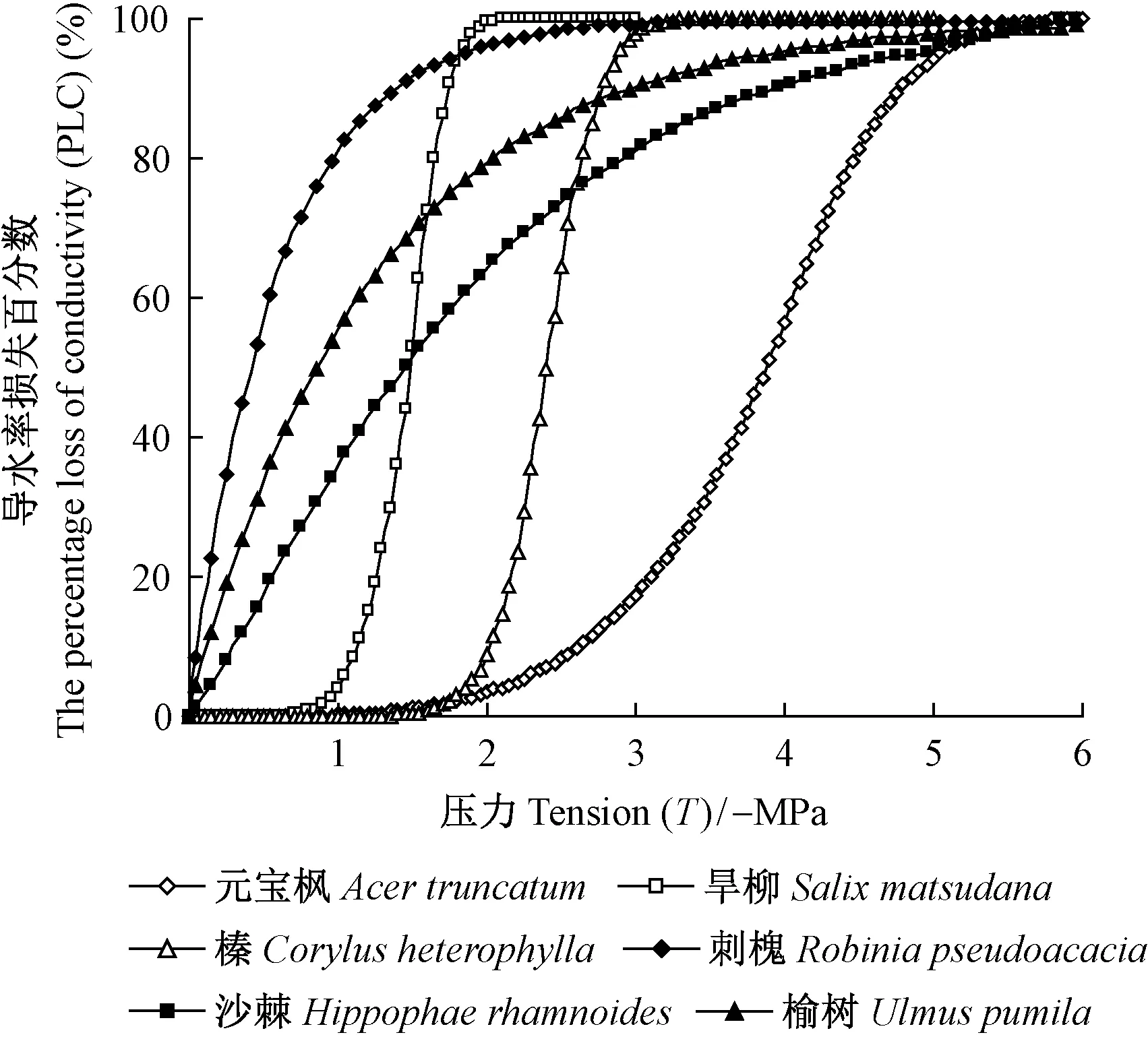
图1 6个树种栓塞脆弱曲线Fig.1 Vulnerability curves of the six tree species
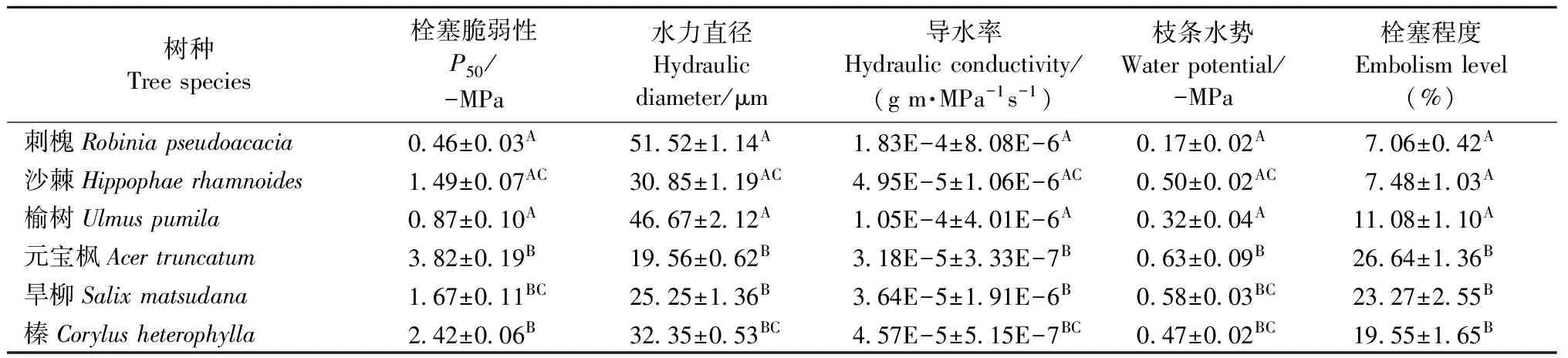
表1 6个树种的水力特征值(平均值±标准误差)①
①不同大写字母表示脆弱曲线呈“r”形与“s”形树种差异显著(P<0.05)。 Different capital letters indicate significant difference between “r” and “s” vulnerability curves of tree species.
6个树种黎明前水势值排序为:刺槐 > 榆树 > 榛 > 沙棘 > 旱柳 > 元宝枫,自然状态下栓塞程度排序为:刺槐 < 沙棘 < 榆树 < 榛 < 旱柳 < 元宝枫。黎明前木质部水势值与其栓塞程度间有一定联系,6个树种中除沙棘水势值较小而栓塞程度也较小外,其余树种均表现出黎明前水势值越小,栓塞程度越高的趋势。差异性分析表明: 脆弱曲线呈“r”形的刺槐、沙棘、榆树与脆弱曲线呈“s”形的元宝枫、旱柳、榛的平均栓塞程度差异显著(P<0.05)。
6个树种木质部栓塞程度与其导水率之间存在着明显的联系(图2)。脆弱曲线呈“r”形的刺槐、沙棘、榆树栓塞程度较小,而导水率较大; 脆弱曲线呈“s”形的元宝枫、旱柳、榛栓塞程度较大,而导水率较小。植物木质部栓塞会增加木质部水分运输的阻力,从而影响输水结构的导水效率,因而木质部栓塞程度大的树种,其导水率相对较低(Caietal., 2010a)。对6个树种导水率进行差异性分析表明: “r”形脆弱曲线的刺槐、榆树与“s”形脆弱曲线的元宝枫、旱柳差异显著(P<0.05),但沙棘与榛差异不显著。这是因为沙棘与榛的直径差异不显著(表1),根据流体力学中Hagen-Poiseuille方程,木质部管道的导水率与管道直径的4次方呈正比(Tyreeetal., 2002)。沙棘与榛导水率差异不显著,但其栓塞程度明显小于榛,可能是由于沙棘多具单独散生且被纤维包裹的独立导管,导管与导管之间由多个彼此相连的纤维组成的“纤维桥”相连,纤维桥具有阻力较小的输水特性,其高效、安全、抗空穴(Caietal., 2014)。
2.2 观测木质部栓塞修复的方法比较
6个树种栓塞后修复不同时间段(40,100 min)的1年生枝导管被染色情况变化趋势相似,且只是在数量上互有差异,因此以刺槐为例进行比较(图3)。从图3中可看出在栓塞修复40 min后只有一小部分导管被染色,说明大部分栓塞导管仍未修复其导水能力; 而在修复100 min时,大部分导管被染色,说明仅有一小部分导管仍处于栓塞状态。
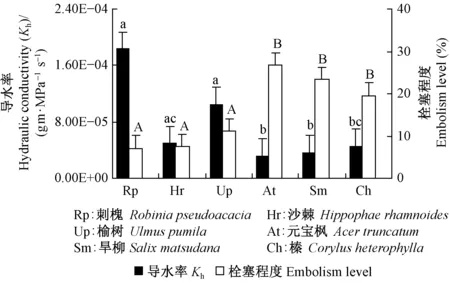
图2 6个树种生长季木质部导水率与栓塞程度的变化Fig.2 Variation of hydraulic conductivity and embolism level in six tree species during growing season不同小写字母表示各树种导水率差异显著,不同大写字母表示各树种栓塞程度差异显著(P<0.05)。Different lowercase letters indicate significant differences in hydraulic conductivity of each tree species, and different capital letters indicate significant difference in embolism level of each tree species(P<0.05).
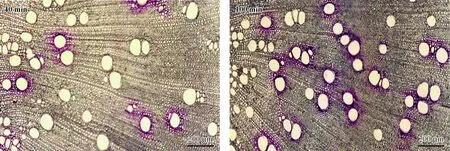
图3 栓塞后不同修复时间刺槐枝条染色的变化Fig.3 Changes of staining in the different embolism refilling time for stems of Robinia pseudoacacia
根据染色和未染色的导管直径,计算出理论的导水率损失百分数(PLCtheory)。其与传统的低压液流计(LPFM)在相同时段测得的导水率损失值(PLC)相一致(图4),回归方程是y=1.047x-7.567(R2=0.863),与y=x差异不显著,即低压液流计和染色法所测定的导水率损失百分数没有差别,因此低压液流计测定的值完全可以反映不同时间段栓塞枝条的修复状况。
2.3 木质部栓塞修复状况

图4 2种方法(染色法与低压液流计)测量的导水率损失值(PLC)Fig.4 Percentage loss of conductivity(PLC) measured by two techniques of staining and Low Pressure Flow Meter (LPFM)
6个树种1年生枝木质部栓塞后的修复状况见表2。可看出,在相同条件下,人为诱导木质部产生栓塞的1年生枝经过不同时间段修复后,6个树种均表现出修复程度随修复时间增长而变好的趋势。在修复初期(20 min),刺槐、榆树、沙棘和榛的修复程度相对较高(>20%),而元宝枫和旱柳的修复程度相对较低(<20%)。在修复后期(100 min),修复程度最好的刺槐高达88.09%,而最差的元宝枫仅36.95%,表现为属于“r”形脆弱曲线的刺槐、沙棘、榆树的修复程度高于属于“s”形脆弱曲线的元宝枫、旱柳、榛,且差异显著(P<0.05)。基于各树种100 min后的栓塞恢修复程度,其修复能力依次为: 刺槐 > 榆树 > 沙棘 > 旱柳 > 榛 > 元宝枫。
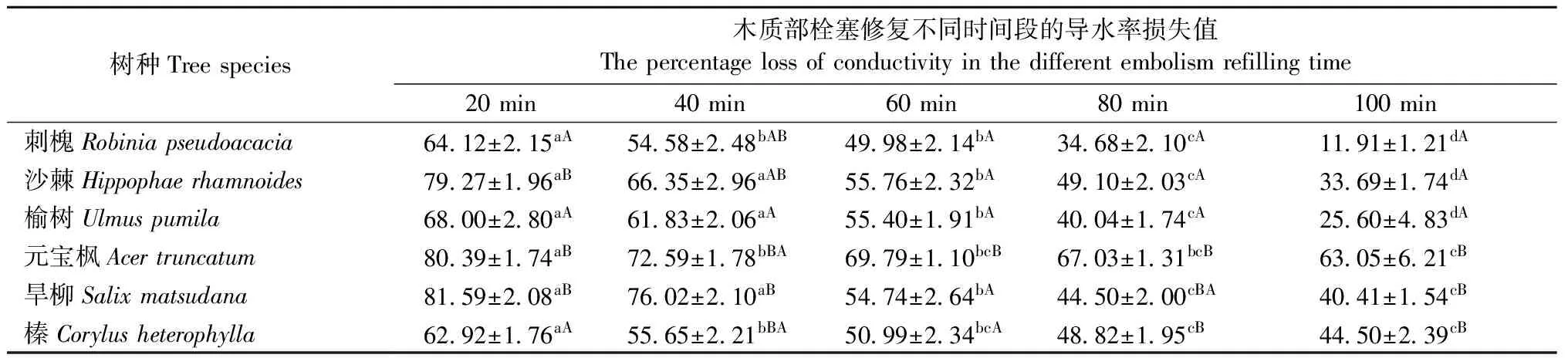
表2 6个树种1年生枝木质部栓塞修复状况①
①表中数据为导水率损失百分数平均值±标准误(%)。不同小写字母表示各树种修复不同时间差异显著,不同大写字母表示脆弱曲线“r”与“s”树种差异显著(P<0.05)。Data are mean ± SE. Different lowercase letters indicate significant differences in different times of each tree species, and different capital letters indicate significant difference between “r” and “s” vulnerability curves of tree species(P<0.05).
2.4 木质部栓塞修复能力与水力特征的关系
对6个树种栓塞脆弱性、水力直径、自然状态下栓塞程度、黎明前水势与栓塞修复能力(修复100 min时的导水率损失值)进行相关性分析(图5)。可以看出,栓塞修复能力与木质部栓塞脆弱性(P50)表现出强烈的正相关(R2=0.980)。6个树种中刺槐的P50值最大,说明其最易发生栓塞,但刺槐黎明前水势值最高,栓塞程度最小,这可能是由于刺槐木质部内栓塞的导管经过一夜得到一定程度的修复,进而反映出刺槐具有很强的修复能力。元宝枫较抗栓塞,但其栓塞后修复能力较弱,这从其黎明前木质部水势值较低也可说明。木质部栓塞脆弱性越大,其栓塞修复能力越大,即在水分充足条件下栓塞导管修复其导水功能的能力越大。沙棘比榛的木质部导管易发生空穴化,但二者黎明前水势差异不显著,且沙棘比榛的栓塞修复能力强(表1,表2),说明容易发生栓塞的树种能够通过高的修复能力进行弥补。安锋等(2006)对8种木本植物木质部栓塞后修复特性的研究表明,栓塞脆弱性越大,重新复水后栓塞修复速率越大,这与本文研究结果一致。由图5B可以看出栓塞修复能力与木质部水力直径呈正相关,相关系数为R2=0.868,木质部水力直径的大小对栓塞修复能力有一定的影响。结合表1,除榛的位置发生变化外,其余5个树种均随着水力直径的增大,栓塞修复能力增大,即植物重新供水后栓塞导管修复其输导功能的能力越大。沙棘和榛的水力直径差异不显著,但沙棘的修复程度明显高于榛,这可能与沙棘导管特殊的附物纹孔及“纤维桥”结构有关,使其具有较强的修复能力及很强的耐旱性(Caietal., 2014)。可见木质部导管直径与导管结构对栓塞修复能力都有一定影响。
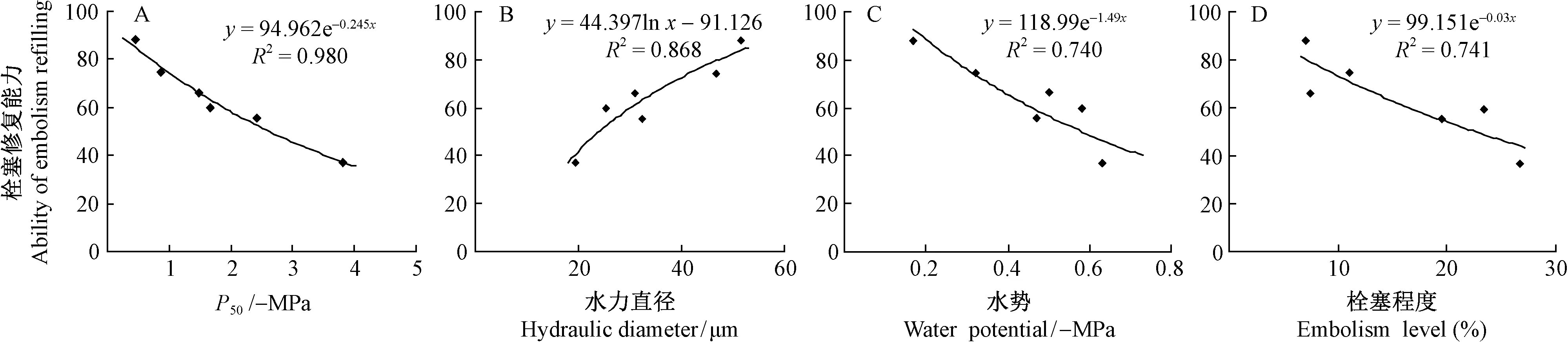
图5 6个树种栓塞脆弱性(P50)、水力直径、枝条水势、栓塞程度与栓塞修复能力的关系Fig.5 The relationship between P50, hydraulic diameter, water potential, embolism level and ability of embolism refilling in six tree species
由图5C可知,栓塞修复能力与黎明前水势间具有较高的相关性(R2=0.740)。Cole等(2015)对葡萄(Vitis)的研究发现,清晨木质部水势能够作为植物抵御水分胁迫的一个指标,并在一定程度上能够反映植物的栓塞修复能力。比较6个树种栓塞修复能力和水势的大小排序,发现除榛外,其余5个树种均表现出栓塞修复能力越大,其黎明前水势越高。结合表1和表2可知,沙棘、旱柳与榛的水势差异不显著,但沙棘栓塞修复能力高于旱柳和榛,说明沙棘在木质部水势较低的情况下也能维持较高的导水能力,抗旱性较强,其修复能力也强于旱柳与榛。在6个树种中,1年生枝黎明前水势值越高,栓塞后修复程度越好,修复能力越强,即重新复水后,植物木质部内栓塞的导管能较好地修复其输水功能。
由图5D可知,栓塞修复能力与栓塞程度具有较高的负相关(R2=0.741)。6个树种自然状态下栓塞程度越小,其修复程度越高,即该树种在水分充足条件下修复栓塞导管的能力较强。沙棘和旱柳的木质部栓塞脆弱性、黎明前水势差异均不显著,但沙棘的栓塞程度明显低于旱柳(表1),说明沙棘即使在木质部水势很低的情况下,栓塞也能很好地修复。属于“s”形脆弱曲线的元宝枫、旱柳、榛具有高的栓塞程度,一方面木质部栓塞可能是植物在干旱环境下节约水分的一种耐旱策略(Tyreeetal., 2002); 另一方面自然状态下栓塞程度高说明植物体内存在不可逆的栓塞导管,使植物很难得到修复(Trifilòetal., 2015),造成其修复能力比较低。
3 讨论
脆弱曲线能够用来描述植物对木质部栓塞的抵抗性(Tyreeetal., 1989; 李荣等, 2015)。“r”形脆弱曲线意味着在水势稍负(较高)时,植物形成大量的栓塞或产生高的导水率损失值,栓塞修复每天都在发生,栓塞的形成和消亡是一个此消彼长的过程(申卫军等, 2000; Cochardetal., 2013); “s”形脆弱曲线表示在一定的水势阈值木质部栓塞不会产生,只有在较严重干旱期间,木质部才会发生栓塞,且该栓塞过程是不可逆的(Holbrooketal., 1999),或栓塞修复的发生可能是季节性的,而不是每天都发生(Jansenetal., 2015)。植物木质部栓塞形成是一个与木材理化性质相关的非生物学过程,但栓塞修复是一个需要提供水分和能量的生理代谢过程(Secchietal., 2010)。最近的研究表明树木的栓塞修复能力与其抗空穴化能力有关(Cochardetal., 2013; Ogasaetal., 2013)。Ogasa等(2013)对7个温带木本植物研究发现,不同树种的木质部栓塞修复能力与空穴化阻力(P50的绝对值)负相关,说明木质部栓塞脆弱的树种能够通过高的修复能力进行补偿。理论上来说,“r”形脆弱曲线树种比“s”形脆弱曲线树种的木质部栓塞修复能力强。本研究的结果也表明植物木质部栓塞修复能力与栓塞脆弱性有很强的正相关(R2=0.980),支持此观点。栓塞修复效率更高的树种具有较高的栓塞脆弱性,栓塞修复机制可能是弥补一些木本植物高的栓塞脆弱性(Johnsonetal., 2012; Ogasaetal., 2013)。栓塞脆弱性大的刺槐,黎明前的木质部水势却最高(表1),刺槐可能进行了夜间修复,使得清晨时大多数导管恢复其导水能力,也说明刺槐的栓塞修复能力强。元宝枫自然状态下栓塞程度(NPLC)很高(表1),这可能是因为不可逆的栓塞导管的存在使植物很难得到修复(Trifilòetal., 2015),从而造成元宝枫栓塞修复能力小。适当的木质部栓塞可能对植物在水分胁迫下生长是有利的,这可能是植物在干旱环境下节约水分的一种耐旱策略(申卫军等, 2000)。本研究也发现,栓塞程度高的元宝枫抵御空穴化的能力也最强。枝条木质部栓塞的日变化能够为植物有规律的经历栓塞和修复提供证据(Nardinietal., 2011)。
与被子植物相比,针叶树种具有更大的水力安全边际,防止茎干木质部发生栓塞。然而,在根系和叶片内针叶树种比被子植物经历更加频繁的栓塞和修复。栓塞修复被认为是糖主动运输到空穴化导管,修复的糖源最有可能来自附近薄壁细胞的非结构碳水化合物或韧皮部(Francescaetal., 2011)。针叶树种比被子植物茎干具较少的木质部薄壁组织细胞或非结构性碳水化合物,但栓塞的快速修复可能依赖于附近的薄壁组织细胞,因此,针叶树种比被子植物需要更高的安全边际,以防止栓塞的发生(Johnsonetal., 2012)。但针叶树种末端(根或叶)经历频繁的栓塞和修复,可能是由于根和叶内存在丰富的薄壁组织细胞,作为液压断路器去防止茎干内张力引起的栓塞。同时,针叶树种叶的韧皮部和管胞位置相近,管胞周围具有供应水分给其余的管胞或缓解内部压力梯度的传输组织(Brodersenetal., 2013)。越来越多的学者认为植物输水结构特征可能是影响栓塞导管修复的一个因子(Ieperenetal., 2002; Leeetal., 2008; Brodribbetal., 2010; Rollandetal., 2015)。植物必须通过构建纹孔膜和厚的导管壁结构去获得高的抗空穴化能力,这些结构使得木材非常紧密,排除大量的活薄壁组织细胞,这可能是栓塞修复的一个原因(Johnsonetal., 2012)。Ogasa等(2013)研究发现木本植物木材密度和栓塞脆弱性与修复能力均呈负相关,认为木材密度可能是木质部抗空穴化和修复能力权衡关系的调节因子。木材密度较小的树种,具有较高的储水能力,有利于栓塞的木质部恢复输水功能。木材密度低的热带树种也能够观察到日常的栓塞发生和修复现象(Johnsonetal., 2012)。李荣等(2016)对本文6个树种木质部结构与栓塞脆弱性关系的研究,发现木材密度、导管长度、导管内径跨度和导管连接度与栓塞脆弱性有很大的相关性; 参考李荣等(2016)测量出的木质部导管长度、导管连接度、导管内径跨度及木材密度的数据,与栓塞修复能力进行回归分析,发现R2分别为0.786,0.859,0.691,都具有较高的线性关系。导管长度越长,水分在导管间运输阻力越小,其修复能力也就越强; 导管连接度越大,水分流通路径越多,其栓塞后修复更易。然而,木材密度与栓塞修复能力没有表现出强烈的相关性(R2=0.031),这可能是因为测量样本的木材密度除榛外均没有显著差异。近年来,多数研究认为同一树种内大径导管比小径导管更易发生栓塞(Wheeleretal., 2005; Caietal., 2010b; 张海昕等, 2013),进而影响植物木质部栓塞修复能力。植物木质部导管直径越大,处于导管中的空气泡就越易被溶解或逐出导管,栓塞导管也就越易修复(安锋等, 2006)。环孔材树种刺槐、榆树的直径大于半环孔材树种沙棘,也大于半散孔材树种榛和散孔材树种旱柳、元宝枫,相关分析表明: 沙棘和榛的导管直径差异不显著,而栓塞修复能力差异显著,这可能与沙棘特殊的半环孔材木质部结构有关,“纤维桥”结构使其具有良好的适应能力和很强的耐旱性(Caietal., 2014)。此外,木质部导管直径径级的分布也会影响“新颖再充水”修复机制。不同直径径级的分布对植物生长是有利的。Brodersen等(2013)发现让易栓塞的大径导管与抗栓塞的小径导管毗邻排列,抗空穴化的导管能够作为储水库,缓解水分胁迫引起的木质部张力或支持栓塞导管的再充水过程。植物木质部栓塞可否消除,取决于相邻区域(如土壤和植物体)或部位(如植物体不同部位间)是否存在足够的水势差。邻近部位或区域的水势越高,栓塞后修复越好。修复过程中所需水势差的大小取决于木质部输水分子的结构特征,特别是纹孔膜的结构特征(Shenetal., 2000)。纹孔膜是水流从一个导管(或管胞)流向另一个导管(或管胞)的入口(Choatetal., 2008; Loepfeetal., 2007),在木质部水分传导上充当了重要角色,在一定程度上对木质部栓塞修复能力有影响。根据毛细管方程,纹孔膜上微孔的直径越小,修复所需的水势差就越大,栓塞修复越难发生。今后应加强了解纹孔膜结构特征(Jansenetal., 2009; Lensetal., 2011),以进一步了解植物木质部栓塞修复特性及机制。
4 结论
植物木质部栓塞修复能力的大小与其水力特征密切相关。1年生枝木质部栓塞修复能力的强弱与栓塞脆弱性大小顺序完全一致(刺槐 > 榆树 > 沙棘 > 旱柳 > 榛 > 元宝枫),呈显著正相关(R2=0.980),即木质部栓塞脆弱性大的树种,其栓塞修复能力也越强。6个树种木质部导管水力直径和黎明前水势与栓塞修复能力也有强的正相关(R2分别为0.868,0.740)。自然状态下栓塞程度(NPLC)与栓塞修复能力具有显著的负相关(R2=0.741)。木质部水力特征对栓塞修复能力存在显著影响,其中木质部栓塞脆弱性(P50)和水力直径大小是决定栓塞修复能力的主要影响因子。
安 锋, 蔡 靖, 姜在民, 等. 2006. 八种木本植物木质部栓塞恢复特性及其与pv曲线水分参数的关系. 西北农林科技大学学报, 34(1): 38-44.
(An F, Cai J, Jiang Z M,etal. 2006. Refilling of embolism in the xylem of eight tree species and its relationship with pressure-volume parameters. Journal of Northwest A& F University, 34(1): 38-44. [in Chinese])
冷华妮. 2012. 植物栓塞修复机制与质膜内在水通道蛋白基因的克隆、表达和转基因研究. 北京: 中国林业科学研究院博士学位论文.
(Leng H N. 2012. Cloning and expression ofPIPsgene inPopulusand aquaporins role in embolism recovery. Beijing: PhD thesis of Chinese Academy of Forestry. [in Chinese])
李吉跃. 1991. 植物耐旱性及其机理. 北京林业大学学报, 13(3): 92-100.
(Li J Y. 1991. Mechanisms of drought tolerance in plants. Journal of Beijing Forestry University, 13(3): 92-100. [in Chinese])
李 荣, 姜在民, 张硕新, 等. 2015. 木本植物木质部栓塞脆弱性研究新进展. 植物生态学报, 39(8): 838- 848.
(Li R, Jiang Z M, Zhang S X,etal. 2015. A review of new research progress on the vulnerability of xylem embolism of woody plants. Acta Phytoecologica Sinica, 39(8): 838-848. [in Chinese])
李 荣, 党 维, 蔡 靖, 等. 2016. 6个耐旱树种木质部结构与栓塞脆弱性的关系. 植物生态学报, 40(3): 255-263.
(Li R, Dang W, Cai J,etal. 2016. Relationships between xylem structure and embolism vulnerability in six drought tolerance trees. Acta Phytoecologica Sinica, 40(3): 255-263. [in Chinese])
申卫军, 张硕新, 张存旭. 1999. 木本植物木质部栓塞研究进展. 西北林学院学报, 14(1): 33-41.
(Shen W J, Zhang S X, Zhang C X. 1999. Progress of studies on xylem embolism in woody plants. Journal of Northwest Forestry University, 14(1): 33-41. [in Chinese])
申卫军, 彭少麟, 张硕新. 2000. 三个耐旱树种木质部栓塞化的脆弱性及其恢复能力. 生态学杂志, 19(6): 1-6.
(Shen W J, Peng S L, Zhang S X. 2000. Studies on the xylem drought-tolerant characteristics of three drought-tolerant tree species. Chinese Journal of Ecology, 19(6): 1-6. [in Chinese])
张海昕, 李 姗, 张硕新, 等. 2013. 4个杨树无性系木质部导管结构与栓塞脆弱性的关系. 林业科学, 49(5): 54-61.
(Zhang H X, Li S, Zhang S X,etal. 2013. Relationship between xylem vessel structure and embolism vulnerability on fourPopulusclones. Scientia Silvae Sinicae, 49(5): 54-61. [in Chinese])
张硕新. 1996. 浆果紫杉木质部栓塞恢复状况的研究. 西北林学院学报, 11(1): 5-8.
(Zhang S X. 1996. The refilling of embolized xylem inTaxusbaccataL. Journal of Northwest Forestry University, 11(1): 5-8. [in Chinese])
张硕新, 申卫军, 张远迎. 2000. 六种木本植物木质部栓塞化生理生态效应的研究. 生态学报, 20(5): 788-794.
(Zhang S X, Shen W J, Zhang Y Y. 2000. Ecophysiological effect of xylem embolism in six tree species. Acta Ecologica Sinica, 20(5): 788-794. [in Chinese])
Awad H, Barigah T, Badel E,etal. 2010. Poplar vulnerability to xylem cavitation acclimates to drier soil conditions. Physiologia Plantarum, 139(3): 280-288.
Brodribb T J, Bowman D J M S, Nichols S,etal. 2010. Xylem function and growth rate interact to determine recovery rates after exposure to extreme water deficit. New Phytologist, 188(2): 533-542.
Brodersen C R, McElrone A J. 2013. Maintenance of xylem network transport capacity: a review of embolism repair in vascular plants. Frontiers in Plant Science, 4(1): 63-64.
Brodersen C R, McElrone A J, Choat B,etal. 2010. The dynamics of embolism repair in xylem: in vivo visualizations using high-resolution computed tomography. Plant Physiology, 154(3): 1088-1095.
Cai J, Hacke U W, Zhang S X,etal. 2010a. What happens when stems are embolized in a centrifuge? testing the Cavitron theory. Physiologia Plantarum, 140(4): 311-320.
Cai J, Tyree M T. 2010b. The impact of vessel size on vulnerability curves: data and models for within-species variability in saplings of aspen,PopulustremuloidesMichx. Plant, Cell & Environment, 33(7): 1059-1069.
Cai J, Li S, Zhang H X,etal. 2014. Recalcitrant vulnerability curves: methods of analysis and the concept ofbre bridges for enhanced cavitation resistance. Plant, Cell & Environment, 37(1): 35-44.
Choat B, Cobb A R, Jansen S. 2008. Structure and function of bordered pits: new discoveries and impacts on whole-plant hydraulic function. New Phytologist, 177(3): 608-625.
Cochard H. 2002. A technique for measuring xylem hydraulic conductance under high negative pressures. Plant, Cell & Environment, 25(6): 815-819.
Cochard H, Barigah S, Kleinhentz M,etal. 2008. Is xylem cavitation resistance a relevant criterion for screening drought resistance amongPrunusspecies? Journal of Plant Physiology, 165(9): 976-982.
Cochard H, Damour G, Bodet C,etal. 2005. Evaluation of a new centrifuge technique for rapid generation of xylem vulnerability curves. Physiologia Plantarum, 124(4): 410-418.
Cochard H, Delzon S. 2013. Hydraulic failure and repair are not routine in trees. Annals of Forest Science, 70(7): 659-661.
Cole J, Pagay V. 2015. Usefulness of early morning stem water potential as a sensitive indicator of water status of deficit-irrigated grapevines (VitisviniferaL.). Scientia Horticulturae, 191: 10-14.
Francesca S, Zwieniecki M A. 2011. Sensing embolism in xylem vessels: the role of sucrose as a trigger for refilling. Plant, 34(3): 514-524.
Francesca S, Zwieniecki M A. 2012. Analysis of xylem sap from functional (nonembolized) and nonfunctional (embolized) vessels ofPopulusnigra: chemistry of refilling. Plant Physiology, 160(2): 955-964.
Holbrook N M, Zwieniecki M A. 1999. Embolism repair and xylem tension: do we need a miracle? Plant Physiology, 120(1): 7-10.
Ieperen W V, Meeteren U V, Nijsse J. 2002. Embolism repair in cut flower stems: a physical approach. Postharvest Biology & Technology, 25(1): 1-14.
Jansen S, Choat B, Pletsers A. 2009. Morphological variation of intervessel pit membranes and implications to xylem function in angiosperms. American Journal of Botany, 96(2): 409-419.
Jansen S, Schuldt B, Choat B. 2015. Current controversies and challenges in applying plant hydraulic techniques. New Phytologist, 205(3): 961-964.
Johnson D M, Mcculloh K A, Woodruff D R,etal. 2012. Hydraulic safety margins and embolism reversal in stems and leaves: why are conifers and angiosperms so different? Plant Science, 195(3): 48-53.
Lee S, Kim Y. 2008. In vivo visualization of the water-refilling process in xylem vessels using X-ray micro-imaging. Annals of Botany, 101(4): 595-602.
Lens F, Sperry J S, Christman M A,etal. 2011. Testing hypotheses that link wood anatomy to cavitation resistance and hydraulic conductivity in the genusAcer. New Phytologist, 190(3): 709-723.
Loepfe L, Martinez-Vilalta J, Piol J,etal. 2007. The relevance of xylem network structure for plant hydraulic efficiency and safety. Journal of Theoretical Biology, 247(4): 788-803.
Martre P, Morillon R, Barrieu F,etal. 2002. Plasma membrane aquaporins play a significant role during recovery from water deficit. Plant Physiology, 130(4): 2101-2110.
McCulloh A K, Meinzer C F. 2015. Further evidence that some plants can lose and regain hydraulic function daily. Tree Physiology, 35(7): 691-693.
McDowell N G, Beerling D J, Breshears D D,etal. 2011. The interdependence of mechanisms underlying climate-driven vegetation mortality. Trends in Ecology & Evolution, 26(10): 523-532.
Milburn J A. 1979. Water flow in plants. London Longman Group Ltd, 1-226.
Nardini A, Battistuzzo M, Savi T. 2013. Shoot desiccation and hydraulic failure in temperate woody angiosperms during an extreme summer drought. New Phytologist, 200(2): 322-329.
Nardini A, Lo Gullo M A, Selleo S. 2011. Refilling embolized xylem conduits: is it a matter of phloem unloading? Plant Science, 180(4): 604-611.
Ogasa M, Miki N H, Murakami Y,etal. 2013. Recovery performance in xylem hydraulic conductivity is correlated with cavitation resistance for temperate deciduous tree species. Tree Physiology, 33(4): 335-344.
Perrone I, Pagliarani C, Lovisolo C,etal. 2012. Recovery from water stress affects grape leaf petiole transcriptome. Planta, 235(6): 1383-1396.
Quigley F, Rosenberg J M, Shachar-Hill Y,etal. 2002. From genome to function: theArabidopsisaquaporins. Genome Biology, 3(1): 129-137.
Rolland V, Bergstrom D M, Lenné T,etal. 2015. Easy come, easy go: capillary forces enable rapid refilling of embolized primary xylem vessels. Plant Physiology, 168(4): 1636-1647.
Salleo S, Logullopaoli D, Zippo M. 1996. Xylem recovery from cavitation-induced embolism in young plants ofLaurusnobilisL: a possible mechanism. New Phytologist,132(1): 47-56.
Salleo S, Nardini A, Pitt F,etal. 2000. Xylem cavitation and hydraulic control of stomatal conductance in Laurel (LaurusnobilisL.). Plant, Cell & Environment, 23(1): 71-79.
Salleo S, Trifilco P, Esposito S,etal. 2009. Starch-to-sugar conversion in wood parenchyma of field-growingLaurusnobilisplants: a component of the signal pathway for embolism repair? Functional Plant Biology, 36(9): 815-825.
Schoonmaker A L, Hacke U G, Landhausser S M,etal. 2010. Hydraulic acclimation to shading in boreal conifers of varying shade tolerance. Plant, 33(3): 382-393.
Secchi F, Zwieniecki M A. 2010. Patterns of pip gene expression inPopulustrichocarpa, during recovery from xylem embolism suggest a major role for the pip1 aquaporin subfamily as moderators of refilling process. Plant, Cell & Environment, 33(8): 1285-1297.
Shen W J, Peng S L, Zhang S X. 2000. Studies on the xylem draught-tolerant characteristics of three draught-tolerant tree species. Journal of Ecology, 19(6): 1-6.
Trifilò P, Nardini A, Gullo M A L,etal. 2015. Diurnal changes in embolism rate in nine dry forest trees: relationships with species-specific xylem vulnerability, hydraulic strategy and wood traits. Tree Physiology, 57(2): 192-197.
Tyree M T, Engelbrecht B M J, Vargas G,etal. 2003. Desiccation tolerance of five tropical seedlings in Panama. Relationship to a field assessment of drought performance. Plant Physiology, 132(3): 1439-1447.
Tyree M T, Sperry J S. 1988. Do woody plants operate near the point of catastrophic xylem dysfunction caused by dynamic water stress? Plant Physiology, 88(3): 574-580.
Tyree M T, Sperry J S. 1989. Vulnerability of xylem to cavitation and embolism. Annual Review of Plant Physiology & Plant Molecular Biology, 40(1): 19-38.
Tyree M T, Zimmermann M H. 2002. Xylem structure and the ascent of sap. 2nd ed. New York: Springer Verlag,127.
Venturas M D, Mackinnon E D, Jacobsen A L,etal. 2015. Excising stem samples underwater at native tension does not induce xylem cavitation. Plant, Cell & Environment, 38(6): 1060-1068.
Wang R Q, Zhang L L, Zhang S X,etal. 2014. Water relations ofRobiniapseudoacaciaL.: do vessels cavitate and refill diurnally or are R-shaped curves invalid inRobinia?. Plant, Cell & Environment, 37(12): 2667-2678.
Wheeler J K, Huggett B A, Tofte A N,etal. 2013. Cutting xylem under tension or supersaturated with gas can generate PLC and the appearance of rapid recovery from embolism. Plant, Cell & Environment, 36(11): 1938-1949.
Wheeler J K, Sperry J S, Hacke U G,etal. 2005. Inter-vessel pitting and cavitation in woody Rosaceae and other vesselled plants: a basis for a safety versus efficiency trade-off in xylem transport. Plant, Cell & Environment, 28(6): 800-812.
Zwieniecki M A, Holbrook N M. 2009. Confronting Maxwell’s demon: biophysics of xylem embolism repair. Trends in Plant Science, 14(10): 1051-1059.
(责任编辑 徐 红)
Relationship between Hydraulic Traits and Refilling of Embolism in the Xylem of One-Year-Old Twigs of Six Tree Species
Dang Wei1Jiang Zaimin2Li Rong1Zhang Shuoxin1, 3Cai Jing1, 3
(1.CollegeofForestry,NorthwestA&FUniversityYangling712100; 2.CollegeofLifeSciences,NorthwestA&FUniversityYangling712100; 3.QinlingNationalForestEcosystemResearchStationYangling712100)
【Objective】 Drought has become a key factor affecting plant growth in the world. Hence, it is necessary to study the xylem embolism and refilling. The aim of this study was to explore the relationship between hydraulic traits and embolism refilling in the xylem of six tree species, to elucidate the influence of xylem hydraulic traits on the embolism refilling, and to provide theoretical evidence for screening drought-resistant tree species. 【Method】Six well-growing tree species,Robiniapseudoacacia,Hippophaerhamnoides,Ulmuspumila,Acertruncatum,SalixmatsudanaandCorylusheterophyllawere studied. Cochard Cavitron centrifuge was used to induce xylem embolism of one-year-old twigs when percentage loss of conductivity was higher than 95%. The “vulnerability curves” of six tree species were plotted to obtain the mean value ofP50. The recovery level of different periods (20, 40, 60, 80, 100 min) was measured by Low Pressure Flow Meter with multi-channels and staining methods. At the same time, the hydraulic diameter, pre-dawn water potential of xylem and natural percentage loss of conductivity (NPLC) were measured. 【Result】1) The order of the averageP50values of the six species wasR.pseudoacacia>U.pumila>H.rhamnoides>S.matsudana> C.heterophylla>A.truncatum, andA.truncatumwas the most drought-tolerant tree species; 2) The recovery level of the xylem embolism by staining method was consistent with embolism recovery level by Low Pressure Flow Meter. The regression equation wasy=1.047x-7.567,R2=0.863. The LPFM method can completely reflect the recovery level of the embolism branches in different time periods; 3) The xylem embolism recovery capacity of the six tree species was ranked as follows:R.pseudoacacia>U.pumila>H.rhamnoides>S.matsudana>C.heterophylla>A.truncatum. This implies that tree species with the high recovery ability of xylem embolism can quickly restore the function of transporting water when the plants are resupplied with water. The results showed that the order of the abilities of xylem embolism refilling was completely consistent with the order of embolism vulnerabilities. The ability of embolism refilling increased with embolism vulnerability (R2=0.980). Regression analysis indicated that the ability of embolism refilling of the six tree species was strongly correlated with hydraulic diameter, pre-dawn water potential of xylem, NPLC, with values ofR2of 0.868, 0.740, 0.741, respectively.【Conclusion】 The hydraulic traits of xylem were closely related to the refilling ability of xylem embolism. In particular, there was a strong positive correlation amongP50, hydraulic diameter and the ability to recover from embolism. Therefore,P50and hydraulic diameter were the main influencing factors for embolism refilling.
embolism refilling; hydraulic traits of xylem; embolism vulnerability; hydraulic diameter
10.11707/j.1001-7488.20170306
2016-04-11;
2016-06-15。
国家自然科学基金项目(31270646; 31570588)。
S718.46
A
1001-7488(2017)03-0049-11
*蔡靖为通讯作者。
