山楂酸与顺铂合用对肺癌A549细胞增殖、凋亡的影响
2017-04-26白雪,彭扬,李慧,张月,何平
白 雪,彭 扬,李 慧,张 月,何 平
山楂酸与顺铂合用对肺癌A549细胞增殖、凋亡的影响
白 雪,彭 扬,李 慧,张 月,何 平*
目的 探讨山楂酸与顺铂合用对肺癌细胞A549增殖及凋亡产生的影响。方法 将人的肺癌细胞系A549经过药物干预(山楂酸、顺铂),并将干预后的肺癌细胞通过MTT实验,分析细胞增殖能力变化,通过流式细胞技术,分析细胞的凋亡水平变化。通过Western blot分析细胞中XIAP、Survivin的表达水平变化。结果 山楂酸和顺铂合用后,A549细胞的增殖率显著降低,凋亡水平显著提高;荧光电子显微镜下观察到凋亡细胞明显增加,核碎裂明显,细胞大片脱落;Western blot结果显示,山楂酸和顺铂合用,显著下调XIAP、Survivin的蛋白表达量。结论 山楂酸和顺铂合用抑制肺癌细胞的增殖,促进肺癌细胞的凋亡,并下调细胞中凋亡抑制相关指标XIAP、Survivin的表达水平。
肺癌;山楂酸;顺铂;增殖;凋亡
0 引言
目前在全世界范围内,肺癌已成为癌症致死的主要原因,以铂类为基础的化疗是肺癌的主要治疗措施之一[1-3]。顺铂(Cisplatin,DDP)是无机金属配位化合物,目前认为,其作用机制是通过与肿瘤细胞的DNA相结合,抑制DNA的复制过程,从而达到抗肿瘤的作用。但是铂类药物往往具有较大的毒副作用,在一定程度上限制了其抗肿瘤的应用[4-6]。因此,寻找无毒或低毒的天然化学物作为增效剂,提高铂类抗肿瘤药物的疗效,以减少其用量和不良反应,是临床肿瘤治疗的策略之一。山楂酸是从油橄榄、红枣、枇杷叶、山楂等植物中分离得到的一个三萜类天然有机化合物[7-10]。近年来的研究表明,山楂酸具有抗肿瘤、抗氧化、抗艾滋病病毒、抗菌等诸多药理活性[11-15]。近年国外研究发现,山楂酸对部分肿瘤细胞有较强的抗肿瘤活性[16]。本研究观察山楂酸与顺铂联合应用对人肺癌细胞A549凋亡的作用,以了解山楂酸是否能增强顺铂的抗肿瘤作用,从而减少顺铂的用量及毒性,为寻找潜在的化疗增效剂提供实验依据。
1 材料与方法
1.1 材料、试剂及仪器 人肺癌细胞系A549购于美国典型培养物保藏中心(American Type Culture Collection,ATCC)。RPMI-1640培养基购于Gibco公司,胎牛血清购于天津索莱宝生物工程有限公司,胰蛋白酶购于以色列Biological Industries公司,山楂酸购于上海纯优生物科技有限公司,顺铂购于山东齐鲁制药有限公司,Hoechst 33342:美国Sigma公司,四甲基偶氮唑蓝(MTT)、Annexin V/PI双染试剂盒购于南京凯基生物科技发展有限公司,XIAP、Survivin购于美国 Santa Cruz 公司,羊抗鼠IgG-HRP购于美国Proteintech公司,超敏ECL化学发光试剂盒购于碧云天生物科技有限公司,离心机购于德国Eppendorf公司,超净工作台(SW-CJ-1FD)购于蚌埠净化设备厂,倒置显微镜(Olympus CKX31)购于日本奥林巴斯公司,酶标仪(BIOTEK-ELX808)购于美国赛默飞世尔公司,流式细胞仪(FACSCalibur)购于美国BD公司,荧光电子显微镜(Nikon C1)购于日本尼康公司。UP50超声粉碎仪购于德国Dr.Hielseher公司,生化摇摆平台购于北京沃德生物医学仪器公司,稳压稳流型电泳仪、电泳槽购于北京市六一仪器厂,凝胶成像分析系统(Tanon GIS-1000)购于上海天能科技有限公司。
1.2 方法
1.2.1 细胞培养 人肺癌A549细胞培养于含10%胎牛血清的RPMI-1640培养基,置于37 ℃、饱和湿度、5%二氧化碳的恒温无菌培养箱中培养。细胞呈单层贴壁生长,将细胞浓度调整为5×105/mL,接种细胞过夜,进入对数生长期后,开始进行药物干预。
1.2.2 MTT实验 消化、收集对数增殖期细胞,并调整成浓度为1×105/mL的细胞悬液,接种于96孔板,过夜培养后,于镜下观察确认细胞贴壁良好。分别加入12 μg/mL山楂酸溶液、5 μg/mL顺铂溶液及联合溶液(同时加入12 μg/mL山楂酸溶液和5 μg/mL的顺铂溶液),实验同时设立含RPMI-1640全培养基的空白对照和未予药物干预的阴性对照。细胞放于37 ℃、饱和湿度、5%二氧化碳的培养箱中培养24 h。结束培养前4 h,每孔加入MTT 20 μL,37 ℃继续培养4 h,吸弃上清,每孔加DMSO 150 μL。酶标仪用于检测波长为570 nm的每孔光密度值(OD值)。增殖抑制率按以下公式计算:抑制率=(1-药物干预组OD值/对照组OD值)×100%。
1.2.3 荧光显微镜观察凋亡 将预处理过的盖玻片用无菌镊子置于六孔板内,将A549细胞以5×105接种于6孔板中,加入终浓度为12 μg/mL的山楂酸溶液、5 μg/mL的顺铂溶液及联合溶液(同时加入12 μg/mL山楂酸溶液和5 μg/mL顺铂溶液),并设立空白对照组(加入等量RPMI-1640培养基),分别置于37 ℃、饱和湿度、5%二氧化碳的恒温、无菌培养箱中培养24 h。取出样本,在固定液(甲醇与冰乙酸的体积比为3∶1)作用下固定15 min。加入浓度为5 mg/L 的Hoechst 33342荧光染料1 mL,37 ℃条件下避光孵育15 min。用含1%甘油的PBS封片,于荧光显微镜下观察、照相。每组实验重复3次。
1.2.4 Annexin V/PI 双标记法检测细胞凋亡 A549细胞以5×105接种于6孔板中,实验分组及药物处理同上,分别于37 ℃、饱和湿度、5%二氧化碳的恒温、无菌培养箱中培养24 h后,胰酶消化、收集细胞。4 ℃离心5 min(1 500 r/min),收集细胞。用500 μL Binding Buffer悬浮细胞后加入5 μL AnnexinV-FITC混匀,再加入5 μL PI后混匀,置于2~8 ℃避光下孵育15 min。在1 h内使用流式细胞仪进行检测。结果用Cellquest专业软件获取分析数据。每组实验重复3次。
1.2.5 Western blot 检测XIAP、Survivin的表达 经过药物处理以及对照组细胞用胰蛋白酶进行消化并收集。样本中加入适量裂解液,低温离心10 min(12 000 r/min,4 ℃),所得上清液即为样本的蛋白溶液。将目的蛋白与蛋白上样缓冲液混合,沸水浴中煮5 min,待冷却后即可上样。上样结束后,在电泳槽加入电泳液,调节电压为80 V,时间约为20 min,接着增大电压为120 V,时间约为1 h,完成电泳。转印、封闭后,孵育一抗。本实验所用一抗抗体为:一抗XIAP、Survivin、GAPDH (1∶200;Santa Cruz;USA),孵育条件为4 ℃过夜。应用羊抗鼠IgG-HRP(1∶3 000),孵育二抗2 h。PVDF膜上均匀滴加适量发光液,行ECL底物发光。
2 结果
2.1 山楂酸和顺铂协同抑制肺腺癌A549细胞的增殖 山楂酸、顺铂单独作用均可抑制A549细胞的增殖,二者合用明显增强对A549细胞的增殖抑制效应。见图1。
2.2 Hoechst 33258标记荧光显微镜观察细胞凋亡 荧光电子显微镜观察发现,山楂酸、顺铂单独作用A549细胞后,细胞核形态均发生显著性改变,呈现染色质浓缩、核固缩、核片断化,二者合用时凋亡细胞明显增多,核碎裂明显,细胞大片脱落形成细胞脱失区(见图2)。
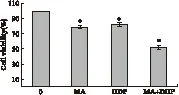
图1 山楂酸(MA)、顺铂(DDP)联合应用对A549细胞的 增殖抑制作用
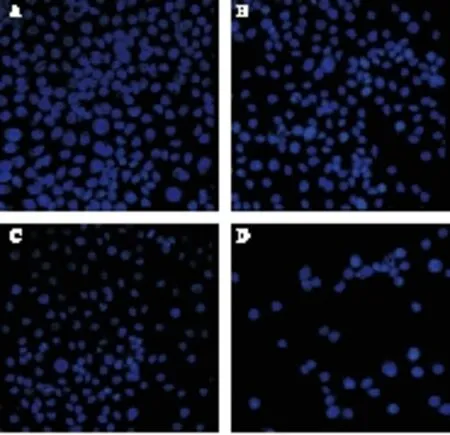
图2 Hoechst 33258标记荧光显微镜观察山楂酸、顺铂 引起A549细胞核形态改变(400×) 注:A.对照组;B.山楂酸 12 μg/mL;C.顺铂5 μg/mL;D.联合组
2.3 Annexin V/PI 双标记法流式细胞仪检测细胞凋亡 流式细胞分析凋亡水平结果显示,山楂酸和顺铂单独作用均可以引起肺癌A549细胞凋亡,联合用药组的凋亡率升高更明显,具有统计学意义。见图3。
2.4 山楂酸和顺铂联合抑制XIAP和Survivin的表达 Western blot方法检测结果显示,山楂酸、顺铂单独应用均可降低XIAP、Survivin蛋白的表达,二者合用可使XIAP、Survivin蛋白的表达明显降低。见图4。
3 讨论
顺铂是治疗非小细胞肺癌最重要的药物之一,单药有效率为16%~20%,含有顺铂的化疗方案是目前非小细胞肺癌的一线化疗方案[17-23]。但顺铂等化疗药物在杀灭肿瘤细胞的同时,对正常细胞也有一定的副作用,限制了其在临床上的应用。如何增加化疗药物对肿瘤的有效性,减轻化疗药物的不良反应,已经引起肿瘤研究人员的广泛关注。

图3 Annexin V/PI 双标记流式细胞仪分析山楂酸(MA)、 顺铂(DDP)单用或联合应用诱导A549细胞凋亡
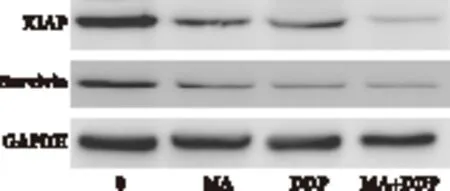
图4 山楂酸、顺铂单用及联用抑制A549细胞XIAP、Survivin表达
有研究表明,多种中药与顺铂合用可起到协同抗肿瘤作用[19,24-27],山楂酸与顺铂联用尚未见报道。本研究通过MTT、荧光染色和凋亡率的检测证明,山楂酸、顺铂联合用药后,较单一应用其中一种药物对A549细胞的凋亡、抑制作用增强。从而可为应用山楂酸作为顺铂的增效剂,增加化疗疗效,减少化疗不良反应及损伤发生提供了体外实验依据。
凋亡抑制蛋白(Inhibitor of apoptosis proteins,IAPs)是细胞内一类内源性的抑制凋亡蛋白家族,可与细胞凋亡的主要调节者半胱氨酸蛋白酶家族分子(Caspases)直接结合,阻断Caspases的水解活性,从而抑制细胞凋亡。XIAP是IAPs家族的重要成员之一,主要通过与Caspase-3、Caspase-7、Caspase-9结合并抑制其活性,来发挥其抗凋亡作用,是IAPs家族中最有效的Caspases 抑制剂,在人体内广泛存在[28-29]。Tamm等[30]发现,XIAP基因在肿瘤细胞中的过度表达是导致肿瘤对化疗药物耐药的一个重要原因,与肿瘤的发生、发展及预后密切相关。有研究表明,转导反义XIAP能增加顺铂对卵巢癌细胞化疗的敏感性,还能激活Caspases及促进Caspases介导下MDM2的加工和p53 基因产物的聚集[31]。还有研究表明,三氧化二砷联合顺铂作用于非小细胞肺癌细胞系H460,可以抑制细胞增殖、增加细胞凋亡及下调XIAP基因表达[32]。
Survivin基因是IAP家族中另一个重要成员。大量研究表明,Survivin是一个肿瘤特异性的凋亡抑制因子,可抑制细胞凋亡。Survivin抑制细胞凋亡的机制可能包括:①直接作用于凋亡终末效应酶Caspases,主要通过抑制Caspases-3和Caspases-7活性来阻断细胞凋亡;②与周期蛋白激酶p34cdc、cdk4相互作用,从而阻断凋亡信号转导通路[33-35]。
本实验Western blot结果充分说明山楂酸与顺铂都能够抑制A549细胞中XIAP、Survivin的表达,联合用药较单药抑制作用更为显著。山楂酸与顺铂诱导A549细胞凋亡的机制之一,可能是通过抑制XIAP、Survivin基因的表达,降低其对Caspases的抑制作用,活性Caspases表达增多,导致肺癌细胞的凋亡增加。
[1] Hu W,Jin P,Liu W.Periostin contributes to cisplatin resistance in human non-small cell lung cancer A549 cells via activation of stat3 and akt and upregulation of survivin[J].Cell Physiol Biochem,2016,38(3):1199-2008.
[2] Nascimento AV,Gattacceca F,Singh A,et al.Biodistribution and pharmacokinetics of Mad2 siRNA-loaded EGFR-targeted chitosan nanoparticles in cisplatin sensitive and resistant lung cancer models[J].Nanomedicine (Lond),2016,11(7):767-781.
[3] Okita R,Yukawa T,Nojima Y,et al.MHC class I chain-related molecule A and B expression is upregulated by cisplatin and associated with good prognosis in patients with non-small cell lung cancer[J].Cancer Immunol Immunother,2016,65(5):499-509.
[4] Miyahara D,Katsuta T,Maehara M,et al.Safety and anti-tumor effects of docetaxel plus cisplatin in intermediate- and high-risk endometrial cancer[J].Anticancer Res,2016,36(7): 3725-3729.
[5] E Silva PV,da Silva RF,Borges C S,et al.Sexual differentiation and reproductive development of female rat offspring after paternal exposure to the anti-tumor pharmaceutical cisplatin[J].Reprod Toxicol,2016,60:112-122.
[6] Yang T,Zhao P,Rong Z,et al.Anti-tumor efficiency of lipid-coated cisplatin nanoparticles co-loaded with microRNA-375[J].Theranostics,2016,6(1):142-154.
[7] Mooi LY,Wahab NA,Lajis NH,et al.Chemopreventive properties of phytosterols and maslinic acid extracted from Coleus tuberosus in inhibiting the expression of EBV early-antigen in Raji cells[J].Chem Biodivers,2010,7(5):1267-1275.
[8] Qian Y,Guan T,Tang X,et al.Maslinic acid,a natural triterpenoid compound from Olea europaea,protects cortical neurons against oxygen-glucose deprivation-induced injury[J].Eur J Pharmacol,2011,670(1):148-153.
[9] Qiu WW,Shen Q,Yang F,et al.Synthesis and biological evaluation of heterocyclic ring-substituted maslinic acid derivatives as novel inhibitors of protein tyrosine phosphatase 1B[J].Bioorg Med Chem Lett,2009,19(23):6618-6622.
[10]Rufino-Palomares EE,Reyes-Zurita FJ,García-Salguero L,et al.Maslinic acid,a triterpenic anti-tumoural agent,interferes with cytoskeleton protein expression in HT29 human colon-cancer cells[J].J Proteomics,2013,83:15-25.
[11]Fukumitsu S,Villareal MO,Fujitsuka T,et al.Anti-inflammatory and anti-arthritic effects of pentacyclic triterpenoids maslinic acid through NF-kappaB inactivation[J].Mol Nutr Food Res,2016,60(2):399-409.
[12]Huang L,Guan T,Qian Y,et al.Anti-inflammatory effects of maslinic acid,a natural triterpene,in cultured cortical astrocytes via suppression of nuclear factor-kappa B[J].Eur J Pharmacol,2011,672(1-3):169-174.
[13]Li C,Yang Z,Li Z,et al.Maslinic acid suppresses osteoclastogenesis and prevents ovariectomy-induced bone loss by regulating RANKL-mediated NF-kappaB and MAPK signaling pathways[J].J Bone Miner Res,2011,26(3): 644-656.
[14]Hsum YW,Yew WT,Hong PL,et al.Cancer chemopreventive activity of maslinic acid:suppression of COX-2 expression and inhibition of NF-kappaB and AP-1 activation in Raji cells[J].Planta Med,2011,77(2):152-157.
[15]Márquez Martín A,De la Puerta Vázquez R,Fernández-Arche A,et al.Supressive effect of maslinic acid from pomace olive oil on oxidative stress and cytokine production in stimulated murine macrophages[J].Free Radic Res,2006,40(3):295-302.
[16]Li C,Yang Z,Zhai C,et al.Maslinic acid potentiates the anti-tumor activity of tumor necrosis factor alpha by inhibiting NF-kappaB signaling pathway[J].Mol Cancer,2010,9:73.
[17]Van Der Steen N,Deben C,Deschoolmeester V,et al.Better to be alone than in bad company:the antagonistic effect of cisplatin and crizotinib combination therapy in non-small cell lung cancer[J].World J Clin Oncol,2016,7(6):425-432.
[18]杨和平,金润女,苏伟平,等.贝伐单抗联合培美曲塞+顺铂治疗非小细胞肺癌的临床分析[J].临床军医杂志,2015,43(10):1053-1055.
[19]张潇,赵庆春.601例非小细胞肺癌患者化疗用药分析[J].创伤与急危重病医学,2016,4(3):158-161.
[20]Tseng CY,Lin CH,Wu LY,et al.Potential combinational anti-cancer therapy in non-small cell lung cancer with traditional Chinese medicine Sun-Bai-Pi extract and cisplatin[J].PLoS One,2016,11(5):0155469.
[21]Kim E,Biswas T,Bakaki P,et al.Comparison of cisplatin/etoposide versus carboplatin/etoposide concurrent chemoradiation therapy for limited-stage small cell lung cancer (LS-SCLC) in the elderly population (age >65 years) using national SEER-Medicare data[J].Pract Radiat Oncol,2016,6(5):e163-e169.
[22]Ma X,Le Teuff G,Lacas B,et al.Prognostic and predictive effect of TP53 mutations in patients with non-small cell lung cancer from adjuvant cisplatin-based therapy randomized trials:a LACE-bio pooled analysis[J].J Thorac Oncol,2016,11(6):850-861.
[23]Kang JH,Ahn MJ,Kim DW,et al.Tolerability and outcomes of first-line pemetrexed-cisplatin followed by gefitinib maintenance therapy versus gefitinib monotherapy in Korean patients with advanced nonsquamous non-small cell lung cancer:a post hoc descriptive subgroup analysis of a randomized,phase 3 trial[J].Cancer Res Treat,2016,48(2):458-464.
[24]周红兵,艾伟,孙林,等.紫杉醇脂质体和吉西他滨分别联合顺铂治疗晚期非小细胞肺癌的效果及其与中性粒细胞/淋巴细胞比值的相关性[J].中国医药,2015,10(4):468-472.
[25]赵卫刚,胡世莲,丁西平,等.吉西他滨联合顺铂与紫杉醇联合顺铂/卡铂治疗非小细胞肺癌疗效的系统评价[J].实用医学杂志,2016,32(9):1508-1511.
[26]Gong C,Qian L,Yang H,et al.Hepatotoxicity and pharmacokinetics of cisplatin in combination therapy with a traditional Chinese medicine compound of Zengmian Yiliu granules in ICR mice and SKOV-3-bearing nude mice[J].BMC Complement Altern Med,2015,15:283.
[27]Zhang QH,Gong C,Yang H,et al.Pharmacokinetics of cisplatin in the absence or presence of zengmian yiliu granules (a traditional Chinese medicine compound) in rats determined via ICP-MS:an investigation on drug-herb interactions[J].Pharm Biol,2015,53(2):159-166.
[28]Chen Y,Di L,Zhang S,et al.The randomized,multicenter,controlled clinic trial for treating advanced non-small cell lung cancer with combined traditional Chinese medicine and vinorelbine (Navelbine,NVB) plus cisplatin (DDP) chemotherapy[J].Zhongguo Fei Ai Za Zhi,2008,11(3):441-444.
[29]To KK,Au-Yeung SC,Ho YP.Differential nephrotoxicity of cisplatin and a novel series of traditional Chinese medicine-platinum anticancer agents correlates with their chemical reactivity towards sulfur-containing nucleophiles[J].Anticancer Drugs,2006,17(6):673-683.
[30]Rodríguez-Berriguete G,Torrealba N,Ortega MA,et al.Prognostic value of inhibitors of apoptosis proteins (IAPs) and caspases in prostate cancer:caspase-3 forms and XIAP predict biochemical progression after radical prostatectomy[J].BMC Cancer,2015,15:809.
[31]Carter BZ,Mak DH,Wang Z,et al.XIAP downregulation promotes caspase-dependent inhibition of proteasome activity in AML cells[J].Leuk Res,2013,37(8):974-979.
[32]Tamm I,Richter S,Scholz F,et al.XIAP expression correlates with monocytic differentiation in adult de novo AML:impact on prognosis[J].Hematol J,2004,5(6):489-495.
[33]Farrand L,Byun S,Kim JY,et al.Piceatannol enhances cisplatin sensitivity in ovarian cancer via modulation of p53,X-linked inhibitor of apoptosis protein (XIAP),and mitochondrial fission[J].J Biol Chem,2013,288(33): 23740-23750.
[34]Chen F,Sui G,Chen H,et al.The influence of arsenic trioxide combined with cisplatin on the growth and expression of X-linked inhibitor of apoptosis protein,XIAP of human non-small cell lung cancer cells[J].Zhongguo Fei Ai Za Zhi,2007,10(3):168-171.
[35]Pyrko P,Soriano N,Kardosh A,et al.Downregulation of survivin expression and concomitant induction of apoptosis by celecoxib and its non-cyclooxygenase-2-inhibitory analog,dimethyl-celecoxib (DMC),in tumor cells in vitro and in vivo[J].Mol Cancer,2006,5:19.
Effect of combination of maslinic acid and cisplatin on proliferation and apoptosis in lung cancer cell line A549
BAI Xue,PENG Yang,LI Hui,ZHANG Yue,HE Ping*
(Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To investigate the effect of combination of maslinic acid and cisplatin on proliferation and apoptosis in lung cancer cell line A549.Methods A549 cells were treated with maslinic acid and cisplatin,then the treated cells were applied to MTT assay and flow cytometer for proliferation and apoptosis analysis respectively.Expression of XIAP and survivin was also analyzed by western blot in A549 cells after treatment.Results Growth rate decreased and apoptosis rate increased in A549 cells when treated with the combination of maslinic acid and cisplatin.The treated cells were found in nuclear condensation,fragmentation and large fall-off through fluorescent electronic microscope.Western blot results showed that expression of XIAP and Survivin was down-regulated after treatment.Conclusion The combination of maslinic acid and cisplatin can inhibit proliferation and promote apoptosis in lung cancer cells,and down-regulate the levels of XIAP and Survivin.
Lung cancer;Maslinic acid;Cisplatin;Proliferation;Apoptosis
2016-08-28
中国医科大学附属盛京医院,沈阳 110004
*通信作者
10.14053/j.cnki.ppcr.201704003
