腹腔镜胃癌根治术治疗进展期胃癌的临床效果分析
2017-04-26葛晓明孙晓光
葛晓明, 孙晓光, 杨 剑, 唐 悦
(南京医科大学附属无锡二院 普外科, 江苏 无锡, 214001)
腹腔镜胃癌根治术治疗进展期胃癌的临床效果分析
葛晓明, 孙晓光, 杨 剑, 唐 悦
(南京医科大学附属无锡二院 普外科, 江苏 无锡, 214001)
目的 探讨腹腔镜胃癌根治术治疗进展期胃癌的临床疗效。方法 选取行腹腔镜胃癌根治术的进展期胃癌患者50例,分析其临床疗效。结果 50例患者均成功完成腹腔镜辅助胃癌根治术,全胃切除、近端胃切除、远端胃切除手术时间分别为(305±45)、(270±380)、(210±40) min, 出血量分别为(260±40)、(230±30)、(110±40) mL, 清扫淋巴结数目分别为(21.3±2.7)、(16.9±5.2)、(15.5±3.7)枚。手术后患者神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、角蛋白21-1片段(CYFRA21-1)、高敏C反应蛋白(hs-CRP)水平与手术前相比均显著改善(P<0.05)。结论 腹腔镜胃癌根治术能明显改善血清肿瘤标志物和hs-CRP水平。
腹腔镜; 胃肿瘤; 胃切除术; 肿瘤标志物; 高敏C反应蛋白
胃癌是常见的一种消化道恶性肿瘤,具有起病隐匿、早期症状不典型等特点, 90%以上的胃癌患者在诊断时已为进展期胃癌[1-2]。1994年Kitano等[3]首次报道采用腹腔镜治疗胃癌后,腹腔镜辅助胃癌根治术在临床上应用已有20余年,它具有微创、术后恢复速度快、术中出血量少、患者住院时间短、不良反应发生率低等优势。本研究探讨腹腔镜胃癌根治术治疗进展期胃癌的临床疗效,现报告如下。
1 资料与方法
1.1 一般资料
选取2014年1月—2016年1月本院收治的50例进行了腹腔镜胃癌根治术的进展期胃癌患者,其中男28例,女22例; 年龄47~78岁,平均(67.3±6.42)岁。患者在手术前均进行胃镜和病理检查确诊; 进行常规胸片、B超、腹部CT加强扫描检查,断定胃癌患者肿瘤部位,断定胃癌患者胃周围脏器肿瘤侵犯状况,是否会有肝脏或者其他部位的肿瘤转移征象。患者肿瘤部位:胃窦26例,贲门14例,胃体10例。患者合并其他疾病:右腹股沟斜疝1例,胆囊结石2例,糖尿病2例,高血压6例。本研究已经由本院伦理委员会审查并且批准,并告知患者此研究的性质以及收益和存在的风险,所有入选患者均签署了知情同意书。入选标准: ① 患者经胃镜活组织病理学检查确诊为胃癌; ② 患者未发生肝脏和其他部位肿瘤转移; ③患者手术耐受良好。排除标准: ① 排除T4期及Ⅳ期进展期胃癌患者; ② 排除具有肝炎、严重感染、结核、严重慢性疾病等的患者。
1.2 手术方法
参照2007版《腹腔镜胃癌手术操作指南(2007版)》[4]。腹腔镜辅助下远端胃癌根治术:适用于胃角部和胃窦部肿瘤。① 采用Trocar 5孔法首先全面探查腹腔,确定肿瘤位置,观察并记录转移情况,明确有无肝脏、腹腔、大网膜转移、周围器官受侵等情况。② 由左及右至结肠肝曲,采用超声刀分离大网膜,进入横结肠系膜前后叶间隙,暴露出胃网膜右血管,采用钛夹后切断,清除幽门下(第6组)淋巴结。③ 然后分离胰腺背膜至胰腺上缘; 在胆总管内侧切开小网膜,清除肝十二指肠韧带内门静脉(12v)、肝固有动脉周围(12a)淋巴结。④ 暴露出肝总动脉,清除周围淋巴结(第8组),暴露出胃左血管,采用钛夹后切断,清除胃左动脉周围淋巴结(第7组); 暴露并清除脾动脉周围淋巴结(第11组)。⑤ 沿肝下缘切断小网膜,显露贲门右侧,清除贲门右淋巴结(第1组)、胃小弯淋巴结(第3组)。⑥ 取上腹正中切口(5 cm), 将胃提出腹腔,常规清理周围组织后行胃切除及相应吻合。
腹腔镜辅助下近端胃及全胃癌根治术:适用于胃底部及贲门部位肿瘤。探查及清扫方法同上。需要裸化食管:切断左三角韧带,将左肝牵向右侧,在食管膈肌裂孔的穹隆部向正前方打开膈肌4~5 cm, 在膈肌脚的中下部充分切断两侧膈肌脚,注意避免损伤胸膜,将胸膜继续向两侧推开。与肿瘤上方食管置牵引线尽量将食管向下牵引,继续向上充分游离食管至保证足够的切缘。
1.3 观察及检测指标
手术相关指标:手术时间、出血量(根据术中吸引及纱布蘸吸量)。肿瘤根治性指标:清扫淋巴结总数。术后恢复指标:术后使用镇痛药次数、肠道排气时间、下地活动时间、并发症、术后住院时间。
血清肿瘤标志物、高敏C反应蛋白(hs-CRP): 手术治疗前后分别采集患者空腹静脉血进行检测,采用酶联免疫吸附试验(ELISA)法检测血清肿瘤标志物,包括神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、角蛋白21-1片段(CYFRA21-1)水平; hs-CRP采用胶乳增强免疫透射比浊法测定; 检测试盒均购自上海佳和生物科技有限公司。
1.4 随访
术后定期进行体格检查、腹部B超或CT检查、胸部X线片、胃镜检查。随访方式包括电话、门诊复查。通过询问病史、病理检查、影像学检查、病理检查以及再手术明确复发情况。
1.5 统计学方法
所得数据均采用SPSS 17.0处理。计数资料用百分比或例数或率表示,采用卡方检验; 计量资料用均数±标准差表示,其中组内比较采用配对t检验,组间比较采用独立样本t检验。检验水准均为α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 手术情况
50例患者完成腔镜辅助下胃癌根治术,其中进行近端胃切除术9例,远端胃切除术29例,全胃切除术有12例。不同手术方式的患者手术时间、出血量、清扫淋巴结数目、使用镇痛药次数、术后排气时间、术后首次下地时间、术后并发症情况以及住院时间见表1。术后并发症共3例,其中腹腔内出血2例,胃瘫1例。
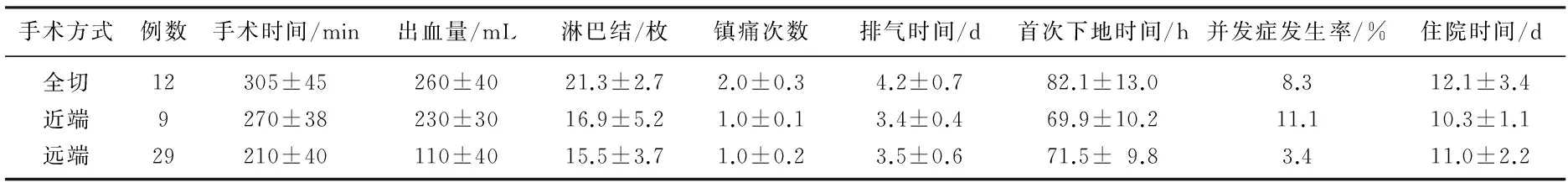
表1 患者手术情况及恢复情况
2.2 血清肿瘤标志物、hs-CRP水平
手术后患者的血清肿瘤标志物(CEA、NSE、CA125、CA19-9、CYFRA21-1)水平和hs-CRP均低于手术前,差异有统计学意义(P<0.05)。见表2。

表2 患者手术前后血清肿瘤标志物、hs-CRP水平
与手术前比较, 有显著差异, *P<0.05
2.3 随访情况
共有48例患者获得随访,随访时间为3~24个月。有1例在术后8个月因心肌梗死死亡,余患者术后恢复良好,能独立进行简单日常活动。
3 讨 论
腹腔镜胃癌根治术利用微创技术为治疗胃癌提供了新的手术方案,被越来越多的外科医生接受,目前已在临床中被广泛应用[5]。与传统的开腹手术相比,腹腔镜辅助下胃癌根治术的技术难度明显更大,手术操作的灵活度不如开腹手术高,需要手术操作者提高熟练度以及提高手术团队的默契度以缩短手术时间; 然而腹腔镜然辅助下胃癌根治术具有微创优势,超声刀具有止血的作用,使得手术出血量减少[6]。叶民峰等[7]研究表明,腹腔镜辅助胃癌根治术治疗进展期胃癌的手术时间明显长于开腹组,但出血量等指标明显优于开腹手术。
中国胃癌患者以进展期胃癌为主,利用腹腔镜辅助胃癌根治术治疗进展期胃癌的疗效已有很多报道。赵昕波等[8]报道显示,腹腔镜辅助胃癌根治术对老年进展期胃癌有良好的临床效果,手术时间、淋巴结清扫数目、出血量、止痛剂使用次数、胃肠道恢复时间、住院时间、不良反应发生率均优于开腹组,并且能明显改善血清肿瘤标志物和hs-CRP水平。李守震等[9]报道显示,进展期胃癌腹腔镜根治手术创伤小、安全可靠, 3年生存率与传统开腹手术相当。腹腔镜胃癌根治术要坚持无瘤原则,在手术时应当保证无癌细胞残留,要求切缘距离肿瘤达5 cm以上; 彻底清扫肿瘤所属淋巴引流区的脂肪组织和淋巴结,并且清扫至血管根部; 切除时减少组织挤压,做到整块切除,防止肿瘤细胞脱落和医源性播散; 最后要排空腹内二氧化碳,移除Trocar以及切口保护圈,然后再关腹[10]。进展胃癌进行腹腔镜辅助下根治术要求高,对于手术的安全性、术后的近期和远期疗效,肿瘤的根治程度都需要进一步研究,本研究中采用腹腔镜胃癌根治术治疗患者进展期胃癌均成功完成,结果良好,各项指标与以往报道基本一致,体现了良好的治疗效果,且并发症少,安全可行。
神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)、糖类抗原125(CA125)、糖类抗原19-9(CA19-9)、角蛋白21-1片段(CYFRA21-1)是常用的血清肿瘤标志物[11-15], 在胃癌患者的血液中可以检出,可以作为辅助胃癌诊断,判断预后以及指导治疗的指标。NSE存在于神经组织和神经内分泌组织之中,它是参与糖类酵解过程的一种关键酶,可以作为判断胃癌的辅助指标; CEA是一种广谱性的肿瘤标志物,可以辅助消化系统癌的诊断; CA19-9是一种高分子糖蛋白,与胃癌的进展有密切关系,在胃部肿瘤具有高表达的特点; CA125是一种高分子糖蛋白复合物,在胃癌患者体内其水平明显升高; CYFRA21-1是细胞角蛋白19的可溶性片段,也是检测胃癌的有效肿瘤标志物。这几种血清肿瘤标志物都可作为反映进展期胃癌手术临床疗效的指标,也对预后起重要的作用。本研究中,患者行腹腔镜胃癌根治术后体内以上几种肿瘤标志物的水平都显著降低(P<0.05)。hs-CRP是一种能够标志炎症反应程度的非特异性急性时相反应蛋白,由肝细胞在多种炎性因子的作用下合成,在炎症反应中发挥着至关重要的作用,是一种炎症标志物。本研究中患者术后hs-CRP的水平明显降低,表明患者体内炎性症状受到了抑制。
综上所述,本研究结果显示腹腔镜胃癌根治术治疗进展期胃癌具有良好的临床治疗效果,安全可行,并且可以改善肿瘤标志物和hs-CRP水平。
[1] 孔曼, 裴文仲, 杨建东. 替吉奥联合奥沙利铂治疗进展期胃癌的临床疗效观察[J]. 首都医科大学学报, 2013, 34(3): 446-449.
[2] 杜京丽, 郭庆森, 林建峰, 等. 腹腔镜辅助远端胃癌根治术并发症原因分析及防治对策[J]. 贵州医药, 2016, 40(8): 844-846.
[3] Kitano S, Iso Y, Moriyama M, et al. Laparoscopy-assisted Billroth I gastrectomy. [J]. Surgical Laparoscopy & Endoscopy, 1994, 4(2): 146-8.
[4] 中华医学会外科学分会腹腔镜与内镜外科学组. 腹腔镜胃癌手术操作指南(2007版)[J]. 中华消化外科杂志, 2007, 6(6): 476-480.
[5] Shinohara T, Satoh S, Kanaya S, et al. Laparoscopic versus open D2 gastrectomy for advanced gastric cancer: a retrospective cohort study[J]. Surgical Endoscopy, 2013, 27(1): 286-294.
[6] Jiang L, Yang K H, Guan Q L, et al. Laparoscopy-assisted gastrectomy versus open gastrectomy for resectable gastric cancer: an update meta-analysis based on randomized controlled trials[J]. Surgical Endoscopy, 2013, 27(7): 2466-80.
[7] 周捷, 范跃祖. 胃癌切除术后消化道重建方式(英文)[J]. 外科研究与新技术, 2015 4(4): 270-277.
[8] 杜京丽, 郭庆森, 林建峰, 等. 腹腔镜辅助远端胃癌根治术并发症原因分析及防治对策[J]. 贵州医药, 2016, 40(8): 844-846.
[9] 石旭峰, 徐飞. 腹腔镜下胃癌根治术的疗效及对患者免疫功能的影响[J]. 实用临床医药杂志, 2016, 20(13): 205+212.
[10] 韩晓鹏, 李三党, 景化忠, 等. 腹腔镜胃癌D2根治术中无瘤技术的应用[J]. 现代肿瘤医学, 2015, 23(4): 509-511.
[11] Emoto S, Ishigami H, Yamashita H, et al. Clinical significance of CA125 and CA72-4 in gastric cancer with peritoneal dissemination[J]. Gastric Cancer, 2012, 15(2): 154-161.
[12] Yamamoto M, Yoshinaga K, Matsuyama A, et al. CEA/CA72-4 levels in peritoneal lavage fluid are predictive factors in patients with gastric carcinoma[J]. Journal of Cancer Research and Clinical Oncology, 2014, 140(4): 607-12.
[13] Sun Z, Zhang N. Clinical evaluation of CEA, CA19-9, CA72-4 and CA125 in gastric cancer patients with neoadjuvant chemotherapy[J]. World Journal of Surgical Oncology, 2014, 12(1): 1-12.
[14] Gwak H K, Lee J H, Park S G. Preliminary evaluation of clinical utility of CYFRA 21-1, CA 72-4, NSE, CA19-9 and CEA in stomach cancer[J]. Asian Pacific Journal of Cancer Prevention Apjcp, 2014, 15(12): 4933-8.
[15] Çakirca G. Comparison of CYFRA 21-1, CEA, CA 19-9 and CA 72-4 levels in gastric cancer[J]. Antimicrobial Agents & Chemotherapy, 2013, 40(2): 227-230.
Clinical efficacy of laparoscopic radical gastrectomy in treatment of patients with advanced gastric cancer
GE Xiaoming, SUN Xiaoguang, YANG Jian, TANG Yue
(DepartmentofGeneralSurgery,WuxiSecondHospitalAffiliatedtoNanjingMedicalUniversity,Wuxi,Jiangsu, 214001)
Objective To explore the clinical efficacy of laparoscopic radical gastrectomy in treatment of patients with advanced gastric cancer. Methods A total of 50 patients with advanced gastric cancer were selected and treated with laparoscopic radical gastrectomy, and efficacy was analyzed. Results All the patients completed surgery successfully, the average operation time was (305±45), (270±380), (210±40) min in patients with total gastrectomy, proximal gastrectomy, distal gastrectomy, the average blood loss volume was (305±45), (270±380), (210±40) min, and the average number of lymph nodes dissected was (21.3±2.7), (16.9±5.2), (15.5±3.7) respectively. The levels of CEA, NSE, CAl25, CAl9-9, CYFRA21-1 and hs-CRP after operation were significantly lower that those before operation (P<0.05). Conclusion Laparoscopic radical gastrectomy can significantly improve the levels of hs-CRP and serum tumor markers in the patients with advanced gastric cancer.
laparoscope; gastric neoplasm; gastrectomy; tumor markers; high sensitive C reactive protein
2016-12-25
R 735.2
A
1672-2353(2017)07-064-03
10.7619/jcmp.201707017
