槲皮素对缺氧缺血性脑损伤新生大鼠神经再生的影响
2017-04-26杨青丽陈彦锋
杨青丽陈彦锋
1.漯河市中心医院NICU,2.漯河医学高等专科学校基础医学部(河南漯河 462000)
槲皮素对缺氧缺血性脑损伤新生大鼠神经再生的影响
杨青丽1,2陈彦锋2
1.漯河市中心医院NICU,2.漯河医学高等专科学校基础医学部(河南漯河 462000)
目的探讨槲皮素对缺氧缺血性脑损伤(HIBD)的神经保护机制。方法48只7日龄新生SD大鼠随机分为假手术组、HIBD组、Que组,每组16只。HIBD组和Que组经右颈总动脉结扎并缺氧制作HIBD模型,假手术组仅分离右颈总动脉。Que组在造模后即刻予腹腔注射槲皮素(40 mg/kg),每日1次,连续7 d;假手术组和HIBD组在同一时间点予等量生理盐水腹腔注射。各组大鼠在末次给药1 h后行神经功能评分,28日龄行Morris水迷宫检测空间学习记忆能力。水迷宫实验结束后断头取脑,HE染色观察海马病理学改变,免疫组织化学法检测海马CA1区脑源性神经营养因子(BDNF)和神经生长相关蛋白(GAP-43)表达情况。结果三组大鼠的神经功能缺陷评分和学习记忆能力差异均有统计学意义(P<0.01),HIBD组神经功能缺陷评分最高,学习记忆能力最差。病理检查显示,假手术组大鼠海马神经元结构完整;HIBD组海马结构疏松紊乱,且出现神经元丢失;Que组与HIBD组比较,结构疏松紊乱较轻,神经元数量有所增多。三组大鼠海马CA1区BDNF和GAP-43阳性表达差异均有统计学意义(P<0.01),HIBD组均低于Que组和假手术组,Que组低于假手术组,差异有统计学意义(P<0.01)。结论槲皮素可以通过上调海马CA1区BDNF和GAP-43表达,促进神经再生,改善HIBD新生大鼠的远期学习记忆能力,发挥脑保护作用。
缺氧缺血性脑损伤; 槲皮素; 神经再生; 脑源性神经营养因子; 神经生长相关蛋白
Key words:hypoxic-ischemic brain damage; Quercetin; neural regeneration; brain derived neurotrophic factor; nerve growth associated protein
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是由于围生期缺氧、窒息导致的新生儿神经系统疾病,致死率和致残率较高,幸存者常伴有后遗症,如脑瘫、癫痫、认知障碍等,严重影响患儿的生存质量和身心健康,给患儿家庭带来沉重的精神和经济负担[1]。目前HIE的发病机制尚不完全清楚,临床上也缺乏针对性的特效治疗药物,因此探讨缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)的发病机制,有效治疗HIBD是目前神经科学家研究的热点之一。
槲皮素(Quercetin)的分子式为C15H10O7,是一种天然的黄酮类化合物,具有清除氧自由基,抑制脂质过氧化和炎症反应等药理活性作用[2-4]。本课题组前期研究发现,槲皮素可以抑制海马区神经细胞凋亡,改善HIBD大鼠的学习记忆能力[5]。突触可塑性是学习记忆的神经生物学基础,而损伤脑区的神经再生是重建突触联系的结构基础[6],槲皮素对HIBD大鼠学习记忆能力的改善是否和神经再生有关,目前国内外少见报道。本研究通过建立新生大鼠HIBD模型,在前期研究的基础上,进一步检测海马CA1区神经再生相关蛋白脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和神经生长相关蛋白(growth-associated protein,GAP-43)的表达变化,探讨大鼠HIBD发病机制及槲皮素对HIBD大鼠神经再生的影响,从而为槲皮素更合理有效的应用于临床治疗HIBD提供实验依据和理论指导。
1 材料和方法
1.1 实验动物及分组
健康7日龄新生SD大鼠(清洁级,母鼠带养)48只,购于河南省实验动物中心(合格证号: SCXK豫2014-0002),体质量12~16 g,雌雄不拘,在光照—黑暗各12 h交替条件下,由母鼠自由喂养。随机分为假手术组、HIBD组和Que组,每组16只。采用改良Rice法制备HIBD模型[7]。具体步骤:大鼠经无水乙醚吸入麻醉后,75%乙醇消毒颈部,颈正中线切开皮肤,分离右侧颈总动脉,丝线结扎,并离断血管,以造成缺血损伤,缝合切口;将进行缺血手术的大鼠放回窝休息2 h后置于37℃恒温水浴的缺氧箱(30 cm×40 cm×50 cm的密闭有机玻璃箱)中,以2 L/min速度输入氧氮混合气体(8% O2+ 92% N2),持续2 h,以造成缺氧损伤,取出后放回原笼饲养。假手术组大鼠只分离颈总动脉,不进行结扎和缺氧处理。Que组在造模后即刻给予腹腔注射槲皮素(40 mg/kg),每日1次,连续7 d;假手术组和HIBD组分别在同一时间点给予等量生理盐水腹腔注射。各组大鼠术后放回原笼,母鼠饲养。末次给药1 h后各组大鼠行神经功能缺陷评分,28日龄时各组大鼠行Morris水迷宫检测空间学习记忆能力。水迷宫实验结束后断头取脑,苏木精-伊红(HE)染色观察海马病理学改变,免疫组织化学法检测海马CA1区BDNF和GAP-43的表达情况。
1.2 方法
1.2.1 神经功能评分 各组大鼠末次给药1 h后,采用Bederson法进行神经功能评分[8],评分标准如下:0分,无神经损伤症状;1分,抓大鼠鼠尾提起,大鼠不能完全伸展对侧前爪;2分,大鼠前肢对对侧推力的抵抗能力下降;3分,大鼠出现向对侧转圈现象。
1.2.2 空间学习记忆能力检测 于28日龄时对各组大鼠行Morris水迷宫实验。Morris水迷宫水池中置放一个直径10 cm的圆形平台,平台在水面以下2 cm,池中倒入适量墨汁,使水池不透明(以避免视觉干扰),水温保持在22℃~23℃。将大鼠面向池壁放入水池,记录大鼠从入水到找到水下隐蔽平台并站立于其上所需时间,作为逃避潜伏期,历时5 d,然后求得每只大鼠5 d的平均逃避潜伏期。第6 天去除平台,测其120 s内穿越原平台的次数,即为穿环次数。
1.2.3 脑标本制备 Morris水迷宫实验结束后,0.8%戊巴比妥钠麻醉,0.9%生理盐水行心脏灌流5 min,然后4%多聚甲醛灌流固定约10 min,断头取出脑组织,4%多聚甲醛中室温固定至少24 h,经酒精梯度脱水(各10 min),二甲苯透明,石蜡包埋后备用。
1.2.4 脑标本HE染色 取石蜡包埋好的脑组织,以海马部位为标志,行冠状面切片,切片厚度为5 μm,经烤片、贴片,HE染色2~3 min,纯乙醇脱水,再经二甲苯透明,中性树胶封片,光镜下观察海马CA1区病理学变化。
1.2.5 海马CA1区BDNF和GAP-43蛋白表达检测采用免疫组织化学法。取石蜡包埋好的脑组织,以海马部位为标志,行冠状面切片,切片厚度为5 μm,经常规脱蜡脱水,0.01 mol PBS漂洗5 min×3次,枸橼酸钠抗原修复液微波加热修复,置于0.3% H2O2中室温避光孵育10 min,PBS漂洗同前,分别滴加一抗(兔抗大鼠BDNF多克隆抗体,1:500,Abcam公司,ab108319;兔抗大鼠GAP-43多克隆抗体,1:500,Abcam公司,ab12274),湿盒中4℃过夜,PBS漂洗同前,辣根酶标记山羊抗兔IgG(1:1 000,北京中衫金桥生物技术有限公司,ZB2301)室温孵育30 min,PBS漂洗同前,DAB显色,显微镜下观察显色,双蒸水适时停止反应,常规脱水、透明,中性树胶封片、镜检。黄色或棕黄色细胞为免疫阳性细胞,利用Image Pro Plus 6.0图像分析软件测定积分光密度值(IOD)。
1.3 统计学分析
采用SPSS 19.0统计软件进行统计学分析。计量资料采用均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况
实验前各组大鼠行为正常,呼吸规律。实验后,假手术组大鼠未出现明显异常行为,无死亡。缺氧5 min后,HIBD组和Que组大鼠均出现不同程度的烦躁不安,呼吸加深加快,站立不稳;缺氧30 min以上后,呼吸变浅变慢,活动明显减少;1 h后出现嗜睡、昏迷、眼睑下垂、反应迟钝等状况。Que组注射槲皮素24 h后以上症状开始逐渐得到缓解,72 h后接近假手术组,于缺氧后2 h死亡1只。HIBD组72 h后以上症状开始缓解,1周后接近假手术组,于缺氧后6 h、1 d各死亡1只。
2.2 大鼠神经功能缺陷评分
三组大鼠间神经功能评分的差异有统计学意义(F=306.10,P<0.01);假手术组无神经功能缺陷,神经功能缺陷评分由低到高依次为假手术组、Que组和HIBD组,HIBD组大鼠神经功能缺陷最严重,组间两两比较差异均有统计学意义(P<0.01)。见表1。
表1 各组大鼠神经功能评分比较 (±s)
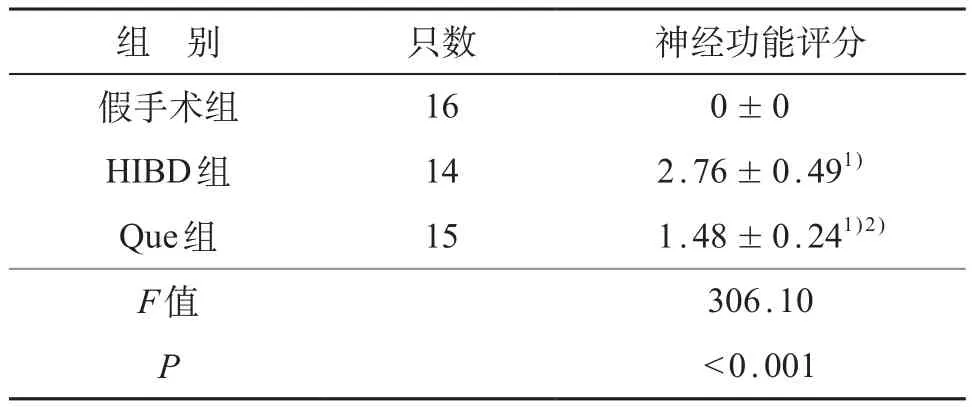
表1 各组大鼠神经功能评分比较 (±s)
注:1)与假手术组比较,P<0.01;2)与HIBD组比较,P<0.01
组 别只数神经功能评分假手术组160±0 HIBD组142.76±0.491)Que组151.48±0.241)2)F值306.10 P<0.001
2.3 大鼠学习记忆能力
Morris水迷宫实验显示,三组大鼠间平均逃避潜伏期的差异有统计学意义(F=57.22,P<0.001);逃避潜伏期由短到长依次为假手术组、Que组和HIBD组,HIBD组大鼠学习能力最差,组间两两比较差异均有统计学意义(P<0.01)。
去除平台后,三组大鼠间穿环次数的差异有统计学意义(F=71.14,P<0.001);穿环次数由多到少依次为假手术组、Que组和HIBD组,HIBD组大鼠对原平台的记忆能力最差,组间两两比较差异均有统计学意义(P<0.01)。见表2。
表2 各组大鼠学习记忆能力比较 (±s)
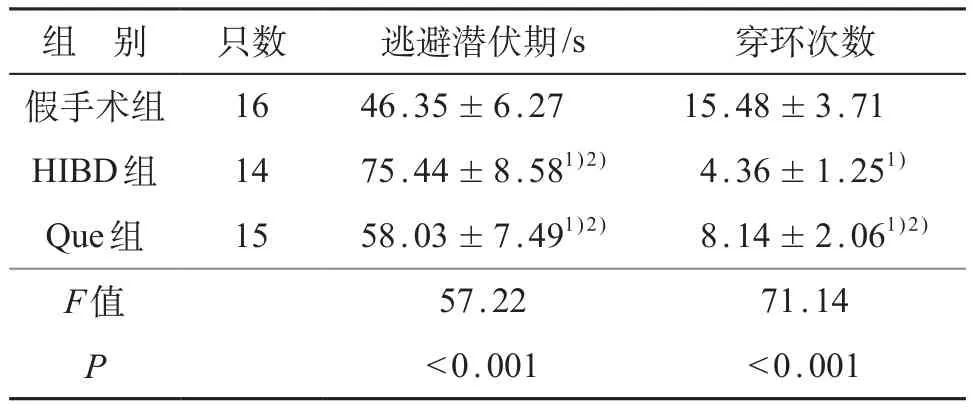
表2 各组大鼠学习记忆能力比较 (±s)
注:1)与假手术组比较,P<0.01;2)与HIBD组比较,P<0.01
组 别只数逃避潜伏期/s穿环次数假手术组1646.35±6.2715.48±3.71 HIBD组1475.44±8.581)2)4.36±1.251)Que组1558.03±7.491)2)8.14±2.061)2)F值57.2271.14 P<0.001<0.001
2.4 各组大鼠海马病理学改变
HE染色结果显示,假手术组大鼠海马神经元结构完整,排列整齐紧密;HIBD组海马结构疏松紊乱,且出现神经元丢失;Que组与HIBD组比较,结构疏松紊乱较轻,神经元数量有所增多。见图1。
2.5 海马CA1区BDNF和GAP-43蛋白表达
海马CA1区BDNF阳性细胞呈棕黄色表达,各组大鼠脑组织中均可见BDNF阳性细胞。三组间差异有统计学意义(F=143.20,P<0.001);组间两两比较发现,Que组BDNF阳性表达较HIBD组显著增高,但仍低于假手术组;HIBD组显著低于假手术组,差异均有统计学意义(P<0.01)。
海马CA1区GAP-43阳性细胞呈棕黄色表达,各组大鼠脑组织中均可见GAP-43阳性细胞。三组间差异有统计学意义(F=127.10,P<0.001);Que组GAP-43阳性表达较HIBD组显著增高,但仍低于假手术组;HIBD组显著低于假手术组,差异均有统计学意义(P<0.01)。见图2、表3。

图2 各组海马CA1区BDNF和GAP-43免疫组化图像(×400)
表3 各组海马CA1区BDNF和GAP-43阳性表达比较 (±s)

表3 各组海马CA1区BDNF和GAP-43阳性表达比较 (±s)
注:1)与假手术组比较,P<0.01;2)与HIBD组比较,P<0.01
F值143.20127.10 P<0.001<0.001
3 讨论
学习记忆障碍是HIE幸存患儿常有的后遗症,海马区尤其是海马CA1区是学习记忆储存和启动的关键脑区,而缺氧、缺血最易造成海马结构损伤,导致海马神经元变形或丢失[9]。因此海马区的形态结构是否发生病理学改变是验证HIBD的标志性指标。本研究采用国际上比较认可的改良Rice法建立新生大鼠HIBD模型,通过Bederson法评估大鼠的神经功能缺陷,经典的Morris水迷宫实验检测大鼠的学习记忆能力,HE染色观察海马CA1区形态结构。结果发现,与假手术组比较,造模后大鼠均有不同程度的神经功能缺陷,学习记忆能力明显下降,海马CA1区发生了明显的病理学改变,与以往报道一致[10],提示HIBD大鼠造模成功。给予槲皮素处理后,大鼠症状有所改善,提示槲皮素对HIBD大鼠具有一定的神经保护作用。
神经再生是中枢神经系统突触重建的结构基础,突触是神经元与神经元之间接触的部位,承担信息传递作用,易受其他因素的影响而发生可塑性变化[11]。突触可塑性是指突触在形态和功能上发生改变的特性,是学习记忆的神经生物学基础。因而缺氧缺血造成脑损伤区域的神经再生是改善认知障碍的关键靶点。为进一步明确槲皮素对HIBD大鼠的神经保护作用机制,本研究通过免疫组织化学方法检测各组大鼠海马CA1区神经再生相关蛋白BDNF和GAP-43的表达水平。
BDNF属于神经营养因子家族成员,广泛表达于中枢神经系统,尤其是海马、大脑皮层等与认知密切相关的脑区,能够营养神经元,促进神经元的分化、增殖和成熟,通过与其特异性受体酪氨酸激酶B(TrkB)结合发挥调节突触发生、维护突触功能等神经可塑性功能,是神经元再生的重要指标[12]。研究表明,在脑缺血损伤后,脑组织内的BDNF表达水平下降,而在给予神经保护剂(一些具有神经保护的药物)干预后可以逆转BDNF表达的下降,改善脑损伤症状[13,14]。
神经生长相关蛋白(GAP-43)是与神经发育、神经再生、突触重建关系密切的一种突触前膜蛋白[15]。脑组织轻度损伤时,GAP-43水平升高,促进损伤部位神经元的生长发育,引导轴突生长,调节轴突之间形成新的突触联系,起到修复损伤脑组织的作用。当损伤时间延长或者损伤超过一定程度后,GAP-43水平下降,对脑组织的代偿功能丧失[16]。研究表明,能够改善中枢神经系统功能损伤的中草药大多能够促进脑组织GAP-43的表达,进而促进神经再生,起到神经保护剂作用[17,18]。因此GAP-43通常被作为神经再生和突触重塑的标志性蛋白。
本研究发现,缺氧缺血后大鼠海马CA1区BDNF和GAP-43表达明显下降,而给予槲皮素处理后,两者表达均明显增加。提示槲皮素可能通过上调海马CA1区BDNF和GAP-43表达,促进神经再生,增加突触联系,进而改善HIBD大鼠的认知障碍。
综上所述,槲皮素对缺氧缺血性脑损伤大鼠具有神经保护作用,其机制不仅与抑制细胞凋亡有关,还可能与上调海马CA1区BDNF和GAP-43表达,促进神经再生有关。本研究为新生儿缺氧缺血性脑损伤后的治疗提供了一定的实验依据和临床治疗参考。
[1] 殷杰, 陈蓉, 肖东凡. 促红细胞生成素对缺氧缺血性脑损伤新生大鼠海马MMP-2表达的影响 [J]. 临床儿科杂志, 2016, 34(5): 366-370.
[2] 刘红亮, 胡磊, 王靖凯, 等. 槲皮素对H2O2损伤PC12细胞的保护效果与机制 [J]. 中国药理学通报, 2014, 30(3): 373-377.
[3] 刘敏, 肖颖, 左爱仁, 等. 槲皮素、根皮素、水飞蓟宾清除自由基和抑制脂质过氧化活性研究 [J]. 中成药, 2012, 34(4): 753-756.
[4] 朱玉婷, 刑同岳, 毛海芬,等. 槲皮素对高糖诱导的原代小胶质细胞炎性反应的抑制作用[J]. 中国医院药学杂志,2013, 33(21): 1787-1790.
[5] 杨青丽, 陈彦锋. 槲皮素对缺氧缺血性脑损伤新生大鼠远期学习记忆及PARP-1/AIF信号通路的影响[J]. 临床儿科杂志, 2016, 34(12): 936-941.
[6] Zhao ZK, Yu HL, Liu B, et al. Antioxidative mechanism of Lycium barbarum polysaccharides promotes repair and regeneration following cavernous nerve injury [J]. Neural Regen Res, 2016, 11(8): 1312-1321.
[7] Rice JE, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat [J]. Ann Neurol, 1981, 9(2): 131-141.
[8] Bederson JB, Pitts LH, Tsuji M, et al. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination [J]. Stroke, 1986, 17(3): 472-476.
[9] Byeon JH, Kim GH, Kim JY, et al. Cognitive dysfunction and hippocampal damage induced by hypoxic-ischemic brain injury and prolonged febrile convulsions in immature rats [J]. J Korean Neurosurg Soc, 2015, 58(1): 22-29.
[10] Ding HF, Zhang H, Ding HF, et al. Therapeutic effect of placenta-derived mesenchymal stem cells on hypoxic-ischemic brain damage in rats [J]. World J Pediatr, 2015, 11(1): 74-82.
[11] Danielewicz J, Trenk A, Hess G. Imipramine ameliorates early life stress-induced alterations in synaptic plasticity in the rat lateral amygdala [J]. Behav Brain Res, 2017, 317:319-326.
[12] Karagyaur M, Dyikanov D, Makarevich P, et al. Non-viral transfer of BDNF and uPA stimulates peripheral nerve regeneration [J]. Biomed Pharmacother, 2015, 74: 63-70.
[13] 万东, 祝慧凤, 罗勇, 等. 梓醇上调局灶脑缺血大鼠缺血灶周围大脑皮质BDNF和TrkB蛋白表达 [J]. 中国药理学通报, 2013, 29(6): 787-792.
[14] 胡国恒, 李映辰, 程齐来, 等. 肾脑复元汤对脑缺血大鼠BDNF及bFGF表达的影响 [J]. 中成药, 2015, 10(37): 2274-2278.
[15] 张岩, 王海燕, 王影, 等. 左乙拉西坦对癫痫大鼠海马组织中SYN和GAP-43 m RNA表达的影响 [J]. 临床儿科杂志, 2013, 31(7): 670-673.
[16] 卿鹏, 柴铁劬, 丁红梅, 等. 双侧电针结合康复训练对局灶性脑缺血/再灌注损伤大鼠海马CA3区神经生长相关蛋白43及突触素表达的影响 [J]. 针刺研究, 2016, 41(4): 314-320.
[17] 肖颖, 刘永亮. 葡萄籽原花青素通过细胞外信号调节激酶1/2途径对放射性脑损伤大鼠海马区生长相关蛋白-43活性的影响 [J]. 中国康复理论与实践, 2015, 21(12): 1397-1401.
[18] 黄海玲, 李建民, 赵亚宁. 参芎化瘀胶囊对大鼠全脑缺血再灌注损伤及其海马CA1区生长相关蛋白43 表达的影响 [J]. 中国中西医结合杂志, 2014, 34(2): 185-190.
Effects of Quercetin on nerve regeneration in neonatal rats with hypoxic-ischemic brain damage
YANG Qingli1,2, CHEN Yanfeng2
(1. NICU, Luohe Central Hospital,2. Department of Basic Medical Sciences, Luohe Medical College, Luohe 462000, Henan, China)
ObjectiveTo explore the protective effects of Quercetin on hypoxic ischemic brain damage (HIBD).MethodsForty-eight 7-day-old SD rats were randomly divided into sham-operation group, HIBD group and Que treatment group, 16 rats each. HIBD group and Que treatment group were treated by ligation of right common carotid artery to make anoxia and build HIBD model; sham-operation group had the separation of the right common carotid artery only. Que treatment group were injected intraperitoneally with quercetin (40 mg/kg) once a day for 7 days immediately after modeling while sham-operation group and HIBD group received equivalent normal saline at the same time. The rats in each group were scored of neurological function at 1 h after the last administration, and the ability of spatial learning-memory was tested by Morris water maze at the age of 28 days. After performing the test above, all rats were decapitated and the brains were taken. Pathological changes of hippocampus were observed by HE staining; the expression of brain-derived neurotrophic factor (BDNF) and nerve growth associated protein (GAP-43) in hippocampus CA1 area were detected by immunohistochemistry.ResultsThere were significant differences in neurological deficit score and learning-memory ability among the three groups (P<0.01), and neurological deficit score was the highest and the learning-memory ability was the lowest in HIBD group. Pathological examination showed that the structure of hippocampal neurons was intact in sham-operation group. It was loose and disorder, and even loss of neurons in HIBD group. Compared with the HIBD group, the loose in the structure of hippocampal was lighter, and the number of neurons was increased in the Que treatment group. There was statistical difference in the positive expression of BDNF and GAP-43 in the hippocampal CA1 area among the three groups (P<0.01), with those in HIBD group being lower than in Que treatment group and sham-operation group and those in treatment group being lower than in sham-operation group (P<0.01).ConclusionsQuercetin can enhance the expression of BDNF and GAP-43 in hippocampal CA1 region, promote nerve regeneration, improve the longterm learning-memory ability of HIBD neonatal rats, and protect the brain.
10.3969/j.issn.1000-3606.2017.03.016
2016-10-08)
(本文编辑:蔡虹蔚)
杨青丽 电子信箱:357027951@qq.com
