德国鸢尾种苗繁殖技术研究
2017-04-26廖晴白楠玛尔哈巴吾斯满沙红韩宏伟廖志立
廖晴,白楠,玛尔哈巴·吾斯满,沙红,韩宏伟,廖志立
(1.新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2.新疆乌鲁木齐市植物园,乌鲁木齐 830011)
德国鸢尾种苗繁殖技术研究
廖晴1,白楠2,玛尔哈巴·吾斯满1,沙红1,韩宏伟1,廖志立1
(1.新疆农业科学院园艺作物研究所,乌鲁木齐 830091;2.新疆乌鲁木齐市植物园,乌鲁木齐 830011)
【目的】对引进筛选出的4个德国鸢尾新品种笛声、青年蓝、梦醒、再享天福进行常规及组培繁殖技术研究,研究德国鸢尾常规及组培育苗的有效途径,为德国鸢尾种苗繁殖生产提供可靠的技术支撑。【方法】研究4个德国鸢尾品种在不同季节(春季、秋季)分株繁殖的成活率、萌芽率及对开花的影响;研究各品种在组培快繁中外植体的诱导、继代及生根培养基最佳激素水平及集成各环节技术建立各品种的快繁体系。【结果】德国鸢尾的常规繁殖,最佳分株繁殖时间是根系活动结束后或开始之前,即秋季休眠后或春季萌芽前,分株最好带2~3个芽进行移栽,单株移栽对植株开花影响较大,开花率较低,分株带5个芽的要优于带3个芽的开花率。德国鸢尾的组培繁殖,以其花器官中的花茎节作为外植体,用MS +BA 3.0~4.0 mg/L+NAA 1.0 mg/L培养基进行诱导,可直接得到不定芽;增殖培养基为MS+BA 1.0 mg/L+NAA 0.5 mg/L,带芽量为4~5个时,其增殖率为300%多;生根培养基为1/2MS+NAA 0.5 mg/L,带芽量为4~5个时,接种15 d,其生根率为100%;移栽基质以进口的粗草炭土为最佳,移栽成活率可达到100%。【结论】德国鸢尾的常规繁殖,最佳分株繁殖时间秋季休眠后或春季萌芽前,分株带2~3个芽进行移栽,单株移栽对植株开花影响较大,开花率较低。德国鸢尾的组培繁殖,用花茎节接种在MS +BA 3.0~4.0 mg/L+NAA 1.0 mg/L培养基上进行诱导,可直接得到不定芽,增殖培养基为MS+BA 1.0 mg/L+NAA 0.5 mg/L,生根培养基为1/2MS+NAA 0.5 mg/L,移栽基质以草炭土为最佳,移栽成活率可达到100%。
德国鸢尾;种苗繁殖;激素
0 引 言
【研究意义】德国鸢尾(IrisgermanicaL.)属多年生草本花卉,花姿奇特,花色丰富, 其根系发达,植株健壮,叶型优美,叶片宽大,无论是观花还是观叶效果极佳。耐瘠薄、抗旱、寒能力强。栽培历史悠久,是久负盛名的观赏花卉,深受人们的青睐。在医药食品、盆栽观赏、切花生产、园林绿化等领域均占有重要地位。目前,国内应用的德国鸢尾品种均引自国外,不但品种数量少、种源有限、且价格昂贵。迫切希望获得更多的、具有优良性状的德国鸢尾种苗,来满足各方面的需求。通过对国内外优良品种的引进,观测其生物学特性及适应性,在综合评价的基础上,结合新疆的地域特点,选出值得推广应用的4个品种并进行了种苗繁殖技术的研究。由于德国鸢尾不结实很难利用种子繁殖,而引进的母株有限,不能满足市场需求。因此,急需解决德国鸢尾优质种苗的繁殖方法,缓解目前市场对德国鸢尾种苗的需求,促进德国鸢尾在新疆园林建设上的应用与发展[1-2]。【前人研究进展】常规分株繁殖的方法存在着繁殖系数低,且易感染软腐病,优良性状难以保持,很难在短时间内获得大量优质种苗,无法满足园林绿化工程需要的问题[3-4]。而通过组织培养的方式生产种苗,虽生产速度快、可缩短繁育周期,有效保持种苗的优良性状,但在德国鸢尾组织培养中存在着污染率高,不定芽诱导困难的瓶颈问题。目前优良的德国鸢尾品种数量很少,在庭园绿化上的应用几乎是空白,因此,通过研究德国鸢尾繁殖技术是目前尽快满足应用需求的唯一有效途径。【本研究切入点】国内外有不少关于德国鸢尾组织培养的报道,且结果差异较大。研究4个德国鸢尾品种在不同季节(春季、秋季)分株繁殖的成活率、萌芽率及对开花的影响;研究各品种在组培快繁中外植体的诱导、继代及生根培养基最佳激素水平。【拟解决的关键问题】研究德国鸢尾在常规繁殖中,繁殖系数低及在组织培养中存在的不定芽诱导。集成各环节技术建立各品种的快繁体系,为其试管苗的工厂化生产提供理论依据。
1 材料与方法
1.1 材 料
供试材料为4个引进的德国鸢尾品种笛声、青年蓝、梦醒、再享天福。
1.2 方 法
1.2.1 德国鸢尾常规繁殖
鸢尾常规繁殖方法以分株繁殖为主,一般在春、秋季进行。选择植株健壮、没有病虫害的分株,剪去叶丛的1/2 或 2/3,以减少叶片水分蒸发,挖出块茎,用刀分株,通常每株保留多个芽,清除部分老根,分株后,稍微晾晒或用草木灰蘸一下再进行栽植。由于新长成的根状茎的根系没有木质化,比较脆嫩,分株栽植过程中应避免伤及新生根系。同时,注意对根状茎和根系伤口的消毒,待伤口自然晾干或蘸取草木灰后进行栽植,以防病原菌侵入感染。
1.2.1.1 不同季节及不同分株芽数对德国鸢尾萌发率、成活率的影响
分别在春秋两季对引进的4个鸢尾品种进行分株繁殖试验,研究不同季节及分株分成不同带芽量各10株(单芽、3个芽、5个芽)对鸢尾萌发率(萌发率=总芽数/起始芽数×100%)、成活率(成活率=成活的株数/移栽苗总数×100%)的影响。
1.2.1.2 不同季节及不同分株芽数对德国鸢尾开花的影响
分别在春秋两季对引进的4个鸢尾品种进行分株繁殖试验,研究不同季节及分株分成不同带芽量各10株(单芽、3个芽、5个芽)对鸢尾开花的影响(开花率=开花数/萌发芽数×100%)。
1.2.2 德国鸢尾组培繁殖
以引进的4个鸢尾品种为外植体,进行不定芽的诱导和继代增殖培养基的筛选,并对已培养出的组培苗进行生根培养激素筛选及移栽技术研究。
1.2.2.1 用不同激素水平配比筛选诱导外植体不定芽分化培养基
以MS添加不同激素水平配比的培养基,将灭菌后的不同品种的花器官外植体接种于培养基中进行诱导。每种培养基分别接种10瓶,每瓶4个外植体,每天光照12 h,光照强度为1 600~2 000 lx,培养温度24~28℃。接种30 d后统计其不定芽及愈伤组织诱导情况及诱导率(不定芽、愈伤组织诱导率=诱导出不定芽或愈伤组织的外植体数/外植体总数×100%),筛选诱导不定芽分化的最佳培养基。
1.2.2.2 同一激素水平下不定芽切分成不同带芽量丛苗对继代增殖的影响
以同一激素水平MS +BA 1.0 mg/L+NAA 0.5 mg/L 为培养基,将不定芽组培苗切分成不同带芽量(单芽、2~3个芽、4~5个芽)的芽苗,接种于培养基中进行继代增殖培养。每个品种每个处理接种10瓶,每瓶接种4株,每天光照12 h,光照强度为1 600~2 000 lx,培养温度24~28℃。30 d后统计不定芽增殖情况及增殖率(增殖率=增殖周期结束时的芽苗数/增殖周期起始时的芽苗数×100%),以筛选出最佳继代增殖的不定芽切分方式。
1.2.2.3 用同一激素水平配比筛选不定芽生根培养基
以1/2MS添加不同激素水平配比的培养基,将不定芽组培苗切分成不同带芽量(单芽、2~3个芽、4~5个芽)的芽苗,接种于培养基中进行生根培养。每个品种每个处理接种10瓶,每瓶接种4株,每天光照12 h,光照强度3 000~5 000 lx,培养温度24~28℃。30 d后统计不定芽生根情况及生根率(生根率=生根苗数/接种苗总数×100%),以筛选出最佳生根培养基。
1.2.2.4 用不同基质移栽筛选组培苗移栽基质
将组培苗从瓶中取出,将其根部培养基清洗干净,栽于不同的基质中(草炭土、珍珠岩、草炭土∶珍珠岩1∶1),每个品种在不同基质上移栽50株苗,每5~7 d定时浇营养液, 30 d后统计其成活率(成活率=成活的株数/移栽苗总数×100%),以筛选最佳栽培基质。
2 结果与分析
2.1 德国鸢尾常规繁殖技术
2.2.1 不同季节分株对鸢尾萌发率和成活率影响
分别在春秋两季对引进的4个鸢尾品种进行分株繁殖试验,研究不同季节及分株分成不同带芽量进行栽培,对鸢尾萌发率、成活率的影响。由于德国鸢尾在花期过后的两个月内,植株进入快速生长发育期,花芽的两侧常生出数个繁殖芽,新形成的繁殖芽继续生长就会形成新的根状茎,并在 8~9月同时进行花芽分化,待深秋停止发育。此时,新根状茎发育成熟,会形成了独立的根系。从理论上来说,秋季分株对植株的损伤会比较小,分株后的植株来年的成活率也会很高。研究表明,所有品种秋季移栽比春季移栽成活率要高,萌发率也是秋季移栽的要比春季移栽的的高;分株成单芽的移栽易死亡,且萌发率低,5芽的萌发率与3芽的萌发率相当,有些品种还低于3芽的萌发率,如果考虑经济因素,当然选择分株成3芽进行移栽比较适宜,既经济萌发率又高,所以,在常规繁殖时,通常每株保留 2~3个芽进行移栽。表1
表1 不同季节分株下鸢尾萌发率和成活率变化
Table 1 The effection of iris germination rate, survival rate divided plants in different seasons
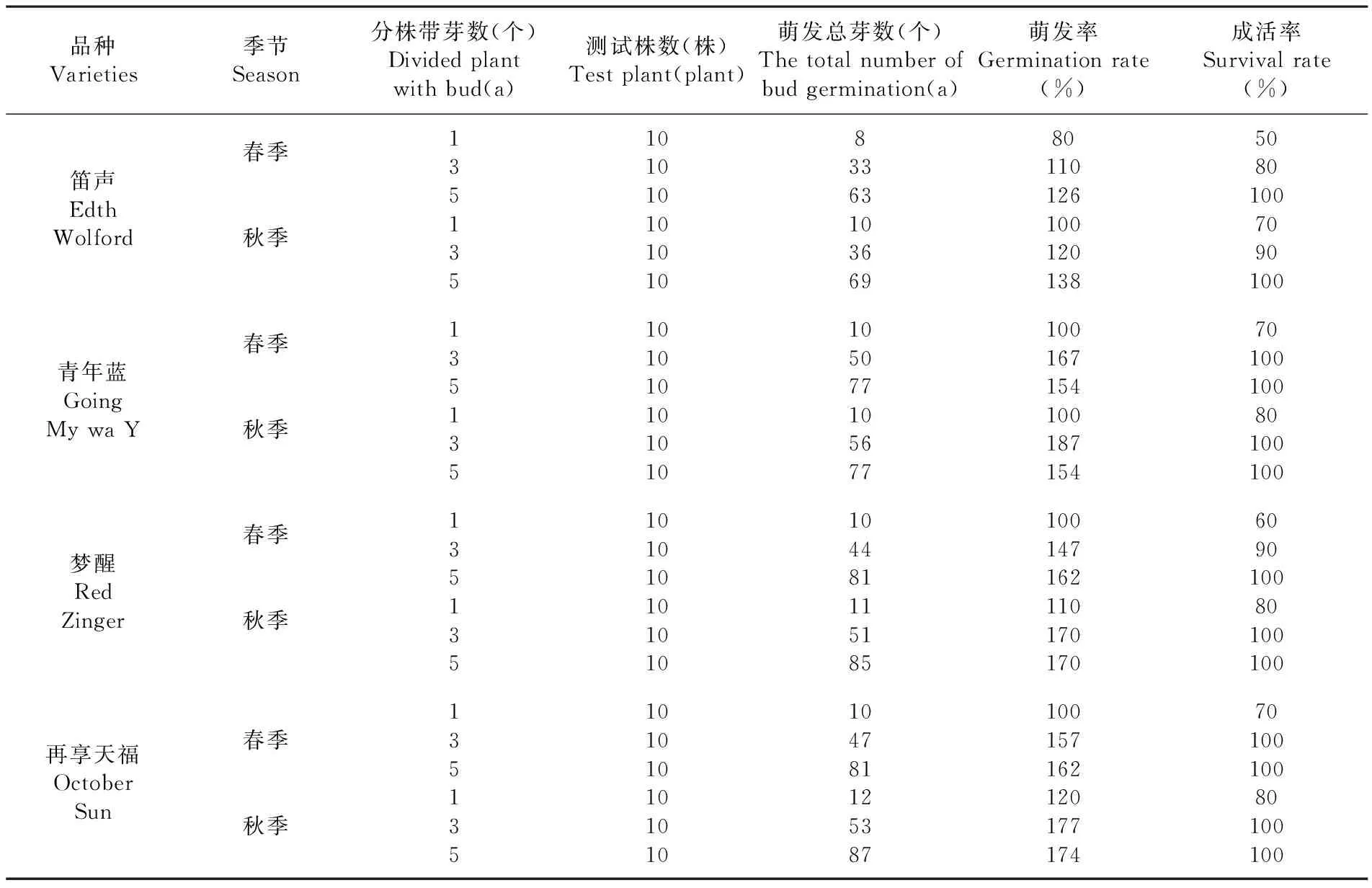
品种Varieties季节Season分株带芽数(个)Dividedplantwithbud(a)测试株数(株)Testplant(plant)萌发总芽数(个)Thetotalnumberofbudgermination(a)萌发率Germinationrate(%)成活率Survivalrate(%)笛声EdthWolford春季秋季135135101010101010833631036698011012610012013850801007090100青年蓝GoingMywaY春季秋季1351351010101010101050771056771001671541001871547010010080100100梦醒RedZinger春季秋季135135101010101010104481115185100147162110170170609010080100100再享天福OctoberSun春季秋季1351351010101010101047811253871001571621201771747010010080100100
2.2.2 不同季节分株对德国鸢尾开花的影响
分别在春秋两季对引进的4个鸢尾品种进行分株繁殖试验,研究不同季节及分株的芽数多少对鸢尾开花的影响。由于德国鸢尾的花芽多在当年的8~9月分化形成,次年的6月上旬至7月上旬,花茎直接从前一年新长成的根状茎中抽生出来,形成花序,绽开花朵。每段根状茎每年只可能开1次花,开过花的根状茎当年不可能再次形成花芽,秋季分株移栽有的晚熟品种可能花芽分化未完成,或分株损失了营养,研究表明,春季萌芽前分株不影响第二年开花,就开花而言,春季分株操作优于秋季。单株移栽对植株开花影响较大,开花率较低;分株带5个芽的要优于带3个芽的开花率。表2
表2 不同季节分株下德国鸢尾开花变化
Table 2 The effection of iris flowering divided plants in different seasons

品种Varieties季节Season分株带芽数(个)Dividedplantwithbud(a)测试株数(株)Testplant(plant)萌发芽数(个)Thetotalnumberofbudgermination(a)开花数(朵)FloweringNumber(flower)开花率Flowerrate(%)笛声EdthWolford春季秋季135135101010101010833631036691612251312.5018.1819.052013.8918.84青年蓝GoingMywaY春季秋季1351351010101010101050771056772152111620203027.271028.5725.97梦醒RedZinger春季秋季13513510101010101010448111518531325115263029.5530.869.0929.4130.59再享天福OctoberSun春季秋季13513510101010101010478112538711224214261025.5330.8616.6724.5329.89
2.3 德国鸢尾组培繁殖
2.3.1 不同激素水平配比对诱导外植体不定芽或愈伤组织分化的影响
研究表明,四个鸢尾品种只有在花茎节部位诱导出了不定芽,而诱导不定芽的最适激素水平配比是不同的,其中青年蓝、再享天福两个品种的不定芽分化率最大值出现在培养基为MS+BA 3.0 mg/L+NAA 1.0 mg/L中,分化率分别为52%和61%;而笛声、梦醒不定芽的最大分化率出现在培养基MS+BA 4.0 mg/L+NAA 1.0 mg/L中,分别为43%和40%。用花茎段和子房部位在培养基为MS+NAA 1.0 mg/L+BA 3.0~4.0 mg/L中,均可诱导出愈伤组织,分化率跟品种有关系,最高的分化率为17%。花药和花丝部位不能诱导出不定芽或愈伤组织。表3
2.3.2 同一激素水平条件下对不同带芽量的不定芽继代增殖的影响
先期已对增殖培养基做了筛选,选出四个品种平均值最佳的增殖培养基为MS+BA 1.0 mg/L+NAA 0.5 mg/L,培养30 d后,四个鸢尾品种的增殖系数可达2.5以上。将不同带芽量的不定芽接种于该培养基中,研究同一激素水平条件下,对不同带芽量的不定芽继代增殖的影响。研究表明,四个鸢尾品种在同一激素水平条件下,不定芽的增殖率不尽相同。这与品种不同有关系,在同一培养基中, 再享天福增殖率最高,笛声增殖率最低。当带芽量为单芽时,不定芽基本不生长,其增殖率为100%;当不定芽带芽量为2~3个时,其增殖率为200%多,最低的是210%,最高的可达270%;当不定芽的带芽量为4~5个时,其增殖率为300%多,最低的是310%,最高的可达380%。在鸢尾继代增殖过程中,最好将不定芽切成带芽量为4~5个芽的苗丛进行增殖培养,这样可以获得高倍的增殖率。表4
表3 不同激素水平配比诱导外植体不定芽或愈伤组织分化率
Table 3 Explant adventitious bud or callus differentiation rate on different levels hormone

品种Varieties培养基Medium花茎段(愈伤)Stemsegments(callus)(%)花茎节(不定芽)Stemsection(adventitiousbud)(%)子房(愈伤)Ovary(callus)(%)花药Anther(%)花丝Filament(%)笛声EdthWolfordMS+BA1+NAA1MS+BA2+NAA1MS+BA3+NAA1MS+BA4+NAA100370011430051000000000青年蓝GoingMywaYMS+BA1+NAA1MS+BA2+NAA1MS+BA3+NAA1MS+BA4+NAA10051101252410031400000000梦醒RedZingerMS+BA1+NAA1MS+BA2+NAA1MS+BA3+NAA1MS+BA4+NAA1002100723400031100000000再享天福OctoberSunMS+BA1+NAA1MS+BA2+NAA1MS+BA3+NAA1MS+BA4+NAA10061701461550051300000000
表4 同一激素水平条件下不同带芽量的不定芽继代增殖变化
Table 4 The effection of adventitious bud subculture with different bud number on same level hormone
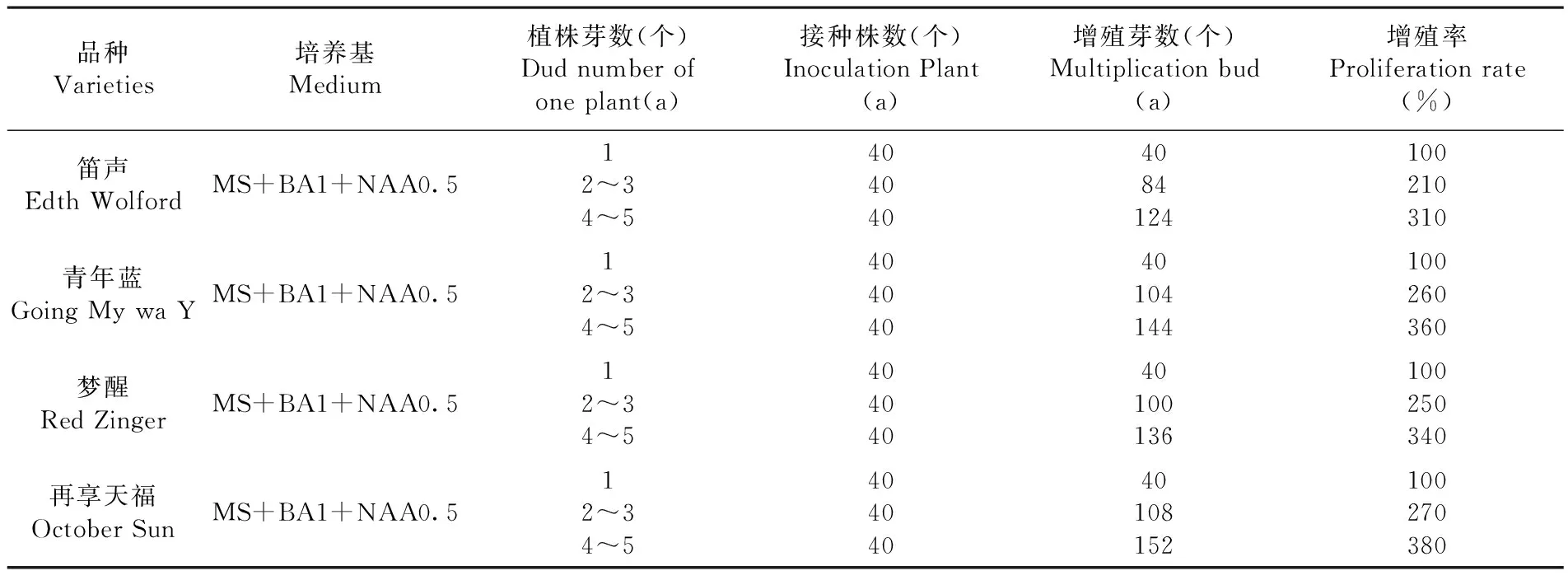
品种Varieties培养基Medium植株芽数(个)Dudnumberofoneplant(a)接种株数(个)InoculationPlant(a)增殖芽数(个)Multiplicationbud(a)增殖率Proliferationrate(%)笛声EdthWolfordMS+BA1+NAA0.512~34~54040404084124100210310青年蓝GoingMywaYMS+BA1+NAA0.512~34~540404040104144100260360梦醒RedZingerMS+BA1+NAA0.512~34~540404040100136100250340再享天福OctoberSunMS+BA1+NAA0.512~34~540404040108152100270380
2.3.3 同一激素水平条件下对不同带芽量的不定芽生根的影响
先期已对生根培养基做了筛选,选出四个品种平均值最佳的生根培养基为l/2MS+NAA 0.5 mg/L,培养30 d后,四个鸢尾品种的生根率均可达100%,且生根形成的愈伤组织也较少。将不同带芽量的不定芽接种于该培养基中,研究同一激素水平条件下对不同带芽量的不定芽生根的影响。研究表明,单芽生根,需要25 d左右才能生根,生根率分别为42.5%、52.5%、62.5%、62.5%;当带芽量2~3的不定芽生根,其生根较单芽快,20 d左右便可生根,且生根率分别为85%、80%、77.5%、87.5%;当带芽量4~5的不定芽生根时, 15 d左右即可生根,生根率可达到100%。根据这种情况,在鸢尾组培苗生根时,最好将不定芽分成带芽量4~5的苗丛进行生根培养,不仅生根快,根系质量好,而且生根率可达到100%。表5
表5 同一激素水平条件下不同带芽量的不定芽生根变化
Table 5 The effection of adventitious bud rooting with different bud number on same level hormone
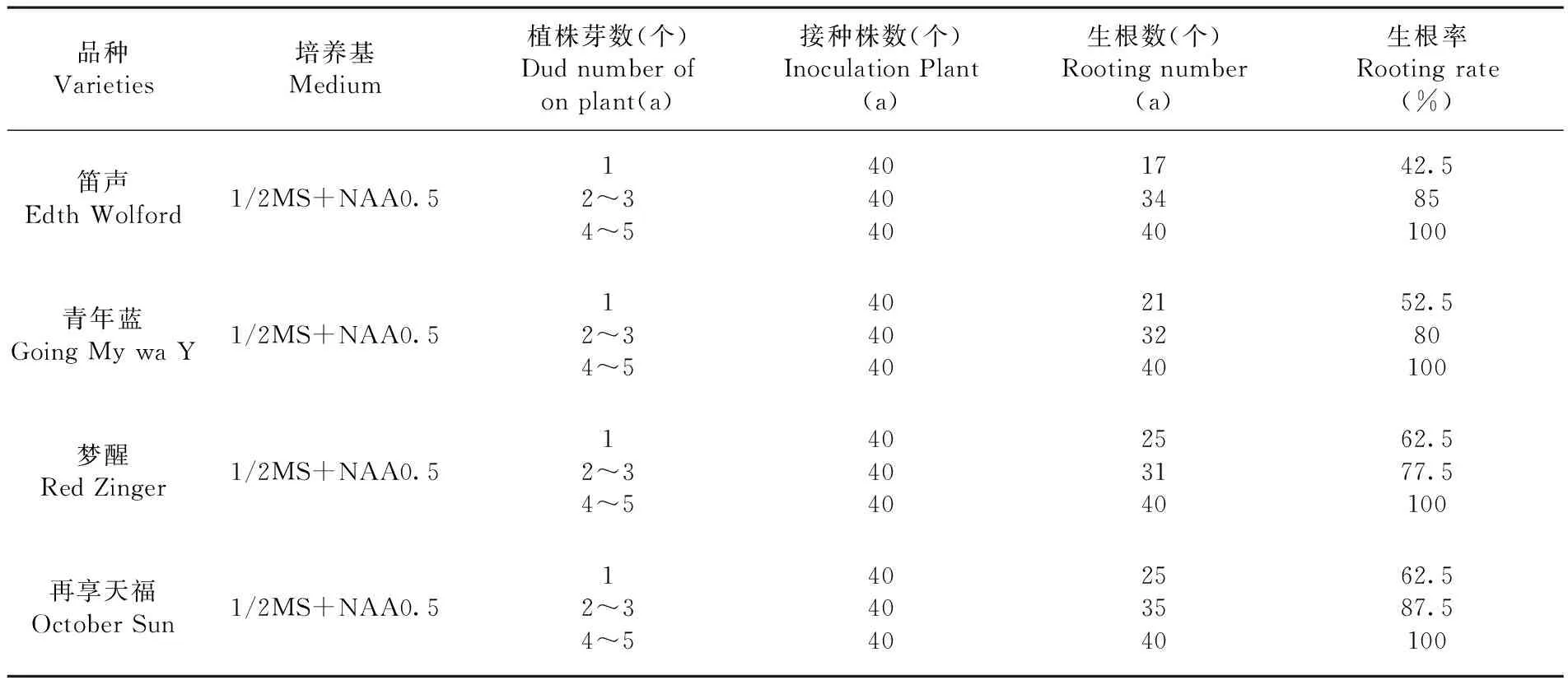
品种Varieties培养基Medium植株芽数(个)Dudnumberofonplant(a)接种株数(个)InoculationPlant(a)生根数(个)Rootingnumber(a)生根率Rootingrate(%)笛声EdthWolford1/2MS+NAA0.512~34~540404017344042.585100青年蓝GoingMywaY1/2MS+NAA0.512~34~540404021324052.580100梦醒RedZinger1/2MS+NAA0.512~34~540404025314062.577.5100再享天福OctoberSun1/2MS+NAA0.512~34~540404025354062.587.5100
2.3.4 不同基质对组培苗移栽成活率的影响
研究表明,四种鸢尾品种在三种基质中,成活率都比较高。其中珍珠岩稍差些,草炭土移栽的成活率最高,基本是100%。这是因为草炭土既有充足的营养又有良好的透气性,更能较好的锁住水分,适宜鸢尾植株的生长。所以,鸢尾最佳的移栽基质为草炭土。移栽基质对移栽成活率起至关重要的作用,珍珠岩透气,但保水性差,几乎没有营养,因而小苗不易感染,但要不停的补充水分及养分。混合基质前期生长比较好,但到了根扎下后生长时,小苗明显长势要比在草炭土中的差。所以,用草炭土移栽鸢尾组培苗成活率高。 表6
表6 不同基质下不定芽移栽成活率变化
Table 6 The effection of the adventitious bud transplanting survival rate on different substrates
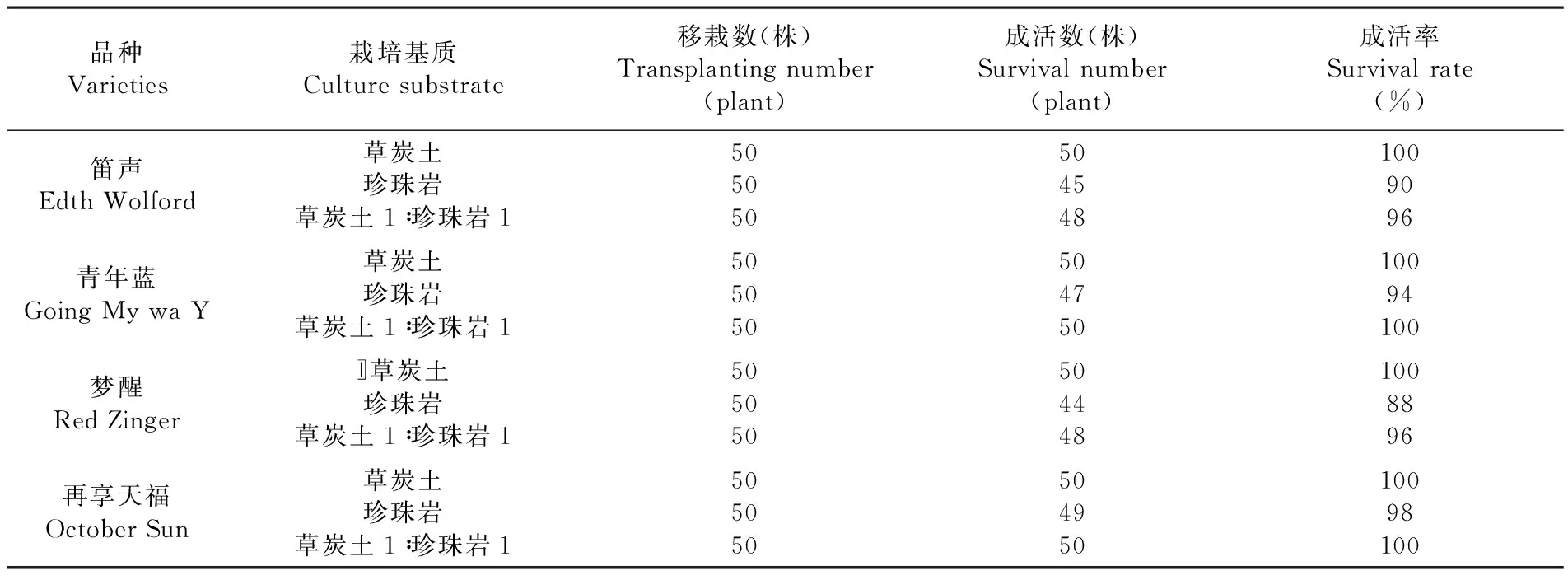
品种Varieties栽培基质Culturesubstrate移栽数(株)Transplantingnumber(plant)成活数(株)Survivalnumber(plant)成活率Survivalrate(%)笛声EdthWolford草炭土珍珠岩草炭土1∶珍珠岩15050505045481009096青年蓝GoingMywaY草炭土珍珠岩草炭土1∶珍珠岩150505050475010094100梦醒RedZinger〛草炭土珍珠岩草炭土1∶珍珠岩15050505044481008896再享天福OctoberSun草炭土珍珠岩草炭土1∶珍珠岩150505050495010098100
3 讨 论
德国鸢尾的分株繁殖,虽没有严格的季节性限制,但如果第二年不是特别要求开花效果或是为生产种苗,就秋季进行分株移栽,因为秋季分株移栽有的晚熟品种可能花芽分化未完成(高海拔地区),或分株损失了营养,就会对第二年的开花有影响;如果第二年要求开花效果好,就春季进行分株,因为春季移栽对开花的影响不大,只是移栽时尽量不要伤到花芽。最佳分株繁殖时间是根系活动结束后或开始之前,即秋季休眠后或春季萌芽前。分株时最好分成带2~3个芽的植株进行栽培,当然带的芽越多,成活率越高,第二年的开花效果也就越好。但结合经济及栽培效果保持等情况综合来看,分株带2~3个芽是最好的。
德国鸢尾的组培繁殖,在外植体的选择上,选用最多的是茎尖,也有选择花器官等作为外植体的。黄苏珍、贾明良、黄洁等以德国鸢尾的茎尖为外植体,陈晨等以德国鸢尾花器官为外植体进行组织培养[5-14]。试验结果证实了用花器官为外植体,尤其是用花茎的茎节处不经愈伤组织可直接诱导出不定芽,不仅诱导时间短,而且诱导率较高,因此这种方法是德国鸢尾组培快繁中,快速高效诱导不定芽的一条捷径。试验结果表明,继代增殖及生根丛生芽的大小对不定芽增殖及生根有显著影响,将芽丛切成单芽进行继代和生根培养,试管苗几乎不再增殖,增殖系数为1,生根速度慢,培养25 d后,生根率最高只能达到62.5%;分成2~3 芽时增殖系数达到2以上,生根培养20 d后,生根率最高达到87.5%;分成 4~5 芽的增殖系数可达到3以上,生根培养15 d后,生根率最高达到100%。这可能是鸢尾的生理特性所决定的,在分株时株丛过小会较大程度地损伤植株,从而严重影响增殖速度及生根速度和生根率。
该试验在诱导外植体所得到的结果与许多文献报道的不太相同,这也许是试验品种不同产生的差异,还有就是采用的激素种类、配比或采外植体的时间、部位等不同也会造成较大的差异。在移栽基质试验中与文献报道也有些出入,德国鸢尾的根系忌水多,喜排水良好的沙壤土,用珍珠岩移栽,可满足根系的喜好,又可避免移栽过程中的污染,但会缺乏生根后的营养,使得生根后会出现营养不良,叶黄的情况,所以用珍珠岩移栽还有待于进行植株营养补充的研究;用草炭土移栽,最好用进口的粗草炭土进行移栽,只要控制好基质湿度及空气湿度,组培苗移栽后就会生长良好,这与是否掌握了移栽基质和空气湿度有关,因而对移栽基质和空气湿度还需进行进一步的研究。
4 结 论
德国鸢尾的常规繁殖,最佳分株繁殖时间是根系活动结束后或开始之前,即秋季休眠后或春季萌芽前,分株最好带2~3个芽进行移栽。单株移栽对植株开花影响较大,开花率较低,分株带5个芽的要优于带3个芽的开花率。德国鸢尾的组培繁殖,以其花器官中的花茎节作为外植体,用MS +BA 3.0~4.0 mg/L+NAA 1.0 mg/L培养基进行诱导,可直接得到不定芽,增殖培养基为MS+BA 1.0 mg/L+NAA 0.5 mg/L,生根培养基为1/2MS+NAA 0.5 mg/L,移栽基质以进口的粗草炭土为最佳,移栽成活率可达到100%。
References)
[1] 张巧平,尹增芳,何祯祥. 中国鸢尾属植物研究概况[J]. 安徽农业科学,2008,36(9):3 609-3 611.
ZHANG Qiao-ping, YIN Zeng-fang, HE Zhen-xiang, et al. (2008). Research Advance in Chinese Iris[J].JournalofAnhuiAgri.Sci. , 36(9):3,609-3,611. (in Chinese)
[2]郭晋燕,张金政,孙国峰,等.根茎鸢尾园艺学研究进展 [J]. 园艺学报 ,2006,33 (5): 1 149- 1 156.
GUO Jin-yan, ZHANG Jin-zheng, SUN Guo-feng, et al. (2006). Advances of Horticultural Study ofRhizomatousIrises[J].ActaHorticulturaeSinica, 33(5):1,149-1,156. (in Chinese)
[3]董艳芳,周媛,郭彩霞,等.德国鸢尾的分株繁殖试验 [J].中国农学通报,2015,31(10):133-137.
DONG Yan-fang, ZHOU Yuan, GUO Cai-xia, et al. (2015). Research on the Division Propagation ofIrisgermanicaL. [J].ChineseAgriculturalScienceBulletin,31(10):133-137 (in Chinese)
[4] 王振一. 德国鸢尾的栽培技术 [J]. 河北林果研究,2005,20(3):291-293.
WANG Zhen-yi.(2005). Cultivation techniques foririsgermanica[J].HebeiJournalofForestryandOrchardResearch, 20(3):291-293.(in Chinese)
[5]黄洁,马登萍. 德国鸢尾的组织培养试验[J].青海农林科技,2008,(1):15-16.
HUANG Jie, MA Deng-ping. (2008) Test on Tissue Culture ofIris germanica.JournalofQinghaiForestryScience&Technology, (1): 15-16. (in Chinese)
[6] Boltenkov, E. V., Labetskaya, N. V., Lauve, L. S., & Zhuravlev, Y. N. (2000). Introduction of iris oxypetala bunge into in vitro culture.RastitelnyeResursy, 36(1):67-70.
[7] 张芳,董然,赵和祥,等. 德国鸢尾新品种'魂断蓝桥'离体快繁的研究[J]. 北方园艺,2011,(9):146-148.
ZHANG Fang, DONG Ran, ZHAO He-xiang, et al.(2011). Research on In vitro Propagation ofIrisgermanicaL. of Waterloo Bridge [J].NorthernHorticulture, (9):146-148. (in Chinese)
[8] 陈晨,毕晓颖,卢明艳.德国鸢尾组织培养快速繁殖技术研究[J]. 沈阳农业大学学报, 2010,41(1):27-32.
CHEN Chen, BI Xiao-ying, LU Ming-yan, et al.(2010).Tissue Culture and Rapid Propagation ofIrisgermanicaL. [J].JournalofShenyangAgriculturalUniversity, 41(1):27-32. (in Chinese)
[9] Kawase, K., Mizutani, H., Yoshioka, M., & Fukuda, S. (1995). Shoot formation on floral organs of japanese iris in vitro.JournaloftheJapaneseSocietyforHorticulturalScience, 64(1):143-148.
[11]赵春莉,张芳,顾德峰,等. 4 个鸢尾新品种组培苗移栽技术研究[J]. 安徽农业科学,2012,40(30) :14 678-14 679.
ZAO Chun-li, ZHANG Fang, GU De-feng, et al.(2012) Transplanting Techniques for Tissue-Cultured Seedling of Four New Varieties of Iridaceae [J].JournalofAnhuiAgri.Sci. , 40( 30) :14,678-14,679. (in Chinese)
[12]董艳芳,郭彩霞,周媛,等. 2种德国鸢尾组织培养体系的建立[J]. 西北农林科技大学学报(自然科学版),2012,42(2):107-112.
DONG Yan-fang, GUO Cai-xia, ZHOU Yuan, et al. (2012). Construction of tissue culture system for twoIrisgermanicavarieties[J].JournalofNorthwestA&FUniversity(Nat.Sci.Ed.) , 42(2): 107-112. (in Chinese)
[13]黄苏珍, 谢明云, 佟海英,等.荷兰鸢尾的组织培养[J]. 植物资源与环境, 1999,8(3) : 48-52.
HUANG Su-zhen, XIE Ming-yun, TONG Hai-ying, et al.(1999) The tissue culture ofIrisxiphiumL. var. hybridum[J].JournalofPlantResourcesandEnvironment, 8(3): 48-52.(in Chinese)
[14] 贾明良,廖乾生,陈集双,等. 路易斯安娜鸢尾快繁体系的建立[J]. 科 技 通 报,2010,26(4):518-522.
JIA Ming-liang, LIAO Qian-sheng, CHEN Ji-shuang, et al.(2010). The Establishment of Rapid Propagation System of Louisiana Iris [J].BulletinofScienceandTechnology, 26(4):518-522. (in Chinese)
Supported by:Supported by Xinjiang Uygur Autonomous Region's Science and Technology Support Program "The introduction of new varieties of iris, its breeding technology development and garden application demonstration" (201591118)
IrisgermanicaL. Seedlings Breeding Technology Research
LIAO Qing1, BAI Nan2, Marbaha Wsman1, SHA Hong1, HAN Hong-wei1, LIAO Zhi-li1
(1.ResearchInstituteofHorticulturalCrops,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China; 2.UrumqiCityBotanicalGarden,Xinjiang,Urumqi830011,China)
【Objective】 Through conventional tissue culture propagation technology of the 4 new introduced varieties of German iris: Edith Wolford, Going My WaY, Red Zinger and October Sun, this project aims to explore the effective way ofIrisgermanicaconventional and tissue culture in the hope of providing reliable technical support for the production of German iris seedlings propagation. 【Method】In different seasons (spring and autumn), the survival rate, germination rate and effects on flowering with division propagation were studied about the four German irises, meanwhile the best hormone levels of explant induction, transgenerational and rooting medium were studied, and the rapid propagation system of each type was established. 【Result】Using German irises of conventional breeding, the optimal points strains breeding time was after or before the start of root activity, after the fall dormancy or before the spring bud. 2-3 shoots were transplanted in ramets. The effect of single plant transplanting on plant flowering was large, and flowering rate was low. The ramets with 5 buds were better than those with 3 buds, when German iris tissue culture propagation was carried out, its flower stems were used as explants and we could obtain directly adventitious bud on induction medium MS +BA 3.0-4.0 mg/L+NAA 1.0 mg/L , multiplication medium was MS + BA 1.0 mg/L + NAA 0.5 mg/L, with buds of 4-5, the propagation rate was more than 300%; rooting medium was 1/2 MS + NAA 0.5 mg/L with buds of 4-5, 15 d vaccination, the rooting rate was 100%; The imported transplanting substrate was the best, and the transplanting survival rate can reach up to 100%. 【Conclusion】Using German irises for conventional breeding, was after the fall dormancy or before the spring bud. 2-3 shoots were transplanted in ramets. The effect of single plant transplanting on plant flowering was large, and flowering rate was low. When German iris tissue culture propagation was being carried on, we obtained directly adventitious bud on induction medium MS +BA 3.0-4.0 mg/L+NAA 1.0 mg/L,using stem section of flower organs as explant, multiplication medium was MS + BA 1.0 mg/L + NAA 0.5 mg/L, the propagation rate was more than 300%; rooting medium was 1/2 MS + NAA 0.5 mg/L; transplanting substrate to import crude plant was the best, and transplanting survival rate can reach up to 100%.
IrisgermanicaL.; seedling breeding; hormone
10.6048/j.issn.1001-4330.2017.03.011
2017-01-12
新疆维吾尔自治区科技支疆项目“鸢尾新品种引进、繁殖技术开发及园林应用示范”(201591118)
廖晴(1962-),女,四川安岳人,副研究员,研究方向为园艺观赏学,(E-mail)lq08270029@sina.com
S682
A
1001-4330(2017)03-0470-09
