溶剂类型对芍药花多酚类物质的提取及其抗氧化能力的影响
2017-04-26陈冠林刘学文谢迎庆赵颖莹韩门娣
陈冠林+刘学文+谢迎庆+赵颖莹+韩门娣+陈松根
摘要:利用不同溶剂提取芍药花中多酚类化合物并测定总酚的含量及其抗氧化能力。结果表明,提取溶剂的差异对芍药花提取物总酚和抗氧化活性影响显著。总酚提取效率最好的是50%乙醇,铁离子还原能力和总抗氧化能力最强的是50%乙醇的提取液,DPPH·自由基清除能力最好的是甲醇-丙酮-水提取液。结果显示芍药花可作为一种经济的抗氧化剂来源。
关键词:芍药花;多酚;抗氧化
中图分类号:TS201.1 文献标识码:A 文章编号:0439-8114(2017)06-1118-05
DOI:10.14088/j.cnki.issn0439-8114.2017.06.032
Abstract:Solvents were used to extracted polyphenol from the flower of Paeonia lactiflora Pall.,total phenolic content and the antioxidant properties of polyphenol were also determined. The results showed that the extracting solvents significantly affected the contents of total polyphenol and antioxidant activities in the flower of Paeonia lactiflora Pall.. The highest total phenolic content was obtained with 50% ethanol. The highest antioxidant activities measured by reducing power and total antioxidant capacity by equivalent antioxidant capacity (TEAC) assays were obtained with 50% aqueous ethanol, while the highest scavenging DPPH· activity was obtained with methanol-acetone-water. The results obtained demonstrated the potential of the flower of Paeonia lactiflora Pall. can use as an economical source of antioxidant.
Key words: the flower of Paeonia lactiflora Pall.; total phenolic contents; antioxidant activity
芍藥(Paeonia lactiflora Pall.),为芍药科(Paenoiaeeae)芍药属(Paeonia)的著名草本花卉,在中国的栽培历史超过4 900年。芍药产于浙江、安徽、河南、山东、贵州、四川等地,中国有野生芍药品种约8个,栽培品种约800个。芍药以根入药,味苦、微寒、归肝经。芍药作为一种传统的中药,在中国、韩国以及日本应用广泛[1,2],具有解痉、补虚、镇痛的作用[3]。除此以外,芍药还有抗氧化、抗炎、解热、抗焦虑以及抑制脂质过氧化等作用[4-10]。芍药花是中国的六大名花之一,作为芍药的附属部分因没有充分的开发和利用常常被废弃,造成了极大的资源浪费。芍药的花色有白、粉、黄、红、蓝、紫、黑等8色。芍药花富含多种重要的高级脂肪酸,以棕榈酸、亚油酸以及亚麻酸为主[11]。含苞待放的花蕾中多酚和Zn的含量最高,而初开的花中黄酮含量最高,Fe元素则在凋谢的花瓣中最高,Cu元素含量在各个花期差不多[12]。芍药花含有糖类、苷类、有机酸类、黄酮类、香豆素类、酚类、甾体类或三萜类和蒽醌类化合物[13]。芍药色素在酸性条件下红色稳定,酸性越强,红色越深,近中性至碱性时,色素极不稳定。该色素有一定的耐热性,不耐光,对氧化剂、还原剂均较敏感。Fe3+、Fe2+、Cu2+可引起色素颜色异常,与色素反应络合生成其他物质;Mn2+对色素有褪色作用;Na+、K+、Ca2+、Mg2+、Zn2+、Pb2+对色素均有一定的增色作用,其中Pb2+增色效果显著;碳水化合物、有机酸对芍药色素具有显著的增色效果;植酸对芍药花色素增色效果最为显著,酒石酸对色素的保色效果最显著;紫外线照射对芍药干燥花瓣的破坏大于自然光,覆膜处理对芍药干燥花的保色效果不显著[14]。从目前掌握的文献看,大部分研究是关于芍药的,而对芍药花的研究较少。虽然有文献对芍药花的提取物进行了相关的研究[12,13,15,16],但溶剂对芍药花多酚的提取及其抗氧化研究以及提取物浓度与抗氧化性的关系没有进行系统的研究。因此,本研究以芍药花为原料,应用不同的溶剂从芍药花中提取多酚,测定提取液中多酚的含量及其抗氧化性,同时对提取物浓度与抗氧化性的关系进行系统研究,为后续研究提供理论依据。
1 材料与方法
1.1 材料与试剂
1)材料。芍药花购于广东省佛山市某超市。
2)试验试剂。乙醇、Trolox(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,水溶性维生素E)、TPTZ(2,4,6-tris-2,4,6-tripiridyl-2-triazine,三吡啶三吖嗪)、FeCl3、HCl溶液、乙酸钠缓冲液、福林-酚试剂(Folin-Ciocalteu reagent)、乙醇溶液、DPPH·(1,1-diphenyl-2-picrylhydrazyl,1,1-二苯基-2-三硝基苯肼)、过硫酸钾、没食子酸、ABTS+·(2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid,2,2'-联氨-双-3-乙基-苯并噻唑啉-6-磺酸)。
1.2 仪器与设备
紫外/可见分光光度计(北京瑞利分析仪器有限公司,UV-9600),超声清洗仪(LEO-150S)。
1.3 样品的制备
芍药花干燥后用粉碎机粉碎,过20目筛,备用。
1.4 芍药花多酚的提取
准确称取1.0 g芍药花,分别加入甲醇,50%甲醇,乙醇,50%乙醇,甲醇-丙酮-水(7∶7∶6;V/V/V)50 mL,室温下超声10 min,抽滤,滤液备用;准确称取1.0 g芍药花加入50 mL开水,10 min后抽滤,滤液备用[17-23]。
1.5 总酚含量的测定
取0.10 mL待测样品,加入2.50 mL 1∶10稀释的Folin-Ciocalteu试剂中,反应4 min后,加入2.00 mL 75 g/L的Na2CO3溶液,置室温下反应120 min,于760 nm下测定吸光度。结果以没食子酸当量(Gallic acid equivalents, GAE)表示,单位为mg GAE/g[24,25]。
1.6 ABTS法测定抗氧化能力
将7 mmol/L的ABTS(用pH为4.5、20 mmol/L的乙酸钠配制)和2.45 mmol/L的过硫酸钾等体积混合,室温下避光反应12~16 h,形成ABTS+·储备液。使用前用20 mmol/L乙酸钠(pH 4.5)将ABTS+·储备液稀释成为工作液,使其在734 nm处吸光度为0.700±0.002。取100 μL待测样品,加入3 mL ABTS+·工作液,室温下反应2 h后,在734 nm处测定吸光度。以20 mmol/L乙酸钠(pH 4.5)为空白,ABTS+·为对照,以Trolox溶液为标样作标准曲线,样品的抗氧化活性用TEAC(Trolox equivalent antioxidant capacity)表示[26],单位为μmol Trolox/g。
1.7 DPPH法测定抗氧化活性
取0.1 mL待测样品,加入0.06 mmol/L DPPH· 80%乙醇溶液3.9 mL,振蕩15 s,放置暗处反应2 h后,于515 nm处测定吸光度,按以下公式计算清除率:清除率=(A对照-A样品)/A对照×100%。以3.9 mL DPPH·+0.1 mL 80%乙醇作对照,空白为80%乙醇,以Trolox溶液为标样作标准曲线,样品的抗氧化活性用Trolox当量表示,单位为μmol Trolox/g[27]。
1.8 FRAP法测定抗氧化活性
FRAP试剂由10 mmol/L的TPTZ(溶于40 mmol/L盐酸)、20 mmol/L的三氯化铁、300 mmol/L的乙酸钠缓冲液(pH 3.6)以1∶1∶10(V/V/V)的比例混合而成。取100 μL待测样品,加入3 mL FRAP溶液中充分混合,反应120 min后于593 nm处测定吸光度。以Trolox溶液为标样作标准曲线,样品的抗氧化活性用μmol Trolox/g表示[26,28]。
2 结果与分析
2.1 多酚含量
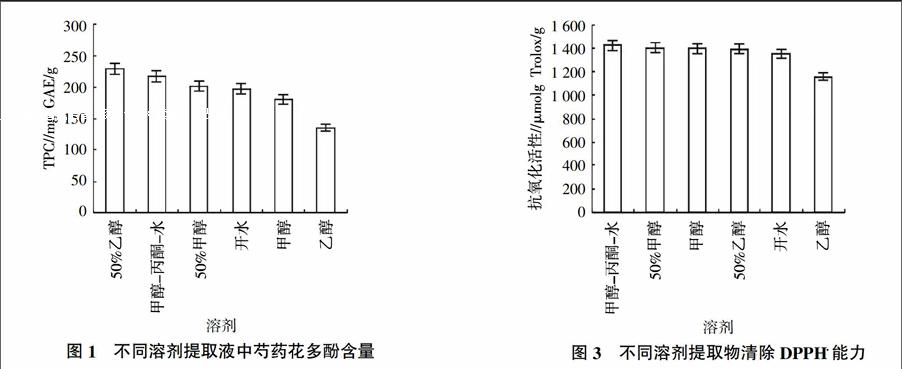
提取物的提取效率及其抗氧化性与提取溶剂相关,不同的溶剂提取所得的化合物极性不同[21],有机溶剂经常被用来提取多酚,选择合适的溶剂进行提取,有利于提高多酚的提取效率[18]。因此,本研究应用不同的溶剂进行相关的研究,以获得最佳的提取溶剂。不同溶剂提取液中的总酚含量为134.94~229.16 mg GAE/g,其中50%乙醇对多酚的提取效果最好(图1)。提取液中多酚含量的顺序为50%乙醇﹥甲醇-丙酮-水﹥50%甲醇﹥开水﹥甲醇﹥乙醇,混合溶剂比单溶剂的提取效率好,这与以往的研究结果是相同的[29]。
2.2 清除ABTS·+能力
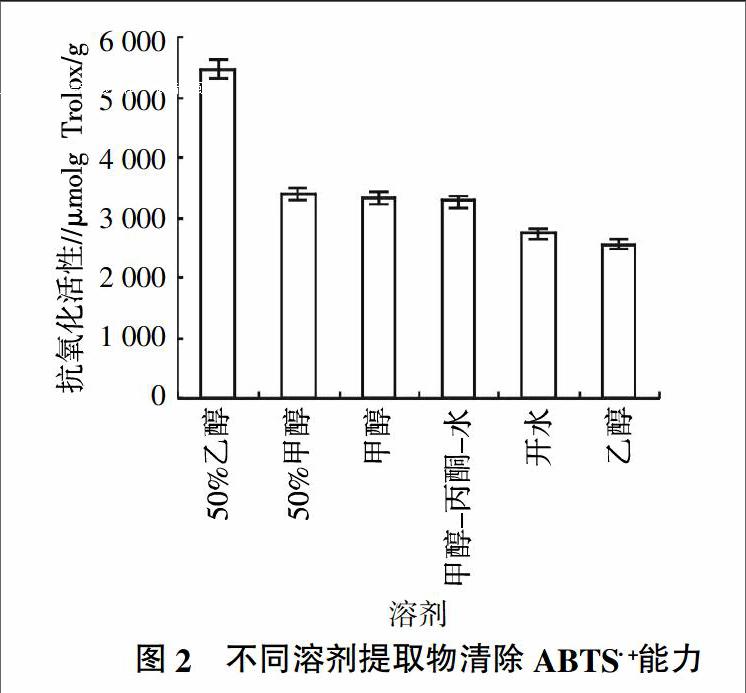
ABTS经过氧化后生成稳定的蓝绿色阳离子自由基ABTS+·,且能溶于水相或酸性乙醇介质中。游离基捕获剂加入到ABTS+·溶液后,可以与ABTS+·作用而使反应体系褪色,通过在最大吸收波长处检测吸光度的变化来评价自由基被清除的情况,从而评价试验样品的抗氧化能力[30-32]。各提取液中清除ABTS+·能力为2 533.41~5 450.41 μmol Trolox/g,其中50%乙醇提取液清除ABTS+·能力最强。提取液清除ABTS+·能力的顺序为50%乙醇﹥50%甲醇﹥甲醇﹥甲醇-丙酮-水﹥开水﹥乙醇(图2)。
2.3 清除DPPH·能力
DPPH·是一种稳定的自由基,其乙醇溶液呈紫色,其孤对电子在517 nm附近有强吸收。加入自由基清除剂时,吸收减弱或者消失,颜色由紫色向黄色变化,通过测定其吸收减弱的程度来评价自由基被清除的情况[33-35]。各提取液中清除DPPH·能力为 1 154.56~1 423.71 μmol Trolox/g,其中甲醇-丙酮-水提取液清除DPPH·能力最强。提取液清除DPPH·能力的强弱顺序为甲醇-丙酮-水﹥50%甲醇﹥甲醇﹥50%乙醇﹥开水﹥乙醇(图3)。
2.4 Fe3+还原能力
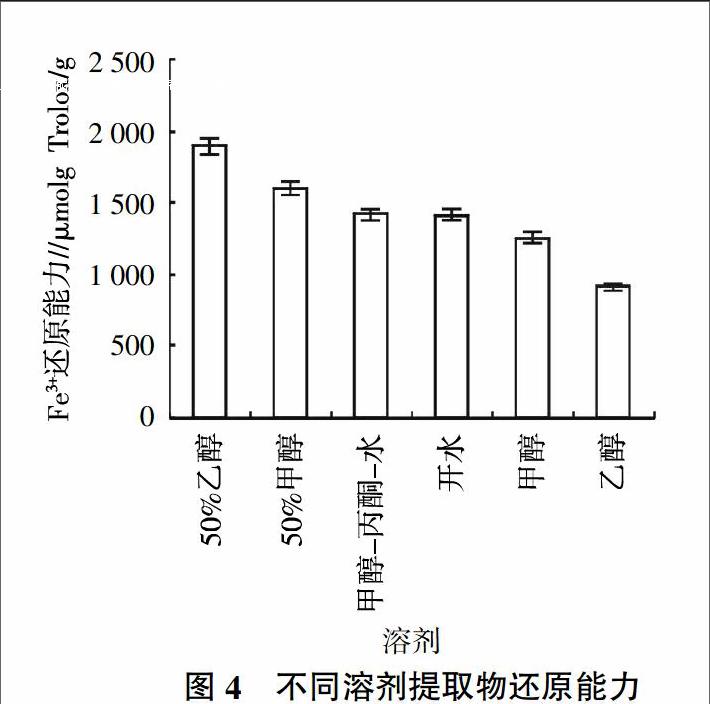
在酸性条件下,样品中的抗氧化物质可以将Fe3+-TPTZ还原为Fe2+-TPTZ而呈蓝色,在593 nm处具有最大吸收光,根据吸光度的大小来计算样品抗氧化能力的强弱[28,36,37]。提取液Fe3+的还原能力为915.11~1 899.11 μmol Trolox/g,其中50%乙醇提取液的Fe3+还原能力最强。提取液Fe3+的还原能力的顺序为50%乙醇﹥50%甲醇﹥甲醇-丙酮-水﹥开水﹥甲醇﹥乙醇(图4)。
2.5 多酚含量与抗氧化活性能力的相关性研究
由图5可知,总酚含量与DPPH·清除能力(y=2.622 3x+842.05,R2=0.753 6)、Fe3+还原能力(y=9.129 7x-342.23,R2=0.833 4)存在着较强的线性相关关系,这与以往的研究结论是一致的[38,39]。结果表明,酚类在清除DPPH·以及还原Fe3+中起着重要的作用。然而在本研究中,总酚含量与ABTS+·清除能力的关系较弱,与以往的研究结论是有差别的[38,39]。随着提取液中酚类含量浓度增高其抗氧化能力增强(图6,表1),这与以往的研究是一致的[20,40]。
2.6 各方法测定抗氧化活性研究之间的相关性
由图7可知,FRAP法与ABTS法之间存在着较强的线性相关关系,显示酚类不但可以还原Fe3+还可以清除ABTS+·,这与以往的研究结论是一致的[16,38,39]。FRAP法与DPPH法之间也存在着较强的线性关系,但DPPH法与ABTS法之间不存在相关关系。
3 结论
结果表明,提取溶剂对酚类物质含量及其抗氧化活性有显著的影响,混合溶剂比单溶剂的提取效率好。提取液中总酚含量与DPPH·清除能力和Fe3+还原能力存在着较强的线性相关关系,随着总酚含量增高其抗氧化能力增强。从本研究可看出芍药花多酚具有较强的抗氧化活性,可作为一种天然的抗氧化剂应用于食品和医药行业中。在选择的溶剂中,甲醇和丙酮是有毒的而乙醇是无毒的,乙醇被廣泛地应用于化合物的提取以及食品工业中,因此选择乙醇作为后续试验的溶剂。
参考文献:
[1] LEE S J,LEE H K,JUNQ M K,et al.In vitro antiviral activity of 1,2,3,4,6-penta-O-galloyl-β-D-glucose against hepatitis B virus[J].Biol Pharm Bull,2006,29(10):4.
[2] SHU X,DUAN W,LIU F,et al.Preparative separation of polyphenols from the flowers of Paeonia lactiflora Pall.by high-speed counter-current chromatography[J].Journal of Chromatography B,2014(948):62-67.
[3] XU S,YANG L,LIN Q,et al. Simultaneous determination of paeoniflorin, albiflorin and benzoylpaeoniflorin in radix Paeoniae Alba by TLC[J].Chromatographia,2008,68(5-6):459-462.
[4] YANG H O,KO W K,KIM J Y,et al. Paeoniflorin:An antihyperlipidemic agent from Paeonia lactiflora[J].Fitoterapia,2004, 75(1):45-49.
[5] CHOU T. Anti-inflammatory and analgesic effects of paeonol in carrageenan-evoked thermal hyperalgesia[J].British Journal of Pharmacology,2003,139(6):1146-1152.
[6] KHAN T,AHMAD M,NISAR M,et al. Enzyme inhibition and radical scavenging activities of aerial parts of Paeonia emodi Wall.(Paeoniaceae)[J].Journal of Enzyme Inhibition and Medicinal Chemistry,2005,20(3):245-249.
[7] LIANG X,WANG Y,JING L,et al. Effects of paeoniflorin on the cerebral infarction, behavioral and cognitive impairments at the chronic stage of transient middle cerebral artery occlusion in rats[J].Life Sciences,2005,78(4):413-420.
[8] MI X J,CHEN S W,WANG W J,et al. Anxiolytic-like effect of paeonol in mice[J].Pharmacology Biochemistry and Behavior,2005,81(3):683-687.
[9] KIM S H,KIM S,PARK M,et al. Paeonol inhibits anaphylactic reaction by regulating histamine and TNF-α[J].International Immunopharmacology,2004,4(2):279-287.
[10] HSIEH C,CHENG C,TSAI T,et al. Paeonol reduced cerebral infarction involving the superoxide anion and microglia activation in ischemia-reperfusion injured rats[J].Journal of Ethnopharmacology,2006,106(2):208-215.
[11] 王荣花,刘雅丽.牡丹和芍药花瓣中高级脂肪酸组分及含量的测定[J].中国农学通报,2004(6):212-214.
[12] 胡喜兰,尹福军,程青芳,等.不同花期芍药花中活性成分的研究[J].食品科学,2008(9):511-514.
[13] 金英善,陈曼丽,金银哲,等.芍药花活性成分分析及体外清除自由基活性研究[J].扬州大学学报(农业与生命科学版),2012(3):86-90.
[14] 王愛晶.芍药花红色素稳定性研究及应用[D].哈尔滨:东北林业大学,2010.
[15] 舒希凯.芍药花抗氧化活性成分的分离和鉴定[D].济南:山东师范大学,2013.
[16] CHEN G,CHEN S,XIE Y,et al. Total phenolic,flavonoid and antioxidant activity of 23 edible flowers subjected to in vitro digestion[J].Journal of Functional Foods,2015,17:243-259.
[17] LIYANAPATHIRANA C,SHAHIDI F. Antioxidant activity of wheat extracts as affected by in vitro digestion[J].Biofactors, 2004,21(1-4):325-328.
[18] ALFARSI M A,LEE C Y. Optimization of phenolics and dietary fibre extraction from date seeds[J].Food Chemistry,2008,108(3):977-985.
[19] CONTINI M, BACCELLONIS, MASSANTINI R,et al. Extraction of natural antioxidants from hazelnut(Corylus avellana L.) shell and skin wastes by long maceration at room temperature[J].Food Chemistry,2008,110(3):659-669.
[20] FEMANDEZ?魷A,PEREIRA E,FREIRE M S,et al. Influence of solvent on the antioxidant and antimicrobial properties of walnut(Juglans regia L.) green husk extracts[J].Industrial Crops and Products,2013,42:126-132.
[21] MOURE A,CRUZ J M,FRANCO D,et al. Natural antioxidants from residual sources[J].Food Chemistry,2001,72(2):145-171.
[22] VZQUEZ G,FONTENLA E,SANTOS J,et al. Antioxidant activity and phenolic content of chestnut (Castanea sativa) shell and eucalyptus(Eucalyptus globulus) bark extracts[J].Industrial Crops and Products,2008,28(3):279-285.
[23] LIYANA C M,SHAHIDI F.Importance of insoluble-bound phenolics to antioxidant properties of wheat[J].J Agric Food Chem,2006,54(4):1256-1264.
[24] SINGLETON V L,ROSSI J A.Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J].American Journal of Enology and Viticulture,1965,16(3):144-158.
[25] SONG F L,GAN R Y,ZHANG Y,et al. Total phenolic contents and antioxidant capacities of selected chinese medicinal plants[J].Int J Mol Sci,2010,11(6):2362-2372.
[26] OZGEN M,REESE R N,TULIO A Z, et al. Modified 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS) method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power (FRAP) and 2,2‘-Diphenyl-1-picrylhydrazyl(DPPH) methods[J].Journal of Agricultural and Food Chemistry,2006,54(4):1151-1157.
[27] CAI Y,SUN M,CORKE H. Antioxidant activity of betalains from plants of the amaranthaceae[J].J Agric Food Chem,2003, 51(8):2288-2294.
[28] BENZIE I F F,STRAIN J J. The ferric reducing ability of plasma(FRAP) as a measure of “Antioxidant Power”: The FRAP assay[J].Analytical Biochemistry,1996,239(1):70-76.
[29] SPIGNO G,TRAMELLI L,DE F D M.Effects of extraction time,temperature and solvent on concentration and antioxidant activity of grape marc phenolics[J].Journal of Food Engineering,2007,81(1):200-208.
[30] MILLER N J,RICE E C,DAVIES M J,et al. A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates[J].Clin Sci (Lond),1993,84(4):407-412.
[31] RE R,PELLEGRINI N,PROTEGGENTE A,et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine,1999,26(9-10):1231-1237.
[32] RICE E C,MILLER N J. Total antioxidant status in plasma and body fluids[J].Methods Enzymol,1994,234:279-293.
[33] 方 敏,王耀峰,宮智勇.15种水果和33种蔬菜的抗氧化活性研究[J].食品科学,2008(10):97-100.
[34] 胡喜兰,韩照祥,陶 莹,等.DPPH·法测定17种植物的抗氧化活性[J].食品科技,2006(10):264-268.
[35] BRAND W W,CUVELIER M E,BERSET C. Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30.
[36] HALVORSEN B L,HOLTE K,MYHRSTAD M C,et al. A systematic screening of total antioxidants in dietary plants[J].J Nutr,2002,132(3):461-471.
[37] PULIDO R,BRAVO L,SAURA C F. Antioxidant activity of dietary polyphenols as determined by a modified ferric reducing/antioxidant power assay[J].Journal of Agricultural and Food Chemistry,2000,48(8):3396-3402.
[38] CHEN G,CHEN S,ZHAO Y,et al. Total phenolic contents of 33 fruits and their antioxidant capacities before and after in vitro digestion[J].Industrial Crops and Products,2014,57(3):150-157.
[39] CHEN G,CHEN S,CHEN F,et al. Nutraceutical potential and antioxidant benefits of selected fruit seeds subjected to an in vitro digestion[J]. Journal of Functional Foods,2016,20:317-331.
[40] BAE H,JAYAPRAKASHA G K,CROSBY K,et al. Influence of extraction solvents on antioxidant activity and the content of bioactive compounds in non-pungent peppers[J]. Plant Foods for Human Nutrition,2012,67(2):120-128.
