糖胶树花次生代谢产物及其抗细菌活性
2017-04-26张伟豪刘易王小晴方萍宋慧
张伟豪++刘易++王小晴++方萍++宋慧云++王军++单体江


摘 要 采用水蒸气蒸馏法提取糖胶树花挥发油,通过气相色谱-质谱联用技术(GC-MS)对挥发油进行成分分析,采用薄层层析——生物自显影法测定糖胶树花乙酸乙酯层提取物对供试细菌的抑制活性。结果表明,糖胶树花挥发油得率为0.018%,通过GC-MS分析,从中鉴定出20个成分,占挥发油总量的97.53%,其主要成分为2-莰烯(23.30%),芳樟醇(23.09%),(-)-4-萜品醇(10.54%)。糖胶树花乙酸乙酯层提取物对大肠杆菌表现出较强的抑制活性,其次为黄瓜角斑病菌,对其他供试细菌未表现出抑制活性。
关键词 糖胶树 ;挥发油 ;次生代谢产物 ;抗细菌活性
中图分类号 S476 ;R284 文献标识码 A Doi:10.12008/j.issn.1009-2196.2017.03.021
Chemical Analysis and Antibacterial Activity of the
Extract from Alstonia scholaris
ZHANG Weihao LIU Yi WANG Xiaoqing
FANG Ping SONG Huiyun WANG Jun SHAN Tijiang
(Guangdong Key Laboratory for Innovative Development and Utilization of Forest
Plant Germplasm, College of Forestry and Landscape Architecture,
South China Agricultural University, Guangzhou, Guangdong 510642)
Abstract The volatile oil from the flowers of Alstonia scholaris was extracted by hydro-distillation, and its chemical components were analyzed by gas chromatography-mass spectrometry (GC-MS). The antibacterial activity of the ethyl acetate extract against bacteria was analyzed by thin layer chromatography bio-autography method. The results showed that the flowers of A. scholaris was extracted to yield 0.018% of volatile oil. The GC-MS analysis showed that 20 components were identified from the volatile oil of the flowers and accounted for 97.53% of total volatile substance. The major components of the volatile oil included 1,7,7-trimethylbicyclo[2.2.1] hept-2-ene (23.30%), 3,7-Dimethyl-1,6- octadien-3-ol (23.09%) and (-)-4-Terpineol (10.54%). The ethyl acetate extracts showed certain antibacterial activity against Escherichia coli and Pseudomonas lachrymans, but not against the other bacteria under test.
Keywords Alstonia scholaris ; volatile oil ; chemical component ; antibacterial activity
糖胶树[Alstonia scholaris R. Br.],又称灯架树、面条树,属于夹竹桃科鸡骨常山属,主要分布在广西南部、西部和云南南部,广东、湖南和台湾等地[1]。糖胶树的根、树皮、叶均可入药。在印度,用其树皮、叶及乳汁来治疗疟疾和发汗[2];在我国民间,则用其树皮来治头痛、伤风、痧气、肺炎、百日咳等,外用可治外伤止血、接骨、消肿、疮节以及杀虫剂的配制等[3-4]。糖胶树喜湿润肥沃土壤,在水边生长良好,是次生阔叶林主要树种,因其树形优美,常作为行道树等观赏用树[1,5]。随着糖胶树的广泛种植,其花期浓烈的气味也引起人们的广泛关注。植物精油又称挥发油,属于植物次生代谢产物,具有广谱抑菌杀菌活性和消炎功能,能使人适度兴奋、减缓疲劳产生松弛感等[6-9],植物精油可作为协同增强剂,与标准药物联合使用时产生强于个体效应的联合效应,并产生增强的抗菌活性[10-11]。目前,關于糖胶树花挥发油的研究较少,且尚未见糖胶树花次生代谢产物抗菌活性的报道。本研究采用水蒸气蒸馏法提取糖胶树花挥发油,并通过GC-MS分析测定其化学组成。同时采用甲醇冷浸提取和乙酸乙酯萃取得到糖胶树花提取物,通过薄层层析-生物自显影法(TLC-MTT-生物自显影法)测定乙酸乙酯层提取物对供试细菌的抑菌活性,为阐明糖胶树花挥发油的化学组成以及糖胶树的综合开发和利用提供重要依据。
1 材料与方法
1.1 材料
糖胶树花于2015年11月21日采自华南农业大学校园,标本由华南农业大学林学与风景园林学院郑明轩老师鉴定。
供试细菌:枯草芽孢杆菌(Bacillus subtilis,G+),溶血葡萄球菌(Staphylococcus haemolyticus,G+),根癌土壤杆菌(Agrobacterium tumefaciens,G-),大肠杆菌(Escherichia coli,G-),黄瓜角斑病菌(Pseudomonas lachrymans,G-),桉树青枯菌(Ralstonia solanacearum,G-),番茄疮痂病菌(Xanthomonas vesicatoria,G-)。以上菌株由华南农业大学林学与风景园林学院森林保护教研室提供。
6890N-5975C气相色谱-质谱联用仪(GC-MS)(美国安捷伦科技有限公司);水蒸气蒸馏装置(北京永光明医疗仪器厂);硫酸链霉素(美国Sigma公司,99%);MTT(美国Sigma公司);C8-C40系列正构烷烃(美国Sigma公司);氯化钠、无水乙醚、无水硫酸钠、二氯甲烷等均为国产分析纯(北京化学试剂公司)。
1.2 方法
1.2.1 挥发油的提取及GC-MS分析
参照Lou等[12]和刘易等[13]的方法提取挥发油。采集糖胶树花(1 123 g),称重后装入水蒸气蒸馏装置内,加入适量蒸馏水,待温度升至180℃后连续蒸馏6 h,收集回流所得的挥发油,加入一定量的氯化钠,用无水乙醚萃取3次,合并萃取液,加入无水硫酸钠干燥处理,让无水乙醚自然挥发,4℃密封保存备用。
糖胶树花挥发油化学组分的鉴定在6890N-5975C GC-MS(Agilent Technologie,USA)上进行,毛细管色谱柱为DB-5(30 m × 250 μm × 0.25 μm),无分流进样,进样口温度230℃,进样量1 μL。升温程序:起始温度70℃,保持1 min;然后8℃/min上升到120℃,保持1 min;以30℃/min上升到150℃,保持1 min;再以5℃/min上升到175℃,保持0 min;然后以1℃/min上升到180℃,保持0 min;最后5℃/min上升到240℃,保持0 min。离子源温度230℃,电离方式为EI,电离能量70 eV,载气为He,流速1 mL/min,全扫描采集,质谱检测器(MSD)检测。通过与NIST(2011)中标准化合物的保留时间和质谱图作对比,确定待测成分。
1.2.2 糖胶树花乙酸乙酯层提取物抗菌活性测定
将采集的糖胶树花剪碎,装入三角瓶,加入适量甲醇,冷浸提取3次,每次7 d。过滤后浓缩提取液,水混悬后用乙酸乙酯萃取3次,浓缩萃取液,得到乙酸乙酯层提取物,4℃保存,备用。
采用TLC-MTT-生物自显影法测定其抗细菌活性[14-16]。将提取物用乙酸乙酯溶解,用直径为0.5 mm的毛细管点样,点样量为5 μL,点样点越小越好。采用石油醚和丙酮的4∶1(V/V)的混合液为展开剂进行薄层层析,薄层层析后,在薄层板的一侧原点处点5 μL浓度为0. 2 mg/mL 的硫酸链霉素作为阳性对照,备用。向灭菌的LB半固体培养基(琼脂浓度为0.5%)中加入一定量准备好的菌液(45 mL LB+5 mL菌液),将其浓度调至约108 CFU/mL,振荡均匀。用喷样器将制备好的菌悬液均匀喷洒到层析后的硅胶板上;待培养基在硅胶板上冷却后,将硅胶板置于培养皿中于4℃冰箱中放置4 h,以利于抗菌成分的扩散;而后将培养皿置于28℃下保温培养,12 h后取出硅胶板,在其上均匀喷洒噻唑蓝(MTT),约10 min后即可观察实验结果。有抗菌活性成分处,供试菌由于受到抑菌成分的抑制而出现抑菌斑;无抗菌活性成分处,供试菌正常生长,通过MTT显色后出现背景色蓝色。通过抗菌斑点的迁移率(即Rf值)来初步评价样品中抗菌化合物的数量和极性,根据抗菌斑点的大小来初步评价化合物的活性和含量。Rf值计算公式如下:
Rf值=■
2 结果与分析
2.1 糖胶树花挥发油GC-MS分析
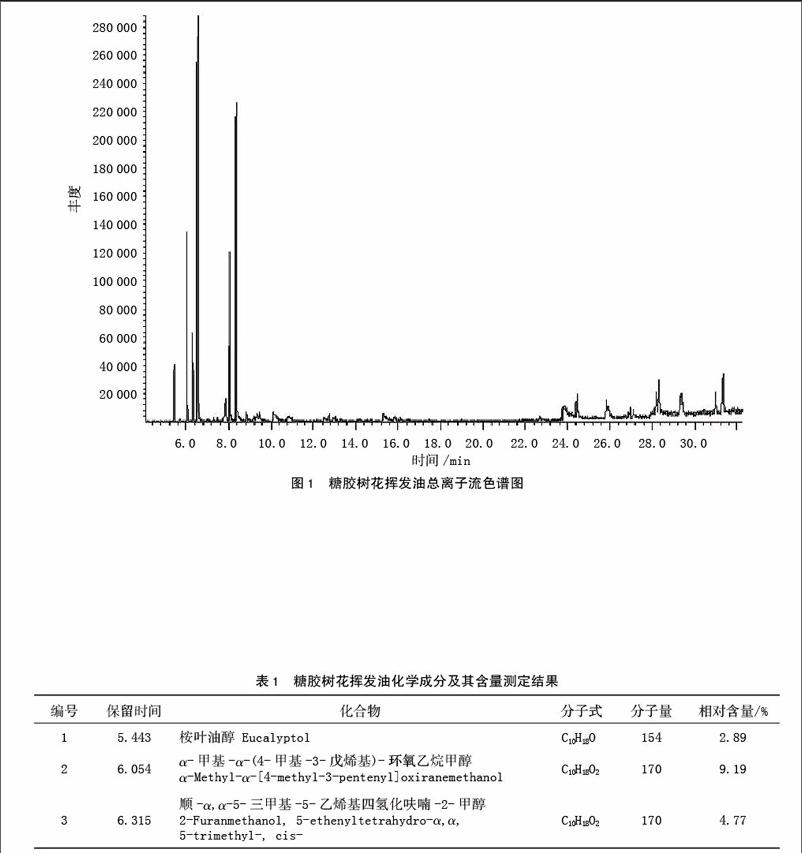
通过水蒸气蒸馏法,糖胶树花挥发油的得率为0.018%(以鲜重为基础)。糖胶树花挥发油总离子流色谱图如图1。
采用峰面积归一化法计算出各组分的相对百分含量,并进行定量分析,结果见表1。通过GC-MS分析,从糖胶树花挥发油中共鉴定出21个成分,占挥发油总量的97.53%。主要成分是2-莰烯(23.30%),芳樟醇(23.09%),(-)-4-萜品醇(10.54%),α-甲基-α-(4-甲基-3-戊烯基)-环氧乙烷甲醇(9.19%),铁锈罗汉柏醇(5.68%),其余成分相对含量均在5%以下。得到的挥发油化合物主要为醇类(57.53%)和烃类(28.51%),其相对含量见图2,说明糖胶树花挥发油中含有种类丰富的化合物。
2.2 糖胶树花乙酸乙酯层提取物的抗菌活性结果
采用TLC-MTT-生物自显影法测定了糖胶树花乙酸乙酯提取物对6种供试细菌的抑制活性,阳性对照为硫酸链霉素,结果见表2。糖胶树花乙酸乙酯提取物对大肠杆菌表现出最强的抑制活性, Rf值为0.28~0.45,抑菌斑的最大直径在5.6~10 mm;其次是黄瓜角斑病菌,在Rf值为0.31~0.40(+),0.42~0.43(+)的范围内表现出抑菌活性,抑菌斑的最大直径为4 mm。糖胶树花乙酸乙酯层提取物对其他供试细菌未表现出抑制活性。硫酸链霉素对黄瓜角斑病菌的抑制活性最强,抑菌斑的直径大于10 mm,而对其他供试细菌的抑菌斑直径均在5~10 mm。
3 讨论
通过本研究发现,糖胶树花挥发油中相对含量较高的成分主要为2-莰烯(23.30%)、芳樟醇(23.09%)和(-)-4-萜品醇(10.54%)。莰烯可以作为合成香料的重要原料[17-18],以莰烯为原料合成的衍生物在精细化工、医药、食品、材料等各个行业有实际应用价值[19-21]。芳樟醇是香水香精、家化产品香精及皂用香精配方中使用频率最高的香料品种,也用于配制食用香精,现在全世界用于配制各种香精的芳樟醇达 1万多t[22]。芳樟醇也是重要的化工原料,用于合成各种芳樟酯类香料并具有广谱抗细菌真菌、抗寄生虫、抗害虫、抗氧化等作用[23]。而萜品醇具有平喘,止咳,祛痰作用,可將糖胶树花中成分开发成安全有效的平喘药物[24]。不同的提取方法对挥发油的化学组成和相对含量影响较大。张宏意等[25]采用乙醚超声提取法提取糖胶树花挥发油,通过GC-MS分析鉴定出19种成分,其中主要成分为角鲨烯,相对含量高达39.44%,而本研究采用水蒸气蒸馏法提取其挥发油,从中鉴定出21种组分,但并未检测到角鲨烯。由于角鲨烯是高度不饱和烃类化合物,分子量大,沸点高(280℃),难挥发[26],通过水蒸气蒸馏法难以获得。此外,张宏意等获得的挥发油中芳樟醇的相对含量只有5.05%,远低于本实验中的23.09%。所以对于需要分离不同的物质,根据需要使用不同的工艺可以取得更好的效果。糖胶树花挥发油中的某些组分在药用和商用上有巨大潜力,本实验可以为进一步开发和利用糖胶树提供参考。
而乙酸乙酯提取物对于常见的几种细菌并未表现出较好的抗菌活性,仅对大肠杆菌的抑菌效果与阳性对照硫酸链霉素效果相当,说明从糖胶树花挥发油中可开发利用抗大肠杆菌的物质。Khan等[27]的研究结果表明,糖胶树的叶、茎和根皮提取物都对革兰氏阳性和阴性细菌有抑制作用,其丁醇提取物对细菌的作用效果尤其显著,但没有对花进行研究,说明在其他部位或者通过其他方法提取抗菌物质仍有待深入研究。
参考文献
[1] 施金生. 糖胶树生长状况及其土壤养分含量的调查分析[J]. 广西热带农业,2002 (3):6-8.
[2] Channa S, Dar A, Ahmed S, et al. Evaluation of Alstonia scholaris leaves for broncho- vasodilatory activity[J]. Journal of Ethnopharmacology, 2005, 97(3): 469-476.
[3] 兰芹英,仇玉萍,刘洪茂,等. 灯架树的组织培养与快速繁殖[J]. 植物生理学通讯,2004,40(2):203.
[4] Arulmozhi S, Mazumder P M, Lohidasan S, et al. Antidiabetic and antihyperlipidemic activity of leaves of Alstonia scholaris Linn. R.Br[J]. European Journal of Integrative Medicine, 2010, 2(1): 23-32.
[5] Macabeo A P G, Krohn K, Gehle D, et al. Indole alkaloids from the leaves of Philippine Alstonia scholaris[J]. Phytochemistry, 2005, 66(10): 1 158-1 162.
[6] 单体江,唐祥佑,刘 易,等. 池杉叶片和球果挥发油化学成分分析及抗细菌活性[J]. 华南农业大学学报,2016,37(5):72-76.
[7] 李文茹,施庆珊,莫翠云,等. 几种典型植物精油的化学成分与其抗菌活性[J]. 微生物学通报,2013,40(11):2 128-2 137.
[8] 郑 华,李文彬,金幼菊,等. 植物气味物质及其对人体作用的研究概况[J]. 北方园艺,2007 (6):76-78.
[9] Maciela M V, Moraisb S M, Bevilaquaa C M L, et al. Chemical composition of Eucalyptus spp. essential oils and their insecticidal effects on Lutzomyia longipalpis[J]. Veterinary Parasitology, 2010, 167(1): 1-7.
[10] 王 锐, 穆 青. 精油——抗细菌耐药性的新视野[J]. 国外医药(抗生素分册),2015(3):103-107.
[11] 汪 燕,冯 皓,余炳伟,等. 白千层叶片和果实挥发油化学成分及抗菌活性[J]. 福建林业科技,2016,43(4):8-12,48.
[12] Lou J, Mao Z, Shan T, et al. Chemical composition, antibacterial and antioxidant properties of the essential oils from the roots and cultures of Salvia miltiorrhiza[J]. Journal of Essential Oil Bearing Plants, 2014, 17(3): 380-384.
[13] 劉 易,唐祥佑,方 萍,等. 花叶良姜果实挥发油化学成分分析[J]. 热带农业科学,2016,36(3):62-66.
[14] 李上标,裴淑艳,蒋 超,等. MTT比色法研究进展[J]. 西北民族大学学报(自然科学版),2013,34(3):68-73,91.
[15] 曲建博,娄红祥,范培红. TLC生物自显影技术在药物筛选中的应用[J]. 中草药,2005,36(1):132-137.
[16] 赵江林,徐利剑,黄永富,等. TLC-生物自显影-MTT法检测滇重楼内生真菌中抗菌活性成分[J]. 天然产物研究与开发,2008,20(1):28-32,51.
[17] 周调调. 以莰烯为原料合成檀香型香料[D]. 北京:北京林业大学,2012.
[18] 游晴如. 莰烯在合成香料中的应用[J]. 林产化工通讯,1996(3):24-28.
[19] 翁玉辉,肖转泉,陈金珠,等. 莰烯衍生物的合成研究进展[J]. 广州化工,2015,43(21):16-21.
[20] Kim S, Choi Y, Choi S, et al. Dietary camphene attenuates hepatic steatosis and insulin resistance in mice [J]. Obesity, 2014, 22(2): 408-417.
[21] Tiwari M, Kakkar P. Plant derived antioxidants-Geraniol and camphene protect rat alveolar macrophages against t-BHP induced oxidative stress [J]. Toxicology in Vitro, 2009, 23(2): 295-301.
[22] 林翔云. 天然芳樟醇与合成芳樟醇[J]. 化学工程与装备,2008 (7):21-26.
[23] 姜冬梅,朱 源,余江南,等. 芳樟醇药理作用及制剂研究进展[J]. 中国中药杂志,2015,40(18) :3 530-3 533.
[24] 邵宏伟,朱婉萍. α-萜品烯醇止咳平喘作用的实验研究[J]. 中国药业,2006,15(9):32.
[25] 张宏意,方思琪,彭 维,等. 糖胶树花挥发油GC-MS分析[J]. 中药材,2010,33(8):1 273-1 274.
[26] 廖 杰,赵玉兰,李 宁,等. 植物油中角鲨烯的GC/MS分析[J]. 现代仪器,2008,14(5):36-37.
[27] Khan M R, Omoloso A D, Kihara M. Antibacterial activity of Alstonia scholaris and Leea tetramera [J]. Fitoterapia 2003, 74(7-8): 736-740.