鼓槌石斛组培快繁技术体系研究
2017-04-26刘扬李宏杨钟祥涛陈冠铭
刘扬++李宏杨++钟祥涛++陈冠铭


摘 要 以鼓槌石斛八成熟蒴果为外植体,通过对其种子无菌萌发培养、原球茎继代增殖及生根壮苗培养基的筛选,建立鼓槌石斛的组培快繁技术体系。结果表明:1/2 MS+1.0 mg/L NAA+8.0%土豆泥+0.10%活性炭培养基效果较理想,种子萌发率较高,发芽快;最适增殖培养基为3/4 MS+3.0 mg/L 6-BA+8%香蕉泥,增殖系数可达7.23;最佳生根培养基为3/4 MS+1.0 mg/L NAA+0.5 mg/L CA+8%香蕉泥,平均根数量达7.49条。炼苗移栽到松树皮作为栽培基质的苗床上,1个月以后,成活率均达80%。
关键词 鼓槌石斛 ;增殖培养 ;活性炭 ;生根壮苗
中图分类号 R282.2 文献标识码 A Doi:10.12008/j.issn.1009-2196.2017.03.014
Tissue Culture-based Rapid Propagation of Dendrobium chrysotoxum Lindl
LIU Yang LI Hongyang ZHONG Xiangtao CHEN Guanming
(Sanya Sci-Tech Academy of Winter Breeding and Multiplication, Sanya, Hainan 572000)
Abstract Immature seeds of Dendrobium chrysotoxum Lindl were used as explants for tissue culture, and mediums for aseptic seed germination, subculture of protocomb, rooting and growth of strong plantlets were screened to establish a rapid propagation system for D. chrysotoxum lindl. The results showed that the medium 1/2 MS+1.0 mg/L NAA+8.0% mashed potato+1.0% activated carbon was optimum for seed germination, under which the seeds germinated fast with a higher germination rate. The optimum subculture medium was 3/4 MS+6-BA 3.0 mg/L+8% mashed banana, which gave a proliferation coefficient of 7.23. The optimum rooting medium was 3/4 MS+NAA 1.0 mg/L+CA 0.5 mg/L+8% mashed banana, and it produced 7.49 roots by average. The rooted plants were transferred to the seedbed with pine bark as the culture substrate and had a survival rate of 80% one month after transferring.
Keywords Dendrobium chrysotoxum Lindl ; proliferation ; activated carbon ; strong rooted plantlets
鼓槌石斛(Dendrobium chrysotoxum Lindl)又名金弓石斛、粗黄草,为兰科石斛属多年生附生草本植物,主要分布在广西、四川以及云南南部至西部等地。此外,印度东北部,缅甸,泰国,老挝以及越南等国家亦有分布[1-2]。鼓槌石斛是一种集食、药、观赏于一身的石斛种类。其花不仅具有很高的观赏价值,还可作饮品及高档菜肴的配料,有安神明目、补血美容、提高免疫力等;茎入药则具有生津益胃、清热养阴等功效,是收入《中国药典》的五种石斛之一[3-4]。研究表明,鼓槌石斛含多种有效成分,如菲类、联苄类、芴酮类、简单苯环衍生物及酯类等,具有抑制腫瘤细胞、滋阴、提高人体免疫力和防止衰老等作用[5]。传统上,鼓槌石斛也用于治疗热病伤津、口干烦渴、病后虚热、阴伤目暗等症,对咽喉和肠胃疾病、白内障、心血管疾病、糖尿病具有明显的疗效。
随着对鼓槌石斛研究的深入,其药用需求量愈来愈大,因长期掠夺性采挖,致使国内野生鼓槌石斛资源日趋枯竭,加上自然条件下,其种子萌发率极低,野生鼓槌石斛已经濒临灭绝[6-7]。为能满足人们不断增长的需求,又能保护野生资源,人工栽培可为药材市场提供石斛原料,对兰科植物种质资源的保育和药用石斛的产业化栽培具有显著的现实意义。
蓝玉甜[8]等研究表明,以N6+2mg/L NAA+0.5 mg/L BA +10%香蕉汁+ 20 g/L蔗糖+0.5 g/L 牛肉蛋白胨+ 5.8 g/L琼脂+0.5g/L AC培养出的苗整齐度高且均匀,但研究也发现,对于鼓槌石斛生根壮苗培养基而言,活性炭的浓度以0.05%为最佳。当活性炭的浓度≥0.10%时,就开始产生抑制效应,AC浓度达到2.0%以上便出现死苗。为了更新培养基,建立更优良的鼓槌石斛组培快繁技术体系,本研究进行了种子无菌萌发试验、原球茎增殖试验、不同浓度生长调节物质和不同活性炭浓度对鼓槌石斛生根壮苗影响等系列研究。
1 材料与方法
1.1 材料
采自海南省三亚市南繁科学技术研究院兰科植物资源圃,经人工授粉八成熟的鼓槌石斛蒴果(图1-C),经表面消毒之后[9],取其未成熟种子作为外植体材料。
1.2 方法
1.2.1 外植体处理
除去鼓槌石斛未成熟蒴果表面杂质,冲洗干净,用洗洁精摇洗3次,每次5 min,倒去洗洁液后,再冲洗,沥干,转至超净工作台上。无菌条件下,以75%乙醇清洗消毒3 min,捞出后以无菌水冲洗3~4次,再用0.15% HgCl2消毒15 min,捞出后用无菌水冲洗4~5遍,沥干备用。灭菌后的蒴果置于不锈钢盘上,切除其两端各约0.5 cm,然后中段纵向切开,夹取一块,并将种子均匀撒在培养基上[10]。
1.2.2 培养条件
实验各阶段材料均置于(25±2)℃和2 000~2 500 lx光照条件培养,每天用日光灯照明10 h照明(8:00~18:00)[11]。
1.2.3 试验配方
① 鼓槌石斛种子无菌萌发培养基 试验了2种无菌发芽培养基,配方1附加有10.0%土豆泥和0.1%活性炭,配方2则不加土豆泥与活性炭;二者的其他组分相同。配方如下:1/2 MS无机盐+肌醇200 mg/L+烟酸1.0 mg/L+盐酸硫胺素2.0 mg/L+盐酸吡哆素1.0 mg/L+甘氨酸2.0 mg/L+NAA 1.0 mg/L+蔗糖2.5 %+卡拉胶粉0.75 %;pH=5.8。
20 d后开始观察发芽情况,连续记录3个月。
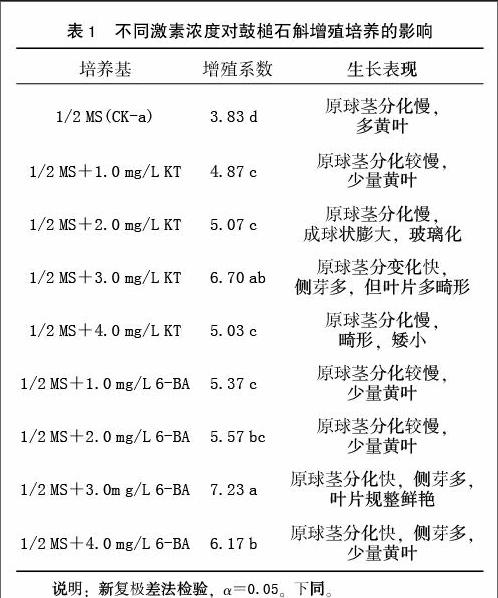
②增殖培养 用鼓槌石斛原球茎作为繁殖体材料,每瓶接入10枚原球茎,每处理各接种5瓶,重复3次。采用以下9种培养基进行原球茎增殖培养:供试的外源激素为KT和6-BA 2种,每种外源激素各设1.0、2.0、3.0、4.0 mg/L 4个浓度梯度,以空白作对照(CK-a),基本培养基为1/2 MS。各处理的编号及外源激素的种类与浓度如表1所示,接种后3个月统计增殖系数。
③生根培养 用鼓槌石斛二叶期无菌苗作为实验材料,每瓶接5株,每处理各接种5瓶,重复3次。采用以下8种培养基进行鼓槌石斛小苗生根培养:(1)3/4 MS;(2)3/4 MS+0.5 mg/L IBA ;(3)3/4MS+3.0 mg/L IBA ;(4)3/4 MS+0.5 mg/L NAA;(5)3/4 MS+1.0 mg/L NAA;(6)3/4 MS+1.0 mg/L NAA+0.5 mg/L AC;(7)3/4 MS+1.0 mg/L NAA+1.0 mg/L AC;(8)3/4 MS+1.0 mg/L NAA+2.0 mg/L AC。以上培養基均加8%香蕉泥匀浆,以空白作为对照(CK-b)。接种3个月后统计鲜重和生根数,
1.2.4 组培苗的移栽
鼓槌石斛移栽前几天要炼苗。移栽前将培养瓶的盖子拧松(不完全打开),并从培养室挪到荫棚下放置2~3 d,然后将瓶盖完全打开,再放置1~2 d。移栽时,用镊子将苗从培养瓶中轻轻取出,小心操作,切忌伤害根系。将附着的琼脂培养基洗净后,用1∶800倍的多菌灵和1∶800倍的百菌清混合液浸泡20 min消毒,然后移栽到用松树皮作为栽培基质的苗床上。移栽后注意要用75%遮阳网遮荫,并注意要适当控制水分和温度,避免阳光直射,注意控温保湿[7](图1-A、1-B、1-D)。移栽1个月后统计成活率。
1.2.5 数据处理
用 SPSS 19.0 软件进行单因素方差分析,采用新复极差法检验,α=0.05。
2 结果与分析
2.1 种子萌发
鼓槌石斛未成熟种子接种到发芽培养基上1处理进行培养时,萌发速度较快,原球茎增殖多,出苗整齐。经约20 d培养,可在培养基表面观察到肉眼可见的绿点,这些绿点即是鼓槌石斛种子经过这段时间的离体培养之后种胚已发育成为成熟的原球茎体(浅绿色),其中发育较快的原球茎体已经形成子叶。至离体培养30 d左右时,在培养基表面可看到除了多数部位分布着比较均匀的一薄层浅绿色的成熟原球茎外,也有不少成堆的直径在0.5~2.0 mm不等的绿色球状物,这种绿色球状物实际上是在接种时种子分散不均匀,以后种胚发育成成熟的原球茎体之后,相互堆叠在一起,形成绿色球状颗粒。随后,原球茎体相继发育成苗,并伴有新增殖出来的原球茎体形成;成熟的原球茎体在离体培养的过程中萌发出子叶和真叶,至接种后第80天左右,整个培养基的表面以及培养基表面1.0~1.5 cm厚的空间内,均充满了具1~2片真叶的鼓槌石斛实生小苗,以及位数不少的新增殖而形成的原球茎体。此时,未成熟种子的无菌萌发过程即告完成,应及时将实生苗转接到新配制的生根壮苗培养基上,或将原球茎体转接到新配制的增殖培养基上进行增殖培养。经过表面消毒处理的鼓槌石斛种子接种到发芽培养基2处理进行培养时,种子的萌发速度较慢,直到60 d后才能在培养基的表面观察到肉眼可见的绿点。离体培养90 d时才少数成苗,但颜色较淡,长势较差。
2.2 鼓槌石斛原球茎增殖培养
不同激素浓度对鼓槌石斛增殖培养的影响见表1。从表1可看出,与对照相比,向培养基中添加细胞分裂素KT与6-BA都显著提高了原球茎的增值率。其中,对于添加KT的配方而言3.0 mg/L KT浓度的增值率显著高于其它浓度处理;对于添加6-BA的配方而言3.0 mg/L 6-BA浓度的增值率显著高于其它浓度处理。添加3.0 mg/L KT与3.0 mg/L 6-BA之间无显著差异。但生长表现来看,添加外源激素KT增殖出来的小苗容易畸形,3.0 mg/L KT增殖率虽然比较高,但小苗畸形,叶片卷缩。说明,适用于鼓槌石斛的增殖培养的培养基是1/2 MS+3.0 mg/L 6-BA,增殖倍数在7左右。
2.3 无菌小苗生根培养
不同浓度激素和活性炭对鼓槌石斛生根壮苗的影响见表2。从表2以看出,不同浓度的生长素IBA和NAA对试管苗生根数和鲜重影响较大,与对照相比,培养基中添加IBA和NAA显著提高了生根数和鲜重,但IBA浓度0.5与3.0 mg/L没有显著性差异,而NAA浓度0.5与1.0 mg/L存在显著性差异,NAA添加浓度1.0 mg/L时平均生根数达到6.53;添加不同浓度的活性炭对试管苗影响较为明显,浓度在0.5 mg/L时,平均生根数可达7.49,显著优于其它处理,随着浓度的增加,生根数显著下降。添加活性炭后的鼓槌石斛小苗的根明显变粗,在后续的生产实践中,配方3/4 MS+1.0 mg/L NAA+0.5 mg/L AC培养出来的无菌苗表现良好,植株粗壮,根长且壮(图1-A,1-B)。
2.4 鼓槌石斛组培苗移栽后成活情况
鼓槌石斛的组培苗移栽到松树皮作为栽培基质的苗床上之后,经过1个月的精细管理,绝大部分植株即可发出新根,成活率达到80%以上。移栽后要特别注意两点,一是定期及时喷施杀菌剂,防止烂根烂苗。移栽前用1∶800倍的多菌灵和1∶800倍的百菌清混合液浸泡20 min,并及时取出摊晾2 h再移栽到苗床上,然后再定植到苗床上。以后每3 d 喷施1次1∶800倍的多菌灵和1∶800倍的百菌清混合液,连续15次,以后视苗情况和天气再定。二是注意水分管理,不能喷水太多,太多容易导致烂苗烂根;太少则容易脱水枯萎而死苗。一般宜于晴天早上喷雾2~3 min,视情况决定是否再喷水1次,下午18:00 左右,如天气太热,基质太干燥,再喷雾2~3 min。如为阴雨天气,则不宜喷雾。栽培基质太湿时,不喷水;中午不宜喷水。
3 讨论
一般认为,活性炭能吸附组培苗生长发育过程中产生的有毒代谢产物;而且加入一定量的活性炭之后,有助于在无菌苗的基部营造出一个较暗的局部环境,进而有利于根系生长发育。因此,在众多组培研究中,或在组培苗工厂化生产实践中,在生根壮苗培养阶段,往往会在培养基中加入一定浓度的活性炭。前人研究结果表明,添加0.5%活性炭和香蕉汁能促进试管苗根的生成和生长[8,12]。本研究注意到,对于鼓槌石斛而言,活性炭的最佳浓度为0.05%,当活性炭的浓度≥0.10%时,开始产生抑制效应,这与高燕[13]等研究结果有所差异,在生根壮苗培养基中添加0.1%AC生根壮苗效果并没有0.05% AC效果好。因此,是否加入活性炭,以及加入的多少,均有必要通过一系列浓度梯度试验来验证。活性炭在吸附有毒或有害代谢产物时,也会强烈吸附培养基中所加入的外源激素、維生素以及大部分矿质营养成分。因此,活性炭的浓度一定要控制在恰到好处,否则会产生严重的负面作用[14]。
本实验在使用生长调节物质浓度及附加物的种类与前人有所不同,为的是进一步寻找生根壮苗的最优培养基配比。结果表明,鼓槌石斛幼苗在以生根培养基为:3/4 MS+1.0 mg/L NAA+0.5 mg/L CA+8%香蕉泥,(25±2)℃和2 000~2 500 lx光照条件下培养,每天用日光灯照明10 h条件下培养 90 d后苗高最高可达10~12 cm、生根数多(平均 7.49条),出苗整齐,适合批量生产。
参考文献
[1] 徐 红,刘 峻,王峥涛,等. 鼓槌石斛组织培养研究[J]. 中国中药杂志,2001,06:18-21.
[2] 杨 虹,毕志明,项素云,等. 不同采收期鼓槌石斛中酚类化合物的测定[J]. 中草药,2005,12:1 885-1 886.
[3] 李熙灿,彭绍忠. 鼓槌石斛及其研究进展[J]. 现代中医药,2005,04:67-69.
[4] 肖春宏,黄飞燕,杨波. 鼓槌石斛研究进展[J]. 山西农业科学,2014,06:647-649.
[5] 杨 虹,龚燕晴,王峥涛,等. 鼓槌石斛化学成分的研究[J]. 中草药,2001,11:15-17.
[6] 白 音,包英华,金家兴,等. 我国药用石斛资源调查研究[J]. 中草药,2006,09:1 440-1 442.
[7] 唐 玲,李 戈,唐德英,等. 鼓槌石斛的资源现状与保护利用研究[J]. 中国野生植物资源,2012,04:61-63.
[8] 蓝玉甜,刘世勇,罗玉婷,等. 鼓槌石斛种子萌发培养与小苗组培快繁技术研究[J]. 安徽农业科学,2011,09:5 380-5 382.
[9] 王 蒂.植物组织培养[M]. 北京:中国农业出版社,2004.
[10] 陈 文,王延春,刘国民,等. 鼓槌石斛未成熟种子无菌萌发与小苗组培快繁的研究[J]. 贵州科学,2008,01:45-51.
[11] 唐德英,杨春勇,王云强,等. 鼓槌石斛生长发育规律研究[J]. 中草药,2006,37(10):1 572-1 574.
[12] 蒋 林,丁 平,郑迎冬. 添加剂对铁皮石斛组织培养和快速繁殖的影响[J]. 中药材,2003,08:539-541.
[13] 高 燕,李泽生,李桂琳,等. 鼓槌石斛杂交育种及组培育苗技术研究[J]. 热带农业科技,2015(1):15-19,23.
[14] 刘国民. 植物组织培养技术教程[M]. 兰州:甘肃科学技术出版社,1998.