紫叶李果实总黄酮抗氧化性能实验研究
2017-04-26吴丽红任丽英陈志钢
吴丽红,任丽英,陈志钢
(河北省唐山市丰润区人民医院,河北 唐山 064000)
·实验研究·
紫叶李果实总黄酮抗氧化性能实验研究
吴丽红,任丽英,陈志钢
(河北省唐山市丰润区人民医院,河北 唐山 064000)
目的考察紫叶李果实总黄酮(PCE)的抗氧化活性。方法 采用紫外-可见分光光度法,在体外化学模拟条件下测定PCE的总还原能力,对1,1-二苯基-2-苦味肼基(1,1-Diphenyl-2-picrylhydrazy,DPPH)、超氧阴离子(O2-)、羟基自由基(·OH)、一氧化氮(NO)的清除作用及对脂质过氧化的抑制作用,研究PCE的抗氧化活性。结果PCE在1,2,4,6,8 g/mL质量浓度下,吸光度逐渐增加(0.189±0.02,0.287±0.01,0.451±0.003,0.708±0.001,0.769±0.002),具有较强的还原能力,能明显地抑制·OH,O2-,DPPH,NO的生成;对照组、抗坏血酸组、PCE组(0.40,0.80,0.160 g/L)丙二醛(MDA)清除率分别为50.1%,19.6%,31.8%,45.9%,能有效抑制MDA的产生。结论 PCE具有较强的抗氧化活性,且呈明显的量效关系。
紫叶李果实总黄酮;脂质过氧化;氧自由基;抗氧化
蔷薇科植物紫叶李是多年生落叶小乔木,原种产于亚洲西南部,较耐湿,有一定耐寒力,在我国广泛种植,资源丰富。国内外学者对紫叶李同属植物的化学成分进行了报道,从叶子、果实、种子等部位分离得到黄酮类、花色素类、香豆素类、新木脂素类等成分[1]。自由基是生物体新陈代谢过程中产生的一类可以单独存在的,具有高度氧化活性的,带有一个或几个不配对电子的分子或原子。研究表明,这些活性氧非常活泼,易攻击生物膜及核酸和蛋白,造成生物膜脂质过氧化,核酸断裂和蛋白硝化等易引发细胞凋亡或坏死的严重后果;心脑血管疾病、衰老及肿瘤疾病的发生和发展也与体内的活性氧自由基密切相关[2-3]。植物中的酚类、黄酮类等物质具有良好的抗氧化作用,尤其是黄酮类成分在清除自由基、抗氧化、抗衰老方面发挥着重要作用,其抗氧化作用主要通过直接捕捉和清除氧自由基来实现,能有效预防上述疾病的发生与发展[4-7]。因此,本研究中通过测定紫叶李果实总黄调(PEC)总还原能力,PCE对羟基自由基(·OH)、超氧阴离子(O2-)、1,1-二苯基-2-苦味肼基(1,1-Diphenyl-2-picrylhydrazy,DPPH)及 NO的清除率,PCE对小鼠肝匀浆自发性脂质过氧化的影响,研究紫叶李果实的药用保健价值,为研发紫叶李果实(作为一种天然的抗氧化物)提供科学的理论依据。
1 材料与方法
1.1 动物、试药与仪器
实验动物:昆明种小鼠,清洁级,雌、雄各半,体质量18~22 g,由河南省实验动物中心提供,动物合格证号为SCXK豫2015~0001。饲养条件,小鼠置经84消毒的塑料笼中饲养,温度(20±2)℃,相对湿度 50% ~60%,光暗周期12 h/12 h,自由摄食、饮水,适应性喂养1周。
试药:邻苯三酚(批号为20150517),邻二氮菲(批号为20150511),抗坏血酸(批号为20150923),均为分析纯,购于中国医药上海化学试剂公司;30% 双氧水(批号为20150918),FeSO4(批号为20150923),硫代巴比妥酸(TBA,批号为20151123),三氯乙酸(TCA,批号为20150815),均为分析纯,购于天津市药通化学试剂有限公司;水杨酸(批号为2015327,天津大茂化学试剂厂);三羟甲基氨基甲烷(Tris,批号为150921,上海源叶生物科技有限公司);1,1-二苯基-2-苦味肼基(DPPH,STBB0510,Sigma-Aldrich公司);维生素C(分析纯,批号为20101101-1,广州化学试剂厂)。紫叶李果实采摘于唐山市华北理工大学校园,经华北理工大学韩淑英教授鉴定为正品。
仪器:Biofuge strutos型高速低温离心机(Kendro Laboratory Products);JY92-2D型超声波细胞粉碎机(宁波新芝科器研究所);YKH-I型液体快速混合器(江西医疗器械厂);TU-180型紫外可见分光光度计(北京普析通用仪器有限责任公司);FJ-200型高速分散均质机(上海标本模型厂);RE52-99型旋转蒸发仪(上海亚荣生化仪器厂);FA2104N型普通电子天平(上海民桥精密仪器厂);ZDHW型电热套(北京中兴伟业仪器有限公司);电热恒温水浴锅(上海医疗器械五厂);予华SHZ-Ⅲ循环水式真空泵(上海知信实验仪器技术有限公司);SB-B20002型电子天平(盛博电子衡器有限公司);NO检测试剂盒(Beyotime公司)。
1.2 方法
1.2.1 PCE的制备
洗净紫叶李果实,去核,粉碎成粗粉,精密称取干燥至恒重的果实粗粉,待用。圆底烧瓶中加入500 mL饱和石灰水,煮沸2~3 min后,加入果实粗粉,然后加热(微沸)回流提取2次,每次2 h,趁热用脱脂棉过滤。将所得滤液放置稍冷(60~70℃),用浓盐酸调pH至4~5,放置过夜,沉淀完全,抽滤,得淡黄色PCE粗品。将总黄酮粗品置烧杯中,加适量(按总黄酮粗品∶水=1 g∶200 mL)蒸馏水,于电热套上加热溶解,趁热过滤。滤液静置1 h,即析出精制PCE,最终总黄酮得率为86%。将上述精制总黄酮溶解至所需的浓度,于4℃冰箱中保存备用。
1.2.2 自由基溶液的制备[8]
O2-溶液:称取0.788 0 g Tris-HCl,精密称定,置100 mL棕色容量瓶中,蒸馏水溶解,调节pH至8.50,定容至刻度,摇匀,制成50.00 mmol/L的缓冲溶液;吸取37%的浓盐酸溶液33.33 mL,置50 mL容量瓶中,蒸馏水定容至刻度,摇匀,制成 8.00 mmol/L的盐酸溶液,吸取0.31 mL,置250 mL容量瓶中,蒸馏水定容至刻度,摇匀,制成 10.00 mmol/L的盐酸溶液;称取0.315 3 g邻苯三酚,精密称定,置100 mL容量瓶中,用10.00mmol/L的盐酸溶液溶解,定容至刻度,摇匀,制成25.00 mmol/L的溶液。
·OH溶液:称取硫酸亚铁0.136 8 g,精密称定,置50 mL棕色容量瓶中,蒸馏水溶解,定容至刻度,摇匀,制成9.84 mmol/L的母液(使用时稀释至1.09 mmol/L);精密称取水杨酸0.124 3 g,置50 mL容量瓶中,无水乙醇溶解,定容至刻度。摇匀,制成18.00 mmol/L的母液(使用时稀释至2.0 mmol/L);吸取30%的过氧化氢溶液1.00 mL,置100 mL容量瓶中,蒸馏水定容至刻度,摇匀,制成0.03%的过氧化氢溶液。
1.2.3 PCE抗氧化作用实验[9-16]
PCE的总还原能力测定:采用铁氰化钾还原法,加样表见表1。取10 mL试管,分别加入系列PCE溶液(1,2,4,6,8 g/L)1 mL,磷酸盐缓冲溶液(0.2 mol/L,pH 6.6)0.5 mL和0.3% 铁氰化钾1.5 mL,置50℃水浴中反应20 min,然后加入10% 三氯乙酸(TCA)1 mL,混匀后以3 000 r/min的速率离心10 min,取上清液2 mL,加0.5 mL 0.3% 三氯化铁溶液,振摇后在700 nm波长处测定吸光度,3次平行试验,得 A1,A2,A3,取平均值。
总还原能力=(A1+A2+A3)/3
式中 A1,A2,A3为每个浓度平行3次的吸光度值。
PCE对O2-清除率的测定:采用改良的邻苯三酚自氧化法,具体操作见表2。加0.05 mol/L Tris-HCl溶液(pH=8.2)4.5 mL于试管中,置25℃水浴20 min。加入不同质量浓度的PCE溶液(1,2,4,6,8 g/L)0.4 mL和25℃保温过的邻苯三酚溶液(10 mmol/L HCl配制)0.08 mL,加入后快速摇匀,然后以空白作对照测定样品的 A325,每隔0.5 min记录1次,连续记录4 min,各管的氧化速率及对O2-的清除率按下列公式计算。

式中,A0为 O2-溶液加蒸馏水1 mL的吸光度,A1为样品溶液本身的吸光度值,A2为O2-溶液加样品溶液1 mL的吸光度。
PCE对·OH清除率的测定[11,13]:具体操作见表3。采用邻二氮菲-Fe2+-H2O2法,PCE不同质量浓度(1,2,4,6,8 g/L),按表3进行加样。将各试管摇匀放入37℃恒温水浴箱中保温1 h后测定 A509,各管对·OH的清除率按下列公式计算。

表1 用铁氰化钾还原法加样表(mL)
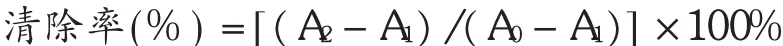
式中,A0为O2-溶液加蒸馏水2 mL的吸光度,A1为O2-溶液加样品溶液1 mL的吸光度,A2为样品溶液本身的吸光度值。
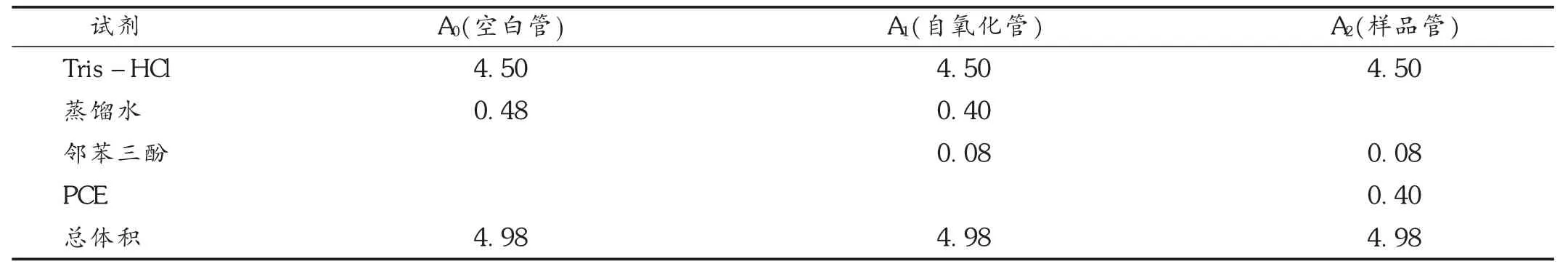
表2 邻苯三酚自氧化法加样表(mL)

表3 邻二氮菲-Fe2+-H2O2法加样表(mL)
PCE对小鼠肝匀浆自发性脂质过氧化的影响[11,13]:小鼠处死后立即打开腹腔,用预冷的生理盐水从门静脉冲洗肝脏后取出肝脏,用4℃生理盐水洗净表面血污,称定质量,用预冷的生理盐水制成 10% 的肝匀浆,以3 000 r/min的速率离心10 min,取上清液备用,卡马斯亮蓝试剂盒测蛋白,制成含蛋白质0.005 g/mL的溶液。取2.5%肝匀浆悬浮液1 mL,加入阳性对照药抗坏血酸(0.080 g/L)及不同质量浓度的PCE溶液0.2 mL (0.040,0.080,0.160 g/L),平行3次,37℃水浴60 min,加入15%TCA 1 mL终止反应,再加入0.67%TBA 1 mL,于沸水浴中显色15 min,冷却后离心,取上清液测定吸光度 A532,以 A表示丙二醛(MDA)的含量,MDA的清除率按下列公式计算。
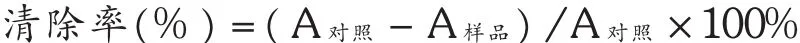
PCE对DPPH清除活性的测定[15]:取DPPH对照品80.00 mg,精密称定,加20.00 mL 70% 乙醇,配制成0.4%的DPPH母液,避光保存,临用前稀释成0.04%。以70%乙醇溶液将紫叶李提取液依次稀释成含黄酮量20,40,60,80,100 mg/L的梯度溶液。样品管中加入0.50 mL不同浓度的紫叶李提取液与 2.50 mL的0.04%DPPH溶液;以95%乙醇代替DPPH溶液为对照溶液,以蒸馏水代替紫叶李提取液作空白溶液。以上3组置28℃ 水浴30 min后,用0.50 mL蒸馏水和2.50 mL 70%的乙醇调零,于517 nm波长处测定 A,平行3次。用同样浓度系列的维生素C溶液作阳性对照,用以下公式计算PCE对DPPH的清除率。
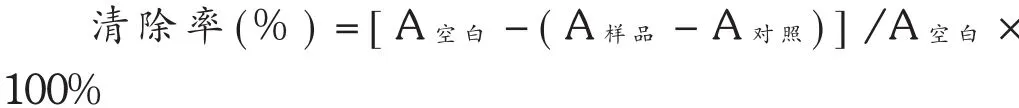
式中,A空白为蒸馏水 0.50 mL+DPPH 2.50 mL的吸光度,A样品为供试液 0.50 mL+DPPH 2.50 mL的吸光度,A对照为供试液 0.50 mL+70% 乙醇 2.50 mL的吸光度。
PCE对NO清除活性的测定[16]:采用Beyotime公司NO检测试剂盒中的NO检测系统略作改进。在0.50 mL硝普钠(25.00 mmol/L)中,加入2.00 mL不同浓度的紫叶李总黄酮提取液(提取液的配制同DPPH清除活性测定项下方法),用0.50 mL蒸馏水代替硝普钠为对照溶液,以 2.00 mL蒸馏水代替样品溶液为空白溶液,25℃下放置90 min后,加入1.50 mL的Griess试剂,于540 nm波长处以蒸馏水调零测定吸光度,平行3次,用同样浓度系列的维生素C溶液作阳性对照,根据以下公式计算各种样品对NO的清除率。

式中,A空白为0.50 mL硝普钠+2.00 mL蒸馏水的吸光度,A样品为0.50 mL硝普钠+2.00 mL药物溶液的吸光度,A对照为0.50 mL蒸馏水+2.00 mL药物溶液的吸光度。
1.3 统计学处理
2 结果
2.1 PCE的总还原能力
以样品吸光度为纵坐标和质量浓度为横坐标作图。抗氧化剂的还原能力是其抗氧化活性的重要指标,一般物质的还原能力越强,其抗氧化活性也越强。PCE 1,2,4,6,8 g/L质量浓度的吸光度逐渐增加,表明PCE的还原能力随着质量浓度的增加而增强。详见图1。
2.2 PCE对O2-的清除作用
以样品清除率和质量浓度作图。PCE清除率总体呈上升趋势,在低质量浓度范围内,清除作用不如高质量浓度范围内清除效果好,且呈良好的剂量依赖关系。详见图2。
2.3 PCE对·OH的清除作用
以样品清除率和质量浓度作图。与对O2-的清除作用相比,对·OH的清除效果较差。PCE清除率总体呈上升趋势,在低质量浓度范围内,清除作用不如高质量浓度范围内清除效果好,且呈良好的剂量依赖关系。详见图3。

图2 PCE对O2-的清除作用
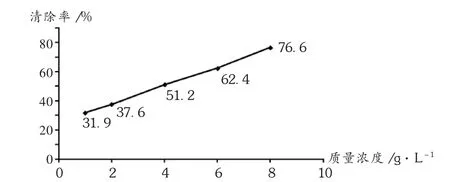
图3 PCE对·OH的清除作用
2.4 PCE对小鼠肝匀浆自发性脂质过氧化的影响
由表4可见,PCE各剂量组均可抑制肝匀浆自发的脂质过氧化反应,呈良好的量效关系,其抑制效果表现为随质量浓度升高而逐渐上升的趋势。
2.5 PCE对DPPH的清除活性
由表5可见,20~100 mg/L紫叶李总黄酮对DPPH自由基有明显的清除作用,呈现明显的量效关系,其抑制效果表现为随质量浓度升高而逐渐上升的趋势。
2.6 PCE对NO的清除活性
由表6可见,20~100 mg/L紫叶李总黄酮对NO自由基有一定的清除作用,呈现明显的量效关系,其抑制效果表现为随质量浓度升高而逐渐上升的趋势。
表4 PCE小鼠肝匀浆自发性脂质过氧化的影响(±s)
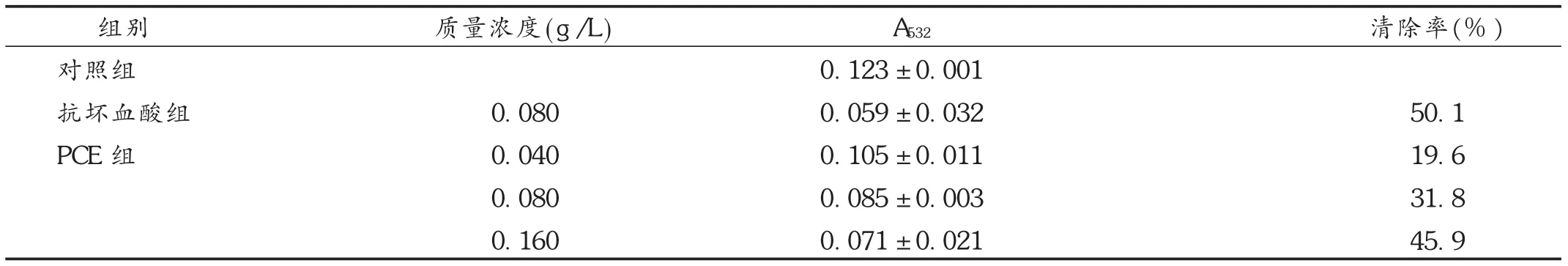
表4 PCE小鼠肝匀浆自发性脂质过氧化的影响(±s)
注:与对照组比较, P<0.05;与抗坏血酸组比较, P<0.05;与PCE低质量浓度组比较, P<0.05。
组别对照组抗坏血酸组PCE组质量浓度(g/L) 0.080 0.040 0.080 0.160 A532 0.123±0.001 0.059±0.032 0.105±0.011 0.085±0.003 0.071±0.021清除率(%)50.1 19.6 31.8 45.9
表5 PCE与维生素C对DPPH的清除率比较(±s,%,n=3)

表5 PCE与维生素C对DPPH的清除率比较(±s,%,n=3)
组别PCE组对照组质量浓度(mg/L) 20 17.55±0.21 15.68±0.14 40 30.64±0.23 33.23±0.07 60 42.68±0.19 47.99±0.21 80 51.48±0.17 64.46±0.05 100 60.98±0.22 66.23±0.13
表6 PCE与维生素C对NO的清除率比较(±s,%,n=3)

表6 PCE与维生素C对NO的清除率比较(±s,%,n=3)
组别PCE组对照组20 22.32±3.69 24.38±7.43 40 20.76±8.09 55.73±5.89质量浓度(mg/L) 60 29.35±5.79 67.21±3.69 80 80.98±9.57 85.25±2.01 100 64.43±2.79 87.95±3.95
3 讨论
自由基可引起人体组织衰老,诱发心血管疾病,癌症等。氧自由基(OFR)主要是指O2-和·OH,可引起细胞损伤和死亡,并与某些疾病的发生有密切关系,已引起社会各界尤其是医学界的广泛关注[17]。OFR能调节花生四烯酸的代谢,刺激吞噬细胞和中性粒细胞的吞噬杀菌功能和免疫过程,有利于机体健康;可使许多生物大分子如核酸、蛋白质、膜多聚不饱和脂肪酸发生超氧化反应,生物大分子出现交联或断裂,进而引起细胞结构和功能的破坏[17]。目前,由氧自由基引起的疾病已超过100余种。有报道称,心血管疾病、呼吸系统疾病及消化系统疾病等都与氧自由基有关[18]。
邻苯三酚自氧化能产生O2-和有色物质,该有色中间物在325 nm波长处有吸收峰,如加入O2-清除剂,就会抑制邻苯三酚自氧化,同时也抑制有色物质的产生,325 nm波长处的吸收峰受到抑制。通过 A325值的变化可判断O2-清除能力的强弱。H2O2和Fe2+产生·OH,邻二氮菲-Fe2+水溶液可被氧化成邻二氮菲-Fe3+,使邻二氮菲-Fe2+在509 nm波长处的最大吸收峰小时,当体系中存在·OH清除剂时,此氧化过程受到抑制,A509降低,可通过 A509来判断·OH 的清除能力[11]。MDA是脂质过氧化的主要降解产物,其含量的多少直接反映脂质过氧化的程度,也反映细胞受自由基攻击的程度[11,19]。
研究表明,PCE具有很好的抗氧化能力,生物活性强,包括免疫调节、抗肿瘤、调血脂、抗辐射、抗菌、抗病毒、保护肝脏等保健作用[20]。本研究对紫叶李果实总黄酮的总还原能力和抗自由基活性进行了研究。关于研究抗氧化活性的实验方法很多,如体外的有测定自由基,包括羟基自由基、超氧自由基、脂质过氧化,DPPH法,体内的如SOD,CAT,GSH-PX,MDA等方法。从总还原能力、清除自由基能力及抑制脂质过氧化能力等方面考虑,采用体外方法测定总还原能力,可通过测定羟基自由基、超氧自由基的变化及小鼠肝匀浆中脂质过氧化过程中MDA的变化来实现。
本研究中采用体外实验的方法探究PCE的抗氧化活性,结果显示,PCE对DPPH,·OH,O2-,NO具有较好的清除能力,能明显抑制脂质过氧化,表明PCE具有较好的抗氧化能力,具有进一步开发利用的价值,因此PCE在抗氧化活性方面的药用价值有待更深层次的开发研究。
[1]曹 燕,庞市宾,徐 磊,等.金鸡菊提取物体外抗氧化活性[J].中国实验方剂学杂志,2011,17(12):144-147.
[2]Labuschagne CF,Brenkman AB.Current methods in quantifying ROS and oxidative damage in Caenorhabditis elegans and other model organism of aging[J].Ageing Res Rev,2013,12(4):918-930.
[3]钱大玮,朱玲英,彭蕴茹,等.菊花、茎、叶总黄酮及绿原酸含量动态分析评价[J].现代中药研究与实践,2005,6(6):14-16.[4]卫到强,纪小影,龙先顺,等.滁菊叶化学成分及其体外抗氧化活性研究[J].中药材,2015,38(2):305-310.
[5]张桂伟,张秋云,江 东,等.中国主栽葡萄柚果肉酚类物质组成及其抗氧化活性[J].中国农业科学,2015,48(9):1785-1794.
[6]郑丹丹,王京龙,王占一,等.石榴叶总黄酮的提取工艺及抗氧化活性考察[J].中国实验方剂学杂志,2016,22(6):12-16.[7]李晓男,陈燕燕,周江韬,等.紫叶李果实的化学成分研究[J].天然产物研究与开发,2015,27(8):1362-1364.
[8]梁生旺.生物碱类成份分析[M].北京:学苑出版社,1999:70-71.
[9]何 华,李先宽,丁 璞,等.五味子红色素抗氧化活性研究[J].中国实验方剂学杂志,2012,18(18):133-137.
[10]王 强,刘玲玲,唐 军,等 .新疆产孜然抗氧化活性研究[J].中国实验方剂学杂志,2012,18(16):313-316.
[11]罗旭艳,黄建春,杨 欣,等.杨桃根多糖体外抗氧化作用的研究[J].中国实验方剂学杂志,2011,17(4):111-113.[12]钟耀广,林 楠,王淑琴,等.香菇多糖的抗氧化性能与抑菌作用研究[J].食品科技,2007,7(7):141-144.
[13]张泽庆,田应娟,张 静.防风多糖的抗氧化活性研究[J].中药材,2008,31(2):368-371.
[14]彭长连,陈少薇,林植芳,等.用清除有机自由基DPPH法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27(6):658.
[15]温 露,闵 颖,严春艳,等.一株藏红花内生真菌多糖的提取及抗氧化活性研究[J].时珍国医国药,2011,22(8): 1850-1852.
[16]罗 超,刘霭明,邢惟青,等 .石参总黄酮抗氧化活性研究[J].中国实验方剂学杂志,2011,17(13):198-201.
[17]龚 涛 .枸杞多糖分离纯化及其对小鼠抗氧化活性的研究[D].沈阳:沈阳农业大学,2006.
[18]Yamamoto H,Watanabe T,Mizuno H,et al.In vivo evidence for accelerated generation of hydroxyl radicals in liver of long-evans cinnamon(LEC)rats with acute hepatitis[J].Free Radic Biol Med,2001,30(5):547-551.
[19]曹 炜,卢 珂,陈卫军,等.不同种类蜂蜜抗氧化活性的研究[J].食品科学,2005,26(8):352-355.
[20]曹纬国,刘志勤,邵 云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003,23(12):2241-2247.
Antioxidant Effect of Total Flavonoids in the Fruits of Pranus Cerasifera
Wu Lihong,Ren Liying,Chen Zhigang
(Fengrun District People′s Hospital,Tangshan,Hebei,China 064000)
Objective To study the antioxidant effect of total flavonoids in the fruits of Pranus cerasifera(PCE).M ethods The total reducing ability of PCE was determined by UV-Vis spectrophotometry.The total reduction ability of PCE,the effects of 1,1-Diphenyl-2-picrylhydrazy(DPPH),superoxide anion(O2-),hydroxyl radical(·OH),nitric oxide(NO)and the inhibition of lipid peroxidation were determined by the method of in vitro chemical simulation.The antioxidant activity of PCE was studied.Results The absorbance of PCE increased at the concentration of 1,2,4,6,8 g/mL (0.189±0.02,0.287±0.01,0.451±0.003,0.708±0.001,0.769±0.002),which had strong reducing ability and could significantly inhibit the generation of·OH,O2-,DPPH,NO;The levels of malondialdehyde(MDA) in the control group,ascorbic acid group and PCE group(0.40,0.80,0.160 g/L)were 50.1%,19.6% and 31.8%,45.9%,respectively,showing the levels of MDA could effectively inhibited.Conclusion PCE has strong antioxidant effect and has obvious dose-effect relationship.
total flavonoids in the fruits of Pranus cerasifera(PCE);lipid peroxidation;oxygen free radical;antioxidant
R285.5
A
1006-4931(2017)05-0015-05
2016-11-23;
2016-12-04)
10.3969/j.issn.1006-4931.2017.05.004
吴丽红,大学本科,研究方向为药物作用机制及药剂学,(电子信箱)18730295361@163.com。
