氟对大鼠支持细胞紧密连接occludin基因与蛋白的影响
2017-04-20张晓燕张慧慧程敏孙子龙王俊东
张晓燕,张慧慧,程敏,孙子龙,王俊东
(山西农业大学动物科技学院,山西太谷030801)
氟对大鼠支持细胞紧密连接occludin基因与蛋白的影响
张晓燕,张慧慧,程敏,孙子龙,王俊东
(山西农业大学动物科技学院,山西太谷030801)
试验旨在研究NaF对支持细胞occudin基因和蛋白表达的影响。采用不同浓度的NaF(0,0.1,1,10 mg/L)分别处理大鼠睾丸支持细胞48 h,qRT-PCR检测occludin基因水平的变化,免疫荧光技术检测occludin蛋白定位及水平的变化。结果显示,与对照相比,10 mg/L NaF染毒,occludin mRNA相对表达量显著下降(P<0.05);0.1,1.0 mg/LNaF染毒,occludin mRNA相对表达量下降,但差异不显著;occludin蛋白随着染氟剂量的增加,表达量逐渐降低,且occludin蛋白由细胞膜转移到细胞核附近的部位。说明NaF对支持细胞紧密连接的破坏可能与occudin基因与蛋白表达的变化有关。
氟化钠;支持细胞;紧密连接;基因;蛋白
全世界大约有15%的家庭存在不孕不育问题,其中由男性因素导致的此问题高达50%[1]。不孕不育症是继癌症和心血管疾病之后出现的新兴全球公共卫生疾病,所以,深入研究其原因是非常必要的[2]。众多学者普遍认为,环境污染是导致生殖功能损害的最重要因素之一,如镉、双酚A、全氟辛烷酸、三氧化二砷等[3]。氟是一种非常活泼的卤族元素,以多种化合物形式存在,广泛分布于水体、土壤、空气、食物等环境中[4-5]。氟中毒的症状往往表现为氟斑牙、氟骨症,但随着研究的深入,现已证实氟对雄性生殖系统也有严重的毒性作用[6-7]。睾丸是雄性哺乳动物重要的生殖器官和精子发生场所,其中,血睾屏障(BTB)保证了精子发生的顺利进行。BTB是动物睾丸中血管和精细管之间的物理屏障,紧密连接是其主要的组成部分。已有研究表明,动物睾丸中的支持细胞是氟暴露对雄性生殖毒性作用的靶细胞[8-9]。紧密连接存在于相邻支持细胞基部两侧细胞膜之间,将生精上皮分成基底室和近腔室[10]。occludin蛋白是紧密连接中最重要的蛋白分子之一,与ZO-1等蛋白形成紧密连接的基础结构。但氟对支持细胞occludin蛋白的影响几乎未见报道。
本试验通过统计氟暴露对大鼠睾丸支持细胞紧密连接occludin基因和蛋白表达的影响,探讨氟化钠损伤睾丸支持细胞紧密连接的可能机制。
1 材料和方法
1.1 试验材料
1.1.1 试验动物出生18~21 d的清洁级SD雄性大鼠,由山西医科大学实验动物中心提供。
1.1.2 主要试剂DMEM/F12培养基、胎牛血清购于Gibco公司;0.25%胰蛋白酶、IV型胶原酶购于Sigma公司;Trizol,Prime-ScriptTMRT reagent Kit,SYBR@Premix Ex TaqTMII kit购于Takara公司;GATA4抗体购于北京博奥森生物技术有限公司;occludin抗体、FITC标记的山羊抗兔IgG购于武汉三鹰生物技术有限公司。
1.2 试验方法
1.2.1 支持细胞的培养20 d左右的SD大鼠颈椎脱臼处死,分离睾丸,去除包膜,在PBS中静置5min。加入10倍体积的0.1%IV型胶原酶,室温振荡7~10min,1000r/min离心5min。弃去上清,加入10倍体积的0.25%胰蛋白酶,室温振荡7~10 min,加入DMEM/F12完全培养液(89%DMEM/F12+10%胎牛血清+1%青链霉素)终止消化,0.074 mm筛网过滤收集悬液,1 000 r/min离心5 min。弃去上清,用PBS洗2次,DMEM/F12完全培养液重悬细胞,铺板接种,放入37℃,5%CO2培养箱中培养。48h后,弃去培养液,PBS洗2次,用20 mmol/mLpH值7.4的Tris-HCl低渗处理2~5min;然后用DMEM/F12培养液洗2次,加入DMEM/F12完全培养液继续培养,细胞密度达到80%~90%时,即可进行传代培养。
1.2.2 支持细胞的鉴定
1.2.2.1 HE染色选择第2代细胞进行HE染色,弃去培养液,PBS洗3次,95%酒精固定15 min,蒸馏水洗3次,苏木精染色2~3 min,自来水冲洗直至变蓝,伊红染色30 s,然后用一系列梯度酒精脱水处理,最后经二甲苯透明、明胶封片后,置光学显微镜下观察。
1.2.2.2 GATA4免疫荧光鉴定取出爬片,用4%的多聚甲醛固定15 min,PBS洗3次,0.5%Tritonx-100破膜15 min,PBS洗3次,10%的山羊血清封闭30 min,加入兔抗鼠GATA4抗体(体积比为1∶100稀释),4℃过夜,PBS洗3次,然后加入FITC标记的山羊抗兔IgG,37℃避光孵育60 min,PBS洗3次,加入含DAPI的抗荧光淬灭封片剂,置激光共聚焦显微镜下观察。
1.2.3 总RNA的提取采用Trizol法提取支持细胞总RNA,具体步骤参照试剂盒说明书。应用Nanodrop ND-1000 spectrophotometer测定总RNA的浓度及A260/A280,A260/A230。
1.2.4 引物设计与合成根据美国国立生物信息技术中心(NCBI)公布的大鼠occludin,GAPDH基因序列,应用Primer 3 Plus软件设计其引物,所有引物均于上海英潍捷基贸易有限公司合成(表1)。

表1 基因引物序列
1.2.5 qRT-PCR反应体系的建立采取2步法进行qRT-PCR反应。第1步将总RNA反转录成cDNA,10 μL反应体系:5 Prime-ScriptTMRT Master Mix 2.0 μL,Total RNA 2.0 μL,RNase Free ddH2O 6.0 μL;反应条件:37℃15 min;85℃5 s。第2步为qRT-PCR反应过程,10 μL反应体系:SYBR PrimixExTaq II(2×)5.0 μL,正、反向引物各0.4 μL,ROXReferenceDyeII(50×)0.2μL,cDNA模板1 μL,RNase Free ddH2O 3.0 μL;反应条件:95℃30 s;95℃5 s,60℃30 s,72℃30 s,共45个循环;95℃1 min,55℃30 s,95℃30 s。采用ΔΔCT法计算目的基因mRNA的表达量。
1.2.6 免疫荧光分析取出爬片,经过4%的多聚甲醛固定,0.5%的Tritonx-100破膜,10%的山羊血清封闭,然后加入兔抗鼠occludin抗体(体积比为1∶50稀释),4℃过夜,加入FITC标记的山羊抗兔IgG,最后加入抗荧光淬灭封片剂,置于荧光显微镜下观察。
1.3 图像分析与数据处理
采用GraphPad Prism5统计分析软件进行数据分析,结果均用“均值±标准差”表示。差异显著性利用one-way analysis of variance(ANOVA)方法进行检验。*表示P<0.05差异显著,**表示P<0.01差异极显著。
2 结果与分析
2.1 支持细胞形态学观察与鉴定
形态学观察结果显示,支持细胞贴壁能力比较强,培养5 h之后开始贴壁,24~48 h之内几乎完全贴壁,由圆形变为多边形,培养液中悬浮着一些圆形的生精细胞,48 h后Tris-HCl低渗处理可以将其去除,得到图1所示结果。细胞折光性降低,呈单层膜状分布,胞质完全铺开,间隙缩小,细胞核清晰可见,呈圆形或椭圆形,此时核质比为(7~9)∶1。

HE染色结果如图2所示,细胞形态不规则,有多个突起,相互连接成网状,胞质染色淡,胞核染色深,细胞核较大且轮廓清晰。

GATA4鉴定结果如图3所示,支持细胞几乎完全被荧光染料着色,验证了支持细胞是睾丸中唯一高表达GATA4的细胞。

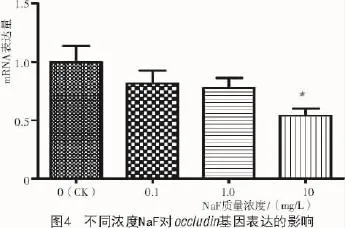
2.2 NaF对紧密连接occludin基因的影响
荧光定量结果显示(图4),随着染毒剂量的增加,occludin mRNA表达量降低,且10 mg/LNaF组与对照组相比差异显著,而0.1,1.0 mg/LNaF组与对照组相比无显著性变化。
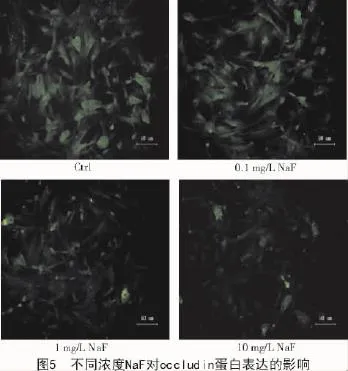
2.3 NaF对紧密连接occludin蛋白的影响
采用免疫荧光法检测occludin蛋白在氟中毒的支持细胞中的表达情况。由图5可知,染氟48 h后,对照组支持细胞occludin蛋白主要在细胞膜上表达,染氟组支持细胞occludin蛋白主要在细胞质靠近核的部位表达;且染氟组支持细胞occludin蛋白与对照组相比表达量降低,尤其10 mg/L染氟组降低明显。
3 讨论
精子的发生是一个复杂的细胞分化过程,它包括3个阶段,第1阶段是有丝分裂,第2阶段是减数分裂,第3阶段是精子形成[11]。睾丸支持细胞是曲细精管内唯一与生精细胞直接接触的体细胞,在生精过程中起支持、免疫屏障等作用[12]。有研究表明,人类支持细胞在含有血清的培养基中,且不添加其他激素和生长因子的条件下能够恢复增殖能力[13]。本试验选取的是18~20 d的大鼠,分离得到的支持细胞纯度高达98%,此时支持细胞已经分化完全,且停止分裂[12]。试验分离培养原代大鼠支持细胞运用组合酶消化法和差速贴壁法[14],刚分离的睾丸支持细胞在倒置相差显微镜下呈圆形或椭圆形,贴壁后胞质伸展,伸出伪足,呈不规则状。
支持细胞的鉴定主要是靠形态观察、富尔根染色、免疫组化、免疫荧光等。WT1在小鼠的胚胎期青青春期、成年期都有表达,但在睾丸的其他体细胞如间质细胞和外周小管肌样细胞内,均未见到WT1的表达,表明WT1可以作为支持细胞的特异性蛋白分子[15]。SUN等[8]通过免疫组化的方法利用GATA4蛋白的高表达鉴定睾丸支持细胞。本试验对培养的支持细胞进行HE染色和GATA4免疫荧光鉴定,结果符合支持细胞的特征,故判定培养的是纯度极高的支持细胞。
在曲细精管中,细胞间连接分为紧密连接、桥粒连接、缝隙连接和胞质外特化[2,16],其中,紧密连接是血睾屏障最主要的组成部分,其主要由2种成分组成:跨膜蛋白和胞质附着蛋白。occludin蛋白是第1个被确定的定位于紧密连接的完整膜蛋白,其基因在进化上非常保守,其中,人、小鼠、狗的该基因有90%的同源性[17]。每一个occludin蛋白分子都有4个跨膜结构域,第1个细胞外环参与了细胞的黏附功能;第2个细胞外环是紧密连接建立和封闭功能所必需的[18]。可见,occludin蛋白是紧密连接功能能够正常发挥的物质基础,它在精子发生中及睾丸内紧密连接屏障的形成和维持上具有重要作用。已有研究表明,全氟辛烷、氯化镉、双酚A等外源化合物诱导的支持细胞间的紧密连接破坏伴随着occludin蛋白的表达下降[17,19],但是氟暴露是否可以导致occludin蛋白的降低还需进行深入探讨。
4 结论
本试验通过对体外培养的支持细胞进行染氟,结果发现,与对照组相比,随着染氟剂量的增加,occludin基因和蛋白表达量都下降,且occludin蛋白由细胞膜逐渐转移至靠近细胞核的部位,表明氟暴露影响occludin基因和蛋白的表达。由此推断,氟暴露破环支持细胞之间的紧密连接,可能是由occludin基因和蛋白表达量的降低与occludin蛋白位置的改变导致的。
[1]KILCHEVSKY A,HONIG S.Male factor infertility in 2011:semen quality,sperm selection and hematospermia[J].Nat Rev Urol,2012,9:68-70.
[2]GAOY,MRUK D D,CHENG C Y.Sertoli cells are the target of environmental toxicants in the testis—a mechanistic and therapeutic insight[J].Expert Opinion on Therapeutic Targets,2015,19(8):1073.
[3]李英,徐志豪,张卓炜,等.铜中毒对小鼠雄性生殖器官的影响[J].河南农业科学,2015,44(9):122-124.
[4]NGOC T D N,SON Y O,LIM S S,et al.Sodium fluoride induces apoptosis in mouse embryonic stem cells through ROS-dependent and caspase-and JNK-mediated pathways[J].Toxicology&Applied Pharmacology,2012,259(3):329-337.
[5]LI P,XUE Y,ZHANG W,et al.Sodium fluoride induces apoptosis in odontoblasts via a JNK-dependent mechanism[J].Toxicology,2013,308(2):138-145.
[6]AGALAKOVANI,GUSEVGP.Molecular mechanisms ofcytotoxicityand apoptosis induced byinorganic fluoride[J].Isrn Cell Biology,2012,DOI:10.5402/2012/403835.
[7]SUN Z,NIU R,WANG B,et al.Fluoride-induced apoptosis and gene expression profilingin mice spermin vivo[J].Archives of Toxicology,2011,85(11):1441-1452.
[8]SUNZ,NIE Q,ZHANGL,et al.Fluoride reduced the immune privileged function of mouse Sertoli cells via the regulation of Fas/FasL system[J].Chemosphere,2017,168:318-325.
[9]ZHANGJ,LI Z,QIE M,et al.Sodiumfluoride and sulfur dioxide affected male reproduction by disturbing blood-testis barrier in mice [J].Food&Chemical Toxicology,2016,94:103-111.
[10]CHENG C Y,MRUK D D.The blood-testis barrier and its implications for male contraception[J].Pharmacological Reviews,2012,64(1):16-64.
[11]HESS R A,RENATO D F L.Spermatogenesis and cycle of the seminiferous epithelium[J].Advances in Experimental Medicine& Biology,2008,636(1):1-15.
[12]MARTINS A D,BERNARDINO R L,NEUHAUSOLIVEIRA A,et al.Physiology of Na+/H+exchangers in the male reproductive tract:relevance for male fertility[J].Biology of Reproduction,2014,91(1):11-11.
[13]CHUI K,TRIVEDI A,CHENG C Y,et al.Characterization and functionalityofproliferative human Sertoli cells[J].Cell Transplantation,2011,20(5):619.
[14]MRUK D D,CHENG C Y.An in vitro system to study Sertoli cell blood-testis barrier dynamics[J].Methods Mol Bio,2011,763:237-252.
[15]胡晓鹏,杨凡,吕忠显,等.小鼠睾丸支持细胞标志蛋白表达的研究[J].生殖与避孕,2015,35(8):509-516.
[16]HUANGH.Effect of oxidative stress on fluoride-induced apoptosis in primary cultured Sertoli cells of rats[J].International Journal of Environmental Health Research,2015,25(1):1-9.
[17]FURUSE M,HIRASE T,ITOH M,et al.Occludin:a novel integral membrane protein localizing at tight junctions[J].Journal of Cell Biology,1993,123(6):1777-1788.
[18]ANDO-AKATSUKA Y,SAITOU M,HIRASE T,et al.Interspecies diversity of the occludin sequence:cDNA cloning of human,mouse,dog,and rat-kangaroohomologues[J].Journal of Cell Biology,1996,133(1):43-47.
[19]QIUL,ZHANGX,ZHANGX,et al.Sertoli cell is a potential target for perfluorooctane sulfonate-induced reproductive dysfunction in male mice[J].Toxicological Sciences,2013,135(1):229-240.
Effect of Fluorine on Sertoli Cell Tight JunctionoccludinGene and Protein in Rat
ZHANGXiaoyan,ZHANGHuihui,CHENGMin,SUNZilong,WANGJundong
(College ofAnimal Science and VeterinaryMedicine,Shanxi Agricultural University,Taigu 030801,China)
The aim of this study was to figure out the effect of NaF on sertoli cell occludin gene and protein expression.Different concentrations of NaF(0,0.1,1.0,10 mg/L)were used to treat rat testis sertoli cells for 48 h,then detected occludin gene changes by qRT-PCR,the protein changes by immunofluorescence technique.The result showed that the relatire expression of occludin mRNA decreased remarkbly(P<0.05),when the cell was treated with 10 mg/LNaF,compared with other groups.When the cell was treated with 0.1,1.0 mg/L NaF,the relative expression of occludin mRNA decreased,but the difference was not significant.And occludin protein expression gradually decreased and transferred from cell membrane to near the nucleus with the increasing dose ofNaF.It illustrates that broken cell tight junction caused byNaF maybe associated with the changes of occludin gene and protein expression.
sodiumfluoride;sertoli cell;tight junction;gene;protein
R114
A
1002-2481(2017)04-0518-04
10.3969/j.issn.1002-2481.2017.04.07
2017-01-09
国家自然科学基金项目(31540061)
张晓燕(1990-),女,山西长治人,在读硕士,研究方向:环境兽医学。王俊东、孙子龙为通信作者。
