金银花花器官实时荧光定量PCR内参基因的筛选
2017-04-20刘霞宇陈亮乔永刚宋芸王金胜
刘霞宇,陈亮,乔永刚,宋芸,王金胜
(山西农业大学生命科学学院,山西太谷030801)
金银花花器官实时荧光定量PCR内参基因的筛选
刘霞宇,陈亮,乔永刚,宋芸,王金胜
(山西农业大学生命科学学院,山西太谷030801)
为了筛选金银花花器官基因表达分析的适宜内参基因,试验以金银花花器官6个时期为材料,选取金银花的9个候选内参基因Lonja.ACT11,Lonja.ACT2/7,Lonja.G6PD,Lonja.GAPDH,Lonja.MTP,Lonja.TUA,Lonja. UBQ10,Lonja.EF1A,Lonja.UBC,利用qRT-PCR技术及GeNorm,NormFinder软件对它们的表达稳定性进行分析评价。结果表明,Lonja.ACT2/7和Lonja.G6PD在金银花花器官生长的不同时期表达水平较稳定,运用qRT-PCR研究金银花花器官基因表达时可选用Lonja.ACT2/7和Lonja.G6PD组合作为内参基因。
实时荧光定量PCR;金银花花器官;内参基因
基因表达在生物研究的许多领域都非常重要[1]。相比于传统的转录组分析,实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)[2]是检测mRNA最可信的方法[3]。其具有高灵敏性、高通量以及特异性高、动态范围广等优点[4],但同时也存在一些困难,最重要的就是内参基因的标准化。
在进行植物qRT-PCR研究时通常选用管家基因作为内参,比如肌动蛋白(actin,ACT)、微管蛋白(tublin,TUA,TUB)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)、核糖体RNA(ribosomal RNA,18sr RNA,28sr RNA)、延伸因子(elongation factor1-α,EF1-α)等[5]。然而,在许多情况下这些基因的表达水平并不是很稳定,甚至会导致错误的试验结果[6-7]。所以,在用qRT-PCR技术进行基因表达研究时要提前筛选适合试验条件的内参基因。目前,常用筛选内参基因的软件有GeNorm[8]和NormFinder[9]。
金银花(Lonicera japonica Thunb.)又名忍冬,为忍冬科多年生半常绿缠绕木质藤本植物,根据金银花花色的变化,可以将金银花开花过程分为米蕾期、三青期、二白期、大白期、银花期、金花期[10]。金银花商品以花蕾为佳,其性甘寒、气芳香,在中医药学中多作为宣散风热、清解血毒等配方,是一种常见的中医药学药用植物[11]。另外,金银花可作为食物,也普遍被认为是一种健康饮品,所以使得金银花在中草药市场的商业价值快速上升[12]。
目前,国内外已有很多关于金银花的研究报道,主要集中在化学成分[13]、质量[14]、生态价值[15]等方面。
本试验对金银花花器官的6个时期:米蕾期、三青期、二白期、大白期、银花期、金花期进行取材,通过qRT-PCR技术对9个候选内参基因Lonja.ACT11,Lonja.ACT2/7,Lonja.G6PD,Lonja.GAPDH,Lonja.MTP,Lonja.TUA,Lonja.UBQ10,Lonja.EF1A和Lonja.UBC进行稳定性分析,旨在为研究金银花花器官的基因表达qRT-PCR分析奠定基础。
1 材料和方法
1.1 试验材料
选择长势一致的金银花植株(种植于山西省晋中市太谷县山西农业大学山西天然药用生物研究院),分别在其米蕾期、三青期、二白期、大白期、银花期、金花期进行取材。
1.2 试验方法
1.2.1 总RNA提取及cDNA第1链合成利用北京华越洋植物RNA提取试剂盒提取各个样品的总RNA,步骤参照说明书进行。用1%的琼脂糖凝胶电泳检测其完整性,RNA的浓度和纯度用Nanodorp 2000c测定。反转录按照全式金TransScriptOne-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒的方法进行,每个样品分别以100 ng/μL总RNA为模板进行反转录,得到的产物部分用于普通PCR,部分冻存在-20℃备用。
1.2.2 荧光定量PCR引物的设计通过前期大量的文献阅读,找出植物中常用的qRT-PCR内参基因(9个),利用生物信息学方法从山西农业大学生命科学学院药用植物育种实验室已得到的金银花转录组数据中找出它们的同源基因。根据荧光定量PCR引物的设计原则,利用在线引物设计软件IDT PrimerQuest Tool(http://sg.idtdna.com/PrimerQuest/H ome/Index)分别设计Lonja.ACT11,Lonja.ACT2/7,Lonja.G6PD,Lonja.GAPDH,Lonja.MTP,Lonja.TUA,Lonja.UBQ10,Lonja.EF1A,Lonja.UBC引物(表1)。

表1 候选内参基因引物信息
1.2.3 内参基因的特异性检验用内参基因的普通PCR检测其特异性:试剂为中科瑞泰2×Taq PCR MasterMix。反应体系列于表2。反应程序为94℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸30 s,40个循环;最后72℃延伸5 min。

表2 普通PCR反应体系(20 μL)
1.2.4 荧光定量PCR反应用全式金TransStartrRTip Green qPCR SuperMix试剂盒进行qRT-PCR反应,每个样品3次生物学重复。反应体系列于表3。反应程序为94℃预变性30 s;94℃变性5 s,57℃退火15 s,72℃延伸10 s,45个循环;特异性检测:以0.5℃/5 s的速率从70℃上升到95℃,期间读取荧光信号值,绘制熔解曲线。

表3 qRT-PCR反应体系(10 μL)
1.3 数据分析
根据荧光定量仪给出的数据,利用GeNorm,NormFinder软件分析内参基因的稳定性。
2 结果与分析
2.1 RNA质量检测
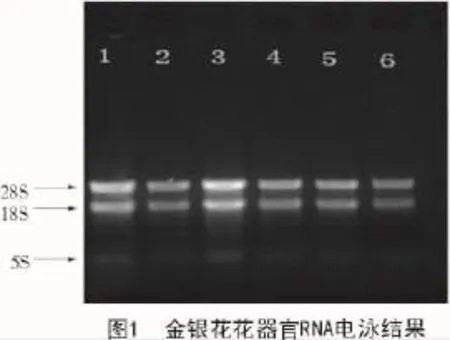
金银花花器官的总RNA经检测可知,A260/A280的值均在2.0左右,琼脂糖凝胶电泳结果显示(图1),28S的亮度约为18S的2倍,说明试验提取的RNA完整性良好,可用于后续的试验。
2.2 内参基因的特异性检验
从图2可以看出,每个基因的产物为单一条带,表明有较高的专一性,而且产物片段在79~150 bp,与预测结果一致,说明设计的引物可用于进一步试验。

2.3 内参基因的选择
利用GeNorm软件通过计算基因的表达稳定值(M)评价基因表达的稳定性,基因的M值越小越稳定。由图3可知,金银花花器官中9个候选内参基因稳定性大小依次是Lonja.ACT2/7=Lonja.G6PD>Lonja.GAPDH>Lonja.MTP>Lonja.ACT11>Lonja. UBC>Lonja.EF1A>Lonja.UBQ10>Lonja.TUA。由图4可知,V2/3小于阈值0.15,说明没有必要引入第3个内参。NormFinder软件计算结果表明(表4),Lonja.ACT2/7和Lonja.G6PD表达较稳定,Lonja. UBQ10和Lonja.TUA稳定性较差。2个软件得到的结果一致,在一定程度上验证了结果的可靠性。
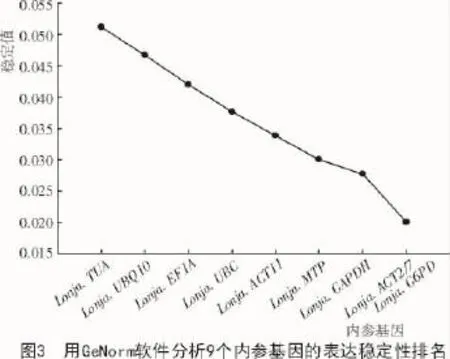


表4 NormFinder软件计算结果
3 讨论与结论
目前,在药用植物领域有一些关于筛选内参基因的研究。侯维海等[16]研究发现,TIP41和UBQ10在地黄花器官中表达稳定,而在地黄根、茎、叶中TIP41和UBQ5表达稳定。张岗等[17]以我国名贵中药材铁皮石斛为材料,研究发现,最适内参基因为EF-1α和18S rRNA。李金弟[18]以托品烷类生物碱药源植物颠茄作为研究对象进行研究,结果表明,PKG是其一个可靠的内参基因。蔡嘉洛等[19]研究发现,18S rRNA是灰毡毛忍冬的适宜内参基因。说明不同种类的药用植物最适的内参基因不同,同一物种不同的组织、器官最适宜的内参基因也不同。因此,在进行基因表达研究前,筛选适合试验的内参基因是非常必要的。
本试验通过qRT-PCR技术,筛选出金银花花器官的最适内参基因为Lonja.ACT2/7和Lonja.G6PD,运用qRT-PCR研究金银花花器官基因表达时可选用Lonja.ACT2/7和Lonja.G6PD组合作为内参基因,这为金银花花器官基因表达研究奠定了基础。
[1]WANH J,ZHAOZG,QIANCT,et al.Selection ofappropriate reference genes for gene expression studies by quantitative real-time polymerase chain reaction in cucumber[J].Analytical Biochemistry,2010,399:257-261.
[2]IZASKUN MALLONA,SANDRA LISCHEWSKI,JULIA WEISS,et al.Validation ofreference genes for quantitative real-time PCR during leaf and flower development in Petunia hybrida[J].BMC Plant Biology,2010,10:4.
[3]JIAN B,LIU B,BI Y,et al.Validation of internal control for gene expression study in soybean by quantitative real-time PCR[J].BMC Molecular Biology,2008,9(1):59.
[4]MUKESH JAIN,AASHIMA NIJHAWAN,AKHILESH K.Validation of housekeeping genes as internal control for studying gene expression in rice by quantitative real-time PCR[J].Biochemical and Biophysical Research Communications,2006,345(2):646-651.
[5]LIBAULT M,THIBIVILLIERS S,BILGIN D D,et al.Identification of four soybean reference genes for gene expression normalization[J]. The Plant Genome,2008,1(1):44-54.
[6]VOLKOV R A,PANCHUK I I,SCHOFFL F.Heat-stress-dependency and developmental modulation of gene expression:the potential ofhouse-keepinggenes as internal standards in Mrna expression profiling using real-time RT-PCR[J].Journal of Experimental Botany,2003,54:2343-2349.
[7]REMANS T,SMEETS K,OPDENAKKER K,et al.Normalisation of real-time RT-PCR gene expression measurements in Arabidopsis thaliana exposed to increased metal concentrations[J].Planta,2008,227(6):1343-1349.
[8]VANDESOMPELE J,DEPRETER K,PATTYN F,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology,2002,3(7):1-11.
[9]ANDERSENCL,JENSENJ L,OENTOFTTF.Normalization ofrealtime quantitative reverse transcription-PCR data:A model-based variance estimation approach to identify genes suited for normalization,applied to bladder and colon cancer datasets[J].Cancer Research,2004,64(15):5245.
[10]任玉锋,马永平,王文丽.金银花花色素的种类和含量的研究[J].安徽农业科学,2015,43(2):90-93.
[11]陈继明,洪超群.金银花药理作用分析[J].亚太传统医药,2015,11(5):43-44.
[12]WANG L J.The study progress of Lonicera japonica[J].Med Inform,2010,8:2293-2296.
[13]姜南辉.金银花化学成分研究[J].中药材,2015,38(2):315-317.
[14]李建军,贾国伦,李静云,等.金银花不同花期花蕾质量及指标成分含量比较分析[J].河南农业科学,2013,42(10):110-114.
[15]郭瑞齐,刘晋仙,胡春苗,等.山东道地药材金银花逆境响应机制研究进展[J].山东农业科学,2016,48(2):154-156.
[16]侯维海,孙鹏,陈全家,等.地黄实时定量PCR内参基因的筛选[J].中国农学通报,2011,27(17):76-82.
[17]张岗,赵明明,张大为,等.铁皮石斛实时定量PCR内参基因的筛选[J].中国药学杂志,2013,48(19):1664-1668.
[18]李金弟.颠茄内参基因筛选及基因表达分析[D].重庆:西南大学,2013.
[19]蔡嘉洛,朱贻霖,谢舒平,等.灰毡毛忍冬内参基因筛选和Mads-box家族基因AGL15的时空表达分析[J].中草药,2016,47(15):2727-2733.
Selection of Reference Genes by qRT-PCR in Flower Organ ofLonicera japonicaThunb.
LIUXiayu,CHENLiang,QIAOYonggang,SONGYun,WANGJinsheng
(College ofLife Science,Shanxi Agricultural University,Taigu 030801,China)
The study aimed to select stable and optimal reference genes for gene expression analysis in flower of Lonicera japonica Thunb.,taking 6 periods of Lonicera japonica Thunb.as materials.A total of nine reference genes including Lonja.ACT11,Lonja. ACT2/7,Lonja.G6PD,Lonja.GAPDH,Lonja.MTP,Lonja.TUA,Lonja.UBQ10,Lonja.EF1A,Lonja.UBC were compared by qRT-PCR.The stability of expression of the nine reference genes were evaluated by GeNorm and NormFinder software.The results showed that Lonja.ACT2/7 and Lonja.G6PD were the most suitable reference genes among different periods of flower organ,Lonja. ACT2/7 and Lonja.G6PD were used as the reference gene in the studyofgene expression ofhoneysuckle flower organs byqRT-PCR.
qRT-PCR;flower organ ofLonicera japonica Thunb.;reference genes
S567.7+9
A
1002-2481(2017)04-0514-04
10.3969/j.issn.1002-2481.2017.04.06
2016-10-04
山西省科技攻关项目(20140312001-2);山西农业大学横向项目(2014HX60)
刘霞宇(1991-),女,山西方山人,在读硕士,研究方向:生物化学与分子生物学。王金胜为通信作者。
