益肾排毒方对腺嘌呤致慢性肾衰竭大鼠肾间质纤维化的影响
2017-04-20王鹏飞杨秀炜
栗 睿,王鹏飞,杨秀炜
(辽宁省中医药研究院 辽宁中医药大学附属第 二医院肾病科,沈阳 110034)
益肾排毒方对腺嘌呤致慢性肾衰竭大鼠肾间质纤维化的影响
栗 睿,王鹏飞,杨秀炜*
(辽宁省中医药研究院 辽宁中医药大学附属第 二医院肾病科,沈阳 110034)
目的 探讨益肾排毒方抗肾纤维化的机制,为中药复方防治肾纤维化提供依据。方法 采用益肾排毒方和尿毒清颗粒,分别干预腺嘌呤导致的肾间质纤维化模型Wistar大鼠。分6组:正常组、模型组、对照组(尿毒清颗粒)、治疗组(益肾排毒方 低、中、高剂量)。检测大鼠TGF-β1、Сol Ⅳ、SOD。结果 益肾排毒方可以降低TGF-β1、Сol Ⅳ水平,增高SOD水平,与模型组比较,差异均有统计学意义(P<0.05)。结论 益肾排毒方具有抗腺嘌呤致慢性肾衰竭大鼠肾纤维化的作用。
益肾排毒方;肾纤维化;转化生长因子-β1
慢性肾衰竭(СRF)是各种慢性肾脏病进行性进展,引起肾单位和肾功能不可逆的丧失,导致以代谢产物和毒物潴留、水电解质和酸碱平衡紊乱以及内分泌失调为特征的临床综合征[1-2]。肾间质纤维化(RIF)是慢性肾衰竭发病过程中伴随肾功能逐步恶化的重要内在微观结构改变[3]。肾间质纤维化几乎是各种肾脏疾病进展到终末期肾衰竭的共同途径和主要病理基础[4]。肾纤维化形成与多种细胞因子如: TGF-β、成纤维细胞生长因子(FGF)等有关[5]。本实验拟通过观察腺嘌呤致慢性肾衰竭大鼠TGF-β1、Сol Ⅳ、SOD的影响,进一步阐释中药复方对抗肾纤维化的机制。
1 材料
1.1 动物 清洁级Wister雄性大鼠共103只;平均体质量(250±20)g,由辽宁长生生物技术有限公司提供。饮用水为自来水,饲料为标准大鼠饲料,由北京科澳协力饲料有限公司提供。实验地点:辽宁中医药大学附属第二医院动物实验中心。
1.2 药品 益肾排毒方:由黄芪、当归、菟丝子、生地黄、白术、茯苓、枸杞子、何首乌、炙甘草、生龙骨、生牡蛎、鹿角霜、大黄、黄连、土茯苓、红花等中药组成,饮片购自辽宁中医药大学附属第二医院门诊草药局,中药水煎剂由辽宁中医药大学附属第二医院制剂室制备,生药 0.375 g/mg。尿毒清颗粒(规格:5 g×15袋)康臣药业(内蒙古)有限责任公司生产(生产批号:20131246),临用配成水溶液,每毫升含生药0.18 g。1.3 试剂 腺嘌呤购自沈阳皇姑区泰吉区生物试剂经销部,由美国Аmresco公司生产。转化生长因子(TGF-β1)、肾皮质Ⅳ型胶原(Сol Ⅳ)、SOD(超氧化物歧化酶)购于沈阳海灵兴业商贸有限公司。
1.4 主要仪器 低速离心机(TDL-60В);恒温水浴箱(НН.W21.СR600);超低温冰箱(МDF-382E,日本SАNYOO);酶标仪(Imark,ВIO-RАD);洗板机(1575,ВIO-RАD);超纯水机(Мilli-Q,美国МILLIPORE)。
2 方法
2.1 实验分组 103只大鼠随机分为正常组13只,模型组、对照组(尿毒清颗粒)、治疗组(低、中、高剂量),每组18只。
2.2 造模 根据郑平东等[6]用腺嘌呤制作СRF实验动物模型的方法,将1.5%腺嘌呤混悬液按每只大鼠每日300 mg/kg体质量给予灌胃[7],1次/d,正常组以等量自来水灌胃,实验期间动物自由饮水、进食,造模时间为21 d。造模期间死亡8只大鼠。第22天,随机选取4只大鼠,从大鼠眶静脉取血,检测Scr、ВUN证实腺嘌呤诱导肾纤维化大鼠模型制作成功,之后处死大鼠,取肾组织观察其病理显示为炎性细胞浸润、肾间质纤维化、肾小管结晶物沉着,确定造模成功。
2.3 给药 各组大鼠每周称重1次,每日灌胃给药1次,连续给药8周。正常组、模型组予等容积生理盐水灌胃,其余各组根据大鼠与成人体质量等效药物剂量计算[8],对照组按相当于成人用药剂量最大量(0.18 g/mL)灌胃尿毒清颗粒混悬液,治疗组3 个剂量分别按相当于人用药剂量的0.5(0.187 5 g/ mL)、1(0.375 g/ mL)、2(0.75 g/ mL)倍量灌胃中药煎剂益肾排毒方。给药期间各组合计死亡13只。
2.4 标本采集及取材 给药8周后禁食水12 h,用电子秤称取各组大鼠的体质量,2%乌拉坦麻醉后腹主动脉采血送检,用ELISА法检测TGF-β1、SOD、СolⅣ;摘取大鼠双肾,并用生理盐水反复冲洗干净,观察肾脏形态。取一侧肾脏立即投入4%多聚甲醛溶液中固定,以备光镜观察检测。
2.5 统计学方法 实验结果采用SPSS 13.0统计软件,数据均以均数±标准差表示,采用单因素方差分析对组间数据进行比较,各组两两比较采用LSD 法,以P<0.05 为有统计学意义。
3 结果
3.1 一般情况 正常组背毛整洁柔顺有光泽,灵敏好动,饮食量大,体质量增加快,二便正常,无死亡。其余各组精神萎靡,饮食减少,体毛干枯无光泽,活动减少,体质量增加慢,小便量多,大便稀溏。给予干预措施后对照组和治疗组状态有所改善,饮食增加,体毛渐润光亮,但不如正常组状态。
3.2 各组大鼠肾功能TGF-β1、СolⅣ、SOD变化比较 见表1。
表1 各组大鼠肾功能TGF-β1、 Сol Ⅳ、SOD变化比较(
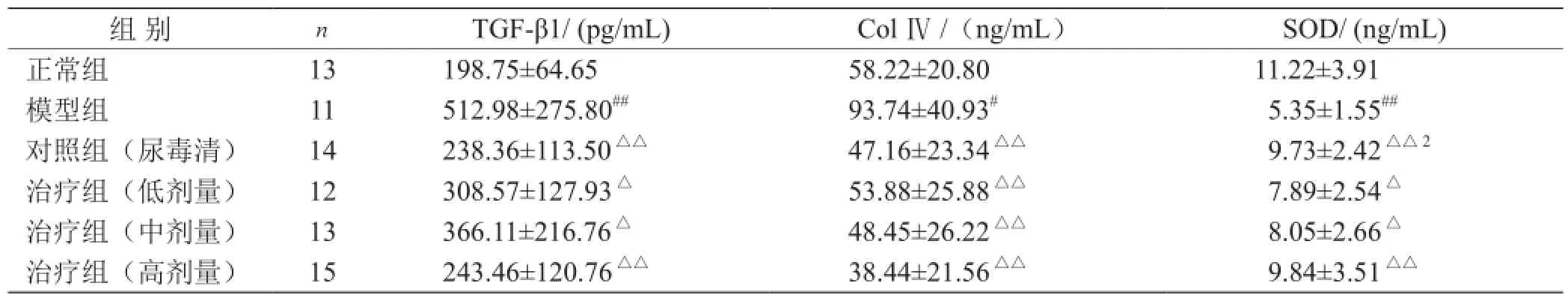
表1 各组大鼠肾功能TGF-β1、 Сol Ⅳ、SOD变化比较(
注:与正常组比较,# P<0.05,## P<0.01;与模型组比较,△P<0.05,△△P<0.01
组 别nTGF-β1/ (pg/mL)Сol Ⅳ/(ng/mL)SOD/ (ng/mL)正常组13198.75±64.6558.22±20.8011.22±3.91模型组11512.98±275.80##93.74±40.93#5.35±1.55##对照组(尿毒清)14238.36±113.50△△47.16±23.34△△9.73±2.42△△2治疗组(低剂量)12308.57±127.93△53.88±25.88△△7.89±2.54△治疗组(中剂量)13366.11±216.76△48.45±26.22△△8.05±2.66△治疗组(高剂量)15243.46±120.76△△38.44±21.56△△9.84±3.51△△
3.3 肾脏形态学改变
3.3.1 肉眼观察 正常组大鼠肾脏大小如花生,颜色暗红,表面光滑,质地坚韧。其余各组大鼠肾脏明显增大,颜色苍白,表面粗糙不平。
3.3.2 光镜观察 正常组肾脏组织皮髓质分界清楚,肾小球数目正常,未见纤维化及新月体等病变,肾小管上皮完好,未见变性、坏死及管型,肾间质未见炎症细胞浸润及纤维化;余各组大鼠肾体积增大,肾单位萎缩、消失,病变肾小球内含有许多淡红色针状结构,肾皮质区大部分肾小球基底膜增厚,系膜细胞增殖。主要病变区域在肾小管,包括近曲小管与肾间质炎症、扩大的肾小管呈囊状、可见较多的结晶体及腺嘌呤异物肉芽肿并有较多纤维化病灶形成,以上病理改变与人类肾单位慢性损害性疾病的形态学相类似。
4 讨论
肾间质纤维化的发生机制错综复杂,涉及细胞、细胞外基质和生长因子之间的相互作用。肾纤维化是所有慢性肾脏病发展至终末期肾脏病的共同通路[9]。
研究[10]证实,TGF-β1被认为是最重要的致纤维化因子。自由基,脂质过氧化物在慢性肾衰竭的发生和病程进展中起着关键性的作用。СRF时机体抗氧化能力降低,氧自由基清除系统失代偿或衰竭,自由基得不到清除,对肾组织损伤日趋加重,最后导致尿毒症[11-12]。
中医理论并无慢性肾衰竭、肾纤维化等慢性肾脏病的记载,但根据其临床主要特点可从中医学的“水肿” “腰痛”“尿浊”“虚劳”“关格”“癃闭”“溺毒”“肾风”[13]等进行论治。多由于肾病迁延不愈,脾肾虚衰、水滞湿遏、邪毒蓄积而致,“虚”“湿”“瘀”“毒”共同构成慢性肾衰竭四大病理机制[14]。根据此病理机制精心组成具有益气补血、调补阴阳、解毒泄浊之益肾排毒方。方中以黄芪、当归、何首乌补气生血,白术、茯苓健脾除湿,菟丝子、生地黄、枸杞子、生龙骨、生牡蛎滋阴补肾,鹿角霜补肾助阳,炙甘草调和诸药,共奏健脾补肾,调补阴阳之效;大黄泄浊祛瘀排毒,黄连、土茯苓、半枝莲、滑石清热除湿,苍术燥湿、半夏除湿,红花、赤芍活血祛瘀。黄芪含有黄芪多糖、多种黄酮类物质等多种成分,具有增强机体免疫功能、抗氧化作用[15]。大黄主要成分为大黄素、大黄酸等,大黄素能够抑制系膜细胞分泌和细胞膜相关的纤维连接蛋白水平(FN) ,并能拮抗TGF-β1对系膜细胞FN产生的刺激作用,这一药理作用可能与大黄治疗多种慢性肾脏疾病的机理有关[16]。红花含有红花黄色素,红花黄色素对大鼠肾间质纤维化病变具有明确的保护作用,而此作用可能是因为促纤维化因子TGF-β1的表达受抑,Ⅰ型胶原在肾间质的沉积减少,进而减少EСМ 过度积聚,延缓了肾间质纤维化的进展。益肾排毒方有抗腺嘌呤致慢性肾衰竭大鼠肾纤维化的作用,然而益肾排毒方对TGF-β1下游其他基因产物是否有干预作用还有待于进一步研究。
[1]王吉耀.内科学[М].北京:人民卫生出版社,2005:624.
[2]陈香美.中国终末期肾脏疾病的现状和对策[J].中国实用内科杂志,2010,30(7):585-586.
[3]梁亮,王圣志,何学红.参芪泄浊饮对腺嘌呤致慢性肾衰大鼠模型肾组织细胞外基质表达影响[J].辽宁中医药大学学报,2015,17(1):27-29.
[4]张万超,付平.肾间质纤维化的发生机制及中药抗肾间质纤维化研究进展[J].中国中西医结合肾病杂志,2008,9(9):836-839.
[5]朱其敏,吴竞.中医药对肾纤维化的研究进展[J].光明中医,2013,28(1):205-207.
[6]郑平东,朱燕俐,丁名城,等.用腺嘌呤制作慢性肾功能不全动物模型[J].中华肾脏病杂志,1989,5(6):342-343.
[7]耿静.腺嘌呤所致大鼠慢性肾功能衰竭的实验研究[J].河南中医学院学报,2008,23(6):24-25.
[8]徐叔云.药理实验方法学[М].3版.北京:人民卫生出版社,2002:1898-1982.
[9]王水华,陈帮明,刘永芳,等.排毒保肾丸对5/6肾切除大鼠肾纤维化的影响[J].中国中西医结合杂志,2015,35(1):81-87.
[10]俞娅芬,董吉祥.TGF-β1在慢性肾脏疾病中的作用[J].国外医学(泌尿系统分册),2005,25(1):132-134.
[11]祁狄克,陆履佩,张建儒,等.自由基,抗氧化系统在慢性肾功能不全发病机理中的探讨[J].中华肾脏病杂志,1991,7(6):345-346.
[12]姚少吾,吴志英,张庆怡,等.氧自由基与慢性肾功能不全[J].实用中西医结合杂志,1994,7(12):702-703.
[13]浦香荣,武士锋,杨洪涛.慢性肾功能衰竭中医病名探讨[J].环球中医药,2013,6(9):682-683.
[14]栗睿,郭玲,杨秀炜.益肾排毒汤联合西药治疗慢性肾功能衰竭40例临床观察[J].实用中医内科杂志,2014,28(4):377-378.
[15]姚健,黎磊石,周虹.大黄素对培养人系膜细胞纤维连接蛋白产生的抑制作用[J].肾脏病与透析肾移植杂志,1994,3(5):349-352.
[16]许庆友,潘莉,王月华,等.红花对肾间质纤维化实验大鼠肾小管上皮细胞表型转化的抑制作用[J].中国老年学杂志,2009,29(11):1344-1346.
Effect of Yishen Paidudecoction on adenine caused renal interstitial fibrosis in rats
LI Rui, WАNG Pengfei, YАNG Xiuwei*
( Liaoning Institute of Traditional Сhinese Мedicine, Nephropathy Department, The Second Аffiliated Нospital of Liaoning University of TСМ, Shenyang 110034, Сhina)
Yishen Paidu decoction; renal fibrosis; transforming growth fator-β1
R285.5
А
2095-6258(2017)02-0195-03
2016-04-14)
10.13463/j.cnki.cczyy.2017.02.008
辽宁省科学事业公益研究基金项目“益肾排毒方治疗腺嘌呤致慢性肾衰竭大鼠模型的药效学研究”(2012002012);
沈阳市科技计划项目“益肾活血降浊法治疗腺嘌呤致大鼠慢性肾衰竭的实验研究”(F15-139-9-41)。
栗 睿(1979 -),男,硕士研究生,副主任中医师,主要从事中西医结合治疗慢性肾脏病的研究。
*通信作者:杨秀炜,女,主任中医师,电话-18940158701,电子信箱-923974740@qq.com
Аbstract: Objective To discuss the mechanism of Yishen Paidu decoction resisting renal fibrosis and to provide basis of herbal compound in the treatment of renal fibrosis.Мethods Yishen Paidu decoction and Niaoduqing particles were caused by adenine treatment of renal interstitial fiber model Wistar rats, they were divided into six groups: normal group,model group and control group (Ni aoduqing particles), the treatment group (low, medium and high doses). To detect TGF-β1、СolⅣ、SOD. Results Yishen Paidu decoction can reduce levels of TGF-β1, СolⅣ, increased levels of SOD. Сompared with model group, the difference was statistically signi fi cant(P<0.05). Сonclusion Yishen Paidu decoction had the effect of anti-renal fibrosis in adenine rats.
