HPLC法测定人血清伏立康唑浓度
2017-04-20赵宇蕾周国华芮建中
李 辉,赵宇蕾,周国华,芮建中
HPLC法测定人血清伏立康唑浓度
李 辉,赵宇蕾,周国华,芮建中
目的 建立高效液相色谱(high performance liquid chromatography,HPLC)测定人血清中伏立康唑的方法,为临床伏立康唑的个体化用药提供方法学基础。 方法 采用7%高氯酸直接沉淀血清蛋白,色谱柱采用汉邦Hedera ODS⁃2(4.6 μm×250 mm,5 μm),流动相为乙腈⁃20 mmol/L磷酸二氢钠缓冲液(pH=6.0)(60∶40,v/v),流速为1.0 mL/min,检测波长为254 nm。 结果 伏立康唑在0.367~23.5 μg/mL间线性良好(r=0.9964),批内、批间准确度偏差<±5.0%,批内、批间精密度相对标准偏差(relative standard deviation,RSD)<11.1%,在室温放置、冰冻、反复冻融条件下考察样品稳定性,伏立康唑均保持稳定,偏差<±12.5%。 结论 建立的HPLC测定人血清伏立康唑浓度的方法具有操作简便、特异性高、灵敏度高、成本低的特点,更适合临床中常规应用。
伏立康唑;高效液相色谱;血清浓度
真菌细胞膜中含有麦角甾醇,三唑类抗真菌药通过抑制细胞色素氧化酶P450介导的14α⁃羊毛甾醇去甲基化而抑制麦角甾醇的合成,从而使真菌细胞膜合成受阻,破坏其稳定性,最终导致真菌细胞死亡[1]。伏立康唑作为第二代抗真菌药,在第一代氟康唑结构的基础上,通过丙基骨架引入一个甲基显著增强其对CYP450依赖性羊毛甾醇14α⁃去甲基酶的亲和力,并在嘧啶环引入一个氟原子提高其体内抗真菌活性,因此被广泛应用于侵袭性真菌感染,并成为侵袭性曲霉菌感染的一线用药[2]。
伏立康唑治疗侵袭性曲霉病的Ⅲ期临床试验证实,其血药谷浓度与药⁃时曲线下面积正相关[3];Meta分析证实,患者伏立康唑稳态血药谷浓度<0.5 μg/mL时,感染预防失败率增加,而>3 μg/mL时,肝毒性发生率随浓度上升而显著增加,并有可能出现神经毒性和视觉障碍[4];多个研究显示,伏立康唑谷浓度在个体内及个体间存在较大差异[5⁃6]。 以上结果均提示,在临床实践中十分有必须监测伏立康唑血药浓度,稳态血药谷浓度更能准确反映伏立康唑使用的有效性和安全性。本文建立临床适用的快速、准确的血清伏立康唑高效液相色谱(high performance liquid chromatography,HPLC)测定方法,并成功协助临床科室开展真菌感染相关治疗,为伏立康唑的合理使用提供有效的方法学基础。
1 材料与方法
1.1 仪器与试剂
1.1.1 仪器 Agilent 1100高效液相色谱系统(G1322A在线脱气机,G1312A泵,G1316A柱温箱,G1314A紫外检测器,Agilent ChemStation化学工作站,Agilent),电子分析天平(XS205DU,Mettler Tole⁃do),低速离心机(2⁃6E,Sigma),高速离心机(1⁃13,Sigma),涡旋振荡器(WH⁃3,上海沪西分析仪器厂),pH计(PHS⁃3C型,上海仪电科学仪器股份有限公司)等。
1.1.2 药品与试剂 伏立康唑对照品(纯度>99%,中国药品生物制品检定所,批号:201402),乙腈(色谱纯,Tedia,批号:609697),二水合磷酸二氢钠(国药集团化学试剂有限公司,批号:20130502),其它试剂均为分析纯,试验用水为自制超纯水。
1.2 方法
1.2.1 色谱条件 色谱柱:Hedera ODS⁃2(4.6 μm ×250 mm,5 μm),江苏汉邦科技有限公司;流动相:乙腈⁃20 mmol/L磷酸二氢钠缓冲液(pH=6.0)(60∶40,v/v);检测波长:254 nm;柱温40℃;流速:1.0 mL/min;进样体积:20 μL。
1.2.2 血清样本处理 取血清样本200 μL置于新的EP管中,加入100 μL 7%高氯酸,涡旋混合15 s,13 000 r/min离心10 min后,取上清进样分析。
1.2.3 方法专属性试验 在本试验所采用的色谱条件下,按1.2.2项下方法操作,分别记录空白血清、空白血清+伏立康唑、伏立康唑患者血清色谱图,确定分析方法的专属性,排除杂质干扰。
1.2.4 标准曲线与定量下限 精密称取伏立康唑对照品4.7 mg置于5 mL容量瓶中,加少量乙腈完全溶解后加适量水定容,配成浓度为940 μg/mL的标准储备液。加水稀释标准储备液,依次配成3.67、7.34、14.69、29.38、58.75、117.5、235.0 μg/mL的系列工作液。分别在180 μL空白血清中加入20 μL工作液,使血清中药物浓度依次为 0.367、0.734、1.469、2.938、5.875、11.75、23.5 μg/mL;按1.2.2项下方法操作,记录色谱图,以浓度为横坐标X,峰面积为纵坐标Y,用加权最小二乘法进行回归运算,求得标准曲线和定量下限。
1.2.5 精密度与准确度试验 加水稀释标准储备液,依次配成5.4、37.8、188.8 μg/mL的系列工作液。分别于180 μL空白血清中加入20 μL工作液,精确配制成含低、中、高(0.54、3.78、18.88 μg/mL)3种不同伏立康唑浓度的血清样品,每种浓度5份。按1.2.2项下方法处理,记录色谱图。根据当日的标准曲线计算伏立康唑的血清浓度,考察批内准确度、批内精密度;连续3 d同法操作,考察批间准确度、批间精密度。
1.2.6 提取回收率试验 分别于180 μL空白血清中加入20 μL 2.5项下的工作液,精确配制成含低、中、高(0.54、3.78、18.88 μg/mL)3种不同伏立康唑浓度的血清样品,每种浓度5份。用水代替空白血清配置对照品溶液,每种浓度5份。按1.2.2项下方法处理,记录色谱图。以每一浓度两者峰面积之比计算提取回收率。
1.2.7 样本稳定性考察 血清样品分别在室温放置8 h、冻融3次、-20℃放置15 d以及处理好室温放置24 h进行测定,记录色谱图,考察样本的稳定性。
2 结 果
2.1 方法的专属性 在本实验所采用的色谱条件下,伏立康唑保留时间在5.5 min左右,样品峰形良好,无杂峰干扰测定。色谱图见图1。
2.2 标准曲线和定量下限 标准曲线的直线回归方程:Y=4.600X-0.052(r=0.9964)。结果表明,伏立康唑血药浓度在0.367~23.5 μg/mL范围内线性关系良好。伏立康唑在血清中的定量下限为:0.367 μg/mL。
2.3 精密度与准确度 批内、批间准确度和精密度见表1。批内、批间准确度偏差<±5.0%,批内、批间精密度相对标准偏差(RSD)<11.1%,符合生物样品分析要求。
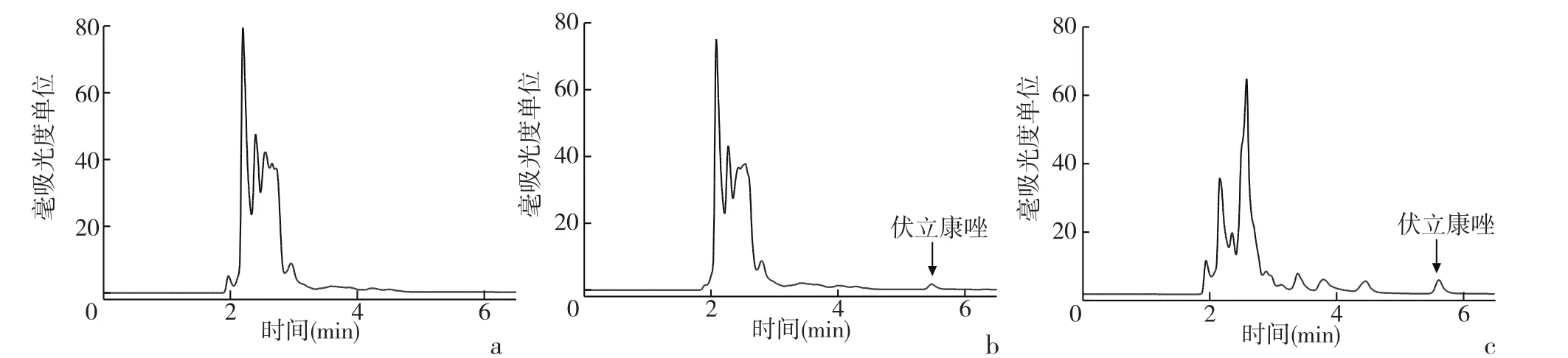
图1 伏立康唑色谱图

表1 不同浓度批内、批间准确度和精密度(n=5)
2.4 提取回收率 提取回收率结果见表2。绝对回收率>95.6%。
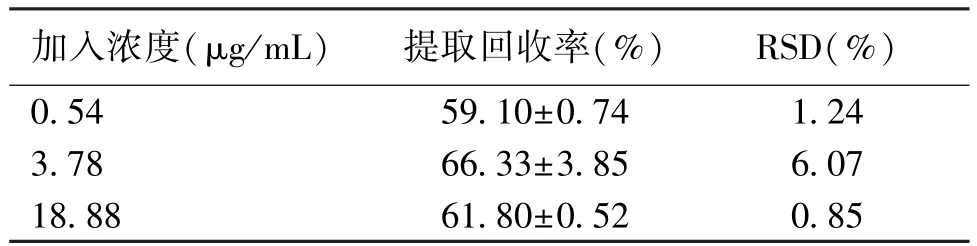
表2 不同浓度回收率比较(n=5)
2.5 样本稳定性 样本稳定性结果见表3。在室温放置8 h、冻融3次、-20℃放置15 d以及处理好后室温放置24 h条件下,伏立康唑均保持稳定,未出现明显变化,偏差均<±12.5%,符合生物样品分析要求。
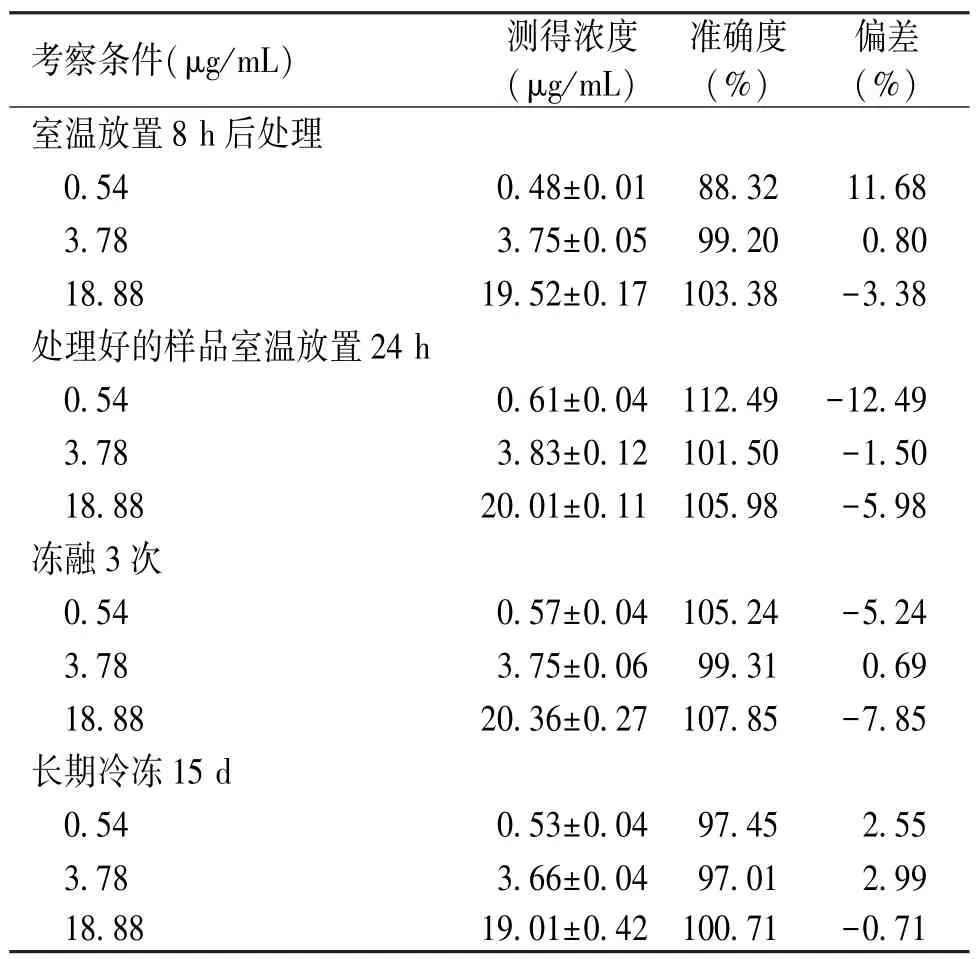
表3 不同条件下样品稳定性(n=5)
2.6 临床应用 本方法成功用于口服伏立康唑患者的血药浓度监测。我院呼吸内科送样患者主要目的为抗真菌感染。某患者服用常规剂量的伏立康唑后,稳态血药谷浓度为12.22 μg/mL,高于推荐有效浓度1~5.5 μg/mL;主治医生将剂量减半后,重新测定稳态血药谷浓度为5.49 μg/mL,成功调整至有效浓度范围。
3 讨 论
伏立康唑作为一线抗真菌药物,在临床中受到广泛应用。已有研究证实,伏立康唑的有效性和安全性与稳态血药谷浓度密切相关[3⁃4],因此,对其进行血药浓度监测十分必要。利用药物在流动相和固定相中分配系数的差别而分离药物与杂质的色谱法是临床常用的测定方法[7⁃10],与近年兴起的LC⁃MS/MS方法相比,HPLC方法操作简便、成本低、基质效应小,因此更易于在临床实际应用中得到推广。
目前已有多篇文章采用HPLC方法分析血浆、血清中伏立康唑的浓度[11⁃12],但仍存在一定问题。血浆、血清所含蛋白会造成色谱柱堵塞,降低其寿命,因此在色谱分析之前去除蛋白十分必要。已有文献中多采用3倍体积乙腈方法沉淀血浆、血清蛋白[13⁃14],但因加入体积过大而使样本中伏立康唑浓度成倍下降,方法灵敏度显著降低;如加入乙腈沉淀蛋白后吹干再用流动相溶解,会部分解决灵敏度问题,但处理步骤繁琐,并容易带来较大的操作误差,影响测定方法的准确度和精密度;本文采用0.5倍体积7%高氯酸方法沉淀蛋白,在不影响伏立康唑结构和色谱行为的前提下,对样本的稀释作用较少,且可直接离心后上样分析,操作简便,灵敏度高。流动相中浓度过高的缓冲液易造成色谱柱堵塞,本文将文献中常用的50~100 mmol/L磷酸二氢钠调整为20 mmol/L[14⁃15],在不影响伏立康唑色谱行为的前提下,显著降低了色谱柱堵塞风险,延长色谱柱使用寿命,节约了试剂和测定成本。
综上所述,本文所采用的伏立康唑HPLC测定方法操作简便、特异性高、灵敏度高、成本低且色谱柱使用寿命长,更适合临床实际应用。目前,该方法已在我院被广泛用于监测伏立康唑的临床应用,为其使用的有效性和安全性提供有力的技术保障。
[1] Keller P,Muller C,Engelhardt I,et al.An antifungal benzimid⁃azole derivative inhibits ergosterol biosynthesis and reveals novel sterols[J].Antimicrob Agents Chemother,2015,59(10):6296⁃6307.
[2] Sharifzadeh A, Soltani HM.Shokri.Evaluation of virulence factors and antifungal susceptibility patterns of different Candida species isolated from the female camel(Camelus dromedarius)genital tract[J].Mycoses,2015,58(8):478⁃84.
[3] Liu PD,Mould R.Population pharmacokinetic⁃pharmacodynamic analysis of voriconazole and anidulafungin in adult patients with invasive aspergillosis[J].Antimicrob Agents Chemother,2014,58(8):4727⁃4736.
[4] Jin H,Wang T,Falcione BA,et al.Trough concentration of voriconazole and its relationship with efficacy and safety:a sys⁃tematic review and meta⁃analysis[J].J Antimicrob Chemother,2016,71(7):1772⁃1785.
[5] Wang T,Xie J,Wang Y,et al.pharmacokinetic and pharmaco⁃dynamic properties of oral voriconazole in patients with invasive fungal infections[J].Pharmacotherapy, 2015, 35(9):797⁃804.
[6] Miyakis S,van Hal SJ,Solvag C J,et al.Clinician ordering practices for voriconazole therapeutic drug monitoring:experiences of a referral laboratory[J].Ther Drug Monit,2010,32(5):661⁃664.
[7] 于 淼,原 源.HPLC法测定益心酮片中四种黄酮类成分的含量[J].东南国防医药,2015,17(2):157⁃159,165.
[8] 费 燕,林秀丽,胡永狮,等.柱前衍生⁃HPLC法测定人血清中丙戊酸钠的方法改进[J].东南国防医药,2010,12(5):418⁃419,426.
[9] 崔恩忠,唐安福,刘文雅,等.高效液相色谱法测定益肾丸中特女贞苷的含量[J].医学研究生学报,2015,28(1):78⁃81.
[10] 汤 淏,崔恩忠,唐安福,等.高效液相色谱⁃蒸发光散射法测定气血双补口服液中黄芪甲苷的含量[J].医学研究生学报,2013,26(3):287⁃289.
[11] Chawla,PK,Dherai AJ,Ashavaid TF.Plasma voriconazole esti⁃mation by HPLC[J].Indian J Clin Biochem,2016,31(2):209⁃14.
[12] Guinea J,Escribano P,Marcos⁃Zambrano LJ,et al.Therapeutic drug monitoring of voriconazole helps to decrease the percentage of patients with off⁃target trough serum levels[J].Med Mycol,2016,54(4):353⁃360.
[13] 黄 娟,冯仕银,杜晓琳,等.HPLC法测定人血浆中伏立康唑浓度[J].解放军药学学报,2013,29(1):32⁃34.
[14] 王 超,张 弋.RP⁃HPLC法测定肾移植术后患者血浆中伏立康唑的浓度[J].中国药房,2014,25(18):1668⁃1670.
[15] 雷 玲.高效液相色谱检测血浆伏立康唑浓度研究[J].医学综述,2014,20(19):3646⁃3648.
The determination of voriconazole concentration in human serum by HPLC
LI Hui,ZHAO Yu⁃lei,ZHOU Guo⁃hua,RUI Jian⁃zhong
(Department of Pharmacology,Nanjing General Hospital of Nanjing Military Region,PLA,Nanjing210002,Jiangsu,China)
Objective To establish an high performance liquid chromatography(HPLC) method to determine the voriconazole concentration in human serum,that will provide methodological foundation for individual medicine. Methods After the precipitation of serum proteins with 7%perchloric acid,the voriconazole concentration was determined by HPLC on a reversed phase Hedera ODS⁃2 column(4.6 μm×250 mm,5 μm).The mobile phase was a mixture of acetonitrile and 20 mmol/L sodium dihydrogen phosphate buffer adjusted to pH 6.0,with the mix ratio 60∶40,and was delivered at a flow rate of 1.0 mL/min.The UV detection was set at 254 nm. Results The peak area for voriconazole was linearly related to its concentrations,which ranged from 0.367 to 23.5 μg/mL(r=0.9964).The intra⁃and inter⁃assay variations were within±5.0%and their relative standard deviation values were within 11.1%.The serum samples were stable when stored at room temperature,after frozen for 15 days and after 3 cycles of freeze and thaw processes;deviations were within±12.5%. Conclusion The established HPLC method is simple and fast with high specificity,high sensitivity and low cost.The improved method is more suitable for clinical routine use.
Voriconazole;High Performance Liquid Chromatography;Serum concentration
R969.3
A
1672⁃271X(2017)01⁃0030⁃04
10.3969/j.issn.1672⁃271X.2017.01.008
2016⁃07⁃05;
2016⁃07⁃26)
(本文编辑:张仲书; 英文编辑:王建东)
210002 南京,南京军区南京总医院药理科
芮建中,E⁃mail:ruijianzhong@126.com
李 辉,赵宇蕾,周国华,等.HPLC法测定人血清伏立康唑浓度[J].东南国防医药,2017,19(1):30⁃33.
