质粒DNA提取及电泳检测实验改革
2017-04-19赵玉红崔建林赵立青李登文张金红
赵玉红, 李 欣, 崔建林, 赵立青, 李登文, 张金红, 周 浩
(1. 南开大学 生物实验教学中心, 天津 300071; 2. 南开大学 医学院, 天津 300071)
质粒DNA提取及电泳检测实验改革
赵玉红1, 李 欣1, 崔建林2, 赵立青1, 李登文1, 张金红1, 周 浩1
(1. 南开大学 生物实验教学中心, 天津 300071; 2. 南开大学 医学院, 天津 300071)
为进一步增强学科间的交叉与渗透,提高学生灵活运用多学科知识与方法的能力,对质粒DNA提取及电泳检测实验进行改革。在改进经典碱裂解法提取质粒DNA、琼脂糖凝胶电泳检测质粒DNA的基础上,新增试剂盒方法提取质粒DNA、超微量分光光度计检测质粒DNA以及快速单酶切鉴定质粒DNA等实验内容。改革后的实验不仅促进经典与现代技术、方法的有机结合,而且增强学科间的相互融合,取得了良好的教学效果。
质粒DNA提取; 质粒DNA检测; 电泳检测
质粒(plasmid)存在于许多细菌以及酵母菌等生物中,是细胞染色体外能够自主复制的环状DNA分子[1-2]。作为基因工程的常用工具,质粒广泛应用于分子生物学基础研究、转基因检测、医疗诊断、基因治疗等领域[3]。鉴于质粒研究的重要性与实际应用的广泛性,在为全校生命科学相关专业开设的基础生物化学实验中开设了“碱裂解法提取大肠杆菌质粒DNA及琼脂糖凝胶电泳检测”的实验项目,目的在于让非生物类学生学习和掌握质粒DNA的分离提取以及电泳检测的基本实验技术。
随着科学水平的整体发展,学术问题越来越细化,学科之间的相互交流和相互渗透成为学术发展的需要[4]。一方面质粒DNA在与生物学相关的医学、药学、环境科学等领域得到了广泛应用,如核酸疫苗、农业转基因产品检测等[5-8];另一方面物理学、化学等学科的发展推动了质粒DNA的提取纯化技术以及质量分析技术的进一步发展,如以纳米磁性粒子为固相载体或是基于各种色谱的试剂盒[9-11]、超微量分光光度计等。在这种大环境条件下,传统的实验教学内容已经不能很好地体现学科间的交叉、渗透和融合,不利于学生灵活运用多学科知识与方法能力的培养,因此对原实验进行了改革。改革后,首先采用碱裂解和试剂盒两种方法提取质粒DNA,然后经超微量分光光度计检测质粒DNA浓度及其纯度,进行快速限制性内切酶分析,最后根据琼脂糖凝胶电泳结果分析2种方法提取的质粒DNA质量。
1 材料与试剂
材料:质粒与菌体为含有pCMV-Myc质粒载体的DH5α大肠杆菌。
试剂:快速酶EcoRⅠ购自Fermentas,RNase A购自Solarbo,琼脂糖购自Biowest,1 Kb DNA Ladder购自NEB,GelRed购自Biotium,其他试剂均为国产分析纯;质粒DNA小量提取试剂盒购自AXYGEN(型号:AxyPep)。
2 方法
2.1 质粒DNA的提取
2.1.1 改良的碱裂解法
参考《生物化学习题及实验技术》[12]。取3 mL在LB培养基中过夜培养的菌液,12 000 r/min,离心1 min,尽可能去除培养液,收集菌体;加100 μL含50 mg/L RNase A的溶液I(50 mmol/L葡萄糖,25 mmol/L Tris-HCl pH 8.0,10 mmol/L Na2EDTA pH 8.0)充分悬浮菌体;200 μL新鲜配制的溶液II(1% SDS,0.2 mol/L NaOH,现用现配),快速、轻柔颠倒离心管数次;加150 μL溶液III(3 mol/L醋酸钾,pH 4.8),快速、轻柔颠倒离心管数次,12 000 r/min离心5 min,上清液转移至新管;加入与上清液等体积的酚、氯仿和异戊醇混合液(酚、氯仿和异戊醇的体积比为25∶24∶1),颠倒混匀,12 000 r/min离心2 min,上清液转移至新管;加2倍体积的无水乙醇,混匀,室温放置5 min;12 000 r/min离心5 min,去除上清液,收集质粒DNA;加1 mL、70%的乙醇洗涤沉淀,12 000 r/min离心2 min,去除上清液,吹风机冷风吹至乙醇挥发(或通风橱内风干);将获得的质粒DNA溶解于60 μL TE溶液(10 mmol/L Tris-HCl pH 8.0,1 mmol/L Na2EDTA pH 8.0),-20℃保存。
2.1.2 试剂盒方法
参照AxyPrep质粒DNA小量试剂盒说明书的步骤提取质粒DNA。取3 mL在LB培养基中过夜培养的菌液,12 000 r/min离心1 min,弃尽上清;加250 μL Buffer S1悬浮细菌沉淀;加250 μL Buffer S2,温和地、充分地上下翻转4~6次使菌体充分裂解;加350 μL Buffer S3,温和地、充分地上下翻转混合6~8次,12 000 r/min离心10 min;将上清液转移至制备管并置于2 mL离心管,12 000 r/min离心1 min,弃滤液;将制备管置回离心管,加500 μL Buffer W1,12 000r/min离心1 min,弃滤液;将制备管置回离心管,加700 μL Buffer W2,12 000r/min离心1 min,弃滤液;以同样的方法再用700 μL Buffer W2洗涤一次,弃滤液;将制备管置回2 mL离心管中,12 000 r/min离心1 min;将制备管移入新的1.5 mL离心管中,加入60 μL 65 ℃预热的Eluent,室温静置1 min,12 000 r/min离心1 min,-20 ℃保存。
2.2 超微量分光光度计检测质粒DNA
分别以TE缓冲液、洗脱液作为空白对照,利用Nanodrop 2000超微量分光光度计检测碱裂解法和试剂盒法两种方法提取的质粒DNA样品浓度,并根据A260/A280的比值判断质粒纯度,A为吸光度。
2.3 质粒DNA的快速单酶切
按照质粒DNA 2 μL(约500 ng)、Buffer 2.5 μL、ddH2O 19.5 μL、FastDigest EcoRI 1 μL配制25 μL的酶切体系,37 ℃温育15 min。通过单酶切,鉴定所提取的质粒DNA,进而判断其质量。
2.4 琼脂糖凝胶电泳检测质粒DNA
制备0.8%琼脂糖凝胶,以GelRed作为核酸染料,将2种方法提取的质粒DNA以及相应的酶切产物,各取2 μl进行电泳,比较2种方法提取的质粒DNA质量。
3 结果与分析
3.1 超微量分光光度计检测2种方法提取的质粒DNA
利用Nanodrop 2000超微量分光光度计检测质粒DNA浓度及其纯度,测得试剂盒法提取的质粒DNA的A260/A280比值为1.87,在1.8~2.0之间,说明纯度较高;测得DNA质量浓度为246.1 mg/μL。测得碱裂解法提取的质粒DNA的A260/A280比值为2.13,比值有点偏高,怀疑质粒DNA中有RNA污染,测得DNA质量浓度为4 093.4 mg/L,也是偏高,这是因为超微量分光光度计不能区分DNA和RNA,当DNA中存在RNA污染时,所检测的浓度值是不准的,需要通过琼脂糖凝胶电泳来进一步鉴定。
3.2 琼脂糖凝胶电泳检测2种方法提取的质粒DNA
将碱裂解和试剂盒两种方法提取的pCMV-Myc质粒以及各自经FastDigest EcoR I快速单酶切的产物进行琼脂糖凝胶电泳,结果如图1所示。从电泳结果可以看出:
(1) 2种方法提取的质粒DNA均呈现两条清晰的条带(见泳道2和4),一条带的泳动速度较快,是处于超螺旋构型的质粒DNA,后面有一条弱带的泳动速度稍慢,是线性状态的质粒DNA,2种方法提取的质粒DNA均主要以超螺旋构型存在;
(2) 质粒DNA经单酶切后位于3.8 Kb左右,与pCMV-Myc质粒实际大小相符;
(3) 碱裂解法提取的质粒DNA含有大量的RNA污染,而试剂盒法提取的质粒DNA纯度较高(见泳道1和3),与超微量分光光度计的检测结果相符;
(4) 根据条带亮度可以看出,碱裂解法提取的质粒DNA浓度稍低于试剂盒法,再次验证,当DNA中含有RNA污染时超微量分光光度计的浓度检测结果是不可靠的。
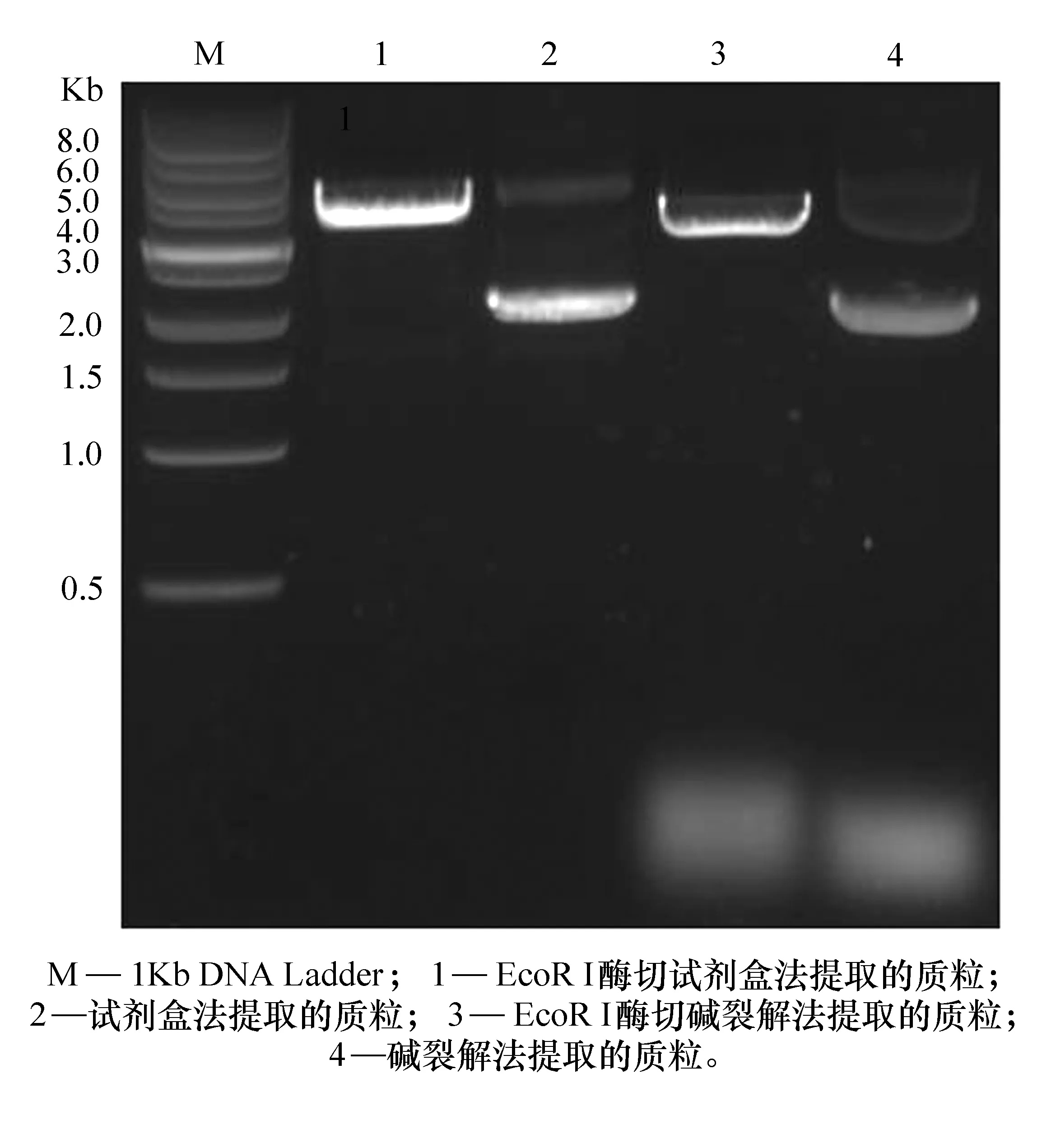
图1 质粒DNA的琼脂糖凝胶电泳
4 教学探讨
4.1 优化实验条件,提高实验效率
4.1.1 质粒的选用
对于大二年级的非生物类专业学生,本实验是他们第一次接触移液器,没有任何的使用基础,在这种情况下进行质粒的提取其难度可想而知。为使实验效果明显,显著提高实验的成功率,实验课程中采用了pCMV-Myc质粒,在菌体内拷贝数较高,试剂盒提取质量浓度一般在200~500 mg/μL之间。
4.1.2 改良经典碱裂解法提取质粒DNA
(1) 经典碱裂解法是在最后一步溶解质粒的TE中加入RNase A,改良后,将RNase A直接加入溶液I中。一方面在质粒提取的过程中即可进行RNA的消化,节约实验时间;另一方面避免RNase A带来的蛋白污染。RNA和蛋白污染的有效降低均利于后续的酶切分析。
(2) 经典碱裂解法中,加入溶液II和III后,需要冰浴总计10~20 min。改良后,所有的实验操作均在室温下进行,加入溶液II和III后,无需冰浴,轻柔、颠倒混匀数次后直接离心即可,时间可缩短10~20 min。
改良碱裂解法提取的质粒DNA可以满足一般的实验教学需求,且有效节约了实验时间,为实验的可行性改革争取了宝贵的实验时间。
4.1.3 选用快速限制性内切酶
pCMV-Myc质粒(见图2)有多个单酶切位点,综合考虑实验课学时和价格因素,采用了当前科研实验室中非常常用的快速限制性内切酶EcoRⅠ,只需要5~15 min就可以完成整个酶切过程。而普通的限制性内切酶一般需要2~3 h,此举可大大节约实验时间,提高实验效率。
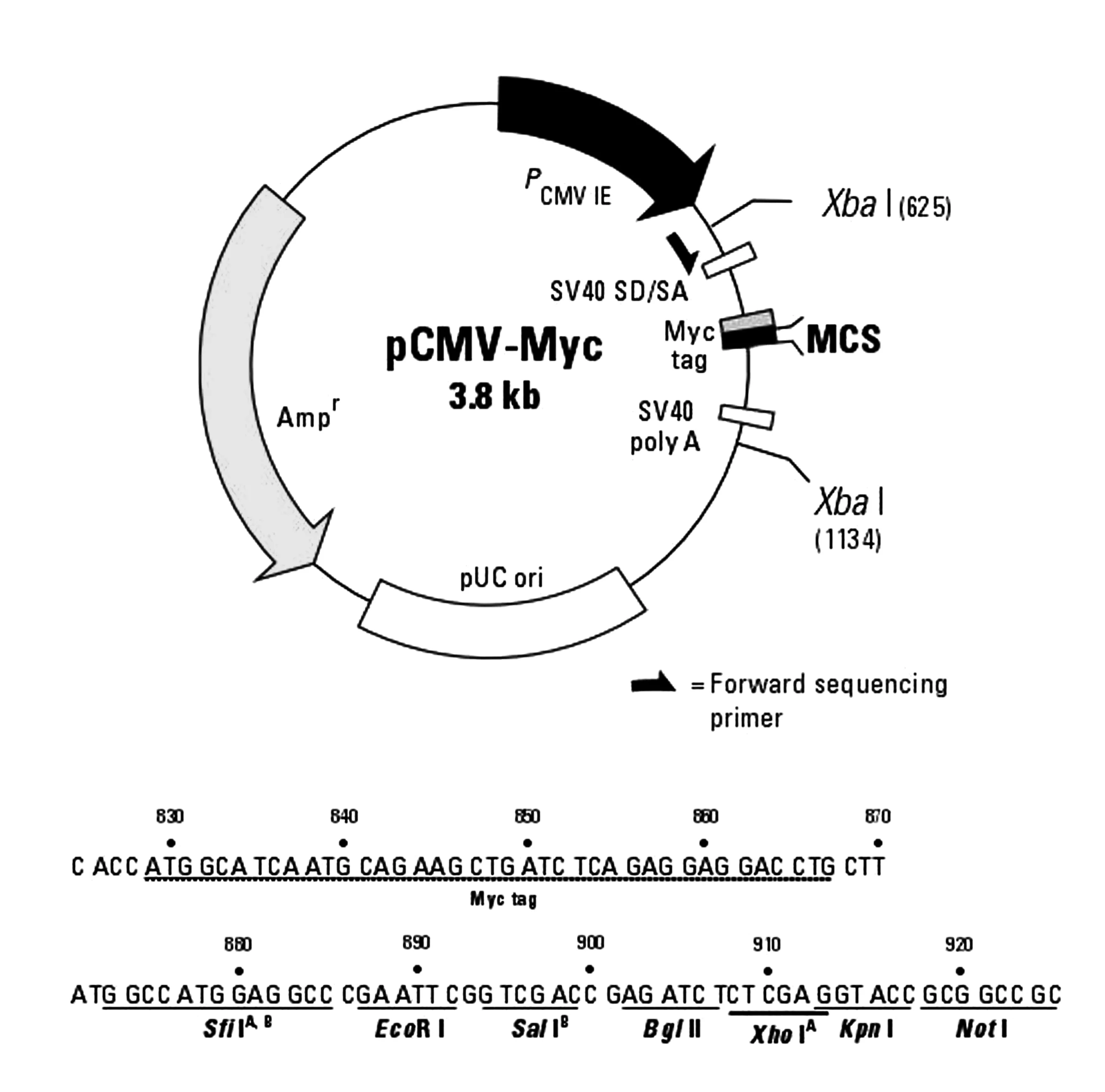
图2 pCMV-Myc质粒示意图
4.2 课程安排
由于受基础实验课课时限制,改进后的实验被拆分为2个独立的实验项目进行授课,即质粒DNA的提取和质粒DNA的质量检测,总计8学时。
在质粒DNA的提取实验中,学生先采用碱裂解法提取质粒,在用乙醇沉淀质粒DNA后,将乙醇吹至挥发的时间内,进行试剂盒方法提取质粒DNA,计4学时。
在质粒DNA的质量检测实验中,先用超微量分光光度计检测两种方法提取的质粒DNA浓度及其纯度,然后根据浓度配制相应的酶切体系。在酶切消化的15 min内配制琼脂糖凝胶,酶切结束,点样、电泳,最后凝胶成像系统扫描成像,计4学时。
4.3 教学效果
4.3.1 促进经典与现代技术、方法的有机结合
碱裂解法是提取质粒DNA的经典方法,其他许多提取方法其实是在碱裂解法的基础上加以改进[13-14]。本实验采用的质粒DNA小提取试剂盒也是采用改进的碱裂解法,只不过Buffer S1、S2、 S3替代了传统的溶液I、II、III,而后质粒DNA选择性的吸附在DNA制备膜上。由于试剂盒方法提取质粒DNA的纯度和浓度能够满足科研中测序、体外转录、限制性内切酶消化、细菌转化等实验要求,且省时省力,因而目前在国内外科研实验室应用广泛。试剂盒法虽然优点诸多,但是将其直接应用到本科实验教学中,却存在着如下的明显不足:由于受专利保护等因素,Buffer S1、S2、S3等主要试剂的具体成分未知,这非常不利于学生对实验原理的理解和掌握。
改革后的实验将碱裂解和试剂盒2种质粒DNA提取方法有机地结合在一起,学生可以通过明确碱裂解法中每种试剂的作用,来推测试剂盒中每种试剂的基本成分及其作用。这种以经典理论“武装”现代技术、“取长补短”的教学方式不仅有利于加强学生对理论知识的深入理解,而且开拓视野,有助于学生在今后的科研工作中根据自身发展需要灵活选择和运用所学的知识、方法和技术。
4.3.2 增强学科间相互融合
学科间相互渗透和交叉、碰撞所产生的火花是科学发展的驱动力之一,也是许多创新性学科论点与方法产生的源泉[15]。因此教学中,在使学生学习基本的生物化学实验技术、了解与生物相关的研究方法和实验设计思路基础上,课程组充分利用学科交叉切入点,有意引导学生将专业知识与生命科学知识多角度、多层次进行关联和整合,为他们未来的研究工作产生新思路、开拓新领域打下基础。
除在课堂上引导、鼓励外,精心设计课后思考题,比如有:(1)从专业角度出发,探讨质粒DNA在自身专业领域的应用;(2)质粒DNA提取纯化技术的新进展;(3)试剂盒法在Buffer S1中加入了RNase A,而碱裂解法也同样在溶液I中加入了RNase A,为什么试剂盒方法提取的质粒DNA纯度较高,而碱裂解法提取的质粒DNA却含有大量的RNA污染?(4)超微量分光光度计与琼脂糖凝胶电泳两种质粒DNA检测方法各有什么优缺点?(5)改良的质粒DNA提取方法有哪些?如何改进?
考虑到学生的学习背景,不同专业的学生可任选其中一个自己感兴趣的思考题,结合课上讲解及课后进行相关文献资料的查阅,写一篇150字左右的小综述,学期末之前上交。该小综述的成绩为本课程考试成绩的理论部分成绩,占比为20%。通过引导学生从自身学科角度出发去发现问题、分析问题直至提出自己的见解,有利于加深学生对学科间相互渗透和相互影响的理解,使其对知识的再创造能力成为可能。
5 结语
根据基础实验课的教学特点,结合授课对象的专业背景和发展需求,对传统的、经典的质粒DNA提取及电泳检测实验进行再开发和改进,并重新设计了实验方案。改革后的实验不仅将经典实验与现代技术、方法的有机结合,而且进一步增强学科间的相互交叉和渗透,有利于提高学生灵活运用多学科知识与方法的能力,值得推广。
References)
[1] 张波,李晨,董慧,等.1种快速高效提取乳酸菌质粒的方法[J].中国食品学报,2014,14(9):7-12.
[2] 金磊.酶切法鉴定质粒的亚型[J].生物学通报,2015,50(1):48-49.
[3] 李亮,柳方方,宛煜嵩,等.基于色谱法的超螺旋质粒DNA纯化与分析进展[J].分析测试学报,2014,33(9):1089-1094.
[4] 李登文,赵立青.提高基础生物化学实验课教学质量的实践和探索[J].实验室科学,2008,11(1):39-40.
[5] 胡岸,吴婷,陈翀,等. 大肠杆菌菌蜕装载质粒DNA实验方法的优化[J].生物技术通报,2014,25(4):532-536.
[6] 胡东,杨小康,王婉,等. pCMV-LC3-Ag85B重组质粒DNA疫苗对结核的免疫保护作用[J].细胞与分子免疫学杂志,2014,30(11):1133-1136.
[7] 沈平,李昂,章秋艳,等.转基因产品标准物质概述DNA[J].中国生物工程杂志,2015,35(4):107-111.
[8] 许丽,梁文,李妍,等. 一种质粒 DNA 标准物质的定值数据统计及不确定度评定[J].中国测试,2014,40(增刊):9-13.
[9] 单志,周中午,吴琦,等.磁珠分离法快速提取大肠杆菌质粒DNA[J].四川农业大学学报,2011,29(2):230-234.
[10] 刘曼丽,张玉玉,刘春巧,等. 超顺磁性Fe3O4@SiO2空心亚微球的制备及其在质粒DNA分离纯化中的应用[J].北京化工大学学报(自然科学版),2016,43(2):58-62.
[11] 张平静,李忠明,刘庆良. 一种简便易行核酸疫苗质粒纯化工艺的开发[J].中国生物工程杂志,2011,31(4):106-112.
[12] 于自然,黄熙泰,李翠风.生物化学习题及实验技术[M].北京:化学工业出版社,2003.
[13] 王勇,袁华,刘国磊,等.改进的碱裂解法大规模提取质粒DNA[J].数理医药学杂志,2010,23(5):519-520.
[14] 徐艳,李茵. 碱裂解法提取P.ananatis变异体质粒DNA改良研究[J].安徽农业科学,2011,39(16):9522-9524.
[15] 卢建飞,吴太山,吴书光,等.基于交叉学科的研究生创新人才培养研究[J].中国高教研究,2006(1):46-48.
Reform on experiment of plasmid DNA extraction and electrophoresis detection
Zhao Yuhong1,Li Xin1, Cui Jianlin2,Zhao Liqing1,Li Dengwen1,Zhang Jinhong1,Zhou Hao1
(1. Biological Experimental Center,Nankai University,Tianjin 300071,China;2. College of Medicine,Nankai University,Tianjin 300071,China)
In order to further enhance the intercross and penetration of different disciplines and improve the students’ ability to use the multi-disciplinary knowledge and methods flexibly, the reform on the experiment of plasmid DNA extraction and electrophoresis detection is carried out. Based on the extraction of plasmid DNA by the improved classical alkaline spitting method and the detection of plasmid DNA by agarose gelelectrophoresis, the experimental contents are newly increased such as the extraction of plasmid DNA by the new kitmethod, the detection of plasmid DNA by ultra micro-spectrophotometer, rapid single enzyme digestion identification of plasmid DNA, etc. After the reform, the experiment not only promotes the combination of classical technologies and methods with the modern ones, but also enhances the mutual integration of disciplines, achieving good teaching effect.
plasmid DNA extraction; plasmid DNA detection; electrophoresis detection
10.16791/j.cnki.sjg.2017.03.010
2016-09-19 修改日期:2016-10-31
国家基础学科人才培养基金“条件建设项目”(J1310003);南开大学2014年教学改革项目
赵玉红(1981—),女,山东青岛,硕士,实验师,从事生物化学和分子生物学实验教学工作
E-mail:zyh@mail.nankai.edu.cn
周浩(1981—),男,湖北荆门,博士,副教授,从事蛋白质结构与功能研究以及基于蛋白质结构的工程应用.
E-mail:haozhou@nankai.edu.cn
G642.0;Q503
B
1002-4956(2017)3-0035-04
