重金属胁迫下白骨壤数字基因表达谱分析
2017-04-19袁长春莫健新袁柳娇余如凤钟军弟刘锴栋
袁长春,莫健新,袁柳娇,余如凤,刘 倩,钟军弟,刘锴栋
(1.岭南师范学院生命科学与技术学院,广东 湛江 524048; 2.广州基迪奥生物科技有限公司,广东 广州 510006)
重金属胁迫下白骨壤数字基因表达谱分析
袁长春1*,莫健新1,袁柳娇1,余如凤1,刘 倩2,钟军弟1,刘锴栋1*
(1.岭南师范学院生命科学与技术学院,广东 湛江 524048; 2.广州基迪奥生物科技有限公司,广东 广州 510006)
[目的]从转录组水平研究重金属污水胁迫处理下白骨壤的基因表达变化,以揭示白骨壤响应重金属污染胁迫的机制。[方法]采用基于高通量测序的数字基因表达谱(DGE)技术对重金属污水胁迫处理组和对照组白骨壤材料进行转录组测序分析。[结果]与对照组相比,重金属处理下白骨壤共有10 459个差异表达基因,其中,8 685个表达量上升,1 774个表达量下降。MeV聚类表明:大部分基因在重金属处理样本中的表达量受到极大的诱导。GO功能注释发现,差异表达基因主要定位于叶绿体以及细胞内各种膜结构,参与“细胞代谢”、“细胞组分的组合和生物合成”、“对刺激的响应”等过程。KEGG 代谢通路分析显示,差异表达基因分布于126条Pathways,涉及“核糖体”、“光合作用”、“乙醛酸盐代谢”、“丙酮酸代谢”等途径。重金属胁迫还促进萜类、黄酮类化合物生物合成的关键酶基因(牻牛儿基焦磷酸合酶(0009238)、黄酮醇合成酶(0001833))的表达,进而促进白骨壤有效成分的积累;显著诱导细胞分裂素水解酶编码基因CKX7(0057124)、油菜素内脂信号转导组分基因BSK(0043741)等的表达,进而提高白骨壤对重金属胁迫的适应能力。此外,转录因子分析发现,bHLH、NAC、MYB-related和WRKY在重金属胁迫中发挥重要作用。实验选取8个与环境刺激响应密切相关的基因,通过qRT-PCR验证了它们在重金属污水胁迫处理下的表达差异,结果与数字基因表达谱分析的结果较一致,证实了差异表达基因数据的有效性。[结论]重金属处理影响了白骨壤大量的新陈代谢、光合作用、小分子酸合成、激素合成与信号转导及次生代谢产物合成相关基因的表达。
白骨壤;重金属胁迫;数字基因表达谱(DEG);差异表达基因;机制
随着我国沿海地区工农业的快速发展以及城市化区域的不断扩大,工农废水和生活污水的排放量越来越大。大量污水涌入江河海湾造成了很大的环境压力[1]。红树湿地系统处在陆地向海洋的过度带,对各种污染物有很强的吸附能力,具有净化污水、沉积污染物的能力[2-4];然而,污水排放对红树植物的正反影响效应存在较大的争议。一方面,污水排放能为红树植物带来丰富的营养物质,促进红树的生长;另一方面,污水中重金属污染物的胁迫作用对红树植物存在一定的不利影响,减缓红树植物的生长发育。因此,探究红树植物响应污染胁迫的机制是当前研究的热点[5]。有研究表明,红树植物能够通过多种途径应对重金属胁迫,如:根部发达的凯氏带可以防止重金属离子向地上部分转运;植物体内的小分子有机酸等物质可以将重金属沉淀于细胞壁或局限于液泡等细胞器;通过增强植物体自身抗氧化系统活性或促进各种抗氧化物质合成来清除重金属胁迫下产生的大量活性氧自由基[6-8];然而,这些研究大多停留在生理层面,从分子层面分析重金属胁迫处理对红树植物生长影响的研究鲜有报道[9-10]。
数字基因表达谱(DGE)是一种高效的高通量测序技术,DEG能用于分析某一物种特定组织在特定条件下基因的表达情况。通过对差异基因涉及到的生物学过程进行搜索、比较和分析,可预测基因的表达模式和蛋白质的功能等信息。目前,已有学者利用该技术在转录水平分析了美洲黑杨(PopulusdeltoidesMarsh)、泡泡刺(NitrariasphaerocarpaMaxim.)、花生(ArachishypogaeaLinn.)等植物基因表达谱[11-13]。如,赖晓娟等[14]通过分析坛紫菜(PyropiahaitanensisRhodophyta)的数字基因表达谱,筛选出了256个上调表达基因和3 820个下调表达基因,证明了高温胁迫对坛紫菜的生长发育有一定的抑制作用,但同时也诱导了补救途径。
作为常见的红树林优势树种白骨壤(Avicenniamarina(Forsskål) Vierhapper)广泛分布于陆地向海洋过渡的潮间带,在我国分布于海南、广东、广西等省的滨海地区。白骨壤能耐受一定浓度的污染胁迫,可在污水污染的潮间带生长[15]。有研究表明,白骨壤模拟湿地系统可对污水起到很好的净化效应,在栽种白骨壤植物的土壤子系统中,重金属积累含量显著降低[16]。进一步研究表明,白骨壤正是通过调控湿地系统中氮、磷的分配、循环达到净化作用[17-18]。周涵韬等[19]通过mRNA差异显示技术,分离得到了白骨壤耐盐相关cDNA,为揭示白骨壤盐胁迫响应机制打下了基础。本文采用基于高通量测序的数字基因表达谱技术研究污水胁迫处理下白骨壤的基因表达变化,从分子层面分析白骨壤对重金属污染胁迫的耐受机制,为深入研究重金属污水胁迫对红树植物生长的影响机制提供参考。
1 材料与方法
1.1 实验试剂与仪器
Hoagland营养液;人工污水;Trizol试剂盒(TaKaRa, 大连,中国);琼脂糖;寡聚(dT)-纤维素;片段化缓冲液(fragmentation buffer);dNTPs;六碱基随机引物;RNase H;DNA polymerase I;QiaQuick PCR试剂盒;EB缓冲液;PrimeScriptTMRT Master Mix (TaKaRa,大连,中国);SYBR Green supermix;PCR仪型:Bio-Rad CFX96 touchTM。
1.2 白骨壤材料处理和收集
1.3 总RNA提取和基因表达谱测序
采用Trizol法提取污水胁迫处理组和对照组白骨壤叶片样品的总RNA,对照和处理各3份生物学重复;然后,将对照和处理的各自3份RNA样品等量混合,由广州基迪奥公司构建测序文库,采用Illumina HiSeqTM 2000平台进行转录组测序。
1.4 差异表达基因的筛选
基因的表达量由比对到基因表达区域序列的readcount频率来估算,通过edgeR软件对得到的readcount数据进行差异分析,以筛选差异表达基因。本实验差异基因筛选标准为P-value<0.05,|log2Fold Change|>1,其中,Fold Change 为污水胁迫处理样本与对照样本中各基因表达量的比值。对于差异表达基因,其log2Fold Change>0时,认为该差异表达基因是上调的;反之,若log2Fold Change <0,则认为该差异表达基因是下调的。
1.5 Gene Ontology (GO) 基因功能注释和KEGG代谢通路分析
采用GO数据库(http://www.geneontology.org/)对污水胁迫处理下白骨壤的差异表达基因进行GO功能富集显著性分析。采用GOseq方法计算得到一个特定的P-value。一般校正后的P-value≤0.05,表示差异表达基因在该GO中出现了富集。同时,使用KOBAS(2.0)软件对差异基因进行KEGG 代谢通路富集性分析,当FDR(错误发现率)≤0.05时,表示该通路中差异表达基因富集显著。
1.6 qRT-PCR验证


表1 引物序列
2 结果与分析
2.1 测序质量分析
分析白骨壤数字基因表达谱测序数据发现,重金属污水胁迫处理样品和对照样品测序所得数据,经过滤筛除含有接头和低质量部分后,得到高质量Clean reads的比例分别为98.26%、98.23%,证明测序质量较高。将得到的Clean reads与参考基因比对,对照样本和重金属污水胁迫处理样本分别有89.20%和87.45%的Clean reads可比对上参考基因,这为白骨壤转录组序列的注释打下了结实的基础。测序结果提交到Genebank,登录号为SRA487295。
饱和度是用来衡量单一样本测序得到的基因数量是否覆盖全基因组的标准,检测所得的基因数量随测序量的增加而增加,当测序量接近基因组的大小时,其检测到的基因总数达到峰值,表明检测到的基因数已基本覆盖全基因组。本研究中,对照样本和污水胁迫处理样本的Reads数量超过10 M时,检测到的基因数量趋于饱和,而实验中2个样品的测序量分别为25.26、25.64 M,证明绝大部分基因已被检测到。随机性分析表明:各样本的Reads呈正态分布,具有很高的随机性。上述结果表明:本次测序结果能够较好地反映各样本中基因表达的真实情况,可用于分析重金属污水胁迫处理下白骨壤基因的表达变化。
2.2 差异表达基因筛选
MeV聚类分析显示:聚在同一类的基因表达量在对照样本和重金属污水胁迫处理样本间差异极大,大部分基因表现为在污水胁迫处理样本中的表达量比对照样本中的高。
通过比较对照样品与重金属污水胁迫处理样品基因表达谱,共筛选出10 459个差异表达基因,其中,有8 685个基因表达量增加,1 774个基因表达量减少,表明重金属污水胁迫处理极大的诱导了白骨壤基因的表达。
2.3 差异表达基因GO功能显著性富集分析
将白骨壤差异表达基因比对到GO数据库,共得到2 041条terms,其中,“分子功能”514条,占25.18%;“细胞组分”202条,占9.90%;“生物学过程” 1 325条,占64.92%。以P-value≤0.01为标准筛选极显著富集条目,共得到230条,其中,“分子功能”39条,“细胞组分”46条,“生物学过程”145条。对差异表达基因GO功能分类发现,大部分类别中,表达量上调的基因数比表达量下调的基因数多,其中,与“生物学过程”相关的差异表达基因主要涉及“代谢过程”、“对刺激因素的响应”、“区域化”、“生物调节”等过程,与“分子功能”相关的差异表达基因主要与“结构分子活性”、“转运体活性”、“催化活性”、“结合活性”等分子活性相关,与“细胞组分”相关的差异表达基因主要与“细胞器组分”、“细胞组分”、“大分子复合物”、“膜组分”等结构相关。此外,重金属污水胁迫处理还提高了白骨壤的“抗氧化因子”、“蛋白质结合转录因子”、“核酸结合转录因子”、“电子载体”、“鸟嘌呤核苷酸交换因子”等关键因子的活性,进而影响“生物粘附”、“ 信号传导”、“ 多细胞调节”等过程。
2.4 KEGG 代谢通路显著性富集分析
通过KEGG 代谢通路富集分析,可以揭示差异表达基因参与的主要生理活动途径。结果表明:重金属污水胁迫处理下,白骨壤差异表达基因辐射到126条Pathway中。从表2可以看出:在P≤0.05显著性富集的20条Pathway中,富集在“核糖体途径”的基因数量最多,共有409个差异表达基因;其次是“碳代谢途径”,富集了303个差异表达基因。“乙醛酸盐代谢”途径、“光合生物固碳途径”和“丙酮酸代谢途径”也是3个显著性富集的代谢途径,分别富集了107、103、113个差异表达基因,占差异表达基因总数的6.32%、6.08%、6.67%。此外,在“苯丙环素的生物合成”、“氮素代谢”、“光合作用”、“脂肪酸代谢”、“氨基酰-tRNA的生物合成”、“半乳糖代谢”等途径也富集了一定数量的差异表达基因。
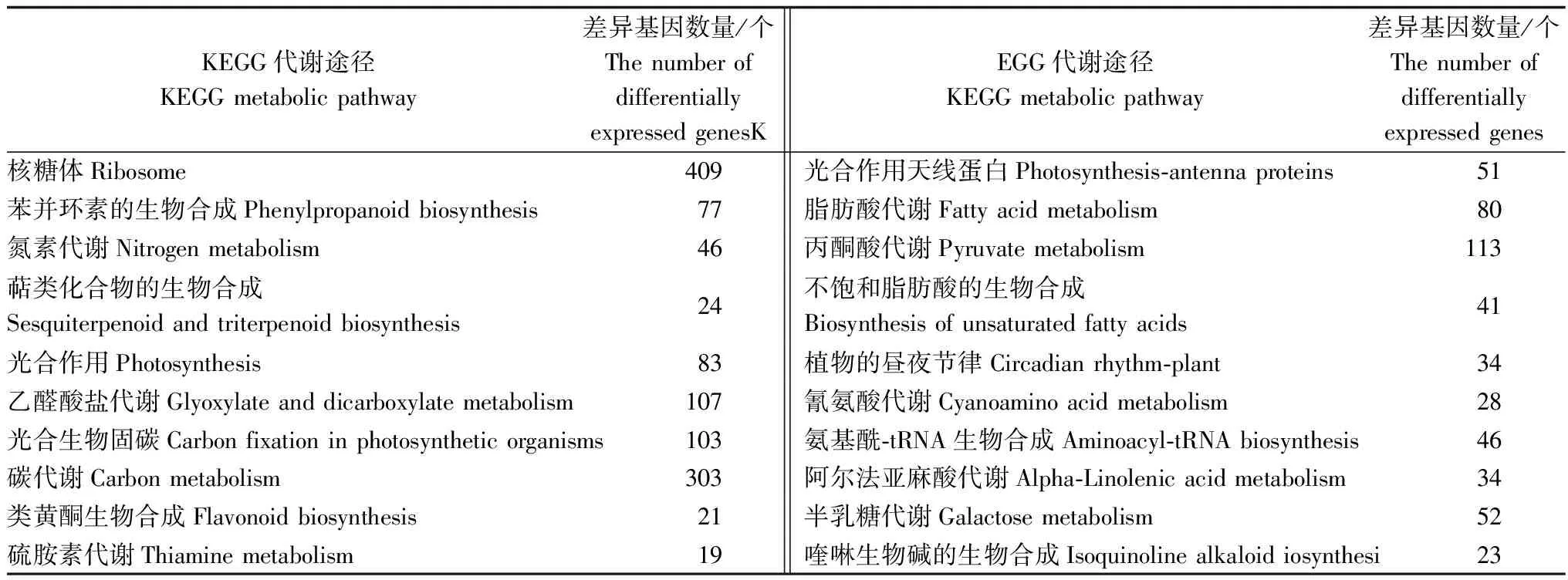
表2 KEGG代谢通路富集分析
2.5 污水胁迫处理对白骨壤激素合成、运输和信号途径基因的表达调控
植物激素是一类参与植物生长发育、代谢和环境响应的重要化学物质[20]。通过对白骨壤DEG分析,得到了生长素、乙烯、细胞分裂素、脱落酸、赤霉素和油菜素内脂等一系列激素相关基因的表达差异情况,并分析了污水胁迫对上述基因的影响。结果(表3)表明:在污水胁迫处理下,一个生长素上调小RNA基因SAUR(0052024)显著上调。多个乙烯信号途径基因也得到了分析,其中,乙烯不敏感3基因EIN3(0016997)的表达保持稳定,而乙烯响应转录因子1基因ERF1(0013995)的表达受到污水胁迫的明显诱导。众多细胞分裂素基因的表达受到污水胁迫的显著影响,如细胞分裂素脱氢酶7基因CKX7(0057124)的表达显著上调,而一个富含组氨酸的磷酸转移蛋白1基因AHP1(0029198)的表达受到极大的抑制。另一个内源细胞分裂素相关基因玉米黄质环氧化酶基因ZEP(0021189)在污水胁迫处理下表达水平也显著上调。在脱落酸途径中,一个脱落酸不敏感5基因ABI5(0061511)的表达显著上调。最后笔者发现,油菜素内脂的一个信号转导组分基因——油菜素内酯信号激酶基因BSK(0043741)的表达受到极大的诱导。

表3 激素相关基因在污水胁迫下的表达变化
2.6 污水胁迫处理影响白骨壤刺激代谢关键酶编码基因的表达
通过KEGG分析发现:污水处理可显著影响白骨壤中萜类和黄酮类次生代谢相关基因的表达(表4),其中,萜类物质生物合成的限速酶牻牛儿基焦磷酸合酶(0009238)、甲基赤藓醇磷酸胞苷酰转移酶(0057458)和1-脱氧-D-木酮糖-5-磷酸还原异构酶(0025369)的表达都受到污水胁迫的显著诱导。另外,黄酮类生物合成的几个关键酶,如:黄酮醇合成酶(0001833)和查尔酮合成酶(0000917)的编码基因表达水平也受到明显的诱导。大量次生代谢相关基因的上调表达,暗示污水胁迫可能加速白骨壤内次生代谢产物的积累。

表4 次生代谢相关基因在污水胁迫下的表达变化
2.7 重金属污水胁迫下的转录因子分析
一系列转录因子家族成员在植物环境胁迫响应中起到了重要的作用[21]。基于模式植物拟南芥(Arabidopsisthaliana(L.) Heynh.)转录因子数据库,笔者对白骨壤转录组进行比对和注释,一共鉴定到了分属于56个常见家族的6 662个转录因子,转录因子家族及其包含的家族成员数据见表5。研究发现:bHLH、NAC、MYB_related、WRKY等家族在白骨壤中拥有大量的成员。此外,一批与激素相关的转录因子家族也得到了鉴定,如ARF、ERF、ARR-B等;一些与植物环境胁迫密切相关的转录因子家族也得到了不同程度的分析,如bZIP、GATA家族。鉴定转录因子家族,有利于形成一个完整的调控网络,揭示白骨壤污水胁迫响应的分子机制。
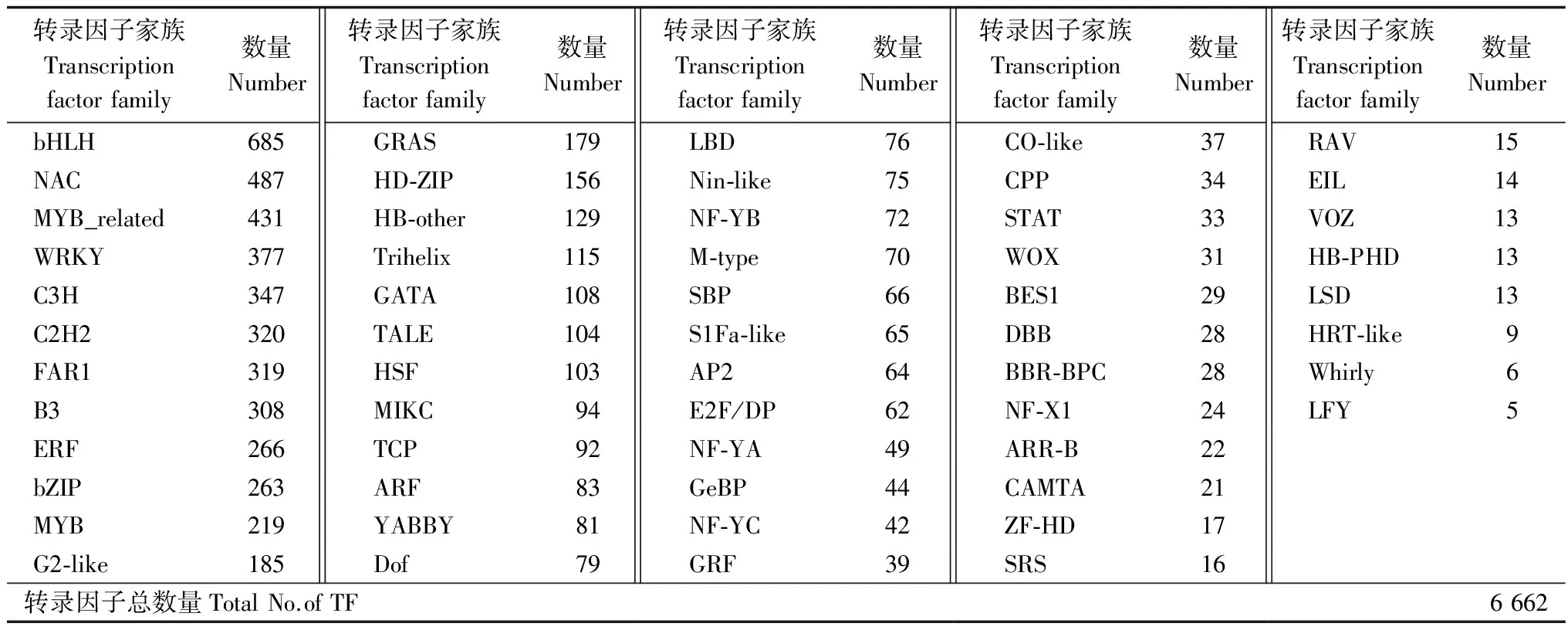
表5 转录因子分析
2.8 差异表达基因qRT-PCR验证
为了验证测序数据的可靠性,笔者选择显著富集的GO分类条目“GO:0016491”、“GO:0005198”、“GO:0016866”和“GO:0003723”中的8个差异表达基因进行qRT-PCR分析,这8个基因分别是:0003922、0048831、0026527、0053069、0020253、0055711、0016422和0049777,它们都是白骨壤中参与基础代谢的关键基因。实验结果表明:这8个基因的qRT-PCR结果与数字基因表达谱中检测到的表达趋势有较高的一致性。
3 讨论
重金属污染是影响植物生长发育较为严重的逆境。植物在长期进化过程中,响应重金属胁迫而形成了特定的生长习性和形态、生理特征。作为一种有代表性的红树植物,白骨壤对污染胁迫表现出极强的耐受性[9],展开对白骨壤的转录组分析,有利于从基因层面揭示红树植物耐受污染胁迫的机制。在本研究中,污水胁迫处理下,白骨壤的差异表达基因大部分上调表达,说明白骨壤可能通过提高自身转录水平应对污染胁迫,并增强适应能力。GO显著性分析发现,“代谢过程”共富集了1 792个上调表达基因,178个下调表达基因;KEGG代谢通路显著性分析表明,“核糖体”、“氮素代谢”、“碳代谢”、“丙酮酸代谢”、“脂肪酸代谢”等途径中富集了大量的差异表达基因(大部分为上调基因),说明白骨壤可能通过上调表达与基本代谢相关的基因来加快有害物质的新陈代谢,从而增强自身对污染胁迫的耐受能力。
光合作用的强弱能反映植物体对外界环境变化的适应情况。微量的重金属能刺激红树植物叶绿素的合成,使光合作用增强,以提供更多的能量促进植物体的生长[22];然而,红树植物对污染胁迫也有一定的耐受范围,当胁迫浓度超过其耐受的上限时,会抑制叶片的光合作用。用大于30 mg·kg-1的Cd处理桐花树(Aegicerascorniculatum(Linn.) Blanco)发现,叶片细胞内膜结构被破坏,叶绿素含量降低[22];另有报道,在高浓度Hg2+(50 mg·L-1)处理下,白骨壤幼苗叶片净光合作用的速率降低[23]。此外,黄国勇等[24]报道,增加复合重金属的胁迫浓度,秋茄(Kandeliacandel(L.) Druce)叶片叶绿素的合成量下降加剧。原因可能是重金属离子与叶绿素合成酶的功能结构域结合,阻碍它们发挥作用。另外,重金属离子也能加快叶绿素的分解速率。在本研究中,KEGG 代谢通路分析发现,“光合作用途径”中富集了83个差异表达基因,说明在污染胁迫下白骨壤可能通过调节与光合作用相关基因的表达,以维持叶绿素的正常合成和叶绿体的结构完整性,从而使光合作用得以正常进行。
大量研究表明,激素作为植物体内一类重要的化学成分参与植物的抗逆反应[25]。在白骨壤的DEGs(差异表达基因)中,鉴定得到一批与激素相关的基因,它们的表达水平受到污水胁迫处理的调控。在拟南芥(Arabidopsisthaliana(L.) Heynh.)和甘草(GlycyrrhizauralensisFisch.)中,镉、铜或者汞胁迫显著诱导了ERF家族基因的表达[26-27]。本研究中,一个乙烯响应转录因子ERF1(0013995)受到诱导,这与模式植物的表达情况一致。脱落酸是已知的逆境激素,张春荣等[27]发现,干旱胁迫显著诱导ABA生物合成关键酶ZEP基因和信号转导组分ABI5基因的表达。在本研究中,细胞分裂素相关基因玉米黄质环氧化酶ZEP(0021189)和脱落酸不敏感基因ABI5(0061511)都受到重金属污水胁迫的显著诱导。重金属胁迫显著促进了白骨壤乙烯、细胞分裂素的生物合成和信号转导,这有可能进而促进根的发生和细胞增殖,从而提高胁迫下的植株适应能力。
环境胁迫往往会导致一些次生代谢产物的积累,研究白骨壤次生代谢相关基因的表达,有助于揭示次生代谢途径参与白骨壤环境胁迫的分子机制[28]。在众多的次生代谢成分中,黄酮类和萜类物质与环境胁迫的联系最紧密。有报道称,多种环境胁迫可以诱导黄酮类植物在植物体内的积累[29]。通过对差异表达基因的分析,笔者发现,与黄酮和萜类化合物次生代谢相关的关键基因的表达都受到污水胁迫处理的一致上调,其中,黄酮合成的2个上游酶编码基因:黄酮醇合成酶(0001833)和查尔酮合成酶(0000917)都受到明显的诱导。这进一步说明,积累的次生代谢产物有助于白骨壤污水胁迫耐受性的形成。
前期的研究表明,一系列转录因子参与了植物对环境胁迫的响应。作为植物中最大的家族之一, MYB类转录因子广泛参与植物次生代谢调控、细胞形态发生、胁迫应答、分生组织形成及细胞周期控制等[30]。在白骨壤中,笔者一共鉴定得到219个MYB转录因子和431个MYB-related转录因子。NAC家族转录因子也被认为是一类重要的胁迫调控因子。OsMAC5和OsNAC6都是水稻(OryzasativaL.)响应生物及非生物胁迫的关键因子,它们与植物的胁迫耐受性密切相关[31-32]。在白骨壤中,可能的NAC转录因子一共有487个。以上结果为进一步分析转录因子家族在白骨壤污水胁迫中的响应机制奠定基础。
4 结论
本实验以重金属处理下的白骨壤差异基因表达谱为基础,得到了大量重金属响应基因,并预测了这些基因可能的生物学功能。笔者分析表明,重金属处理影响了白骨壤大量的新陈代谢、光合作用、小分子酸合成、激素合成与信号转导及次生代谢产物合成相关基因的表达。白骨壤对重金属胁迫响应机制具有极高的复杂性,深入研究一些关键基因将有助于全面了解其分子机制。
[1] 丘耀文,余克服. 海南红树林湿地沉积物中重金属的累积[J]. 热带海洋学报, 2011, 30(2): 102-108.
[2] 万 璐,康丽华,廖宝文,等.红树林根际解磷菌分离、培养及解磷能力的研究[J]. 林业科学研究,2004,17(1):89-94.
[3] Li R L, Chai M W, Qiu G Y. Distribution, fraction, and ecological assessment of heavy metals in sediment-plant system in Mangrove forest, South China Sea[J]. PLoS One,2016, 11(1): e0147308.
[4] 白保勋,樊 巍,卞新民,等.生活污水胁迫对Ⅰ-72杨树人工林的影响[J].林业科学研究,2010,23(4):602-606.
[5] 陈桂葵, 陈桂珠, 黄玉山, 等. 人工污水对白骨壤生长的影响[J]. 海洋环境科学, 2003, 22(3): 39-43.
[6] 程 皓, 陈桂珠, 叶志鸿. 红树林重金属污染生态学研究进展[J]. 生态学报, 2009, 29(7): 3893-3900.
[7] MacFarlane G R, Burchett M D. Zinc distribution and excretion in the leaves of the grey mangrove,Avicenniamarina(Forsk) Vierh[J]. Environmental and Experimental Botany, 1999, 41: 167-175.
[8] Zhang Z W, Xu X R, Sun Y X,etal. Heavy metal and organic contaminants in mangrove ecosystems of China: a review[J]. Environ Sci Pollut Res Int, 2014, 21(20):11938-11950.
[9] 陈昌徐, 陆志强, 章耕耘, 等. 镉与萘复合胁迫对红树植物白骨壤幼苗萌芽及生长的影响[J]. 热带亚热带植物学报, 2016, 24(1):80-86.
[10] 陆俊锟,康丽华,陈 俊,等.华南三地红树林土壤微生物及其与土壤化学性质的相关性研究[J].林业科学研究,2008,21(4):523-527.
[11] 丁昌俊, 张伟溪, 高 暝, 等. 不同生长势美洲黑杨转录组差异分析[J]. 林业科学, 2016, 52(3):47-58.
[12] 马 婧, 邓 楠, 褚建民, 等. 泡泡刺高通量转录组鉴定及其黄酮类代谢途径初步分析[J]. 林业科学研究, 2016, 29(1):61-66.
[13] 孙爱清, 张杰道, 万勇善, 等. 花生干旱胁迫响应基因的数字表达谱分析[J]. 作物学报, 2013, 39(6): 1045-1053.
[14] 赖晓娟, 严小军, 杨 锐, 等.高温胁迫下坛紫菜的数字基因表达谱研究[J]. 海洋学报, 2014, 36(6):104-111.
[15] Wang L Y, Wang Y S, Zhang J P,etal. Molecular cloning of class III chitinase gene fromAvicenniamarinaand its expression analysis in response to cadmium and lead stress[J]. Ecotoxicology, 2015, 24:1697-1704.
[16] 陈桂珠,陈桂葵,谭凤仪,等. 白骨壤模拟湿地系统对污水的净化效应[J]. 海洋环境科学, 2000, 19(4):23-26.
[17] 陈桂葵,陈桂珠. 白骨壤模拟湿地系统中磷的分配循环及其净化效应[J]. 生态学报, 2005, 25(3):627-632.
[18] 陈桂葵,陈桂珠. 模拟分析白骨壤湿地系统中Ni的分配循环及其净化效果[J]. 海洋环境科学, 2005, 24(4):16-19.
[19] 周涵韬,林 鹏. 利用mRNA差别显示技术分离盐胁迫下红树植物白骨壤耐盐相关cDNA[J]. 生物工程学报, 2002, 18(1):51-54.
[20] 齐飞艳,彭镇华,胡 陶,等.毛竹花期不同器官内源激素含量的变化[J].林业科学研究,2013,26(3):332-336.
[21] 王计平, 史华平, 毛 雪, 等. 转录因子网络与植物对环境胁迫的响应[J]. 应用生态学报, 2006, 17(9):1740-1746.
[22] 吴桂容, 严重玲. 镉对桐花树幼苗生长及渗透调节的影响[J]. 生态环境, 2006, 15(5): 1003-1008.
[23] 袁彦婷, 丁振华, 张 玲. 汞胁迫对白骨壤(Avicenniamarina)幼苗生理生态的影响[J]. 生态学杂志, 2011, 30(5): 1013-1017.
[24] 黄国勇, 王友绍, 孙翠慈, 等. 秋茄叶对复合重金属的胁迫反应及其积累能力研究[J]. 热带海洋学报, 2010, 29(6): 104-109.
[25] Montero-Palmero M B, Martin-Barranco A, Escobar C,etal. Early transcriptional responses to mercury: a role for ethylene in mercury-induced stress[J]. New Phytologist, 2014, 201(1):116-130.
[26] Schellingen K, Van Der Straeten D, Vandenbussche F,etal. Cadmium-induced ethylene production and responses inArabidopsisthalianarely onACS2 andACS6 gene expression[J]. BMC Plant Biology,2014,14:214.
[27] 张春荣, 桑雪雨, 渠 萌, 等. 基于转录组测序揭示适度干旱胁迫对甘草根基因表达的调控[J]. 中国中药杂志, 2015, 40(24):4817-4823.
[28] 覃柳燕, 李 力, 缪剑华. 环境胁迫对药用植物次生代谢产物的影响[J]. 湖北农业科学, 2012, 51(8):1528-1532.
[29] 梁 滨, 季平扬, 唐宋辉, 等. La对UV-B胁迫下大豆幼苗类黄酮含量影响:I对类黄酮总量影响[J]. 农业环境科学学报, 2006, (3):584-586.
[30] 乔 孟, 于延冲, 向凤宁. 拟南芥R2R3-MYB类转录因子在环境胁迫中的作用[J]. 生命科学, 2009, 21(1):145-150.
[31] Nakashima K, Tran LSP, Dong VN,etal. Functional analysis of a NAC-type transcription factor OsNAC6 involved in abiotic and biotic stress-responsive gene expression in rice[J]. Plant Journal, 2007, 51(4):617-630.
[32] Takasaki H, Maruyama K, Kidokoro S,etal. The abiotic stress-responsive NAC-type transcription factor OsNAC5 regulates stress-inducible genes and stress tolerance in rice[J]. Mgg Molecular & General Genetics, 2010, 284(3):173-183.
(责任编辑:徐玉秀)
Digital Gene Expression Profiling Analysis ofAvicenniamarinaunder Heavy Metal Stress Treatment
YUANChang-chun1,MOJian-xin1,YUANGLiu-jiao1,YURu-feng1,LIUQian2,ZHONGJun-di1,LIUKai-dong1
(1.Life Science and Technology School, Lingnan Normal University, Zhanjiang 524048, Guangdong, China; 2.Guangzhou Gene Denovo Company, Guangzhou 510006, Guangdong, China)
[Objective]Transcriptome sequencing was perform to study the molecular mechanism in response to heavy metal stress inAvicenniamarina.[Method]Digital Gene Expression Profiling (DGE) technique was used to analyze the differences in gene expressions ofA.marinaunder artificial heavy metal stress.[Result]Compared to the controls, 10459 differentially expressed genes (DEGs) were detected, including 8685 up-regulated genes and 1774 down-regulated genes. MeV cluster analysis indicated that the expression level of most genes was largely induced in artificial heavy metal treatment sample than that in control sample. Gene Ontology analysis showed that most DEGs locate in “organelle envelope”, “plastid envelope” and “chloroplast part”, and were enriched in the biological process of “response to stimulus”, and “localization”, etc. Kyoto Encyclopedia of Genes and Genomes pathway enrichment analysis revealed that these genes are distributed in 126 pathways involved in “ribosome”, “photosynthesis”, and various metabolism pathways, such as pyruvate and glyoxylate. Several terpenoid and flavonoid biosynthesis-related enzymes, such as geranylgeranyl pyrophosphate synthase (Unigene0009238) and flavonol synthase (Unigene0001833), were up-regulated by heavy metal stress, which might be the reason for the enhancement for the active ingredients accumulation inA.marina. Furthermore, heavy metal stress significantly induced the cytokinin dehydrogenase 7(CKX7) (Unigene0057124) and serine/threonine-protein kinase (BSK) (Unigene0043741). Besides, the transcription factor analysis demonstrated that bHLH, NAC, MYB-related and WRKY play vital roles in response to heavy metal stress.Furthermore, eight randomly selected genes were used to confirm the accuracy of DGE by qRT-PCR method.[Conclusion]Heavy metal stresses have effects on the expression of related genes involved in the metabolism, photosynthesis, small molecule acid synthesis, hormone synthesis and signal transduction, and secondary metabolites synthesis ofA.marina
Avicenniamarina; heavy metal stress; digital gene expression profiling (DGE); differentially expressed genes (DEGs); mechanism
2016-06-12 基金项目: 广东省林业科技创新项目(2013KJCX011-03; 2015KJCX025);国家级大学生创新创业训练计划项目(201510579277);湛江市热带特色资源植物技术开发重点实验室项目(2014A06008);岭南师范学院自然科学研究项目(LZL1507) 作者简介: 袁长春,博士,教授. 主要研究方向:植物分子生物学. E-mail:yuanchangchun@163.com * 通讯作者:刘锴栋,硕士,副研究员. 研究方向:植物分子生物学. E-mail: liukaidong2001@126.com
10.13275/j.cnki.lykxyj.2017.02.004
S718.46
A
1001-1498(2017)02-0206-08
