外源NO对盐胁迫下小麦幼苗生长及生理特性的影响*
2017-04-19王弯弯诸葛玉平王慧桥贺明荣王振林张吉旺董元杰
王弯弯诸葛玉平王慧桥贺明荣王振林张吉旺董元杰
(1 山东农业大学资源与环境学院,山东泰安 271018)
(2 山东农业大学农学院,山东泰安 271018)
外源NO对盐胁迫下小麦幼苗生长及生理特性的影响*
王弯弯1诸葛玉平1王慧桥1贺明荣2王振林2张吉旺2董元杰†
(1 山东农业大学资源与环境学院,山东泰安 271018)
(2 山东农业大学农学院,山东泰安 271018)
在盆栽试验条件下,以冬小麦(山农22)为供试材料,以硝普钠(SNP)为外源一氧化氮(NO)供体,研究了3种施用方式的外源NO对盐胁迫下小麦幼苗生长及生理特性的影响。试验共设5个处理:对照(CK)、氮磷钾(NPK)肥(T1)、NPK肥+SNP浸种(T2)、NPK肥+ SNP粉末施入土壤(T3)和NPK肥+ SNP缓释颗粒施入土壤(T4)。结果表明:盐胁迫条件下,小麦植株体内会积累大量的活性氧,抑制了小麦幼苗的生长;T1-T4处理的小麦幼苗长势均优于CK。与T1处理相比,添加外源NO的T2-T4处理均可显著提高小麦出苗率,其中以T4效果最为显著,可显著促进小麦幼苗的生长,提高叶片鲜重、叶片干重、叶绿素含量及抗氧化酶活性,降低叶片中超氧阴离子产生速率及过氧化氢含量,减少小麦幼苗对Na+的吸收,增加K+的吸收,维持小麦体内Na+、K+平衡,并促进根系对N、P元素的吸收,从而保证小麦植株养分吸收平衡。因此,添加外源NO既能通过促进幼苗生长、提高抗氧化酶活性、调节离子平衡等途径来提高小麦幼苗的抗盐性,缓解盐胁迫对小麦幼苗的伤害,又能通过调节根系对营养元素的吸收来促进小麦幼苗的生长。且在3种不同的SNP施用方式中,以SNP制成缓释颗粒施入土壤的施用方式对小麦盐胁迫的缓解效果最优。
外源NO;盐胁迫;小麦;抗氧化酶;养分吸收
土壤盐渍化是影响植物生产的主要因素之一。目前我国有6.67×106 hm2的盐渍化耕地,约占可耕地面积的25%,加之自然与人为因素使得土壤盐渍化的面积越来越大,土壤盐渍化严重制约了农作物的生长发育,对农业生产造成了巨大的损失[1]。进入21世纪,人多地少还是我国的基本国情,人与土地稀缺的矛盾越来越尖锐,因此,发掘盐渍土地的利用价值日益受到人们的重视。研究表明,土壤中盐分通过渗透与离子效应等途径影响种子的萌发,引起植物体生理功能紊乱,从而导致植物幼苗生长减缓,直接影响到作物的产量[2]。植物则主要通过限制盐分过量吸入细胞、将盐离子区域化以及提高体内抗氧化酶活性和脯氨酸含量等对盐胁迫产生抗性。因此,寻求提高植物耐盐性的新途径对于促进农业增产、农民增收至关重要。近年来,已有大量研究表明添加外源化学物质可以有效提高作物的耐盐性[3-4]。
NO是植物体内重要的氧化还原信号分子和气体活性分子,参与调节植物的生长发育、光形态建成等多种生理过程[5],并与激素相互作用、参与生物和非生物逆境抗性的调节[2]。NO对植物体的作用具有双重性:低浓度的NO可通过诱导抗氧化酶基因的表达等方式与活性氧(ROS)作用,发挥抗氧化功能[6];而高浓度的NO则对细胞带来严重伤害。已有研究表明,NO可以显著增强超氧化物歧化酶(SOD)与过氧化氢酶(CAT)的活性,这两种酶可以减小盐胁迫下小麦叶片中超氧阴离子(O2
·-)和过氧化氢(H2O2)的积累[7]。因而,外源NO在缓解植物盐胁迫方面具有重要的应用前景。在土壤盐渍化日益加重的时代背景下,研究NO与盐胁迫条件下植物抗性的关系受到广泛的关注。
小麦是我国主要的粮食作物,也是滨海盐碱土壤上重要的栽培作物之一。种子萌发期与幼苗期是小麦一生中的重要生育阶段,对盐胁迫反应较为敏感,促进盐胁迫下小麦种子萌发和幼苗建成,提高小麦耐盐能力,对于促进滨海盐土区小麦的生产、保障国家的粮食安全均有重要意义。前人的研究表明,外源NO可提高镉胁迫下小麦[8]及盐胁迫下黄瓜根系抗氧化系统活性[9],促进铜胁迫下小麦萌发[10],缓解干旱胁迫[11]及盐胁迫[12]下小麦叶片的氧化损伤。以上研究进展表明外源NO在提高小麦抗逆能力,尤其是在提高小麦抗盐能力方面具有重要作用;但是,前人的相关研究主要集中在营养液培养条件下的相关机理研究,外源NO的施用方式主要是以营养液添加为主,而有关土培条件下不同施用方式的外源NO对盐渍化土壤上小麦幼苗生长及生理特性影响的相关研究并不多见。为此,本文采用盆栽试验的研究方法,探讨不同施用方式的外源NO对盐胁迫下小麦幼苗生长指标、叶绿素含量、抗氧化系统以及养分吸收等指标的影响,可为揭示外源NO缓解土培条件下小麦的耐盐机制及寻求提高盐碱地上小麦抗盐能力的新途径提供理论依据。
1 材料与方法
1.1 供试材料
试验于2016年在山东农业大学北校区资源与环境学院植物营养实验室进行。供试土壤为山东省滨州市无棣县渤海粮仓实验示范区的滨海盐潮土,其基本理化性状为有机质15.07 g kg-1,全氮 0.94 g kg-1,有效磷14.79 mg kg-1,速效钾67.31 mg kg-1,全盐2.66 g kg-1,pH为8.73。供试小麦品种为“山农22号”,外源NO供体为SNP。
1.2 试验设计
试验在盆栽方式下进行,每盆装风干土1.0kg,试验用肥为尿素(N 46%)、磷酸二铵(N 18%,P2O546%)和氯化钾(K2O 60%),N、P2O5、K2O的施用量分别为0.05、0.05、0.05 g kg-1土。试验共设5个处理:CK,对照;T1,单施NPK;T2,NPK+3.33 mg SNP 溶于110 ml水中,进行浸种;T3,NPK+3.33 mg SNP粉末直接施入土壤;T4,NPK+3.33 mg SNP制成缓释颗粒(直径为3~4 mm)施入土壤。为保证试验一致,除T2处理外,小麦种子均用蒸馏水进行浸种。将肥料与土壤混合均匀,每盆播小麦种子20粒,待出苗后统计各处理出苗率,并于两叶一心期定苗15株,每个处理重复4次,随机区组排列,管理与常规盆栽试验相同。
1.3 样品采集与分析
播种30 d后进行各项指标测定。株高、鲜重和干重采用常规直尺测量和天平称量方法;植株N、P、K、Na含量测定:样品经烘干、研磨过筛后,H2SO4-H2O2消化,火焰光度计法测定全钾、全钠含量[13],凯氏定氮法测定全氮含量[13]、钼锑抗比色法测定全磷含量[13];叶绿素含量采用乙醇提取、紫外分光光度法测定;O2·-采用羟胺氧化反应法测定;H2O2含量测定参照Patterson等[14]的方法;抗氧化酶活性的测定:超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法[15],过氧化物酶(POD)活性测定采用愈创木酚法[15],过氧化氢酶(CAT)活性测定采用紫外吸收法[15]。
1.4 数据处理
采用Excel 2003软件处理数据和绘表,采用DPS 7.05软件进行数据统计分析,采用最小显著极差法(LSD)进行差异显著性检验(p<0.05)。
2 结 果
2.1 外源NO对盐胁迫下小麦出苗率及幼苗生长的影响
与CK相比,各施肥处理的小麦出苗率、株高、鲜重及干重均有所提高(表1)。与T1相比,T2、T3、T4苗率分别提高了4.54%、3.63%、4.54%;株高分别增加了3.03%、4.14%、11.86%;鲜重分别增加了17.62%、15.57%、

表1 外源NO对盐胁迫下小麦出苗率及幼苗生长的影响Table 1 Effects of exogenous nitric oxide on emergence rate of wheat and growth of wheat seedlings under salt stress
51.64%;干重分别增加了30.77%、38.46%、69.23%。说明添加外源NO能够显著缓解盐胁迫对小麦出苗率及幼苗生长的胁迫,而其中以SNP制成缓释颗粒施入方式的T4缓解效果最显著。
2.2 外源NO对盐胁迫下小麦叶绿素含量的影响
由表2可知,与CK相比,各施肥处理小麦幼苗叶片的叶绿素含量均有所提高。与T1相比,随着SNP的添加,小麦幼苗的叶绿素含量也相应增加,其中以T4的叶绿素含量最高。T4与T1相比,其叶绿素总含量、叶绿素a、叶绿素b及类胡萝卜素含量分别增加了51.47%、41.04%、30.78%、22.86%。说明施入外源NO能够增加盐胁迫下小麦幼苗叶片的叶绿素含量,提高光合作用,从而促进小麦生长,其中以T4的效果最显著。

表2 外源NO对盐胁迫下小麦叶绿素含量的影响Table 2 Effects of exogenous nitric oxide on chlorophyll contents in wheat seedlings under salt stress
2.3 外源NO对盐胁迫下小麦幼苗叶片中O2·-产生速率及H2O2含量的影响
由图1与图2可见,与CK相比,各施肥处理的
O2
·-产生速率及H2O2含量均有不同程度的降低。与T1相比,T2、T3、T4的O2·-产生速率分别降低了3.61%、3.65%、18.83%;H2O2含量分别减少了1.22%、2.80%、8.34%。说明添加外源NO能够缓解盐胁迫下ROS累积对小麦幼苗造成的氧化损伤,而其中以T4的缓解效果最明显。
2.4 外源NO对盐胁迫下小麦幼苗叶片抗氧化酶系统的影响
由图3可见,与CK相比,各施肥处理的SOD、POD及CAT活性均有所提高。与T1相比,T2、T3、T4的SOD活性分别提高了4.91%、37.47%、4 5.0 9%;P O D活性分别提高了 3 4.4 8%、43.85%、48.71%;CAT活性分别提高了4.09%、5.63%、17.08%。说明添加外源NO可以一定程度提高叶片中抗氧化酶活性,从而增强小麦幼苗的抗盐能力,其中以T4效果最好。
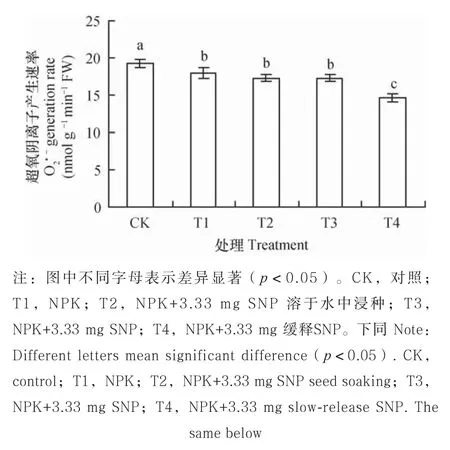
图1 外源NO对盐胁迫下小麦幼苗叶片中O2·-产生速率的影响Fig. 1 Effects of exogenous nitric oxide on O2·-generation rate in leaves of the wheat seedlings under salt stress
2.5 外源NO对盐胁迫下小麦幼苗叶片氮、磷、钾、钠吸收的影响

图2 外源NO对盐胁迫下小麦幼苗叶片中H2O2含量的影响Fig. 2 Effects of exogenous nitric oxide on H2O2content in leaves of the wheat seedlings under salt stress

图3 外源NO对盐胁迫下小麦幼苗叶片中SOD(A)、POD(B)及 CAT(C)活性的影响Fig. 3 Effects of exogenous nitric oxide on SOD(A),POD(B)and CAT(C)activity in leaves of the wheat seedlings under salt stress

表3 外源NO对盐胁迫下小麦幼苗叶片氮、磷、钾、钠吸收的影响Table 3 Effects of exogenous nitric oxide on N,P,K and Na contents in leaves of the wheat seedlings under salt stress
由表3可知,在盐胁迫下,与CK相比,各施肥处理小麦幼苗叶片中钠含量显著降低,而氮磷钾的含量均有所提高。与T1相比,T2、T3、T4的钠含量分别减少了18.92%、15.66%、21.93%;氮含量分别增加了0.32%、1.24%、1.59%;磷含量分别增加了 12.88%、0.76%、15.61%;钾含量分别增加了1.65%、2.70%、6.53%。说明在盐胁迫下,添加外源NO能够明显抑制小麦幼苗对Na+的吸收,促进其对N、P、K元素的吸收,其中以T4效果最好。
3 讨 论
3.1 外源NO对小麦生长指标及叶片叶绿素含量的影响
盐胁迫条件下,植物碳同化量减少,渗透调节和维持生长的能耗增加,生长受到抑制。因此,生长量可以反映植物对盐胁迫的适应程度,也是植物耐盐性的直接指标[16]。NO作为信号分子在植物应答逆境胁迫中起着重要作用。NO分子小,具有脂溶性,能够在细胞间自由穿梭,可以通过质外体直接作用于细胞壁组分,使细胞壁松弛,还可以作用于膜的磷脂双分子层,增强膜的流动性,从而促进细胞扩展,促进生长。本研究结果表明,添加NO显著缓解了盐胁迫对小麦幼苗生长的抑制作用,使施用外源NO处理的小麦出苗率、干重、鲜重和株高等指标均显著高于单独盐胁迫处理的小麦幼苗(表1),这可能是由于NO提高了盐胁迫下小麦体内的水分有效性,从而促进了叶绿素的合成(表2),增强了叶片的光合能,促进了干物质的积累,进而促进了小麦幼苗的生长。樊怀福等[1]指出100 mmol L-1NaCl胁迫下,用0.06 m mol L-1外源NO供体SNP处理24 h可以有效缓解盐胁迫对小麦种子萌发的抑制作用;Gao和Yang[17]的研究表明适宜浓度的NO使苹果苗的株高和地上部鲜重均显著提高,这与本研究结果一致。缓释颗粒形态施用的SNP较其他添加形式的外源NO缓解小麦幼苗盐胁迫的效果更好,可能是由于缓释形态施用的NO能够较长时间的维持小麦根际土壤中具有较高浓度的NO,从而能够在较大程度上缓解盐胁迫对小麦根系产生的毒害作用。Zhang等[18]的研究表明以缓释颗粒形态添加的外源NO能显著促进缺铁胁迫下花生的生长,这与本研究结果一致。
叶绿体是植物进行光合作用的主要部位,也是细胞中对盐敏感的细胞器[19-20]。盐胁迫下,植物细胞叶绿体和线粒体电子传递中泄漏的电子增加,活性氧大量产生,而叶绿素的降解主要由活性氧的氧化损伤引起盐害使叶绿体内蛋白质的合成受到破坏,蛋白质数量减少从而导致叶绿体与蛋白质的结合削弱,叶绿体趋向分解,光合作用受到抑制[21],而维持光合功能是植物耐盐的重要机理之一。前人研究表明低浓度的NO预处理能缓解盐胁迫和高温胁迫下水稻叶片叶绿素的降解、维持光系统Ⅱ的高活性等[22]。本研究结果也表明,添加外源NO的处理能够显著增加盐胁迫下小麦幼苗叶片中叶绿素的含量,促进小麦幼苗的生长(表2),这与史庆华等[23]的研究结果一致。这可能是添加外源NO后,提高了抗氧化酶的活性,清除了植物体内盐胁迫产生的部分ROS,抑制了叶绿素的分解,促进了叶片的光合作用所引起的。添加NO的3个处理中以SNP制成缓释颗粒施入方式的T4缓解效果最显著,这可能是缓释形态施入的外源NO能够在较长时间内持续不断的供应NO可以延长NO对小麦幼苗盐胁迫的缓解效应。Zhang 等[18]的研究也表明以缓释颗粒形态添加的外源NO更能提高花生叶片叶绿素含量促进花生的幼苗的生长,与本研究结果一致。
3.2 外源NO对小麦叶片活性氧代谢和抗氧化酶活性的影响
逆境胁迫下,植物体内活性氧产生与清除的平衡状态会遭到破坏,使ROS水平升高,膜脂过氧化程度加剧,导致细胞膜损伤与破坏,严重时导致细胞死亡。O2·-和H2O2具有强氧化性,可以导致生物体生物膜的机构和功能受损,引起核酸和蛋白质变性等,从而加快植株老化[24]。盐胁迫下,为避免活性氧诱导的细胞损伤,植物通过提高抗氧化系统酶活性,减轻盐胁迫的伤害,从而保证植物正常的生理功能[25]。抗氧化酶SOD、POD、CAT 是清除ROS的重要酶类。SOD作为膜保护的第一道防线,能将毒性较强的O2·-歧化为毒性较轻的H2O2[25],而POD是重要的H2O2清除酶,其利用各种基质作为电子供体将H2O2还原为H2O,同时CAT也能将H2O2歧化为H2O和O2,但是CAT清除H2O2的效率非常低[26]。前人研究表明NO在植物中起到抗氧化剂的作用,可以提高抗氧化酶活性,降低ROS对植株的氧化胁迫,缓解植物干早、盐渍、除草剂、重金属等环境胁迫引起的氧化损伤,外施SNP能够显著缓解盐胁迫导致的O2·-和H2O2的积累,并提高盐胁迫下植株叶片中SOD、POD、CAT 和APX等抗氧化酶的活性[27-28],从而减轻质膜受氧化损伤的程度。
本研究结果表明,外源NO能提高SOD、POD 及CAT等抗氧化酶的活性(图3),显著降低小麦叶片O2·-产生速率(图1)和H2O2含量(图2)。樊怀福等[29]证实了NO对NaCl胁迫下黄瓜幼苗的生长具有促进作用,并提高SOD、POD、CAT和APX的活性,降低了叶片MDA和O2·-的产生速率;阮海华等[7]研究发现,外源NO供体SNP可以提高盐胁迫下小麦叶片SOD和CAT的活性,延缓了和H2O2的积累,从而减轻了叶片的氧化损伤。这些研究与本研究结果一致。这可能是由于NO通过提高抗氧化酶活性来增强植株清除自由基防御系统的防御能力,进而缓解了盐胁迫对小麦幼苗的氧化伤害作用,从而促进幼苗生长。而外源NO能提高保护酶活性,主要原因在于NO对含铁的相关酶类有很高的亲和性[30]。在本研究外源NO的3种添加方式中,以缓释颗粒形态施入的外源NO缓解效应最显著,则是由于缓释颗粒能在较长时间内维持小麦根系土壤中能有较高浓度的NO可长时间缓解盐胁迫对根系所造成的损伤所致。
3.3 外源NO对小麦叶片氮磷钾与钠积累量的影响
氮磷钾是植物体内重要的三大营养元素,而营养元素充足是植物完成正常生命周期的保障,并且钾元素能够提高逆境生理条件下植物的抗逆性,因而在逆境下植物钾含量与逆境下植物的长势密切相关[31]。盐毒害影响作物对矿质元素的吸收和运输。过量的Na元素影响其他矿质元素的含量,从而影响了植物的正常新陈代谢。盐胁迫对植物造成的主要危害之一就是造成根系养分吸收不平衡,这种现象主要是由于介质中高浓度的Na+和Cl-的存在严重干扰了植物对其他营养元素的吸收,从而造成植物体内营养元素比例失调[32]。前人的研究表明盐胁迫会导致小麦[31]和玉米[32]植株体内氮、磷、钾的吸收效率下降,这可能是由于Cl-竞争排斥 NO3-、H2PO4-的吸收,Na+竞争排斥 K+的吸收,最终导致氮、磷、钾含量降低。本试验研究表明在盐胁迫下,添加外源NO可以使小麦幼苗叶片中Na+的含量显著降低,并促进对N、P和K营养元素的吸收(表3),说明添加外源NO能够提高盐胁迫下小麦幼苗对土壤中营养元素的吸收,维持了植物体内的离子平衡,促进了小麦幼苗的正常生长。这可能是由于施用外源NO后抑制了Na+的吸收,促进了植物细胞的离子平衡,缓解了盐胁迫造成的氧化胁迫,进而促进了小麦幼苗的正常生长。而所有添加外源NO处理中,以SNP制成缓释颗粒施入方式的增效效果最好,则可能是由于缓释的外源NO,能够持续维持盐胁迫下根系正常生长对NO的需求,较好地缓解了盐胁迫对小麦根系质膜的过氧化作用,抑制了土壤中过量盐的离子胁迫作用,提高了小麦根系对养分的吸收能力。
4 结 论
盐胁迫下,小麦幼苗生长显著受到抑制。添加外源NO能够缓解盐胁迫对小麦幼苗造成的伤害,促进小麦幼苗生长,提高叶片光合作用及抗氧化酶SOD、POD、CAT的活性;降低 O2·-产生速率以及H2O2含量;减少小麦对Na+的吸收,促进其对K+的吸收,维持正常的Na+/K+,从而提高小麦植株的抗盐性。此外,盐胁迫下,小麦对营养元素的吸收也明显受到抑制。添加外源NO可显著改善这种抑制作用,提高小麦幼苗根系对土壤中氮磷钾的吸收。三种不同的SNP添加方式中以SNP制成缓释颗粒的施用方式对土培条件下小麦盐胁迫的缓解效果最优。
[1]樊怀福,郭世荣,焦彦生,等.外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响.生态学报,2007, 27(2):546—553
Fan H F,Guo S R,Jiao Y S,et al. The effects of exogenous nitric oxide on growth,active oxygen metabolism and photosynthetic characteristics in cucumber seedlings under NaCl stress(In Chinese). Acta Ecologica Sinica,2007,27(2):546—553
[2]常青山,张利霞,刘龙昌,等. 壳聚糖浸种对盐胁迫苜蓿种子萌发受阻的缓解作用.贵州农业科学,2015,43(5):69—71
Chang Q S,Zhang L X,Liu L C,et al. Relieving effects on germination of Medicago sativa seeds under salt stress soaking in Chitosan(In Chinese). Journal of Guizhou Agricultural Science,2015,43(5):69—71 [3]郑春芳,姜东,戴廷波,等. 外源一氧化氮供体硝普钠浸种对盐胁迫下小麦幼苗碳氮代谢及抗氧化系统的影响. 生态学报,2010,30(5):1174—1183
Zheng C F,Jiang D,Dai T B,et al. Effects nitroprusside,a nitric oxide donor,on carbon and nitrogen metabolism and the activity of the antioxidation system in wheat seedings under salt stress(In Chinese). Acta Ecologica Sinica,2010,30(5):1174—1183
[4]钟雪梅,代其林,马明莉,等. 外源 NO 浸种对 NaCl胁迫下油菜种子萌发和幼苗生长的影响. 江苏农业科学,2016, 44(3):102—106
Zhong X M,Dai Q L,Ma M L,et al. Effects of priming of seeds with exogenous nitric oxide on seed germination and seedling growth of rape under NaCl stress(In Chinese). Jiangsu Agricultural Sciences,2016,44(3):102—106
[5]Arasimowicz M,Floryszak-Wieczorek J. Nitric oxide as a bioactive signaling molecule in plant stress responses. Plant Science,2007,172(5):876—887
[6]Frank S,Kämpfer H,Podda M,et al. Identification of copper/zinc superoxide dismutase as nitric oxideregulated gene in human(HaCaT)keratinocytes:Implication for keratinocyte proliferation. Biochemical Journal,2000,346:719—728
[7]阮海华,沈文飚,叶茂炳,等. 一氧化氮对盐胁迫下小麦叶片氧化损伤的保护作用. 科学通报,2001,46 (23):1993—1997
Ruan H H,Shen W B,Ye M B,et al. Protective effect of nitric oxide on oxidative damage of wheat leaves under salt stress(In Chinese). Chinese Science Bulletin,2001,46(23):1993—1997
[8]Singh H P,Batish D R,Kaur G,et al. Nitric oxide(as sodium nitroprusside)supplementation ameliorates Cd toxicity in hydroponically grown wheat roots. Environmental and Experimental Botany,2008,63:158—167
[9]Shi Q H,Ding F,Wang X F,et al. Exogenous nitric oxide protect cucumber roots against oxidative stress induced by salt stress. Plant Physiology and Biochemistry,2007,45(8):542—550
[10]Hu K D,Hu L Y,Li Y H,et al. Protective roles of nitric oxide on germination and antioxidant metabolism in wheat seeds under copper stress. Plant Growth Regulation,2007,53(3):173—183
[11]刘鹏程,王辉,程佳强,等. NO对小麦叶片干旱诱导膜脂过氧化的调节效应. 西北植物学报,2004,24 (1):141—145
Liu P C,Wang H,Cheng J Q,et al. Regulation of nitric oxide on drought-induced membrane lipid preoxidation in wheat leaves(In Chinese). Acta Botanica Boreali-Occidentalia Sinica,2004,24 (1):141—145
[12]Ruan H H,Shen W B,Ye M B,et al. Protective effects of nitric oxide on salt stress-induced oxidative damage to wheat(Triticum aestivum L. )leaves. Chinese Science Bulletin,2002,47(8):671—677 [13]鲁如坤. 土壤农业化学分析方法. 北京:中国农业科技出版社,2000:205—226
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing:China Agricultural Science and Technology Press,2000:205—226
[14]Patterson B D,MacRae E A,Ferguson I B. Estimation of hydrogen peroxide in plant extracts using titanium (IV). Analytical Biochemistry,1984,139(2):487—492
[15]朱正杰,陈敬安,李航,等. 贵州草海沉积物碳酸盐碳同位素异常正值的发现及其环境指示意义. 湖泊科学,2011,23 (5):681—685
Zhu Z J,Chen J A,Li H,et al. Discovery of abnormal positive values of carbon isotope of carbonate sediments from Lake Caohai,Guizhou Province and their implications(In Chinese). Journal of Lake Sciences,2011,23(5):681—685
[16]魏博娴. 中国盐碱土的分布与成因分析. 水土保持应用技术,2012(6):27—28
Wei B X. Analysis of distribution and cause of Chinese saline alkali soil(In Chinese). Technology of Soil and Water Conservation,2012(6):27—28
[17]Gao H J,Yang H Q. Nitric oxide effect on root architecture development in Malus seedlings. Plant Soil and Environment,2011,57(9):418—422
[18]Zhang X W,Dong Y J,Qiu X K,et al. Exogenous nitric oxide alleviates iron-deficiency chlorosis in peanut growing on calcareous soil. Plant Soil and Environment,2012,58(3):111—120
[19]Tuna A L,Cengiz K,Muhammad A,et al. The effects of calcium sulphate on growth,membrane stability and nutrient uptake of tomato plants grown under salt stress. Environmental and Experimental Botany,2007,59 (2):173—178
[20]Cheeseman J M. Mechanism of salinity tolerance in plants. Plant Physiology,1988,87(3):547—550
[21]张怡,路铁刚. 植物中的活性氧研究概述. 生物技术进展,2011,1(4):242—248
Zhang Y,Lu T G. The research of reactive oxygen species(ROS)in plants(In Chinese). Progress in Biotechnology,2011,1(4):242—248
[22]Uchida A,Jagendorf A T,Hibino T,et al. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice. Plant Science,2002,163 (3):515—523
[23]史庆华,朱祝军,Khalida Al-aghabary,等. 渗Ca (NO3)2和NaCl胁迫对番茄光合作用的影响. 植物营养与肥料学报,2004,10(2):188—191
Shi Q H,Zhu Z J,Al-Aghabary K,et al. Effects of iso-osmotic Ca(NO3)2and NaCl treatment on photosynthesis in leaves of tomato. Plant Nutrition and Fertilizing Science,2004,10(2):188—191
[24]吴雪霞,朱月林,朱为民,等. 外源一氧化氮对 NaCl胁迫下番茄幼苗生理影响. 中国农业科学,2006,39 (3):575—581
Wu X X,Zhu Y L,Zhu W M,et al. Studies on influences of exogenous nitric oxide on physiological characteristics in tomato seedlings under salt stress (In Chinese). Scientia Agricultura Sinica,2006,39 (3):575—581
[25]李西,吴亚娇,孙凌霞. 铅胁迫对三种暖季型草坪草生长和生理特性的影响. 草业学报,2014,23(4):171—180
Li X,Wu Y J,Sun L X. Growth and physiological responses of three warm-season turfgrasses to lead stress (In Chinese). Acta Prataculturae Sinica,2014,23(4):171—180
[26]列淦文,叶龙华,薛立. 臭氧胁迫对植物主要生理功能的影响. 生态学报,2014,34(2):294—306
Lie G W,Ye L H,Xue L. Effects of ozone stress on major plant physiological functions(In Chinese). Acta Ecologica Sinica,2014,34(2):294—306
[27]刘建新,王鑫,李博萍. 外源一氧化氮供体SNP 对NaCl 胁迫下多裂骆驼蓬幼苗氧化损伤的保护效应. 干旱地区农业研究,2009,27(6):139—143
Liu J X,Wang X,Li B P. Effects of exogenous nitric oxide donor SNP on protecting Peganum multisectum seedlings from oxidative damage under NaCl stress(In Chinese). Agricultural Research in the Arid Areas,2009,27(6):139—143
[28]孙立荣,郝福顺,吕建洲,等. 外源一氧化氮对盐胁迫下黑麦草幼苗生长及生理特性的影响. 生态学报,2008,28( 11):5714—5722
Sun L R,Hao F S,Lü J Z,et al. Effects of exogenous nitric oxide on growth and physiological characteristics of ryegrass seedlings under salt stress(In Chinese). Acta Ecologica Sinica,2008,28(11):5714—5722
[29]樊怀福,郭世荣,段九菊,等. 外源NO对NaCl胁迫下黄瓜(Cucumis sativus L.)幼苗生长和谷胱甘肽抗氧化酶系统的影响.生态学报,2008,28(6):2511—2517
Fan H F,Guo S R,Duan J J,et al. Effects of nitric oxide on the growth and glutathione dependent antioxidant system in cucumber(Cucumis sativus L.)seedlings under NaCl stress. Acta Ecologica Sinica,2008,28(6):2511—2517
[30]Clark D,Durner J,Navarre D A,et al. Nitric oxide inhibition of tobacco catalase and ascorbate peroxida. Molecular Plant Microbe Interactions,2000,13 (12):1380—1384
[31]马洪波,曹月阳,陈杰,等. 土壤盐胁迫对小麦养分和渗透调节物质的影响. 江苏农业学报,2012,28 (6):1300—1305
Ma H B,Cao Y Y,Chen J,et al. Effects of soil salt stress on wheat nutrient and osmotic regulator(In Chinese). Jiangsu Journal of Agricultural Sciences,2012,28(6):1300—1305
[32]Azevedo Neto A D,Tabosa J N. Nutritional efficiency for N,P,K on corn seedlings under salt stress. Ecossistema,2000,25(2):194—198
Effects of Exogenous Nitric Oxide on Growth and Physiological Characteristics of Wheat Seedlings under Salt Stress
WANG Wanwan1ZHUGE Yuping1WANG Huiqiao1HE Mingrong2WANG Zhenlin2ZHANG Jiwang2DONG Yuanjie1†
(1 College of Resources and Environment,Shandong Agricultural University,Tai’an,Shandong 271018,China)
(2 College of Agronomic Sciences,Shandong Agricultural University,Tai’an,Shandong 271018,China)
【Objective】NO has been found to function in plant responses to various environmental stresses. Salt stress causes water deficit,ion toxicity,and nutrient deficiency,leading to growth and yield reduction,and even to plant death. Exogenous NO may effectively enhance plant tolerance to salt stress by activating antioxidant enzyme,mitigating oxidative damage and regulating cytosolic ionic balance in the plant. The aim of this paper is to evaluate effects of application of sodium nitroprusside(SNP)as donor of exogenous nitric oxide(NO)on growth and physiological characteristics of wheat seedlings under salt stress relative to application method. 【Method】A pot experiment,designed to have five treatments,that is,control(CK),NPK fertilizer(T1),NPK fertilizer + soaking seeds in 3.33 mg SNP solution(T2),NPK fertilizer+3.33 mg SNP applied into soil directly(T3)and NPK fertilizer+3.33 mg SNP prepared into controlled release fertilizer(T4),and four replicates,was carried out. Wheat Shannong 22 was cultivated in the pots,which were arranged in randomized block designs. During the growing season,plants were managed in the same way as the local farmers do.【Result】Results show:under salt stress,a lot of reactive oxygen species(such as superoxide anion and hydrogen peroxide,etc)accumulated in wheat plants,inhibiting growth of the wheat seedlings;the wheat seedlings in all the treatments grew better than those in the control,and the application of SNP reduced the adverse effects caused by salt stress;exogenous NO obviously improved wheat seed emergence rate;in comparison with Treatments T2 and T3,Treatment T4 significantly mitigated the damage caused to the wheat seedlings under salt stress and significantly improved growth of the wheat seedlings in terms of fresh weight,dry weight,chlorophyll content and antioxidant enzymes(SOD,POD,CAT)activities;reduced superoxide anion production rate and hydrogen peroxide content in the leaves;decreased the absorption of Na+while increasing that of K+,helping keep Na+and K+in balance in the plants;and promoted root absorption of N and P,thus improving fertilizer use efficiency of the plant and ensuring adequate nutrients in the wheat plant. 【Conclusion】On the one hand,the application of exogenous NO can improve resistance of the wheat seedlings to salt by promoting growth of the seedlings,enhancing antioxidant enzymes activities and regulating ion balance or other ways,and alleviate damage of salt stress to the wheat seedlings;and on the other hand,exogenous NO can also regulate plant absorption of nutrients and improve fertilizer use efficiency and hence promote growth of the wheat seedlings. Among the three different application methods,the one of preparing NPK and SNP into controlled release fertilizer is the best in reducing the effect of salt stress on wheat.
Exogenous nitric oxide;Salt stress;Wheat;Antioxidative enzymes;Nutrient uptake
S512.1;Q945.78
A
10.11766/trxb201611180360
(责任编辑:卢 萍)
* 国家重点基础研究发展计划(973 计划)项目(2015CB150404)、山东省自主创新及成果转化专项(2014ZZCX07402)与史丹利功能性生物肥料基金项目(380078)共同资助 Supported by the National Basic Research Program of China(No. 2015CB150404),the Indigenous Innovation Project of Shandong Province(No. 2014ZZCX07402),and the Stanley Functional Bio Fertilizer Foundation(No. 380078)
† 通讯作者 Corresponding author,E-mail:yuanjiedong@163.com
王弯弯(1991—),女,硕士研究生,主要从事土壤生态与植物营养方面的研究。E-mail:wanwang91@163.com
2016-11-18;
2016-12-04;优先数字出版日期(www.cnki.net):2017-01-05
