土壤不同粒径有机无机复合体对丁草胺的吸附特性*
2017-04-19黄玉芬刘忠珍魏李衍亮黄连喜许桂芝
黄玉芬 刘忠珍魏 岚 李衍亮 黄连喜 黄 庆 许桂芝
(广东省农业科学院农业资源与环境研究所,农业部南方植物营养与肥料重点实验室,广东省农业资源循环利用与耕地保育重点实验室,广州 510640)
土壤不同粒径有机无机复合体对丁草胺的吸附特性*
黄玉芬 刘忠珍†魏 岚 李衍亮 黄连喜 黄 庆 许桂芝
(广东省农业科学院农业资源与环境研究所,农业部南方植物营养与肥料重点实验室,广东省农业资源循环利用与耕地保育重点实验室,广州 510640)
为了解土壤不同粒径组分对农药吸附-解吸行为的影响和吸附贡献率,以及不同粒径组分中有机无机组分的结合方式和复合程度如何影响有机质对农药的吸附,选取我国6个省区的7种理化性质差别较大的土壤,并采用物理方法提取该7种土壤的三个粒径有机无机复合体(黏粒:<0.002 mm;粉粒:0.02~0.002 mm;砂粒:0.05~0.02 mm)为研究材料,采用批量平衡法研究丁草胺在不同土壤和不同粒径有机无机复合体固/液界面的分配规律。同时,定量计算土壤各粒径组分对丁草胺的吸附贡献率,并从有机无机复合体角度探讨不同粒径组分中总有机碳(TOC)对丁草胺的吸附特性。结果表明:土壤黏粒组分对丁草胺具有最大的吸附量和较小的解吸率,而砂粒组分对丁草胺则具有较小的吸附量和最大的解吸率。土壤黏粒、粉粒和砂粒组分对丁草胺的吸附贡献率分别为36.7%~72.4%、21.7%~50.5 %和< 10 %。TOC是影响各粒径组分对丁草胺吸附的主要原因,但其影响程度受各粒径组分中TOC的理化性质以及其与无机矿物的复合程度控制。
丁草胺;有机无机复合体;粒径;吸附;总有机碳
土壤是农药在环境中的“贮藏库”与“集散地”,施入农田的农药大部分残留于土壤环境介质中。进入土壤的农药将发生一系列物理或化学过程,如被土壤胶粒及有机质吸附、随水分向四周移动(地表径流)或向深层土壤移动(淋溶)、向大气中挥发扩散、被作物吸收、被土壤微生物降解[1-2]。其中,土壤对农药的吸附行为将间接地调控该农药的有效剂量以及在土壤中的持久性,很大程度上影响农药在环境中的归趋[3-5]。
酰胺类除草剂丁草胺是一种高效的选择性芽前除草剂农药,是我国施用量最大的三种除草剂之一。丁草胺在土壤中具有明显的持留性,对环境生物尤其是水体生物具有较高的毒性[6-8]。目前人们对丁草胺在土壤中的吸附行为研究表明,对于有机质含量中等以上的土壤,有机质是控制丁草胺土-水界面吸附行为的关键因素,但黏粒含量会间接影响土壤中有机质的分配吸附作用[9-10]。也有研究者从土壤中提取腐殖质和采用纯矿物进行丁草胺的吸附机理研究,但强酸强碱提取出的腐殖质和纯矿物与土壤中天然存在的有机质、矿物特性存在较大差异。实际土壤中大部分有机质是和黏土矿物紧密结合在一起形成有机无机复合体,许多研究表明,土壤不同粒径有机无机复合体中有机质的理化特性有很大差异[11-12],那么,其吸附丁草胺的能力是否会因与无机矿物结合紧密程度不同而受影响?此外,同一土壤不同粒径有机无机复合体以及不同类型土壤的各粒径有机无机复合体对丁草胺的吸附特性和吸附贡献如何?不同粒径有机无机复合体对丁草胺的吸附行为与各粒径中总有机碳(TOC)的关系又是怎样?目前仍鲜见报道。
鉴于此,本试验对来自我国东部6个省区理化性质差别较大的7种土壤,采用物理方法进行粒径分级后,从有机无机复合体的角度研究其对丁草胺的吸附行为,并定量分析不同粒径有机无机复合体对丁草胺的吸附贡献率,最后试图比较不同粒径有机无机复合体中的TOC对丁草胺的吸附作用差异。研究成果有助于更深入认识不同类型土壤对丁草胺的吸附行为,从而在生产中因地制宜,合理施用,为避免丁草胺的环境风险提供理论依据。
1 材料与方法
1.1 供试试剂和土样
丁草胺标准品,纯度≥97.9 %,购于沈阳化工所;石油醚,分析纯,经70℃重蒸纯化;甲醇(色谱纯);氯化钾(优级纯);叠氮化钠(分析纯);水(Milli-Q超纯水)。主要仪器包括气相色谱仪(GC ,6890型,美国Agilent)、恒温摇床(TS-200B,上海天呈实验仪器制造有限公司)、表面积分析仪(NOVA BET,美国Quantachrome corporation)、元素分析仪(Flash EA1112,美国Thermofinnigan)。
7种供试土壤,分别采自我国东部6个省区的非耕作土壤,采样深度0~20 cm。采集的土壤风干后,研磨,过2 mm 筛备用。土壤pH、机械组成、阳离子交换量(CEC)、游离态氧化铁(Fed)和无定型氧化铁(Feo)均采用常规方法分析[13],理化性状见表1。
1.2 粒径分级
采用Balesdent 等[14]的内虹吸粒径分级方法,完全物理分散,不添加任何化学分散剂。基本步骤如下:100 g土样加入250 ml 去离子水,加入适量玻璃珠,振荡16 h(150r min-1),保证悬液密度小于3%。湿筛法收集大于0.05 mm粒径,小于0.05 mm 粒径部分高功率超声分散20 min后,把悬液转移至1 L高型烧杯中,沉降法分组,在规定时间内虹吸法分为黏粒(<0.002 mm)、粉粒(0.002~0.02 mm)和砂粒(0.02~0.05 mm)三个粒级。各粒径组分冷冻干燥后,研磨过60目筛备用。常规分析法[13]测定各粒径组分中TOC含量,结果见表2,由于砖红壤(S7)砂粒组分太少,没办法测其TOC含量。
同时,原土也采用土水比为1∶2.5加入去离子水,充分搅拌后,漂浮法去除轻组组分。离心去水后,冷冻干燥,研磨过60目筛,并测定其TOC含量,结果见表2。
1.3 吸附解吸试验
吸附:采用恒温振荡平衡法测定。称取各土样0.500 g(过0.25 mm 筛)若干份置于25 mL玻璃离心管中,分别加入8.0 ml浓度为7.910 mg L-1的丁草胺标准溶液,以0.02 mol L-1KCl溶液为支持电解质,加入0.02 %的NaN3作为抑菌剂。所有样品在(25±2)℃下,250 r min-1恒温避光振荡36 h取样,并经3 000 rpm离心15 min,上清液用重蒸石油醚萃取后GC测定分析。同时做空白试验控制准确度。前期实验表明该萃取方法的变异系数范围为1.39%~3.17%,添加回收率为99.13%~108.56%。
解吸:离心后的残渣加入8.0 ml电解质,涡旋分散后,同样条件振荡36 h后,离心,上清液同样用石油醚萃取,GC测定分析。称重法扣除残液中丁草胺含量。
测定条件:Agilent-6890 GC工作站;30 m×0.32 mm HP-5毛细管柱(Agilent 19091J-413,USA);μ-ECD电子捕获检测器;流速1.0 ml min-1;进样口、色谱柱和检测器的温度分别为240℃、230℃ 和270℃;恒压,分流进样,分流比为50∶1;进样量为1 μl;外标法定量。
1.4 数据分析
丁草胺吸附量采用以下方程计算:
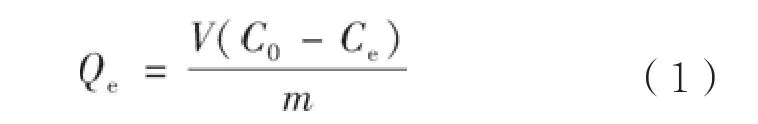
式中,Qe为反应达到表观平衡后土壤对丁草胺的吸附量(mg kg-1);V为溶液体积(ml);C0为丁草胺初始浓度(mg L-1);Ce为不同土样达到表观吸附平衡时溶液中丁草胺的浓度(mg L-1);m为风干土换算为烘干土的质量(g)。
表观吸附平衡时,丁草胺在土/水体系中的分配系数(Kd,L kg-1):


表1 供试土壤基本理化性质Table 1 Basic properties of the soils used in this study
式中,Qe、Ce同上。
丁草胺在各吸附剂中的解吸率(%):

式中,Cd代表解吸后溶液中丁草胺浓度(mg L-1);Δm代表残液质量(g);V、Ce、Qe同上。
各粒径组分中所含总有机碳(TOC)量占土壤中TOC含量的百分比(Wp,%):

式中,Cf表示不同粒径中TOC含量(g kg-1);fi表示不同土壤中各粒径的质量百分含量(%);Cb表示原土中TOC的含量(g kg-1)。
各吸附剂对丁草胺的吸附贡献率(%):

式中,Qif表示土壤粒径在初始浓度下的吸附量(g kg-1);fi表示不同土壤中各粒径的质量百分含量(%);Qb表示原土在初始浓度下的吸附量(g kg-1)。
2 结果与讨论
2.1 土壤基本理化性质及有机碳在土壤各粒径中的分布
由表1和表2可知,本实验所选用的土壤理化性质差别较大,土壤pH 4.09~8.36,CEC 6.6~37.5 cmol kg-1,Feo含量0.7~6.3 g kg-1,Fed含量7.2~25.8 g kg-1,TOC含量1.8~34.3 g kg-1。除砖红壤(S7)外,其他6种土壤各粒径组分中TOC含量关系均为:黏粒>粉粒>砂粒,且黏粒组分TOC含量是原土TOC含量的1.49~3.78倍。而砂粒组分TOC含量极低,其含量均小于5 g kg-1(表2)。
根据各粒径组分的重量百分含量和TOC含量,按式(4)计算各粒径中TOC占土壤中总TOC含量的质量百分比,结果示于表2。由表2可知,TOC在黏粒、粉粒和砂粒组分中的分布分别占土壤总TOC含量的44.44%~74.74%、16.77%~37.25%和0.73%~16.53%。可见,土壤中TOC几乎50%以上和黏粒组分结合在一起,形成有机无机复合体。土壤在三种粒径组分中的TOC含量总和占原土TOC总量的69.01%~105.68%,这与理论上应≤100%有部分不符。分析认为主要是因为该实验中用比重计法测定土壤机械组成,而粒经分级用虹吸法,两种方法之间存在一定的误差[4]。
2.2 丁草胺在不同土壤不同粒径组分固液两相间的分配吸附
本研究是各固相组分在丁草胺初始浓度为7.910 mg L-1的单点吸附实验,达到吸附平衡时各平衡体系中丁草胺的浓度范围为1.37~6.68 mg L-1。笔者前期研究表明,土壤及各粒径组分对丁草胺的吸附行为在高浓度范围(平衡液浓度大于1.0~2.0 mg L-1)表现为线性吸附[4,18],故此情况下可采用分配系数Kd来比较土壤不同粒径有机无机复合体对丁草胺的吸附能力[16-17]。由表3可知,各土壤对丁草胺的吸附分配系数Kd值大小顺序为黄壤>黑土>黄棕壤>砖红壤>红壤1>红壤2>褐土;黏粒组分对丁草胺的吸附分配系数Kd值大小顺序为黄壤>黑土>黄棕壤>红壤2>褐土>砖红壤>红壤1;粉粒组分对丁草胺的吸附分配系数Kd值大小顺序为黄壤>砖红壤>黑土>黄棕壤>红壤2>红壤1>褐土;砂粒组分对丁草胺的分配系数Kd值大小顺序为黄壤>黄棕壤>红壤1>黑土>红壤2>褐土。可见,不同土壤以及不同粒径组分对丁草胺的吸附能力均存在较大差异。

表2 不同粒径组分中总有机碳含量及其占土壤总有机碳含量的百分数Table 2 Total organic carbon contents in different particle-size fractions(TOC,g kg-1)and their percentages of the TOC in soil (Wp,%)
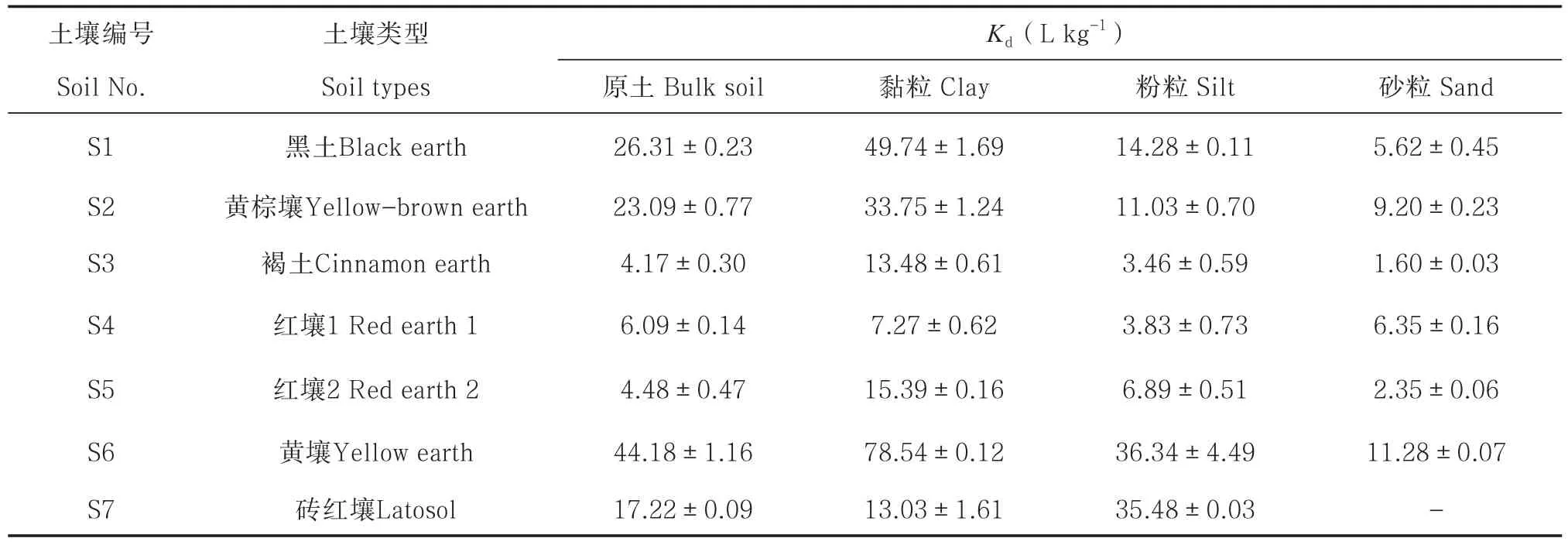
表3 不同土壤及粒径组分对丁草胺的分配系数Table 3 Distribution coefficients(Kd)of butachlor in different soils and their particle-size fractions
除广东砖红壤(S7)外,其他土壤各粒径对丁草胺的吸附能力均为:黏粒>粉粒>砂粒,黏粒组分的吸附能力远大于原土对丁草胺的吸附能力,其Kd值是原土Kd值的1.2倍~3.4倍,而砂粒组分对丁草胺的吸附能力很弱,其Kd值均≤12 L kg-1(表3)。已有研究表明,土壤黏粒组分对农药具有最强的吸附性能,其主要原因是:(1)由于黏粒组分具有较大的比表面积,可以为农药提供较多的吸附位点;(2)许多具有较强吸附性能的物质(如TOC、蒙脱石和无定型氧化物等)主要分布于黏粒组分中。例如,张雪丽等[17]研究表明,红壤的黏粒组分较粉粒和砂粒组分,具有较高的比表面积、孔容和孔径,其对苯系物(邻二甲苯、对二甲苯和乙苯混合物)吸附的Kd值明显高于其他组分。Liu等[18]通过去除土壤黏粒组分中的TOC,研究处理前后土壤黏粒对丁草胺的吸附特性,结果表明,处理后土壤黏粒的Kd值远小于处理前的Kd值。本研究结果也表明,土壤TOC几乎50%以上是和黏粒组分结合在一起(表2),TOC对原土及其粒径组分吸附丁草胺具有显著的影响(p<0.01),其与原土和粒径组分吸附丁草胺的Kd值相关系数分别达到0.746和0.906。
对于广州砖红壤,其黏粒含量极高(73.1%)。在进行虹吸法粒径分级前,用玻璃珠分散土壤时发现24 h仍不能充分分散,只好延长时间,由于没有添加任何化学分散剂,只采用了物理的分散方法存在分散不完全的可能,这会造成各组分分级不准。有可能部分黏粒组分被误分到了粉粒组分中,从而造成粉粒组分中TOC含量高于黏粒组分,其对丁草胺的分配能力也大于黏粒组分的分配能力。红壤1的砂粒组分Kd大于粉粒组分Kd的原因有待进一步探讨。
2.3 不同粒经有机无机复合体所吸附丁草胺的可逆性评价
土壤所吸附丁草胺的可逆性可通过吸附后土壤中的丁草胺被电解质解吸的程度来评价[19-20],通过式(3)计算各粒径组分吸附丁草胺的解吸率,结果如图1所示,可见,除了红壤1(S4)和砖红壤(S7)外,随着土壤粒径的增加,其吸附的丁草胺越来越容易被解吸。不同土壤不同粒经组分吸附丁草胺后的解吸率与丁草胺在吸附平衡时在固液两相中的分配系数(Kd)有较好的负相关关系(r=-0.868,p<0.01)(图2)。具有较高Kd值的固相组分其解吸率较低,即被吸附在吸附能力较强的固相组分上的丁草胺其可逆性较低,特别对于Kd值大于或等于49 L kg-1的黄壤(S6)黏粒组分(78.54 L kg-1)和黑土(S1)黏粒组分(49.74 L kg-1),所吸附的丁草胺其解吸率仅分别为6.5%和9.4%;而对于吸附能力较弱的固相组分所吸附的丁草胺较容易解吸,具有较高的环境风险。由图1还可以看出,对于黏粒组分,除了红壤1(S4)外,其他黏粒对丁草胺的解吸率均小于20%,而粉粒组分,除了TOC含量极高的黄壤(S6)粉粒(14.3 g kg-1)和砖红壤(S7)粉粒(32.8 g kg-1)外,其他土壤解吸率均大于20%。对于砂粒组分,各土壤解吸率均大于25%。可见,各土壤组分对丁草胺的吸持能力大小表现为:黏粒>粉粒>砂粒,即黏粒组分对丁草胺的吸附不可逆程度较高,而砂粒组分对丁草胺的吸附可逆程度较大。
大量的研究表明[21-22],吸附在土壤中的农药存在一定程度的解吸行为,而影响农药解吸行为的主要因素是:农药本身的理化性质、土壤的比表面积和TOC、黏粒含量、以及解吸平衡时间等。例如Wauchope和Myers[23]的研究表明,当解吸平衡时间≤2 h时,土壤沉积物对阿特拉津的解吸率达到75%。Wang和Keller[24]的研究表明,土壤黏粒和粉粒对农药吸持能力明显强于原土及砂粒组分。高敏苓等[25]的研究表明,农药在土壤不同粒径组分中的吸持能力受各粒径组分中TOC和黏土矿物的结合方式和结合程度影响。本研究结果也表明,具有较高TOC含量的黏粒组分对丁草胺的解吸率较低,TOC含量与解吸率之间具有显著的负相关关系(r=-0.658,p<0.01)。可见,黏粒组分TOC含量高且大多数TOC和黏土矿物复合在一起是导致土壤吸附丁草胺的不可逆部分主要发生在黏粒组分中的主要原因之一。
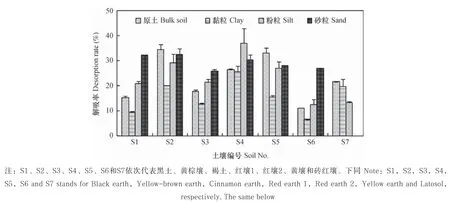
图1 不同土壤不同粒经有机无机复合体吸附丁草胺的解吸率Fig. 1 Butachlor desorption rate of organo-inorganic compounds relative to particle-size fraction and soil
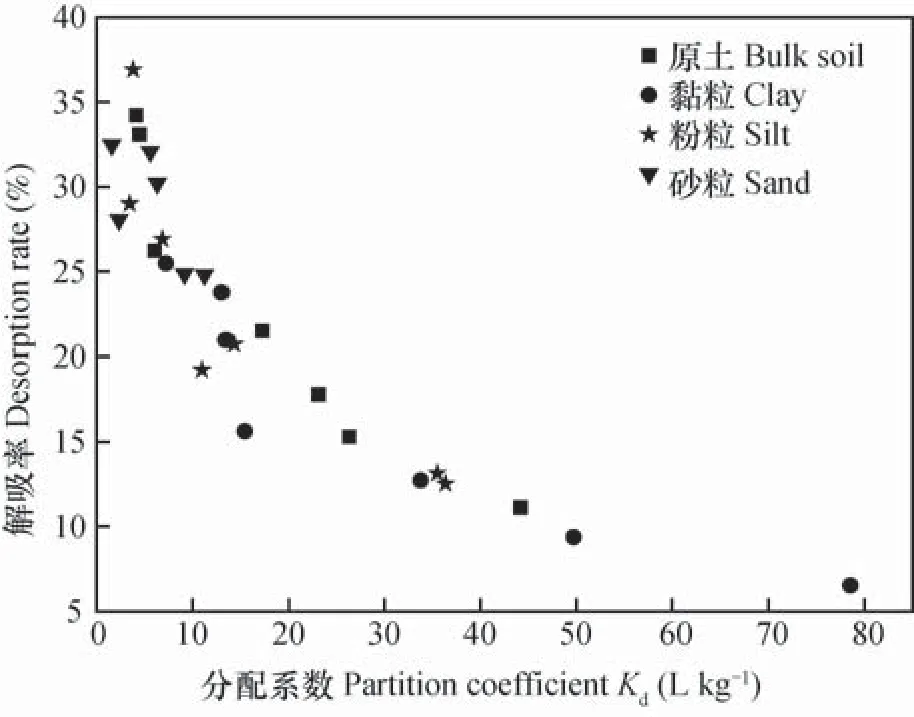
图2 丁草胺在不同土壤不同粒径组分/水界面分配系数和解吸率的关系Fig. 2 Relationship between partition coefficient(Kd)of butachlor and desorption rate in the interface of particles and soil water relative to particle-size fraction and soil
2.4 不同粒径组分对丁草胺吸附贡献率
以土壤各粒径在丁草胺初始浓度时的吸附量和质量百分含量为基础,根据式(5)计算出7种土壤不同粒径在丁草胺初始浓度下的吸附贡献率,结果如图3所示。由图3可看出,除了红壤2(S5),其他土壤各粒径对吸附丁草胺的贡献率大小顺序为:黏粒>粉粒>砂粒。各土壤黏粒组分对丁草胺吸附贡献率为36.7%~72.4%;粉粒组分对丁草胺吸附贡献率为21.7%~50.5%;除红壤2(S5)外,其他土壤砂粒组分对丁草胺的吸附贡献均小于10%。红壤2(S5)的砂粒组分对丁草胺吸附的贡献率达到39.0%,分析认为虽然此土壤砂粒组分对丁草胺的吸附能力很弱(Kd=2.35),但该组分含量极高,达到74.4%,故其吸附贡献率大,而黏粒组分和粉粒组分对丁草胺的吸附能力虽然强,但其含量太低(分别为11.5%和14.1%)。可见,除红壤2外,大部分类型土壤对丁草胺的吸附主要发生在黏粒组分中。
黄棕壤(S2)三粒径对丁草胺的吸附总贡献率为72%,这与前面三粒径组分TOC含量占总TOC含量69.01%(远小于100%)的结果相符。可能是因为本实验采用比重法(加入分散剂)测定土壤机械组成和虹吸法(完全物理方法分散)进行三粒径分级存在一定误差所致,也可能是在粒径分级时,抛弃了土壤中的轻组组分所致。褐土(S3)和黄壤(S6)三粒径组分对丁草胺吸附的总贡献率大于110%,与前面该两种土壤三粒径组分TOC含量占总TOC含量超过100%相符,同样是因为本实验采用比重法测定土壤机械组成和虹吸法进行三粒径分级存在一定误差所致。总之,此分析方法结果接近于理论值,可以有助于更清楚地了解土壤不同粒径组分对丁草胺的吸附贡献率。
2.5 有机碳对丁草胺在不同粒径有机无机复合体/水界面吸附行为的影响

图3 不同粒径组分对丁草胺吸附的贡献率Fig. 3 Contributions of different particle size fractions to butachlor sorption in the soil
许多研究表明[26-27],土壤TOC是影响土壤对农药吸附的关键因素,但也有研究表明[28-29],当土壤TOC含量≤20 g kg-1或农药本身带有极性功能团时,土壤矿物对农药吸附的影响几乎相当于甚至超过TOC的作用。然而,目前关于土壤有机、无机组分对农药吸附影响的报道主要是从土壤中提取纯化得到的腐殖质和蒙脱石、高岭石等纯矿物。由于土壤中的TOC和无机矿物一般以有机无机复合体形式存在,不同粒径组分中其有机、无机的复合程度不同,从而影响其对农药的吸附性能。为探明不同粒径组分中TOC的理化特性及其与无机矿物组分复合程度对土壤吸附丁草胺的影响,本研究对7种土壤及各土壤的三个粒径组分中TOC含量和Kd值作相关分析(图4)。由图4可知,7种土壤对丁草胺的分配系数Kd与TOC含量的决定系数为0.5558,各土壤三个粒径组分中Kd与TOC含量的拟合优度均优于原土中两者的拟合优度,且决定系数大小表现为:黏粒>粉粒>砂粒,由此说明,土壤及各粒径组分对丁草胺的吸附主要受土壤TOC的影响,但其影响程度却存在一定差异。这可能是由于TOC在土壤和各粒径组分中的理化特性不同,以及其与无机矿物组分的复合程度不同所致[30-31]。
为进一步了解不同粒径组分中TOC与无机矿物的复合程度对丁草胺吸附能力的影响,分别将不同粒径组分对丁草胺吸附贡献率和TOC含量占土壤总TOC含量百分率做相关性分析(图5)。由图5可知,黏粒组分两者百分含量的决定系数明显小于两者含量的决定系数,而砂粒组分两者百分含量的决定系数则明显大于两者含量的决定系数,粉粒组分两者百分含量的决定系数略大于两者含量的决定系数。分析认为,黏粒组分两者百分含量的拟合优度差,正好说明了TOC与无机矿物紧密地结合在一起,其对丁草胺的吸附能力很大程度上受到了黏土矿物的影响。而砂粒组分两者百分含量的拟合优度极强,说明此组分中TOC与无机矿物结合程度较低,TOC对丁草胺的吸附能力受无机矿物组分的影响较弱,TOC是控制丁草胺吸附的关键因素。对于粉粒组分,无机矿物组分对TOC吸附丁草胺有较小程度的影响。本研究运用此种分析方法,可以较好地排除不同土壤中TOC结构特性对吸附丁草胺的影响,从而更清楚地认识土壤各粒径组分中无机矿物对丁草胺吸附的影响。
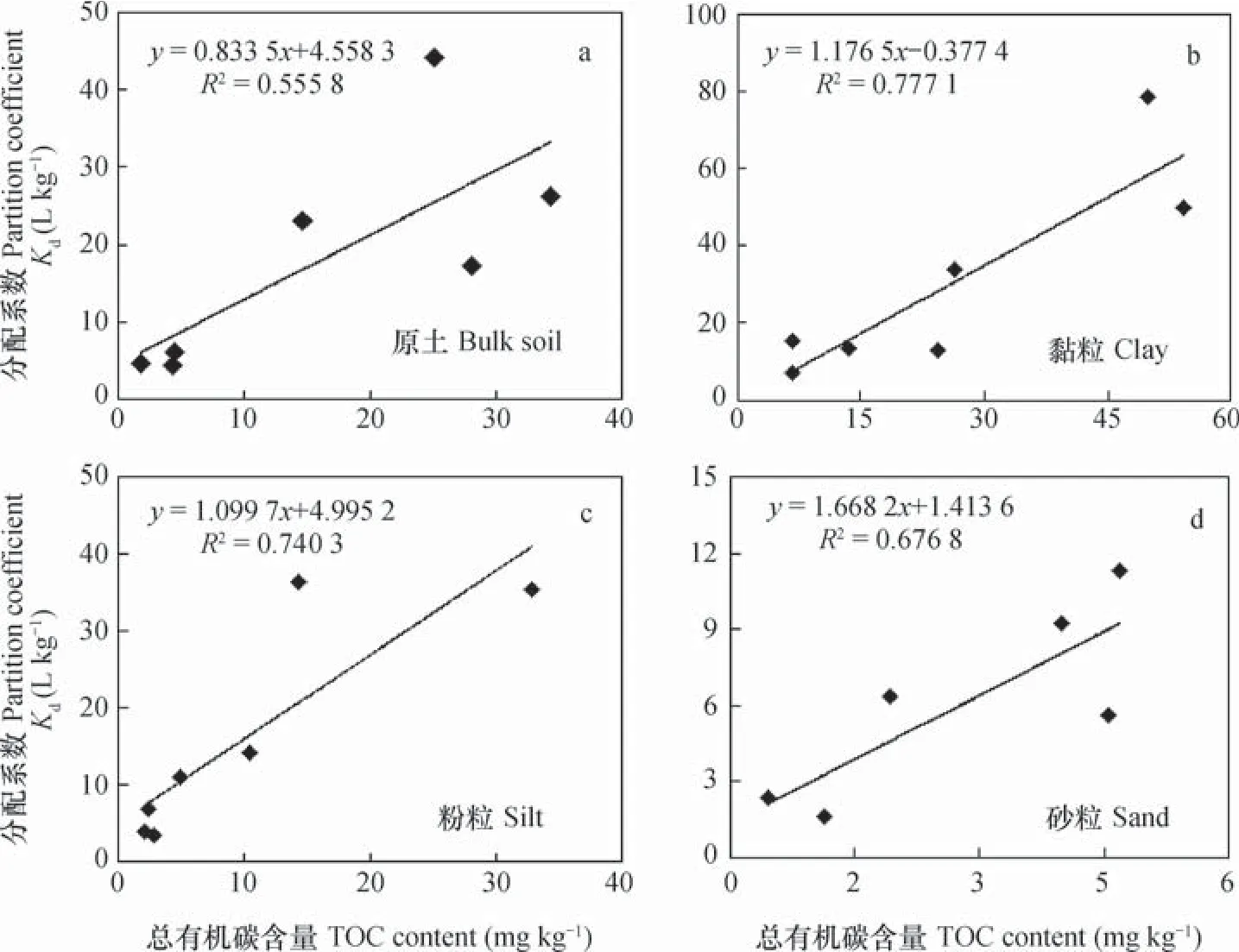
图4 不同粒径组分对丁草胺的分配系数Kd和各组分TOC含量的关系Fig. 4 Relationship between butachlor distribution coefficient(Kd)and content of total organic carbon(TOC)relative to particle-size fraction
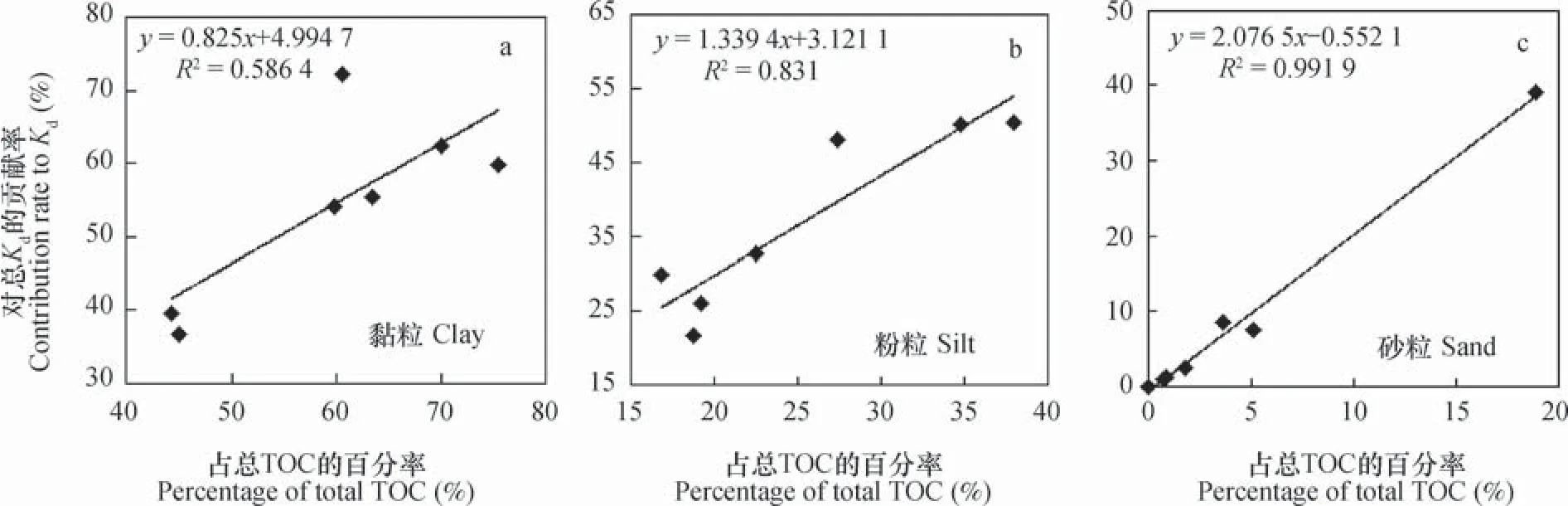
图5 不同粒径组分对丁草胺总Kd的贡献率和该组分所含TOC量占土壤总TOC量的百分数之间的关系Fig. 5 Relationship between contribution rate to Kdand percentage of TOC in the fraction against the total TOC in the soil relative to particle-size fraction
3 结 论
土壤各粒径组分对丁草胺的吸附量和吸附贡献率大小均表现为黏粒>粉粒>砂粒,而解吸率大小则表现为砂粒>粉粒>黏粒,这主要是由于土壤中50%以上的TOC分布于黏粒组分中,并与黏粒矿物复合形成有机无机复合体。TOC是影响土壤对丁草胺吸附的最重要因素,但其影响程度受不同土壤不同粒径组分中TOC的特性以及其与无机矿物的结合程度控制。黏粒组分中TOC对丁草胺的吸附受无机矿物影响较大,粉粒组分无机矿物对TOC吸附丁草胺的影响程度较小,而砂粒组分中TOC对丁草胺的吸附几乎不受无机矿物的影响。
[1]Zheng S L,Chen B,Qiu X Y,et al. Distribution and risk assessment of 82 pesticides in Jiulong River and estuary in South China. Chemosphere,2016,144:1177—1192
[2]Verma J P,Jaiswal D K,Sagar R. Pesticide relevance and their microbial degradation:A-state-of-art. Reviews in Environmental Science and Bio/Technology,2014,13:429—466
[3]Yu Y L,Wu X M,Li S N,et al. An exploration of the relationship between adsorption and bioavailability of pesticides in soil to earthworm. Environmental Pollution,2006,141:428—433
[4]He Y,Liu Z Z,Su P,et al. A new adsorption model to quantify the net contribution of minerals to butachlor sorption in natural soils with various degrees of organomineral aggregation. Geoderma,2014,232/234: 309—316
[5]Katz H,Mishael Y G. Reduced herbicide leaching by in situ adsorption of herbicide-micelle formulations to soils. Journal of Agricultural and Food Chemistry,2014,62:50—57
[6]Zhu L F,Li W,Zha J M,et al. Butachlor causes disruption of HPG and HPT axes in adult female rare minnow(Gobiocypris rarus). Chemico-Biological Interactions,2014,221:119—126
[7]Che C,Wang Y H,Zhao X P,et al. Combined toxicity of butachlor,atrazine and k-cyhalothrin on the earthworm Eisenia fetida by combination index(CI)-isobologram method. Chemosphere,2014,112:393—401
[8]Anbumani S,Mohankumar M N. Cytogenotoxicity assessment of monocrotophos and butachlor at single and combined chronic exposures in the fish Catla catla (Hamilton). Environmental Science and Pollution Research,2015,22:4964—4976
[9]Liu Z Z,He Y,Xu J M,et al. The ratio of clay content to total organic carbon content is a useful parameter to predict adsorption of the herbicide butachlor in soils. Environmental Pollution,2008,152:163—171
[10]Xu D P,Xu Z H,Zhu S Q,et al. Adsorption behavior of herbicide butachlor on typical soils in China and humic acids from the soil samples. Journal of Colloid and Interface Science,2005,285:27—32
[11]Chen J S,Chiu C Y. Characterization of soil organic matter in different particle-size fractions in humid subalpine soils by CP/MAS C-NMR. Geoderma,2003,117:129—141
[12]Kölbl A,Kögel-Knabner I. Content and composition of free and occluded particulate organic matter in adifferently textured arable Cambisol as revealed by solid-state13C NMR spectrodcopy. Journal of Plant Nutrition and Soil Science,2004,167:45—53
[13]鲁如坤. 土壤农业化学分析方法. 北京:中国农业科技出版社,2000
Lu R K. Analytical methods for soil and agro-chemistry (In Chinese). Beijing:China Agricultural Science and Technology Press,2000
[14]Balesdent J,Besnard E,Arrouays D,et al. The dynamics of carbon in particle-size fractions of soil in a forest-cultivation sequence. Plant and Soil,1998,201:49—57
[15]Chiou C T,Kile D E,Rutherford D W,et al. Partition characteristics of polycyclic aromatic hydrocarbons on soils and sediments. Environmental Science and Technology,1998,32:264—269
[16]Lee J F,Liao P M,Kuo C C,et al. Influence of a nonionic surfactant(Triton X-100)on contaminant distribution between water and several soil solids. Journal of Colloid and Interface Science,2000,229:445—452
[17]张雪丽,马福俊,伍斌等. 苯系物在红壤不同粒径组分上的吸附-解吸行为.安全与环境学报,2015,15:210—215
Zhang X L,Ma F J,Wu B,et al. Effect of different particle sizes of red soil on BTEX sorption and desorption(In Chinese). Journal of Safety and Environment,2015,15:210—215
[18]Liu Z Z,Ding N,Hayat T,et al. Butachlor sorption in organically rich soil particles. Soil Science Society of America Journal,2010,74(6):2032—2038
[19]刘新程,董元华. 金霉素在不同耕作土壤中的吸附-解吸行为. 土壤学报,2009,46(5):861—868
Liu X C,Dong Y H. Adsorption-desorption of chlortetracycline in various cultivated soils in China(In Chinese). Acta Pedologica Sinica,2009,46:861—868 [20]Alonso D G,de Oliveira R S Jr,Koskinen W C,et al. Sorption and desorption of indaziflam degradates in several agricultural soils. Scientia Agricola,2016,73:169—176
[21]Boivin A,Cherrier R,Schiavon M. A comparison of five pesticides adsorption and desorption processes in thirteen contrasting field soils. Chemosphere,2005,61:668—676
[22]Wu Q F,Li Z H,Hong H L,et al. Desorption of ciprofloxacin from clay mineral surfaces. Water Research,2013,47:259—268
[23]Wauchope R D,Myers R S. Adsorption-desorption kinetics of atrazine and linuron in freshwater-sediment aqueous slurries. Journal of Environmental Quality,1985,14:132—136
[24]Wang P,Keller A A. Sorption and desorption of atrazine and diuron onto water dispersible soil primary size fractions. Water Research,2009,43:1448—1456
[25]高敏苓,宋文华,依艳丽. 棕壤不同粒径组分对阿特拉津吸附-解吸作用的影响. 南开大学学报,2009,42:92—98
Gao M L,Song W H,Yi Y L. Effect of different particle-size separates of brown soil on the sorption and desorption of atrazine(In Chinese). Acta Scientiarum Naturalium Universitatis Nankaiensis,2009,42:92—98
[26]Prado B,Duwig C,Hidalgo C,et al. Transport,sorption and degradation of atrazine in two clay soils from Mexico:Andosol and Vertisol. Geoderma,2014,232/234:628—639
[27]李克斌,刘广深,刘维屏. 酰胺类除草剂在土壤上吸附的位置能量分布分析. 土壤学报,2003,40(4):574—580
Li K B,Liu G S,Liu W P. Site-energy distribution analysis for adsorption of selected acetanilide herbicides in soils(In Chinese). Acta Pedologica Sinica,2003,40:574—580
[28]汪翠萍,宋存义,李晖. 洁霉素在黏土和有机质土中的吸附特性研究. 土壤学报,2011,48(4):879—882
Wang C P,Song C Y,Li H. Adsorption characteristics of lincomycin in clay soil and organic soil(In Chinese). Acta Pedologica Sinica,2011,48(4):879—882
[29]Sun K,Gao B,Zhang Z Y,et al. Sorption of atrazine and phenanthrene by organic matter fractions in soil and sediment. Environmental Pollution,2010,158:3520—3526
[30]舒月红,黄小仁,贾晓珊,等. 不同粒径沉积物对1,2,4,5-四氯笨的吸附-解吸特性. 环境化学,2009,28:191—195
Shu Y H,Huang X R,Jia X S,et al. Sorptiondesorption characteristic of 1,2,4,5-tetrachlo benzene on sediment of different grain diameter sizes (In Chinese). Environmental Chemistry,2009,28:191—195
[31]Li H,Sheng G Y,Teppen B J,et al. Sorption and desorption of pesticides by clay minerals and humic acid-clay complexes. Soil Science Society of America Journal,2003,67:122—131
Effect of Soil Organo-Inorganic Compounds Different in Particle Size on Butachlor Sorption
HUANG Yufen LIU Zhongzhen†WEI Lan LI Yanliang HUANG Lianxi HUANG Qing XU Guizhi
(Key Laboratory of Plant Nutrition and Fertilizer in South Region,Ministry of Agriculture;Guangdong Key Laboratory of Nutrient Cycling and Farmland Conservation,Institute of Agricultural Resources and Environment,Guangdong Academy of Agricultural Sciences,Guangzhou 510640,China)
【Objective】The sorption of pesticides(including herbicides)by soil is an important factor affecting environmental behaviors of the substances. It is important to investigate effects of composition manner and complexation degree of the organic and inorganic components in particles different in size on pesticide sorption-desorption behaviors in the soil,and their contributions to pesticides sorption in the soil. 【Method】In the current study,soil samples of 7 different types of soils were collected from six different provinces or regions and processed physically and separately for extraction of three particle-size fractions,that is,clay(<0.002 mm),silt(0.02~0.002 mm),and sand(0.05~0.02 mm),of organo-inorganic compounds. The batch equilibrium method was used to explore rule for allocation of butachlor in the interfaces between different particle-sized compounds and soil solution and at the same time quantitative calculation was done of contributions of the different particle size fractions of compounds to the total butachlor adsorption in the soil. In the end,analysis was performed of butachlor adsorption characteristics of total organic carbon(TOC)in different particle size fractions from the angle of organo-inorganic compounds.【Result】 Results show that the clay fraction was the highest in butachlor adsorption capacity but the lowest in desorption rate,while the sand fraction was the lowest in adsorption capacity but the highest in desorption rate. The contribution rate of the three fractions to butachlor adsorption ranged from 36.7 to 72.4%,from 21.7 to 50.5 % and<10 % for clay,silt and sand fractions,respectively. TOC was the key factor affecting butachlor sorption in the three fractions of the soil,but how much was the effect depends on physico-chemical properties of the TOC per se in each fraction and degree of the TOC compounding inorganic minerals. In the clay fraction,butachlor retention on TOC was affected significantly by inorganic minerals;in the silt fraction,it was not much affected;while in the sand fraction,it was almost not affected. 【Conclusion】In the current study,bioavailability of butachlor absorbed in different soil size fractions and migration of the substance in the environment was effectively predicted. The findings can be used to serve as theoretical basis for farmers to rationalize application of butachlor in the light of soil type so as to reduce environmental pollution.
Butachlor;Organo-inorganic compounds;Particle-size;Adsorption;Total organic carbon
S153.3
A
10.11766/trxb201605130237
(责任编辑:檀满枝)
* 国家自然科学基金项目(41571313)、广东省自然科学基金项目(2016A030313772,2015A030313570)和浙江省亚热带土壤与植物营养重点研究实验室项目共同资助 Supported by the National Natural Science Foundation of China(No. 41571313),the Natural Science Foundation of Guangdong Province(Nos. 2016A030313772,2015A030313570 )and Zhejiang Provincial Key Laboratory of Subtropic Soil and Plant Nutrition
† 通讯作者 Corresponding author,E-mail:lzzgz2001@163.com
黄玉芬(1983—),女,广东潮州人,硕士,助理研究员,主要从事土壤有机污染环境行为和生态修复研究。E-mail:hyf0758@163.com
2016-05-13;
2016-07-19;优先数字出版日期(www.cnki.net):2016-09-30
