固相萃取-气相色谱/质谱法测定地下水中15种农药残留
2017-04-18董军袁鹏辉马超高帅王青华范晓静
董军,袁鹏辉,马超,2,高帅,王青华,范晓静
(1. 山东省地矿工程勘察院,山东 济南 250014;2. 中国石油大学(北京)重质油国家重点实验室,北京 102249)
固相萃取-气相色谱/质谱法测定地下水中15种农药残留
董军1,袁鹏辉1,马超1,2,高帅1,王青华1,范晓静1
(1. 山东省地矿工程勘察院,山东 济南 250014;2. 中国石油大学(北京)重质油国家重点实验室,北京 102249)
通过优选色谱柱,进一步改进色谱分离条件,优化前处理方法,建立一种快速高效测定地下水中15种农药残留量的GC-MS方法。该法采用分段法选择离子(SIM)扫描,具有更高的灵敏度、较低的检出限和较高的回收率,检出限低于0.004 8 μg/L,回收率为85.9%~107.4%。本方法的突出特点是前处理速度快、萃取溶剂用量少、环境污染小、色谱运行时间短,基本稳定在25 min内完成分析,适用于大批量样品检测。
地下水;农药;GC-MS
农药施用过程,仅有1%左右作用于靶生物,其余的或残留于土壤,或通过地表径流、淋溶、干湿沉降等方式进入水体,从而对土壤生物和水生生物产生不利影响[1]。当农药在地下水中的浓度超过一定限量时,会对人体健康造成风险,预警则是科学判定环境风险变化、提升环境应急响应水平和规避环境风险的有力手段[2]。我国《生活饮用水卫生标准》(GB 5749—2006 )[3]中规定了马拉硫磷等近20种农药的限量值,部分农药的限量值低至 0.001 mg/L。为保证地下水安全,更加准确地评价水质状况,亟须针对地下水中的农药残留,建立简单、快速、准确、高效、灵敏的测定方法,为地下水调查提供技术支持。现参考EPA的方法[4],建立固相萃取(SPE)与气质联用(GC/MS)相结合的方法[5-11],同时测定地下水中较难分离并定量的15种农药残留。
1 实验部分
1.1 仪器与试剂
7890B/5977A气相色谱-质谱联用仪(Agilent公司,美国);Turbo Vap II全自动氮吹浓缩仪(Biotage公司,瑞典);24道固相萃取装置(Supelcd公司,美国);GM-0.33A隔膜真空泵(津腾实验设备有限公司);BK-360B超声波清洗机(济南巴克超声波科技有限公司);PRACTUM124-1CN电子天平(Sartorius公司,德国);T-50溶剂过滤器(津腾实验设备有限公司);GZX-9070MBE电热鼓风干燥箱(上海博迅实业有限公司);Molelement1810a超纯水机(上海摩勒科学仪器有限公司)。
乙酸乙酯、正己烷、丙酮、甲醇(色谱纯,天津市科密欧化学试剂有限公司);无水硫酸钠柱(5 g/12 mL,博纳艾杰尔科技);盐酸(优级纯,南京化学试剂股份有限公司);定制农残混合标样(除五氯酚为400 mg/L,其他组分均为100 mg/L,溶剂为甲醇,天津阿尔塔科技有限公司)、内标(苊-D10、菲-D10,均为0.5 g/L,AccuStandard公司,美国)及替代物(十氯联苯,纯度≥99.0%,国家标准物质中心);实验用水为无有机物的二次蒸馏水。
1.2 实验条件
1.2.1 色谱条件
DB-35MS色谱柱(30 m×0.25 mm×0.25 μm),载气为氦气(纯度99.999%);柱温箱升温程序:50 ℃保持1 min,以25 ℃/min升至160 ℃,以3 ℃/min升到280 ℃,280 ℃保持15 min;不分流进样,进样量为1 μL,进样口温度300 ℃,传输线温度280 ℃,在m/z 35~500范围内进行全扫描。
1.2.2 质谱条件
电离模式:电子轰击(EI);轰击能量70 eV;灯丝电流60 μA;离子源温度230 ℃,四极杆温度150 ℃;溶剂延迟时间5.0 min;全扫描(SCAN)用于目标物定性分析,选择离子检测(SIM)定量(依据保留时间,分成5~10 min,10~17 min,17~21 min和21 min到试验结束4段监测,并通过定量离子进行定量),各目标物定量离子及保留时间见表1。

表1 15种农药的定量离子、保留时间及线性、精密度及检出限
1.2.3 预处理条件
将C18固相萃取小柱(1 g/6 mL,Waters公司,美国)固定在固相萃取装置上,依次加入5 mL二氯甲烷、5 mL二氯甲烷和乙酸乙酯混合溶液(1∶1,V/V)、5 mL甲醇进行活化,近干时加10 mL实验用水,保持水位高于小柱内填料。
水样以指定流速流经活化后的C18固相萃取小柱进行富集,然后用一定量的洗脱剂洗脱后待测。
2 结果与讨论
2.1 色谱柱的选择
采用HP-5MS柱(30 m×0.25 mm×0.25 μm)与DB-35MS柱(30 m×0.25 mm×0.25 μm),比较不同极性的色谱柱对农药残留的分离效果,结果见图1(a)(b),各峰号对应化合物同表1。由图1可见,采用DB-35MS柱,各组分分离效果明显较好,故确定使用DB-35MS柱。

图1 15种农药残留量全扫描总离子流色谱图
2.2 洗脱剂的选择
乙酸乙酯、乙腈和丙酮是较常用的洗脱剂,通常能够获得较高的回收率,由于乙腈毒性较强,故选取乙酸乙酯、正己烷、丙酮、1∶1(V/V)的正己烷和丙酮混合溶剂分别进行洗脱,考察不同洗脱剂的洗脱效果,结果见图2。

图2 不同洗脱剂对回收率的影响
由图2可见,正己烷对15种农药的回收率最低;1∶1的正己烷、丙酮混合溶剂与丙酮的回收率大体相当,基本>65%,但是进样分析后的色谱图基线波动较大;乙酸乙酯洗脱得到的回收率最高,且含有较少的共提取物。因此,确定乙酸乙酯为地下水中15种农药残留量检测的洗脱剂。
2.3 样品富集流速选择
水样流经C18固相萃取小柱的流速对回收率的影响也较大。通过设置不同流速发现,流速为8 mL/min时,回收率较稳定,但工作效率较低;流速>15 mL/min时,个别组分回收率起伏较大,且C18固相萃取小柱有被击穿的可能。为了保证回收率,并实现快速分析,确定样品富集流速为10 mL/min。
2.4 样品除水方式选择
水样流经C18固相萃取小柱后,可通过抽真空除去固相萃取小柱内的水分。现设定抽真空时间分别为0,0.5,1.0,5.0和10.0 min,比较抽真空时间不同对农药残留回收率的影响。结果显示,六氯苯与七氯随着抽真空时间的延长,其回收率呈降低趋势,其他组分的回收率无明显变化。考虑到接下来可借助无水硫酸钠小柱进行脱水,故本法不选用抽真空方式除水。
2.5 样品洗脱剂用量选择
加入不同用量的乙酸乙酯进行洗脱,考察洗脱剂用量对回收率的影响。结果表明,随着乙酸乙酯加入量不断增大,样品回收率逐渐变大并趋于稳定。从节约成本、减少污染,及满足分析要求角度考虑,确定用洗脱剂用量为15.0 mL。
2.6 标准曲线
用定制农残混合标样配制5 mg/L(五氯酚为20 mg/L)的标准储备液,然后移取100 μL至1 mL容量瓶中,用甲醇定容,得到质量浓度为500 μg/L(五氯酚为2 000 μg/L)的农药标准中间液。将质量浓度为500 mg/L的苊-D10、菲-D10混合内标溶液用甲醇稀释10倍,得到质量浓度为50 mg/L的内标使用液。
以甲醇为溶剂,用农药标准中间液、内标使用液和替代物溶液配制各目标化合物质量浓度为20.0,50.0,100.0,200.0,400.0 μg/L(其中五氯酚浓度为各标准曲线点上其他目标化合物浓度的4倍)的标准曲线工作液系列,每个标准曲线工作液中含有相同浓度的内标和替代物,内标物为100 μg/L,替代物为50.0 μg/L。标准曲线工作液储存于棕色玻璃瓶中,4℃低温避光保存。定期检查该标准曲线工作液,确保没有降解。对标准曲线工作液系列进行分析,所得结果进行线性拟合,结果见表1。由表1可见,各目标化合物在20.0~400.0 μg/L(五氯酚为80.0~1 600 μg/L)范围内线性良好,相关系数均>0.995。
2.7 方法精密度、检出限与加标回收率
取1 L实验用水,分别加入不同体积的农药标准中间液,配制成目标化合物质量浓度分别为5.0,7.5,10.0 ng/L的加标水样(其中内标物质量浓度为100 ng/L,替代物质量浓度为50 ng/L),各浓度分别重复测定7次,计算7次平行测定的标准偏差,按照MDL=t(n-1,0.99)×S计算方法检出限,并统计加标回收率,结果见表1。由表1可见,该法与《GB 5749—2006》附录B中的检测方法[12]比,具有检出限低、回收率高、前处理速度快、分析时间短等优势。
2.8 实际样品测定
按本文方法对济南市某地区的样品进行实际检测,由于靠近蔬菜大棚基地,部分水样中检出痕量农药残留,但均未超出国家限量值,结果见表2,未检出化合物未列出。
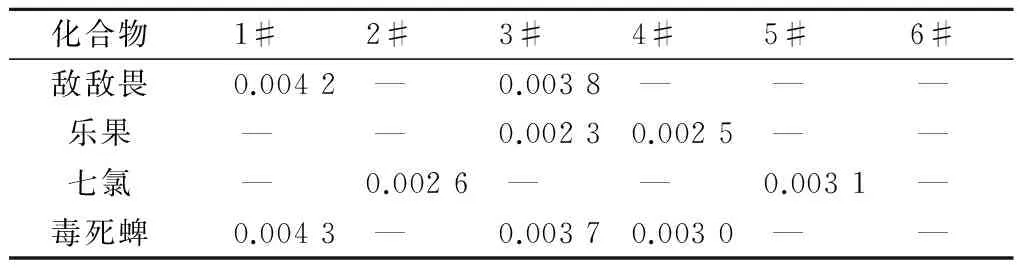
表2 实际样品中半挥发性有机物的测定 μg/L
3 结语
固相萃取-气相色谱/质谱法(SPE-GC-MS)测定地下水中15种农药残留量,分离效果好,检出限低,重现性好,方法回收率高,能够快速准确、科学严谨地批量测定地下水中15种农药残留。
[1] 刘锋章. 农药对自然环境和人类社会的负面影响及危害[J]. 山东环境,1998(4):70-77.
[2] 毕军,曲常胜,黄蕾. 中国环境风险预警现状及发展趋势[J].环境监控与预警,2009,1(1):1-5.
[3] 中华人民共和国卫生部,中国国家标准化管理委员会. 生活饮用水标准检验方法 总则:GB/T 5750.1—2006 [S]. 北京:中国标准出版社, 2006.
[4] EPA 3535. A Solid Phase Extraction revision 1 [S].
[5] 万益群,李申杰,付贵琴. 中草药中有机磷及氨基甲酸酯类农药残留量的GC-MS测定[J].分析试验室,2007, 26(6):81-84.
[6] 何笑荣,邹定,冯金红,等. 固相萃取GC-MS法测定金银花中有机磷农药残留量[J]. 中国药学杂志,2007, 42(24):1901-1904.
[7] 钟洪兰,谢立,黄华英. GC-MS检测中草药中残留的有机磷农药[J]. 实用医学杂志,2005,21(3):315-316.
[8] 霍江波,王小逸,孙东玲,等. 离子液体富集-热脱附-气相色谱-质谱联用法测定空气中半挥发性有机物[J]. 分析化学研究报告,2014,42(4):531-535.
[9] 高冉,饶竹,郭晓辰,等. 气相色谱-质谱法同时测定地下水中42种半挥发性有机污染物[J].分析测试学报,2014,33(5):539-544.
[10] 贾妍艳,谭建华,徐晨,等. 固相萃取-气相色谱-质谱法同时测定水中9种药品及个人护理用品[J].色谱,2014,32(3):263-267.
[11] 孟凡生,陈晶,王业耀. 环境中多环芳烃前处理和分析方法[J].环境监控与预警,2011,3(1):12-16.
[12] 中华人民共和国卫生部, 中国国家标准化管理委员会. 生活饮用水标准检验方法 有机物综合指标:GB/T 5750.8—2006 [S].北京:中国标准出版社,2006.
SPE-GC/MS Method for the Determination of 15 Pesticide Residues in Ground Water
DONG Jun1,YUAN Peng-hui1,MA Chao1,2,GAO Shuai1,WANG Qing-hua1,FAN Xiao-jing1
(1.ShandongGeologicalEngineeringInvestigationInstitute,Jinan,Shangdong250014,China; 2.ChinaUniversityofPetroleum,Beijing,StateKeyLaboratoryofHeavyOilProcessing,Beijing102249,China)
The GC-MS method for the determination of 15 pesticide residues in ground water was established by utilizing the appropriate chromatographic column, further improving the chromatographic separation condition and optimizing the pretreatment method. The outstanding characteristic of this method is the fast processing speed, less solvent consumption, less environmental pollution and short running time within 25 min, which is suitable for the detection of large quantities of samples. In addition, select ion monitoring (SIM) mode combined with segmentation obtained higher sensitivity. This method has better recover and lower detection limit, the detection limit is less than 0.004 8 μg/L, and the recovery rate ranged from 85.9%~107.4%.
Groundwater; Pesticides; GC-MS
2016-07-26;
2016-08-11
山东省2015年度31个省级地质勘查基金资助项目(SDZS-2015-GTT01)
董军(1988—),男,工程师,本科,从事水中有机污染物分析与监测工作。
X832; O657.6; O657.7
B
1674-6732(2017)01-0028-04
