环境糖皮质激素受体干扰物的研究进展
2017-04-18沈艳红史薇于红霞
沈艳红,史薇,于红霞
(污染控制与资源化研究国家重点实验室,南京大学环境学院,江苏 南京 210023)
·前沿评述·
环境糖皮质激素受体干扰物的研究进展
沈艳红,史薇*,于红霞
(污染控制与资源化研究国家重点实验室,南京大学环境学院,江苏 南京 210023)
综述了糖皮质激素受体干扰物的作用机制和生态效应,列举了多种活性筛选方法,并根据性质对干扰物进行了种类的划分。在当前环境糖皮质激素受体干扰物研究的基础上,指出了作用机制的研究不全面、个体生物筛选方法匮乏、缺少可信的活性模拟预测技术等问题,并提出了应借助模式生物完善作用机制研究,在此基础上建立稳定、高通量的个体生物活性筛选方法和动力学过程模拟替代技术用以活性预测等发展方向。
糖皮质激素;受体干扰;作用机制;活性筛选;内分泌
内分泌干扰物(Endocrine Disrupting Chemicals,即EDCs),也称为环境激素(Environmental Hormone),是指环境中存在的能够干扰生物体内源激素的合成、释放、转运、结合、作用或清除的外源性物质。其能够通过模拟或拮抗内源性激素,影响激素受体家族,干扰内源性激素的产生进而改变内分泌与生殖系统的正常功能。内分泌干扰物根据激素效应的不同,可分为雌激素干扰物、雄激素干扰物、甲状腺激素干扰物、孕激素干扰物、糖皮质激素干扰物、胰岛素干扰物、肾上腺皮质激素干扰物、生长激素干扰物等[1]。目前,对于内分泌干扰物质的研究主要集中在拟/抗雌激素物质,大量的研究报道了其在环境中的存在状况,对人类及生物的影响及作用机理,环境介质中的迁移以及转化行为等[2-5]。此外,关于环境雄激素和甲状腺激素的研究也在日益增多[6-7]。
文献[8]研究表明,人体内糖皮质激素受体(Glucocorticoid receptor,GR)的异常调节,是抑郁症的一个主要致病因。随后,有学者利用3T3-L1细胞株,发现双酚A(Bisphenol A,BPA)、邻苯二甲酸二环己酯(Dicyclohexyl phthalate,DCHP)、异狄氏剂(Endrin)和对甲抑菌灵(Tolylfluanid,TF)等环境物质,可通过激活糖皮质激素受体,加快细胞中脂肪的生成,从而导致肥胖、糖尿病等流行病的形成[9]。
1 糖皮质激素受体干扰物的作用机制
糖皮质激素受体是一种可溶性单链多肽组成的磷蛋白,其在结构上主要由2个功能区组成,包括DNA 结合域(DNA binding domain,DBD)和配体结合域(ligand binding domain,LBD)。其中DNA 结合域的主要功能是识别靶基因上具有增强子性质的特异DNA序列——激素反应元件(hormone response elements,HRE)并与之结合,调节效应基因的转录。配体结合域则主要与配体结合有关[10]。糖皮质激素受体是一种依赖配体激活的内源性转录因子。当没有糖皮质激素与之结合时,GR 在细胞质内以蛋白复合体形式存在,此复合体包括一个受体分子和四分子热休克蛋白(heat shock protein, HSP),不具有刺激转录的活性[11]。当糖皮质激素进入细胞质后,特异性地与糖皮质激素受体结合形成配体-受体复合物,GR与热休克蛋白解离并发生自身构象的改变,暴露出被覆盖的DNA结合域,从而启动核转位信号,使配体-受体复合物进入细胞核,并进一步识别靶细胞核中HRE与之结合。在转录共激活因子及基础转录复合物中转录因子相互作用下,最终特异性地促进靶基因的表达而发挥激素效应[12]。
环境糖皮质激素受体干扰物按作用机制划分,可分成拟糖皮质激素物质和抗糖皮质激素物质。拟糖皮质激素物质的作用机制与内源糖皮质激素相类似,当环境拟糖皮质激素与GR结合形成配体-受体复合物后,在构象改变的前提下识别细胞核中的HRE并与之结合,从而发挥类激素效应,因此,拟糖皮质激素物质也可称作糖皮质激素受体的激动剂。而另一类物质虽可以与GR相结合,却能产生迥然不同的结果,称之为抗糖皮质激素物质,亦可称作糖皮质激素受体的拮抗剂。当抗糖皮质激素与糖皮质激素受体结合后,可抵抗糖皮质激素与GR结合或是阻止共调节因子的结合,使GR处于未被激活的状态,阻止其发挥生理效应[13]。
2 糖皮质激素受体干扰物活性筛选方法
内分泌干扰物质的筛选,如环境雌激素,一般采用体内分析和体外分析相结合的方法,综合评价物质的毒性效应。环境糖皮质激素干扰物由于目前研究匮乏,存在技术短板,在筛选物质方面,多采用能够大规模快速分析的体外分析方法。常用的环境糖皮质激素干扰物体外活性筛选方法包括受体竞争结合实验、报告基因实验、转录激活实验等。受体竞争实验的原理是:糖皮质激素与糖皮质激素受体的结合引起反应,通过体外测定外源性化合物与糖皮质激素受体的亲和力初步判定其糖皮质激素干扰活性。主要操作过程包括从组织中分离出糖皮质激素受体, 之后用已知的外源性化合物与使用放射性标志物标记的糖皮质激素进行竞争性替换,通过替换实验来评估该外源性化合物的糖皮质激素效应活性。Tajika等[14]即利用3H标记的地塞米松和抗炎药二氟孕甾丁酯(difluprednate)开展受体竞争结合实验,进而评估药物使用的安全性。但受体结合实验仅能表明某种外源性化合物与糖皮质激素受体的结合能力,而无法研究其在生物体内的代谢情况及对受体的激活能力。为了弥补这一局限,科学家们尝试开展其他的体外实验,提出了报告基因实验。其原理是利用基因工程技术,将已知的反应原件剪接到报告基因上游,从而控制报告基因的表达并构建出基因重组质粒,转染至宿主细胞内。当外源化合物与糖皮质激素受体结合后,可启动宿主细胞中报告基因的表达。荧光素酶由于其敏感性高和线性范围宽,已成为哺乳动物中最常用到的报告基因类型[15]。报告基因实验既可检测化学物与受体的结合能力,又可检测结合后引起的生物学效应,而且能够区分激动剂和拮抗剂,故现有的关于环境糖皮质激素活性筛选实验,均以报告基因法为主[15-17],所用的细胞系包括MDA-kb2、CHO-K1,其优点在于能反映对人体的作用,且操作简单、灵敏度较高。表1详细列出了目前2种常用的环境糖皮质激素受体干扰物体外活性筛选方法。
此外,运用计算的方法预测毒性,也是筛选环境糖皮质激素的一种有效手段。在糖皮质激素活性筛选方面,常用的计算模拟方法包括定量构效关系(Quantitative Structure-Activity Relationship,QSAR)、分子对接技术(Molecular Docking)等。QSAR是用化合物的分子结构参数与已从实验中获得的生物活性数据建立统计模型,然后用于预测未进行测试的化合物的活性[18]。

表1 环境糖皮质激素干扰物体外活性筛选方法
QSAR方法的实现,需要2点假设:化合物的结构参数与所研究性质如活性、毒性等性质之间存在定量关系,并且可以用数学、统计学和计算机科学的方法探索和描述[19-20]。目前,QSAR方法已经在研究中得到了广泛运用[21]。此外,随着计算毒理学的不断发展,分子对接技术也开始逐渐运用于糖皮质激素干扰物活性的筛选中。分子对接是指通过计算配体与受体之间的静电作用、氢键作用、疏水作用、范德华作用等,依据“锁-钥理论”来模拟小分子配体和生物大分子受体相互作用的技术手段[22]。Kolšek等[23]运用分子对接技术,模拟了双酚A(BPA)在内的4种化合物与14种人体核受体之间的结合。
以BPA为例,计算结果显示其具有拟糖皮质激素活性,与文献报道很好地吻合。然而,对于环境中糖皮质激素受体干扰物的活性预测方面,这2种方法仍然存在着诸多不足。QSAR方法需要使用已有的实验数据作为训练集来建模。然而目前对于环境糖皮质激素干扰物的研究仍缺乏足够的数据,故无法建立有效的模型,此外在解释致毒机制上,该方法也很受限制,但可为进一步的研究提供有力基础。在分子对接中,生物大分子不具有柔性,不能考察生物大分子与小分子化合物结合的动态过程,从而不利于后续研究。
3 糖皮质激素受体干扰物的种类与性质
3.1 拟糖皮质激素物质
环境中的糖皮质激素可分为天然糖皮质激素和人工合成糖皮质激素。天然糖皮质激素主要包括皮质酮(cortisone)和皮质醇(cortisol),广泛存在于灵长类及啮齿动物体内,具有调节糖、脂肪、和蛋白质生物合成和代谢的作用,还具有抑制免疫、抗炎、抗毒、抗休克作用。由于糖皮质激素的多种生理功能,目前人工合成了大约30种以上的糖皮质激素,被广泛应用于医疗[24]。
这类药物主要包括地塞米松(dexamethasone)、泼尼松(prednisone)、泼尼松龙(prednisolone)、曲安西龙(triamcinolone)、曲安奈德(triamcinolone acetonide)、布地奈德(budesonide)、丙酸氯倍他索(clobetasol propionate)、戊酸倍他米松(betamethasone valerate)等。几类主要糖皮质激素的物化性质见表2。
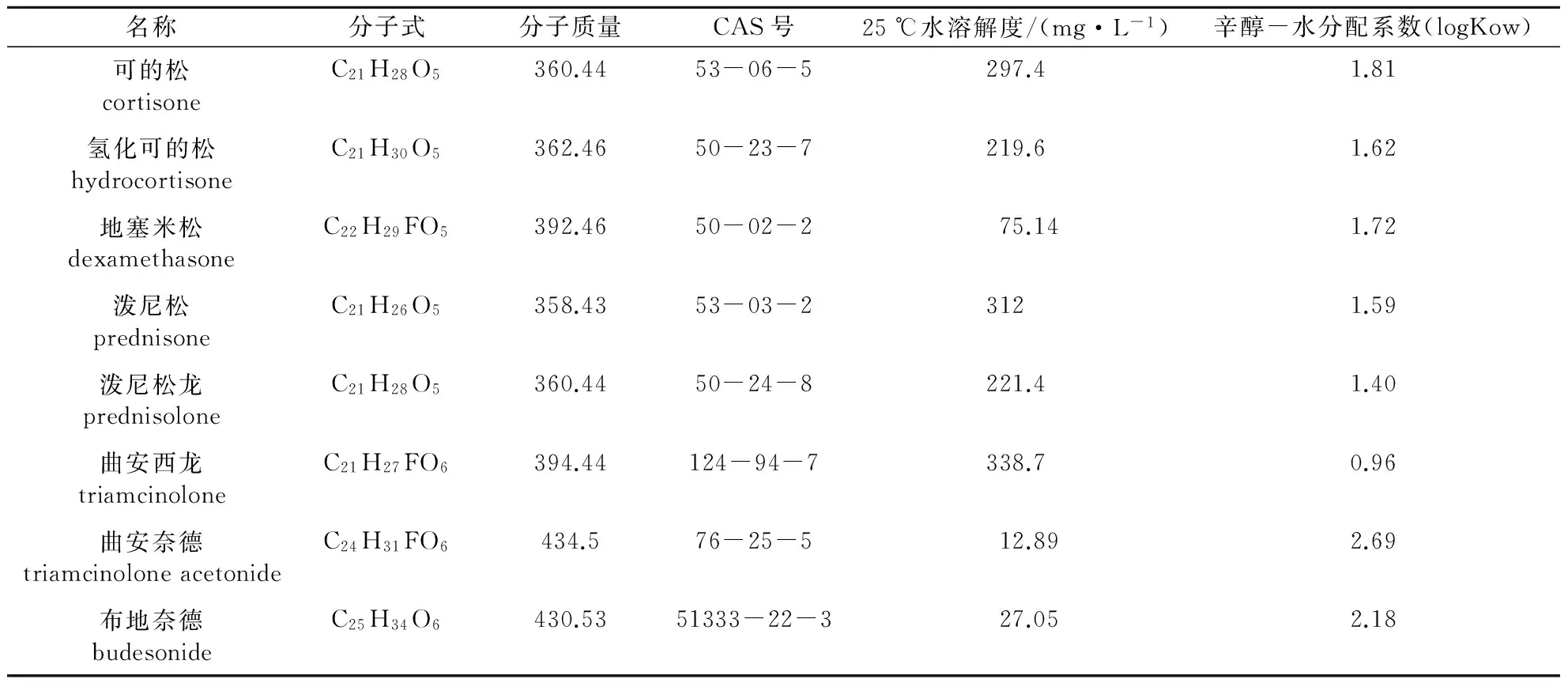
表2 主要糖皮质激素的物化性质①
①由于实验数据的缺失,25 ℃水溶解度和辛醇-水分配系数是通过美国EPA推荐的EPA Suite 4.1版软件计算获得。
由表2可见,这8种常见糖皮质激素的辛醇-水分配系数较为接近,为0.96~2.69,易溶于水体。Chang等[25]借助高效液相色谱质谱联用技术(LC-MS/MS),检测了城市河流中6种药用糖皮质激素的浓度。在41个采集的样本中,可的松、氢化可的松、地塞米松和泼尼松龙检出率高达96%~100%,泼尼松次之为53%,甲基强的松龙的检出频率最少仅为6.7%。其中可的松和氢化可的松的质量浓度分别为0.11~20 ng/L和0.05~28 ng/L,其值远高于其他4种糖皮质激素(地塞米松0.05~8.0 ng/L、甲基强的松龙0.20~0.41 ng/L、泼尼松龙0.25~1.8 ng/L、泼尼松0.04~2.4 ng/L)。
3.2 抗糖皮质激素物质
目前,已有一些学者通过开展体外细胞实验,对环境中的污染物进行了糖皮质激素活性的检测。其中,包括农药、多溴联苯醚(PBDEs)、有机磷酸酯类在内的多种污染物被检出了抗糖皮质激素活性。
Zhang等[15]利用荧光素酶报告基因法,研究34种农药对于人体糖皮质激素受体的活性效应。实验表明,测试的34种农药均没有表现出拟糖皮质激素活性,但是其中的12种农药表现出了明显的抗糖皮质激素活性,包括联苯菊酯、λ-三氟氯氰菊酯、氯氰菊酯、苄呋菊酯、3-苯氧基苯甲酸、o,p′-DDT、p,p′-DDT、p,p′-DDE、甲氧DDT、杀虫丹、阿特拉津和对甲抑菌灵。研究表明,这12种农药的活性大小不等,其中p,p′-DDT的抗性最强,阿特拉津的抗性最小,两者的RIC20(使糖皮质激素活性表达受到20%抑制时的化合物浓度)值最大可相差234倍。这些农药在日常生活中应用普遍,易残留于土壤中,并随地表径流及蒸发、干湿沉降等方式迁移到水体中,在环境中被广泛检出。这些农药一般具有亲脂性、化学性质稳定、不易被降解、易挥发和残留期长等特点,可通过生物富集和食物链的放大作用在体内富集。
Kojima等[26]通过使用中国仓鼠卵巢细胞,研究了8种PBDEs、4种HO-PBDEs和4种MeO-PBDEs的糖皮质激素活性效应。实验证明,在这16种被测物质中,有7种物质,包括2种HO-PBDEs和2种MeO-PBDEs显示了微弱的抗糖皮质激素活性。PBDEs作为一种阻燃剂,被广泛应用到了塑料制品、油画、纺织品等材料中。由于其可持续性和生物积累性,在环境样品,如河流沉积物、鱼体、室内空气和灰尘中,均检测到了PBDEs的存在[27-28]。
Stapleton等[29]借助气相色谱质谱联用技术,发现在每个灰尘样品中均检测到PBDEs,经计算发现,1~4岁儿童每天对PBDEs的摄入量可达120~6 000 ng,具有较高的潜在风险。
Kojima等[16]通过细胞反式激活实验,研究了11种有机磷阻燃剂(OPFRs)GR活性。研究表明,磷酸三丁酯、磷酸三(1,3-二氯-2-丙基)酯、磷酸三(2-乙基)己基酯、磷酸三苯酯和磷酸甲苯这5种物质被检测到抗糖皮质激素活性,且毒性大小较为相似,RIC20值基本为11~22 μmol/L。作为溴代阻燃剂的替代物,有机磷阻燃剂被广泛应用在建筑材料、纺织品、电子产品方面。经统计,在日本,有机磷阻燃剂的应用已经远远超过了多溴联苯醚,同时,越来越多的文献开始报道在室内样品中检测到了多种有机磷阻燃剂[28]。
此外,Johansson等[17]利用人类的糖皮质激素受体进行了结合实验,发现PCBs的代谢产物具有显著的抗糖皮质激素活性。而Sargis[9]发现双酚A、邻苯二甲酸二环己酯、异狄氏剂等环境物质均可与糖皮质激素受体相结合,具有潜在内分泌干扰活性。
目前在被检测的近90种化合物中,共有32种物质被报道出具有抗糖皮质激素受体活性,其余物质均未能检测出糖皮质激素活性。表3列出了文献报道的不同抗糖皮质激素物质相对RU486(又名米非司酮(mifepristone),常用作衡量抗糖皮质激素活性的标准物质)的影响因子,其中毒性最强的p,p′-DDT,其RIC20值为1.05×10-8mol/L,是标准物质RU486的1.10倍。毒性最小的为BDE-100,其RIC20值仅为RU486的6.71×10-4倍。遗憾的是,目前关于环境中的糖皮质激素受体干扰物的报道仍相对较少,仅有少量研究检测到了显著的抗糖皮质激素效应。

表3 不同抗糖皮质激素物质相对RU486的影响因子
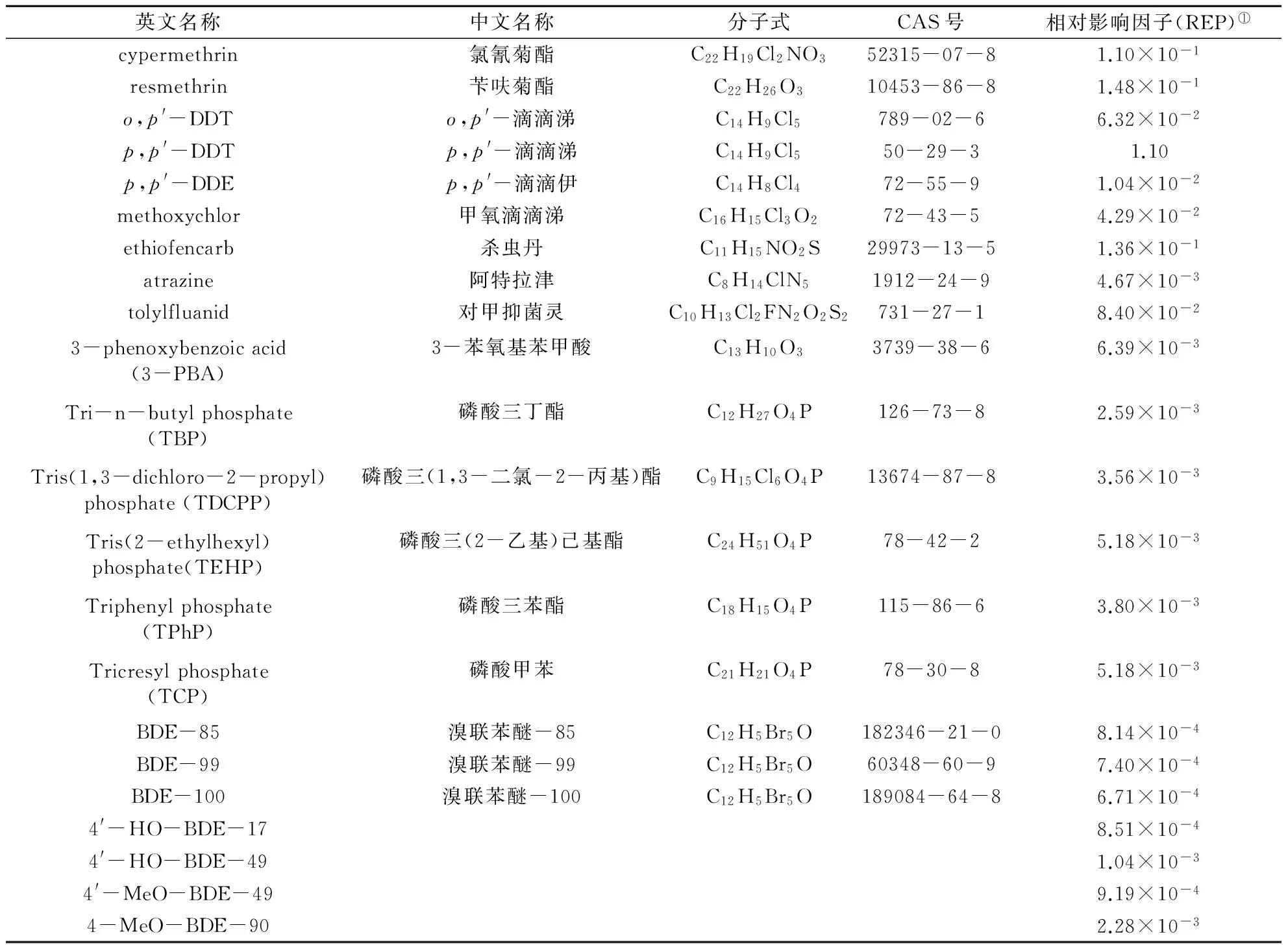
续表
4 环境糖皮质激素受体干扰物的生态效应
4.1 糖皮质激素受体干扰物的生物毒理学效应
糖皮质激素受体作为核受体家族中的重要成员,在代谢、应激、内分泌及免疫系统等方面均发挥着重要的作用[30]。文献[31]研究表明,GR功能缺失的小鼠,体内糖皮质激素水平异常升高,其含量是正常小鼠含量的10倍左右,与临床上库辛综合征患者病理生理相一致。GR受损的小鼠中,约30%表现出了抑郁等行为[32]。Davani等[33]发现转基因小鼠可通过激活糖皮质激素受体,加快血糖的生成且减少胰岛素的分泌,最终导致糖尿病的形成。
目前对于环境糖皮质激素受体干扰物的生物学效应研究多集中于药用糖皮质激素受体物质个体暴露实验。研究表明,动物体长时间暴露高剂量糖皮质激素的,可能导致免疫反应抑制、生理状况恶化等一系列生理障碍[34-35]。长期喂食氢化可的松,不仅可以抑制鱼类的活动和进攻行为,还会降低鱼类的免疫反应[36-37]。暴露在低浓度的药用糖皮质激素丙酸氯倍他索及戊酸倍他米松下的鲤鱼,其体内可能会产生蛋白质分解速率加快、血液内自由氨基酸增加、血液中葡萄糖浓度下降等现象[38]。Nyirenda等[39]发现,在老鼠怀孕后期喂食过量的地塞米松,会导致幼崽体重下降,同时也使怀孕雌鼠对葡萄糖不耐,极易造成高血糖。
在人体研究方面,可借助体外细胞实验手段,进一步关注环境糖皮质激素干扰物带来的生物学效应。Sargis[9]将几种典型内分泌干扰物质暴露于小鼠3T3-L1细胞株,分别利用荧光检测和染色技术,研究暴露后细胞中GR活性和脂肪含量的变化。检测结果发现,双酚A、邻苯二甲酸二环己酯、异狄氏剂和对甲抑菌灵这4种物质具有显著的糖皮质激素受体干扰活性,促进了细胞中脂质的堆积,并上调了脂肪细胞蛋白的表达,最终可能导致肥胖、糖尿病等流行病的形成。基于简单的人体调查结果发现,外源干扰物与GR结合后,可进一步诱导焦虑或是抑郁等症状的发生。Plihal等[40]通过设计实验,发现10名健康男性志愿者在长期摄入地塞米松后,负面情绪明显增加,表明GR功能的干扰严重影响人体情绪,最终可能导致抑郁。
关于环境糖皮质激素受体干扰物的生物毒理学研究,目前仍存在着大量的数据空白。研究大多集中于拟性物质的个体暴露实验,以鱼类和鼠类为主。研究表明一定剂量的人工合成糖皮质激素,可能会使实验动物产生免疫反应抑制、血糖变化等一系列生理障碍。有科学家通过体外细胞实验等发现环境糖皮质激素干扰物是肥胖、抑郁的潜在致病源,但已有研究较少,未能引起广泛关注与深入研究。
4.2 糖皮质激素受体干扰物的暴露特征
人体和动物的分泌排泄、医疗用药的排放以及各类化学品的大量使用,是环境中糖皮质激素干扰物的主要来源。而大范围的滥用糖皮质激素药物及其他具有潜在活性的化学品,使得其在环境中进一步分布富集,造成了潜在的危害。包括中国在内的很多国家和地区都报道在环境中检出糖皮质激素受体干扰物,并且存在于地表水、沉积物、室内灰尘等多种环境介质中。
人工合成的糖皮质激素在环境中的存在多集中于水体,包括地表水、污水处理厂出水、工业废水及医院废水均检测到其存在,见表4。
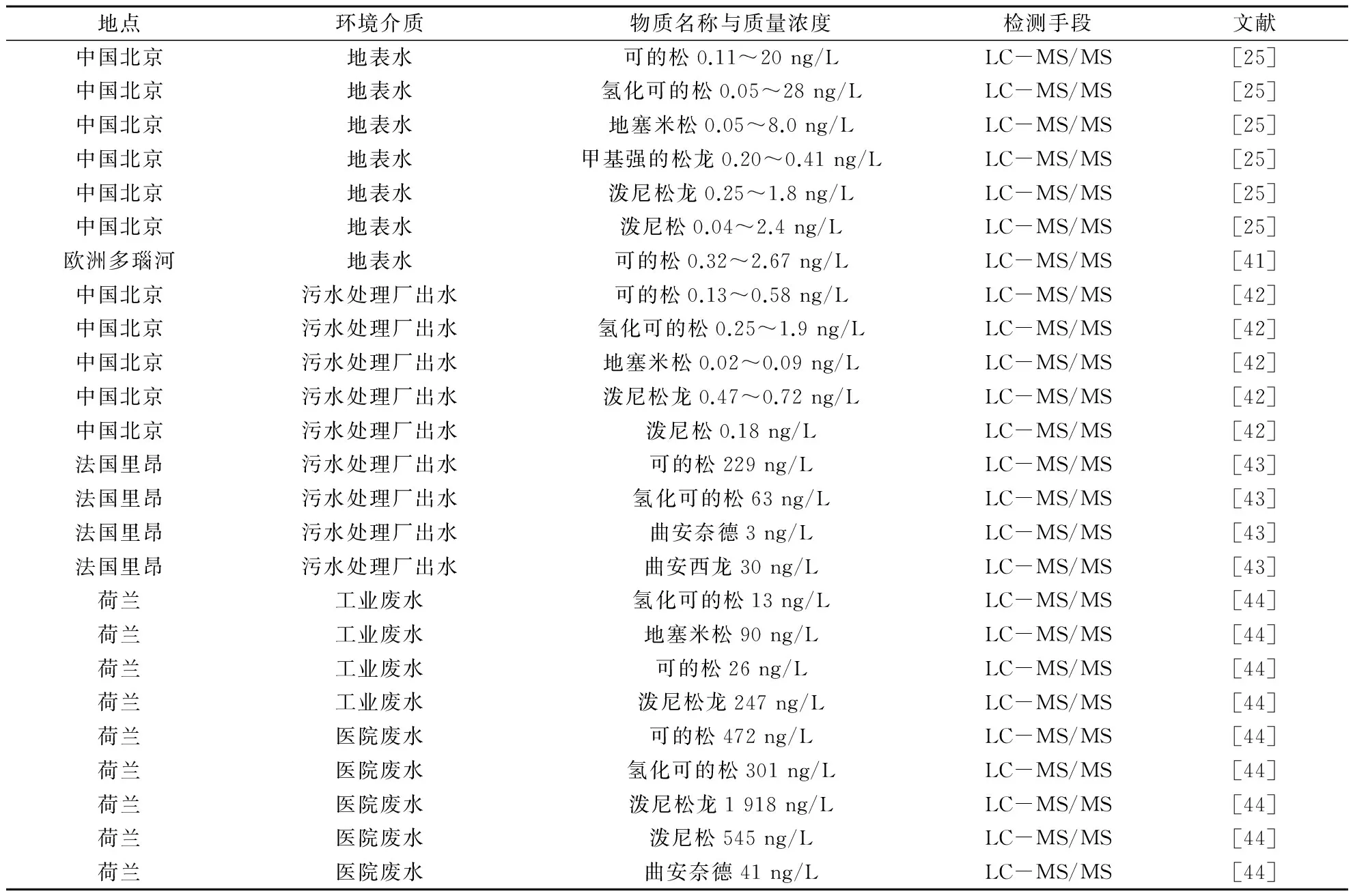
表4 药用糖皮质激素的环境检出
随着分析技术的不断发展,对于环境水体中糖皮质激素的检测,目前应用最多的检测手段即为LC-MS/MS。Chang等[25]使用LC-MS/MS,在北京地区河水中检出了相对较高的激素污染水平,其中可的松和氢化可的松的质量浓度最高可达20和28 ng/L,远高于荷兰、匈牙利等地区地表水中糖皮质激素质量浓度的检测值(0.1~1.3 ng/L)[41]。在法国里昂污水处理厂中,可的松、氢化可的松、曲安奈德、曲安西龙的最高质量浓度分别可达229,63,3和 30 ng/L[43]。Schriks等[44]发现,医院废水中泼尼松龙的最高检出质量浓度为1 918 ng/L,远高于其他水体中的浓度。此外,还可以进一步通过体外实验评估环境水样的糖皮质激素受体活性。Linden等[45]借助人体细胞荧光素酶报告基因实验,发现医院废水、工业废水及污水处理厂出水中均检测到了明显的拟糖皮质激素活性。其中工业废水的拟性最强,其地塞米松质量浓度可达243 ng/L,比生活污水处理厂高21倍;医院废水的拟糖皮质激素活性也比污水处理厂出水高8倍。
农药类物质作为典型的抗糖皮质激素受体干扰物,其在环境中具有分布广、介质多样、浓度高等特点。以莠去津为例,它作为世界上使用最为广泛也是最重要的除草剂之一,常在地下水和地表水中被检测到[46-47]。其在农业工人尿液中的最高值甚至可达68×10-9[48]。在希腊地表水中,p,p′-DDT和p,p′-DDE的质量浓度最高分别可达1 000和64 ng/L[49]。此外,室内灰尘中也常检测到农药类物质的存在。Tan等[50]利用GC-MS分析技术,在新加坡室内灰尘中,检测到了多种农药,其中p,p′-DDT和p,p′-DDE的质量比最高可达700和50 ng/g。Rudel等[51]发现,在英国科德角的室内灰尘样品中,氯氰菊酯的质量比甚至高达172 μg/g,甲氧滴滴涕的质量比同样不容忽视,最大可达12.9 μg/g。
阻燃剂类物质也是典型的抗糖皮质激素类物质,广泛存在于建筑材料及各类生活用品中,故多检出于室内灰尘中。主要包括溴代阻燃剂和有机磷阻燃剂,在美国、中国、日本与一些欧洲国家的室内灰尘样品中,检出率高,且含量不容忽视。Garcia等[52]在西班牙北部的私人住宅的室内灰尘样品中测得TBP和TPP质量比分别为0.9和4.9 μg/g。同样的,PBDEs在室内灰尘中也有很高的检出,美国华盛顿的灰尘样品中BDE85 质量比为5.8~620 ng/g[53],英国伯明翰地区BDE99为2.8~180 ng/g[54]。此外,在鱼体、沉积物样品中,PBDEs均有不同程度的残留[27]。
环境糖皮质激素受体干扰物在环境中广泛存在,且其浓度水平不容忽视,具有分布广、含量高、持久性强等特点。值得注意的是,由于结构的特殊性,一些糖皮质激素受体干扰物甚至可以和其他激素受体相结合,如雌激素受体、雄激素受体、甲状腺激素受体等,从而发挥不同的激素效应,带来更强的内分泌干扰作用,严重危害人体及生态环境。然而,由于环境的复杂性,仍然存在着很多物质未能受到关注或未能被发现其干扰作用。目前对于个体活性检测方面的技术缺陷及对人体流行病学方面的证据缺乏,对环境糖皮质激素的生态毒性效应的研究带来了极大的挑战。
5 结语
随着社会和经济的发展,化合物的种类及生产和使用量越来越多,这些化合物在生产、使用等过程中,被不断地排放到环境中,其中部分物质可以引起糖皮质激素干扰效应。已有研究表明,环境糖皮质激素干扰物与抑郁、肥胖、高血糖等流行病有着潜在的联系。在受体介导作用机制前提下,科学家通过以报告基因为主的体外实验和以QSAR为主的计算模拟方法研究了环境化合物的糖皮质激素干扰活性,包括农药、多溴联苯醚、有机磷酸酯类在内的多种污染物被检出了抗糖皮质激素活性,具有潜在危害。
然而,目前对环境污染物糖皮质激素干扰活性的研究还处于起步阶段,数据仍相对匮乏。在理论研究方面,环境糖皮质激素干扰机制仍停留在受体介导作用方面,而对于非受体介导的作用机制,则需要进一步借助模式生物展开深入研究。对于环境雌激素干扰物,目前已开发了多种体内外的筛选方式,相较而言,现有的糖皮质激素受体干扰物的筛选仅依靠体外实验,且以报告基因受体结合实验为主。体外筛选方法由于不包括生物体利用与代谢的过程,不利于准确有效地鉴别环境中潜在的干扰物。因此,需要建立基于个体生物的毒性评估与筛选技术或替代技术,将体外实验与体内实验相结合进行综合研究。通过计算模拟的方法也是筛选潜在糖皮质激素受体干扰物的一种有效途径,然而数据的缺乏和机制研究的不足极大地限制了发展。未来需要进一步建立能够反映作用机制的模拟方法,并在此基础上以目标或非目标方式筛选关键的糖皮质激素干扰物及其潜在危害。随着分子生物学、基因组学及计算毒理学的不断渗透与发展,相信在不久的将来这些问题将逐一被解决。
[1] 刘先利, 刘彬, 邓南圣. 环境内分泌干扰物研究进展[J]. 上海环境科学, 2003, 22(1): 57-63.
[2] ROUTLEDGE E J, SUMPTER J P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen[J]. Environmental Toxicology and Chemistry, 1996, 15(3): 241-248.
[3] FOLMAR L C, HEMMER M J, DENSLOW N D, et al. A comparison of the estrogenic potencies of estradiol, ethynylestradiol, diethylstilbestrol, nonylphenol and methoxychlor in vivo and in vitro[J]. Aquatic Toxicology, 2002, 60(1): 101-110.
[4] PAWLOWSKI S, TERNES T A, BONERZ M, et al. Estrogenicity of solid phase-extracted water samples from two municipal sewage treatment plant effluents and river Rhine water using the yeast estrogen screen[J]. Toxicology in Vitro, 2004, 18(1): 129-138.
[5] CARGOUET M, PERDIZ D, MOUATASSIM-SOUALI A, et al. Assessment of river contamination by estrogenic compounds in Paris area (France)[J]. Science of the Total Environment, 2004, 324(1): 55-66.
[6] THOMAS K V, HURST M R, MATTHIESSEN P, et al. An assessment of in vitro androgenic activity and the identification of environmental androgens in United Kingdom estuaries[J]. Environmental Toxicology and Chemistry, 2002, 21(7): 1456-1461.
[7] ZHOU J, QIN Z, LIN C, et al. Research progress of the endocrine disrupting activities of polychlorinated biphenyls[J]. Chinese Science Bulletin, 2004, 49(3): 215-219.
[8] BET P M, PENNINX B W J H, BOCHDANOVITS Z, et al. Glucocorticoid receptor gene polymorphisms and childhood adversity are associated with depression: new evidence for a gene-environment interaction[J]. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 2009, 150(5): 660-669.
[9] SARGIS R M, JOHNSON D N, CHOUDHURY R A, et al. Environmental endocrine disruptors promote adipogenesis in the 3t3-l1 cell line through glucocorticoid receptor activation[J]. Obesity, 2010, 18(7): 1283-1288.
[10] WORDINGER R J, CLARKA A F. Effects of glucocorticoids on the trabecular meshwork: towards a better understanding of glaucoma[J]. Progress in Retinal and Eye Research, 1999, 18(5): 629-667.
[11] PRATT W B, TOFT D O. Steroid receptor interactions with heat shock protein and immunophilin chaperones 1[J]. Endocrine Reviews, 1997, 18(3): 306-360.
[12] 王德杰, 刘兴国, 张东. 糖皮质激素受体的研究进展[J]. 现代生物医学进展, 2010 (8): 1592-1594.
[13] SCHOCH G A, D’ARCY B, STIHLE M, et al. Molecular switch in the glucocorticoid receptor: active and passive antagonist conformations[J]. Journal of Molecular Biology, 2010, 395(3): 568-577.
[14] TAJIKA T, WAKI M, TSUZUKI M, et al. Pharmacokinetic features of difluprednate ophthalmic emulsion in rabbits as determined by glucocorticoid receptor-binding bioassay[J]. Journal of Ocular Pharmacology and Therapeutics, 2011, 27(1): 29-34.
[15] ZHANG J, ZHANG J, LIU R, et al. Endocrine-disrupting effects of pesticides through interference with human glucocorticoid receptor[J]. Environmental Science & Technology, 2015, 50(1): 435-443.
[16] KOJIMA H, TAKEUCHI S, ITOH T, et al. In vitro endocrine disruption potential of organophosphate flame retardants via human nuclear receptors[J]. Toxicology, 2013, 314(1): 76-83.
[17] JOHANSSON M, NILSSON S, LUND B O. Interactions between methylsulfonyl PCBs and the glucocorticoid receptor[J]. Environmental Health Perspectives, 1998, 106(12): 769.
[18] HANSCH C, LEO A, HOEKMAN D H. Exploring QSAR, fundamentals and application in chemistry and biology[M]. Washington:American Chemical Society, 1995.
[19] STOJIC N, ERIC S, KUZMANOVSKI I. Prediction of toxicity and data exploratory analysis of estrogen-active endocrine disruptors using counter-propagation artificial neural networks[J]. Journal of Molecular Graphics and Modelling, 2010, 29(3): 450-460.
[20] ZHAO C Y, ZANG H X, ZHANG X Y, et al. Application of support vector machine (SVM) for prediction toxic activity of different data sets[J]. Toxicology, 2006, 217(2): 105-119.
[21] XU Y, ZHANG T, CHEN M. Combining 3D-QSAR, docking, molecular dynamics and MM/PBSA methods to predict binding modes for nonsteroidal selective modulator to glucocorticoid receptor[J]. Bioorganic & Medicinal Chemistry Letters, 2009, 19(2): 393-396.
[22] JAIN A N. Surflex: fully automatic flexible molecular docking using a molecular similarity-based search engine[J]. Journal of Medicinal Chemistry, 2003, 46(4): 499-511.
[24] BARKER M E. Evolution of adrenal and sex steroid action in vertebrates: a ligand‐based mechanism for complexity[J]. Bioessays, 2003, 25(4): 396-400.
[25] CHANG H, WAN Y, HU J. Determination and source apportionment of five classes of steroid hormones in urban rivers[J]. Environmental Science & Technology, 2009, 43(20): 7691-7698.
[26] KOJIMA H, TAKEUCHI S, URAMARU N, et al. Nuclear hormone receptor activity of polybrominated diphenyl ethers and their hydroxylated and methoxylated metabolites in transactivation assays using Chinese hamster ovary cells[J]. Environmental Health Perspectives, 2009, 117(8): 1210.
[27] SELLSTRÖM U, KIERKEHAARD A, DE WIT C, et al. Polybrominated diphenyl ethers and hexabromocyclododecane in sediment and fish from a Swedish river[J]. Environmental Toxicology and Chemistry, 1998, 17(6): 1065-1072.
[28] SAITO I, ONUKI A, SETO H. Indoor organophosphate and polybrominated flame retardants in Tokyo[J]. Indoor Air, 2007, 17(1): 28-36.
[29] STAPLETON H M, DODDER N G, OFFENBERG J H, et al. Polybrominated diphenyl ethers in house dust and clothes dryer lint[J]. Environmental science & technology, 2005, 39(4): 925-931.
[30] SAVORY J G A, PREFONTAINE G G, LAMPRECHT C, et al. Glucocorticoid receptor homodimers and glucocorticoid-mineralocorticoid receptor heterodimers form in the cytoplasm through alternative dimerization interfaces[J]. Molecular and Cellular Biology, 2001, 21(3): 781-793.
[31] TRONCHE F, KELLENDONK C, KRETZ O, et al. Disruption of the glucocorticoid receptor gene in the nervous system results in reduced anxiety[J]. Nature Genetics, 1999, 23(1): 99-103.
[32] CHOURBAJI S, GASS P. Glucocorticoid receptor transgenic mice as models for depression[J]. Brain Res. Rev, 2008, 57, 554-560.
[33] DAVANI B, PORTWOOD N, BRYZGALOVA G, et al. Aged transgenic mice with increased glucocorticoid sensitivity in pancreatic β-cells develop diabetes[J]. Diabetes, 2004, 53(suppl 1): S51-S59.
[34] ROMERO L M. Physiological stress in ecology: lessons from biomedical research[J]. Trends in Ecology & Evolution, 2004, 19(5): 249-255.
[35] MUNCK A, GUYER P M, HOLBROOK N J. Physiological functions of glucocorticoids in stress and their relation to pharmacological actions[J]. Endocrine Reviews, 1984, 5(1): 25-44.
[36] ØVERLI Ø, KOTZIAN S, WINBERG S. Effects of cortisol on aggression and locomotor activity in rainbow trout[J]. Hormones and Behavior, 2002, 42(1): 53-61.
[37] GILMOUR K M, DIBATTISTA J D, THOMAS J B. Physiological causes and consequences of social status in salmonid fish[J]. Integrative and Comparative Biology, 2005, 45(2): 263-273.
[38] NAKAYAMA K, INOUE Y, IKEDA N, et al. Uptake and biological effects of synthetic glucocorticoids in common carp (Cyprinus carpio)[J]. Marine Pollution Bulletin, 2014, 85(2): 370-375.
[39] NYIRENDA M J, LINDSAY R S, KENYON C J, et al. Glucocorticoid exposure in late gestation permanently programs rat hepatic phosphoenolpyruvate carboxykinase and glucocorticoid receptor expression and causes glucose intolerance in adult offspring[J]. Journal of Clinical Investigation, 1998, 101(10): 2174.
[40] PLIHAL W, KRUG R, PIETROWSKY R, et al. Corticosteroid receptor mediated effects on mood in humans[J]. Psychoneuroendocrinology, 1996, 21(6): 515-523.
[42] CHANG H, HU J, SHAO B. Occurrence of natural and synthetic glucocorticoids in sewage treatment plants and receiving river waters[J]. Environmental Science & Technology, 2007, 41(10): 3462-3468.
[43] PIRAM A, SALVADOR A, GAUVRIT J Y, et al. Development and optimisation of a single extraction procedure for the LC/MS/MS analysis of two pharmaceutical classes residues in sewage treatment plant[J]. Talanta, 2008, 74(5): 1463-1475.
[44] SCHRIKS M, VAN LEERDAM J A, VAN DER LINDEN S C, et al. High-resolution mass spectrometric identification and quantification of glucocorticoid compounds in various wastewaters in the Netherlands[J]. Environmental Science & Technology, 2010, 44(12): 4766-4774.
[45] LINDEN S C, HERINGA M B, MAN H Y, et al. Detection of multiple hormonal activities in wastewater effluents and surface water, using a panel of steroid receptor CALUX bioassays[J]. Environmental Science & Technology, 2008, 42(15): 5814-5820.
[46] BYER J D, STRUGER J, SVERKO E, et al. Spatial and seasonal variations in atrazine and metolachlor surface water concentrations in Ontario (Canada) using ELISA[J]. Chemosphere, 2011, 82(8): 1155-1160.
[47] LOOS R, LOCORO G, COMERO S, et al. Pan-European survey on the occurrence of selected polar organic persistent pollutants in ground water[J]. Water Research, 2010, 44(14): 4115-4126.
[48] CURWIN B D, HEIN M J, SANDERSON W T, et al. Urinary pesticide concentrations among children, mothers and fathers living in farm and non-farm households in Iowa[J]. Annals of Occupational Hygiene, 2007, 51(1): 53-65.
[49] KONSTANTINOU I K, HELA D G, ALBANIS T A. The status of pesticide pollution in surface waters (rivers and lakes) of Greece. Part I. Review on occurrence and levels[J]. Environmental Pollution, 2006, 141(3): 555-570.
[50] TAN J, CHENG S M, LOGANATH A, et al. Selected organochlorine pesticide and polychlorinated biphenyl residues in house dust in Singapore[J]. Chemosphere, 2007, 68(9): 1675-1682.
[51] RUDEL R A, CAMANN D E, SPENGLER J D, et al. Phthalates, alkylphenols, pesticides, polybrominated diphenyl ethers, and other endocrine-disrupting compounds in indoor air and dust[J]. Environmental Science & Technology, 2003, 37(20): 4543-4553.
[52] GARCIA M, RODRIGUEZ I, CELA R. Optimisation of a matrix solid-phase dispersion method for the determination of organophosphate compounds in dust samples[J]. Analytica Chimica Acta, 2007, 590(1): 17-25.
[53] ALLEN J G, MCCLEAN M D, STAPLETON H M, et al. Linking PBDEs in house dust to consumer products using X-ray fluorescence[J]. Environmental Science & Technology, 2008, 42(11): 4222-4228.
[54] ABDALLAH M A E, HARRAD S, IBARRA C, et al. Hexabromocyclododecanes in indoor dust from Canada, the United Kingdom, and the United States[J]. Environmental Science & Technology, 2007, 42(2): 459-464.
栏目编辑 李文峻
Study Progress of Environmental Contaminants with Glucocorticoid Receptor(GR)-disrupting Activities
SHEN Yan-hong, SHI Wei*, YU Hong-xia
(StateKeyLaboratoryofPollutionControlandResourceReuse,SchooloftheEnvironment,NanjingUniversity,Nanjing,Jiangsu210023,China)
The mechanism of action and ecological effects of GR-disrupting chemicals were reviewed in this paper. Moreover, different methods for GR-activity screening were summarized and disrupting chemicals were classified. On the basis of current studies on GR-disrupting chemicals, knowledge gaps were identified, which include the further elucidation of mechanism, the development of in vivo screening methods and the prediction of GR-disrupting activities. According to these, there is a need to obtain more information on model organisms. Furthermore, establishing the stable high throughput in vivo screening methods and optimizing computational simulation based on molecular dynamic process to generate reliable data for minimum cost should be taken into account in the future research.
Glucocorticoid; Receptor-disrupting; Mechanism of action; GR-activity screening; Endocrine
2016-11-14;
2016-11-15
国家自然科学基金资助项目(21577058;21307054);江苏省自然科学基金青年资助项目(BK20130551);国家环保部公益性行业科研专项基金资助项目(201409040);国家水体污染控制与治理重大专项基金资助项目(2012ZX07101-003)
沈艳红(1993—),女,硕士研究生,主要从事有机污染化学分析研究。
X18
A
1674-6732(2017)01-0001-09
