青枯雷尔氏菌胞外多糖研究进展
2017-04-17陈德局张海峰朱育菁郑雪芳陈小强
陈德局,张海峰,刘 波,朱育菁,郑雪芳,陈小强
(福建省农业科学院农业生物资源研究所 350003)
微生物多糖是细菌、真菌、蓝藻等微生物在代谢过程中合成的生物高聚物,主要以3种形式存在: 粘附在细胞表面上,即胞壁多糖;分泌到培养基中,即胞外多糖; 构成细胞的成分,即胞内多糖。广义上的胞外多糖指的是糖被,包括微荚膜、荚膜、黏液层和菌胶团[1]。病原微生物的胞外多糖被认为是一种致病因子,越来越受到科研工作者的重视[2-3]。铜绿假单胞菌是人和动物的机会致病菌,它合成的大量胞外多糖是形成生物膜的重要组分,其形成生物膜后对药物具有更高阈值的抗药性,给病人抗感染治疗增加难度[4-5]。Baker等[6]通过抑制铜绿假单胞菌的胞外多糖形成生物膜,能显著提高细菌对药物的敏感性,提出针对胞外多糖形成生物膜的治疗铜绿假单胞菌的感染策略。在植物病原菌中,合成胞外多糖形成外夹膜可以逃避宿主免疫系统识别,并防止自身水分和养分的丢失[7],也可以促进微生物在寄主内形成生物膜而获得群体性的生存优势[8]。
青枯雷尔氏菌(Ralstoniasolanacearum)是植物细菌性青枯病的致病菌,具有破坏性的土传性植物病原菌,地理分布广泛,寄主范围广,可侵染50多个科的200多种植物[1,9]。青枯雷尔氏菌在营养丰富的环境,能合成胞外多糖(Exopolysaccharides,EPS)分泌到细胞壁外,有的胞外多糖分泌到胞外后依附于微生物细胞壁形成荚膜,称为荚膜多糖;有的胞外多糖分泌到胞外后进入培养基形成粘液,称为粘液多糖。胞外多糖,被广泛认为是青枯雷尔氏菌重要的致病因子[10-11]。因此,研究青枯雷尔氏菌胞外多糖在植物青枯病发生过程中的生理功能对了解青枯病的发生和进行病害的生物防治具有重要的意义。本文从青枯雷尔氏菌胞外多糖合成基因、调控和生理功能等方面进行归纳综述。
1 青枯雷尔氏菌胞外多糖合成基因
青枯雷尔氏菌是一种革兰氏阴性细菌,能合成胞外多糖分泌到细胞外适应生存环境。胞外多糖的合成基因形成eps操纵子,由调控基因和合成基因组成,调控基因与合成基因在基因组的位点不相邻,为合成基因的反式调控因子。目前,在青枯雷尔氏菌中,与胞外多糖合成的结构基因有7个,它们在基因组上成簇存在,如图1所示。
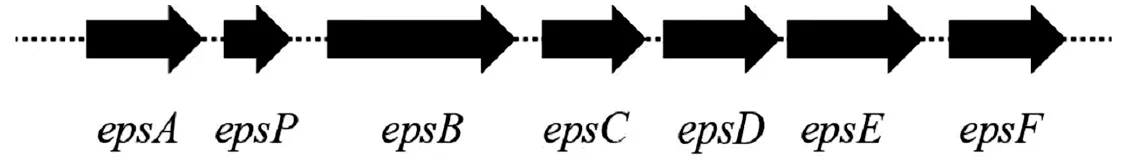
图1 青枯雷尔氏菌合成胞外多糖结构基因注:epsA:EPSI多糖外排外膜蛋白;epsP:酪氨酸磷酸酶;epsB:EPSI多糖外排蛋白;epsC:UDP-N-乙酰葡萄糖胺2异构酶;epsD:NDP-N-乙酰-D-半乳糖胺醛酸脱氢酶;epsE:EPSI多糖外排内膜蛋白;epsF:EPSI多糖外排内膜蛋白。
2 青枯雷尔氏菌胞外多糖合成调控
胞外多糖合成主要由全局性调控因子PhcA蛋白调控,PhcA属于LysR家族蛋白,位于青枯雷尔氏菌毒力因子表达调控网络的核心,它调节毒力因子如胞外多糖的合成、效应分子的表达、宿主细胞壁降解酶和细胞游动相关蛋白的表达[12]。PhcA通过群体感应系统感知细胞浓度而激活,群体感应系统的诱导物质包括3-羟基棕榈酸甲酯(3-OH PAME),在病原菌感染宿主早期,PhcA不表达,当细胞宿主体内达到一定数量时,3-OH PAME积累到一定浓度,激活了PhcA并诱导胞外多糖操纵子表达合成胞外多糖[13]。当细胞浓度达到1×107cfu/mL时,由PhcB合成的群体感应分子3-OH-PAME浓度上升,PhcR通过磷酸化激活PhcA,激活eps操纵子表达合成胞外多糖[14]。图3为EPS在青枯雷尔氏菌中合成被激活的调控过程,表1为参与EPS合成调控因子。青枯雷尔氏菌的EPS合成的调控研究主要集中在20世纪八九十年代,其中eps操纵子包含12个以上的基因,调控eps操纵子表达的调节基因至少有10个,另外至少有3种以上诱导信号启动合成胞外多糖[15]。
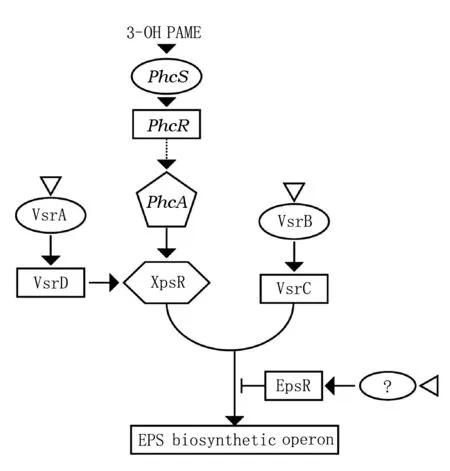
图3 青枯雷尔氏菌中EPS合成调控示意图注:资料来源于文献[16]。
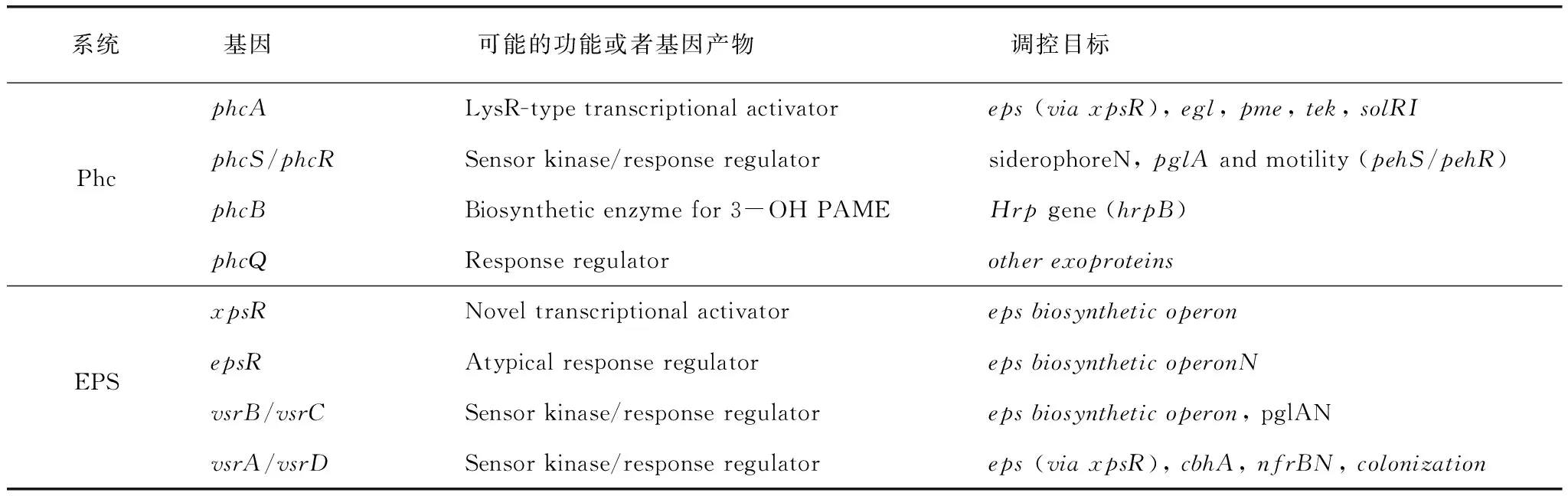
表1 青枯雷尔氏菌中调控EPS合成的Phc和Eps系统
注:资料来源于文献[16]。
随着对EPS合成代谢研究的深入,科学家们发现越来越多的遗传因子在青枯雷尔氏菌EPS合成调控中发挥作用。目前,在其他微生物中发现越来越多的遗传因子与EPS合成相关[17-20],这将为研究青枯雷尔氏菌的EPS代谢调控具有启发作用。
3 青枯雷尔氏菌胞外多糖的生理功能
胞外多糖被认为是植物病原菌致病发生过程中的一个关键的致病因子之一[21],其积累能力与青枯雷尔氏菌的致病力相关。Denny等[21]通过Tn5插入突变获得两类胞外多糖产量不同的青枯雷尔氏菌,第一类菌在丰富培养基上胞外多糖产量低于野生菌株产量的5%,宿主青枯病发病时间延缓,发病植株数为野生菌的1/3;另一类菌在丰富培养基上胞外多糖产量接近野生菌株的产量,其致病力与野生菌没有显著差异,表明胞外多糖是青枯雷尔氏菌致病的关键毒力因子。在其他植物病原菌中也发现胞外多糖合成能力与致病力相关,通过基因敲除玉米枯萎病菌(Pantoeastewartii)的群体感应系统调控基因lrhA和rcsA,胞外多糖的产量显著下降,从而降低玉米枯萎病菌的致病力[22];将胞外多糖降解酶在蔷薇科果树中表达,能降低苹果和梨树对火疫欧文氏菌的敏感性[23- 24]。青枯雷尔氏菌侵染宿主后,将宿主的茎制成横切面切片后,利用胞外多糖抗体对切片染色后在免疫荧光显微镜下观察,可以观察到青枯雷尔氏菌在导管中形成致密的堵塞[25];在葡萄病原菌Xylellafastidiosa侵染宿主后显微镜中也观察到堵塞导管的现象[26]。因此,学者认为,青枯雷尔氏菌在宿主导管中定殖后,积累大量的胞外多糖阻塞宿主营养和水分运输,导致宿主萎蔫[27]。
研究表明,在青枯雷尔氏菌侵染宿主后合成的EPS,能帮助其逃避宿主免疫系统的识别而对自身具有保护作用[28-30]。青枯雷尔氏菌在宿主导管中合成大量的EPS,形成了一个类似的生物膜,可以逃避宿主识别或者提高对宿主分泌杀菌物质的抗性[31]。
病原微生物侵染宿主的能力与其运动能力相关[32],青枯雷尔氏菌侵染番茄需要其具有运动能力[33],而胞外多糖与细菌的运动能力相关[34-35]。因此,青枯雷尔氏菌的胞外多糖与其运动能力相关,合成胞外多糖有助于提升其侵染宿主能力。科学家们在研究其他微生物胞外多糖生理功能时,发现其具有吸附营养物质[36]、耐受低温[37]等功能,但在青枯雷尔氏菌中还未见相关报道。
4 展望
胞外多糖的合成和积累对病原菌的致病力至关重要,阐明其在青枯雷尔氏菌致病过程中的生理功能,有助于研究人员以胞外多糖为靶标,设计新型农药,为素有植物“癌症”之称的青枯病的防治提供一种新的策略。但是近10年来,植物青枯病研究领域的科学家主要关注于病原菌分泌的效应分子在致病性与致病力方面,而忽视了胞外多糖在病害发生进程中的重要性。因此,在研究青枯病防治策略上,可以以胞外多糖为靶标,开发出新型农药。
参考文献:
[1]SKVORTSOV I M,LGNATOV V V.Extracellular polysaccharides and polysaccharides-containing biopolymers fromAzospirillumspecies:properties and the possible role in interaction with plant root [J].Fems Microbiol Letters,1998,165(2):223- 229.
[2]MARMONT L S,RICH J D,WHITNEY J C,et al.Oligomeric lipoprotein PelC guides Pel polysaccharide export across the outer membrane ofPseudomonasaeruginosa[J].Proc Natl Acad Sci USA,2017,114(11):2892-2897.
[3]YANG F,QIAN S,TIAN F,et al.The GGDEF-domain protein GdpX1 attenuates motility,exopolysaccharide production and virulence inXanthomonasoryzaepv.oryzae[J].Journal of Applied Microbiology,2016,120(6):1646-57.
[4]GARG R P,HUANG J Z, YINDEEYOUNGYEON W,et al.Multicomponent transcriptional regulation at the complex promoter of the exopolysaccharide I biosynthetic operon ofRalstoniasolanacearum[J].Journal of Bacteriology,2000,182(23):6659-6666.
[5]HUANG J,CARNEY B F,DENNY T P,et al.A complex network regulates expression of eps and other virulence genes ofPseudomonassolanacearum[J].Journal of Bacteriology,1995,177(5):1259-1267.
[7]ORDAX M,MARCO-NOALES E,LóPEZ M M,et al.Exopolysaccharides favor the survival of Erwinia amylovora under copper stress through different strategies[J].Research in Microbiology, 2010,161(7):549-555.
[8]KOCZAN J M,MCGRATH M J,ZHAO Y,et al.Contribution ofErwiniaexopolysaccharides amylovoran and levan to biofilm formation:implications in pathogenicity[J].Phytopathology,2009,99(11):1237-1244.
[9]BONOMI H R,TOUM L,SYCZ G,et al.Xanthomonascampestrisattenuates virulence by sensing light through a bacteriophytochrome photoreceptor[J].EMBO Reports,2016,17(11):1565-1577.
[10]VALLS M, GENIN S, BOUCHER C.Integrated regulation of the Type III secretion system and other virulence determinants in Ralstonia solanacearum [J].Plos Pathog,2006,2(8):e82.
[11]PERRIER A, PEYRAUD R, RENGEL D, et al.Enhanced in planta Fitness through Adaptive Mutations in EfpR, a Dual Regulator of Virulence and Metabolic Functions in the Plant PathogenRalstoniasolanacearum[J].Plos Pathog, 2016,12(12):e1006044.
[12]SNARR B D, BAKER P,BAMFORD N C,et al.Microbial glycoside hydrolases as antibiofilm agents with cross-kingdom activity[J].Proc Natl Acad Sci USA,2017,114(27):7124-7129.
[13]CHAPMAN M R,KAO C C.EpsR modulates production of extracellular polysaccharides in the bacterial wilt pathogenRalstonia(Pseudomonas)solanacearum[J].Journal of Bacteriology,1998,180(1):27-34.
[14]AL-WRAFY F,BRZOZOWSKA E,GRSKA S,et al.Pathogenic factors ofPseudomonasaeruginosa-therole of biofilm in pathogenicity and as a target for phage therapy[J].Postepy Hig Med Dosw,2016,71(71):78-91.
肿瘤是一类细胞周期疾病,经历多基因、多步骤突变,细胞呈失控性生长,其中细胞凋亡失衡是肿瘤发生、发展的重要机制[6-7]。凋亡抑制蛋白家族是一类抑制凋亡的调节因子,Survivin是上世纪九十年代末发现的凋亡抑制蛋白家族新成员,定位于人类染色体17q25,由142个氨基酸组成,只表达于肿瘤与胚胎组织,与其他凋亡抑制蛋白家族成员比较,Survivin结构简单,具有其他成员无可比拟的抗凋亡能力。近年来研究显示,在肺癌、喉癌、胃癌、结直肠癌、鼻咽癌、卵巢癌等多种恶性肿瘤均可发现Survivin过表达,Survivin已成为肿瘤诊断与治疗的新靶点[8-10]。
[15]KEKEC O,GOKALSIN B,KARALTI I,et al.Effects of Chlorine Stress onPseudomonasaeruginosaBiofilm and Analysis of Related Gene Expressions [J].Current Microbiology,2016,73(2):228-35.
[16]SCHELL M.Control of virulence and pathogenicity genes of Ralstonia solanacearum by an elaborate sensory network [J].Annual Reviwe of Phytopathology,2000,38(4):263-292.
[17]MAO M Y,YANG Y M,LI K Z,etal.The rnc Gene Promotes Exopolysaccharide Synthesis and Represses thevicRKXGene Expressions via MicroRNA-Size Small RNAs inStreptococcusmutans [J].Frontiers in Microbiology,2016(7):687.
[18]XU Q,BLACK W P,NASCIMI H M,et al.DifA,a methyl-accepting chemoreceptor protein-like sensory protein,uses a novel signaling mechanism to regulate exopolysaccharide production inMyxococcusxanthus[J].Journal of Bacteriology,2011,193(3):759-767.
[19]WHITNEY J C,COLVIN K M, MARMONT L S,et al.Structure of the cytoplasmic region of PelD,a degenerate diguanylate cyclase receptor that regulates exopolysaccharide production inPseudomonasaeruginosa[J].Journal of Biological Chemistry,2012,287(28):23582-23593.
[20]BLACK WP,SCHUBOT FD,LI Z,et al.Phosphorylation and dephosphorylation among Dif chemosensory proteins essential for exopolysaccharide regulation inMyxococcusxanthus[J].Journal of Bacteriology, 2010,192(17):4267-4274.
[21]DENNY T P,BAEK S.Genetic evidence that extracellular polysaccharide is a virulence factor ofPseudomonassolanacearum[J].Molecular Plant-Microbe Interactions,1991,4(2):198-206.
[22]BURKE A K,DUONG D A,JENSEN R V,et al.Analyzing the Transcriptomes of two quorum-sensing controlled transcription factors,RcsA and LrhA,important forPantoeastewartiivirulence [J].Plos One,2015,10(12):e0145358.
[23]HANKE V,GEIDER K,RICHTER K.Transgenic apple plants expressing viral EPS-depolymerase:evaluation of resistance to the phytopathogenic bacteriumErwiniaamylovora[M].Dordrecht:Kluwer,2003:153-157.
[24]MALNOY M,FAIZE M,VENISSE JS,et al.Expression of viral EPS-depolymerase reduces fire blight susceptibility in transgenic pear [J].Plant Cell Reports,2005,23(9):632-638.
[25]MCGARVEY JA,DENNY TP,SCHELL MA.Spatial-temporal and quantitative analysis of growth and EPS I production byRalstoniasolanacearumin resistant and susceptible tomato cultivars [J].Phytopathology,1999,89(12):1233-1239.
[26]ROPER M C,GREVE L C,LABAVITCH J M,et al.Detection and visualization of an exopolysaccharide produced byXylellafastidiosain vitro and in planta [J].Applied & Environmental Microbiology,2007,73(22):7252-7258.
[27]GENIN S,BOUCHER C.Ralstonia solanacearum:secrets of a major pathogen unveiled by analysis of its genome [J].Molecular Plant Pathology,2002,3(3):111-118.
[28]ORGAMBIDE G,MONTROZIER H,SERVIN P,et al.High heterogeneity of the exopolysaccharides ofPseuodomonassolanacearumstrain GMI1000 and the complete structure of major polysaccharide [J].Journal of Biological Chemistry,1991,266(13):8312-8321.
[29]DENNY T P.Involvement of bacterial polysaccharides in plant pathogenesis [J].Annual Review of Phytopathology,1995,33(33):173-197.
[30]SAILE E,MCGARVEY JA,SCHELL MA,et al.Role of extracellular polysaccharide and endoglucanase in root invasion and colonization of tomato plants byRalstoniasolanacearum[J].Phytopathology,1997,87(12):1264-1271.
[31]MORI Y,INOUE K,IKEDA K,et al.The vascular plant-pathogenic bacteriumRalstoniasolanacearumproduces biofilms required for its virulence on the surfaces of tomato cells adjacent to intercellular spaces [J].Molecular Plant Pathology,2015,17(6):890-902.
[32]OTTEMAN K M,MILLER J F.Roles for motility in bacterial-host interactions [J].Molecular Microbiology,1997,24(6):1109-1117.
[33]TANS-KERSTEN J,HUANG H,ALLEN C.Ralstoniasolanacearumneeds motility for invasive virulence on tomato [J].Journal of Bacterology,2001,183(12):3597-3605.
[34]LIU A,MI Z H,ZHENG X Y,et al.Exopolysaccharides Play a Role in the Swarming of the Benthic BacteriumPseudoalteromonassp.SM9913 [J].Frontiers Microbiology,2016,7:473.
[35]BERLEMAN J E,VICENTE J J,DAVIS A E,et al.FrzS regulates social motility inMyxococcusxanthusby controlling exopolysaccharide production [J].Plos One,2011,6(8):e23920.
[36]GUEZENNEC J.Deep-sea hydrothermal vents:a new source of innovative bacterial exopolysaccharides of biotechnological interest [J].Journal of Industrial Microbiology & Biotechnology,2002,29(4):204-208.
[37]CARRION O,DELGADO L,MERCADE E.New emulsifying and cryoprotective exopolysaccharide from AntarcticPseudomonassp. ID1 [J].Carbohydrate Polymers,2015,117:1028-1034.
