菠萝EST资源的SSR信息分析与开发
2017-04-17陈俊浩倪燕婕张智俊钟雅萍鲍晶晶罗淑萍
陈俊浩,陆 洋,倪燕婕,张智俊,钟雅萍,鲍晶晶,罗淑萍
(1.浙江农林大学 亚热带森林培育国家重点实验室培育基地, 浙江 临安 311300;2.新疆农业大学 农学院,新疆 乌鲁木齐830052)
菠萝EST资源的SSR信息分析与开发
陈俊浩1,陆 洋1,倪燕婕1,张智俊1,钟雅萍1,鲍晶晶1,罗淑萍2
(1.浙江农林大学 亚热带森林培育国家重点实验室培育基地, 浙江 临安 311300;2.新疆农业大学 农学院,新疆 乌鲁木齐830052)
表达序列标签-简单重复序列(EST-SSRs)存在于表达序列标签中,是一种最常用的新型微卫星标记。它可以被嵌入到功能基因序列中,有效并高效地提供更多的相关信息。通过对已公开的5 659条菠萝Ananas comosus的表达序列标签(ESTs)进行电子筛选,获得了617条含有简单重复序列(SSR)的菠萝EST。平均7.39 kb EST序列中含有1个SSR,其中二核苷酸,三核苷酸和六核苷酸是SSR的主要重复类型,分别占SSR总数的42.61%,29.25%和20.13%。所有重复类型中重复次数最少的是四核苷酸序列(3.46%)。AG/TC是二核苷酸中的优势单元。根据搜索出的EST序列,共设计出30对物,其中27对引物扩增产物具有多态性。本次实验中开发的EST-SSR标记是迄今为止有关于菠萝的第1次大规模SSR标记开发。研究结果为利用EST-SSR分子标记进行菠萝连锁图谱构建,数量基因定位,种质资源遗传多样性,亲缘关系研究和指纹图谱构建奠定了基础。图2表4参24
分子生物学;菠萝;表达序列标签;简单重复序列
菠萝Ananas comosus原产巴西,为热带多年生草本植物,16世纪时传入中国,有70多个品种,岭南四大名果之一。菠萝含有大量的果糖,葡萄糖,维生素A,维生素B,维生素C,磷,柠檬酸和蛋白酶等营养物质。其果味甘性温,具有解暑止渴、消食止泻之功,为夏令医食兼优的时令佳果。另外,菠萝皮中富含菠萝酶,有丰富的药用价值,长期食用菠萝皮,心脑血管,糖尿病发病率显著降低,并有一定的抗癌效果。近年来分子生物学的发展以及各种分子标记技术不断出现,使得植物遗传分析研究得以迅速发展,其中以简单重复序列(simple sequence repeat,SSR)标记在植物遗传研究上应用最为广泛。随着测序技术成本的降低,GenBank中大量的植物表达序列标签(expressed sequence tag,EST)数据为SSR分子标记的开发提供了新的途径。EST-SSR除具一般SSR分子标记特点外,还有信息量大,通用性好,开发简单、快捷、成本低等[1]的特殊优势。目前,许多作物[2-5]已开发大量的EST-SSR,并应用于遗传作图、遗传多样性等[6]研究上,但在菠萝栽培种上至今尚未见从EST中开发SSR的相关报道。本研究对现有菠萝EST中SSR信息进行全面分析,以明确菠萝EST-SSR发生频率和特点,为进一步建立EST-SSR标记并探索其在菠萝研究中的遗传作图、育种材料评价、品种鉴定等的应用奠定基础。
1 材料与方法
1.1 材料
采集菠萝品种 ‘巴厘’Ananas comosus ‘Comte de Paris’的幼嫩叶片于-20℃保存。
1.2 菠萝EST的获得及EST-SSR序列查找
从美国生物技术中心(NCBI)的植物基因组数据库(http://www.ncbi.nlm.nih.gov/genomes/PLANTS/ PlantList.html)共搜索到5 659条菠萝的EST序列。应用Websat(http://wsmartins.net/websat/)在线程序搜索EST-SSR。搜索的标准为:二核苷酸、三核苷酸、四核苷酸、五核苷酸和六核苷酸重复序列的重复次数分别大于或等于9,6,5,4和3。
1.3 EST-SSR引物设计
利用Primer Premier 3.0在线程序对包含有SSR的EST设计引物,引物设计的原则为EST序列长度大于100 bp,SSR序列的开始和结束位置分别距5′和3′端不少于20 bp。引物设计的主要参数为:引物长18~27 bp,最适为22 bp;引物退火温度Tm值57~60℃,上游与下游引物的Tm值相差 ±1℃;PCR预期产物长100~400 bp;尽量避免引物二聚体,发夹结构和错配等。按重复类型的比例挑选30对引物由上海生物工程技术服务有限公司合成。
1.4 EST数据冗余分析
利用VecScreen(http://www.ncbi.nlm.nih.gov/VecScreen)及RepeatMasker(http://www.repeatmasker.org)去除载体污染和重复序列,对于那些能设计出引物的EST序列,最后通过Tm值和引物序列比对进一步删除冗余序列。
1.5 DNA提取
采用改良十六烷基三甲基溴化铵法(CTAB)[7]提取菠萝的基因组DNA。
1.6 PCR扩增、电泳检测
PCR反应体系(25 μL):10×缓冲液 2.5 μL,镁离子(Mg2+)(25.0 mmol·L-1)1.5 μL,dNTP(10.0 mmol·L-1)0.5 μL,引物(100.0 μmol·L-1)1.0 μL,Taq酶(5.0×16.67 nkat)0.2 μL,模板DNA(20.0 mg·L-1)3.0 μL。
反应程序为:94℃预变性5 min,94℃变性30 s,51℃退火40 s,72℃延伸50 s,38个循环,72℃终延伸7 min,8℃保存。
PCR产物用质量分数为6%非变性聚丙烯酰胺凝胶电泳进行分离检测,120 V电压电泳1.5 h后,采用银染法染色,BIO-RAD Gel Doc2000凝胶成像系统中成像。
1.7 SSR位点的功能分析
对筛选出的SSR提取其所在的基因序列,翻译成蛋白质序列后,利用Blastp比对,提取相似性最高的序列注释信息,作为SSR靶向基因的功能注释,并对SSR位点的注释信息进行分类。
2 结果与分析
2.1 菠萝EST-SSR的频率和分布密度
在5 659条EST序列中,经过筛选共发现SSR序列636个,占整个EST数据库的11.24%,表明菠萝中的EST-SSR十分丰富。经计算去除冗余后的菠萝EST序列总长约为4.7×106bp,菠萝SSR分布密度为平均7.39 kb EST就存在1条SSR(表1),并且不同重复类型的平均距离有明显差异,EST-SSR出现频率越高其平均距离则越小。菠萝EST-SSR中含有二核苷酸、三核苷酸、四核苷酸、五核苷酸、六核苷酸重复的序列分别占EST数据库中发现SSR序列总数的42.61%(271/636),29.25%(186/636),3.46%(22/636),4.56%(29/636),20.13%(128/636)(表1),说明菠萝EST-SSR的优势重复单元为二核苷酸、三核苷酸和六核苷酸,三者共占EST-SSR总数的91.99%。其中二核苷酸重复的出现频率(42.61%)明显高于其他类型,三核苷酸(29.25%)和六核苷酸(20.13%)重复的出现频率也相对较高。重复类型为四核苷酸、五核苷酸的重复所占的比例比较小,只占总SSR的8.02%。
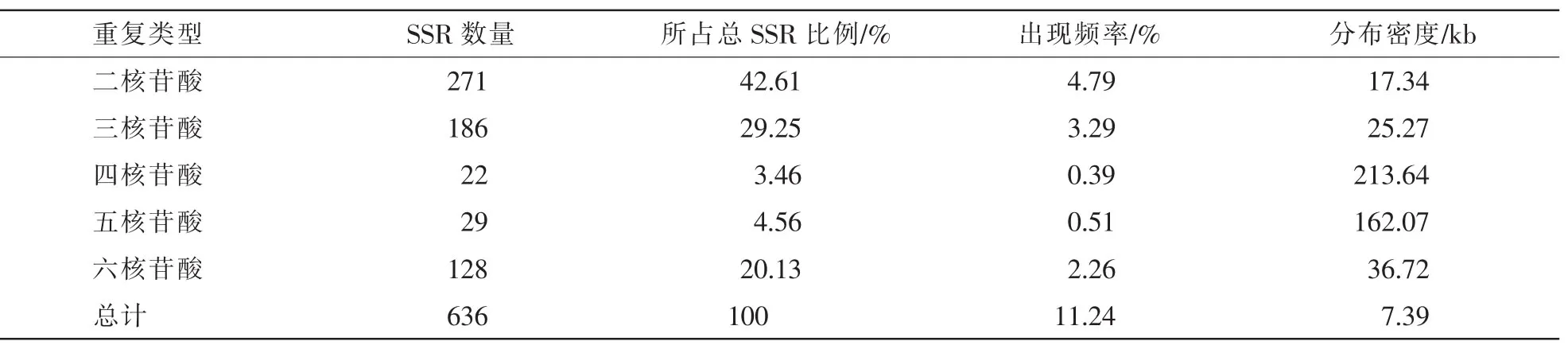
表1 菠萝中EST-SSR的数量、比例、出现频率与平均距离Table 1 Number,Proportion,frequency and mean distance of EST-SSR in pineapple
2.2 菠萝EST-SSR的重复类型特点
全部菠萝的EST-SSR中共搜索出174种重复基元,其中二核苷酸重复基元有10种,三核苷酸重复基元有48种,四核苷酸重复基元有15种,五核苷酸重复基元有21种,六核苷酸重复基元有80种(表2)。在二核苷酸重复基元中AG/TC和GA/CT出现频率最高,在总的SSR中所占比例为23.27%(148/ 636)和15.88%(101/636)。而三核苷酸的重复基元中AGA/TCT,AGC/TCG,CAG/GTC,CTC/GAG,CTG/GAC,CTT/GAA的出现次数在10以上,并且其中重复次数最大的AGC/TCG也仅为总SSR的4.09%(26/ 636)(表3)。统计显示三核苷酸的基元种类相对来说较多,比较分散。六核苷酸的SSR在总的EST中有128条,但六核苷酸的重复基元种类有80种,其中60种重复基元出现1次,其余20种重复基元出现次数在1次以上,在六核苷酸重复基元中CCTCCG出现7次,发生频率仅占总SSR的1.10%。总体而言六核苷酸重复基元总数虽然多,但每种基元类型出现的频率却不高。而四核苷酸和五核苷酸的重复基元不仅在数量上很少,而且基元分布较平均,未出现优势基元。
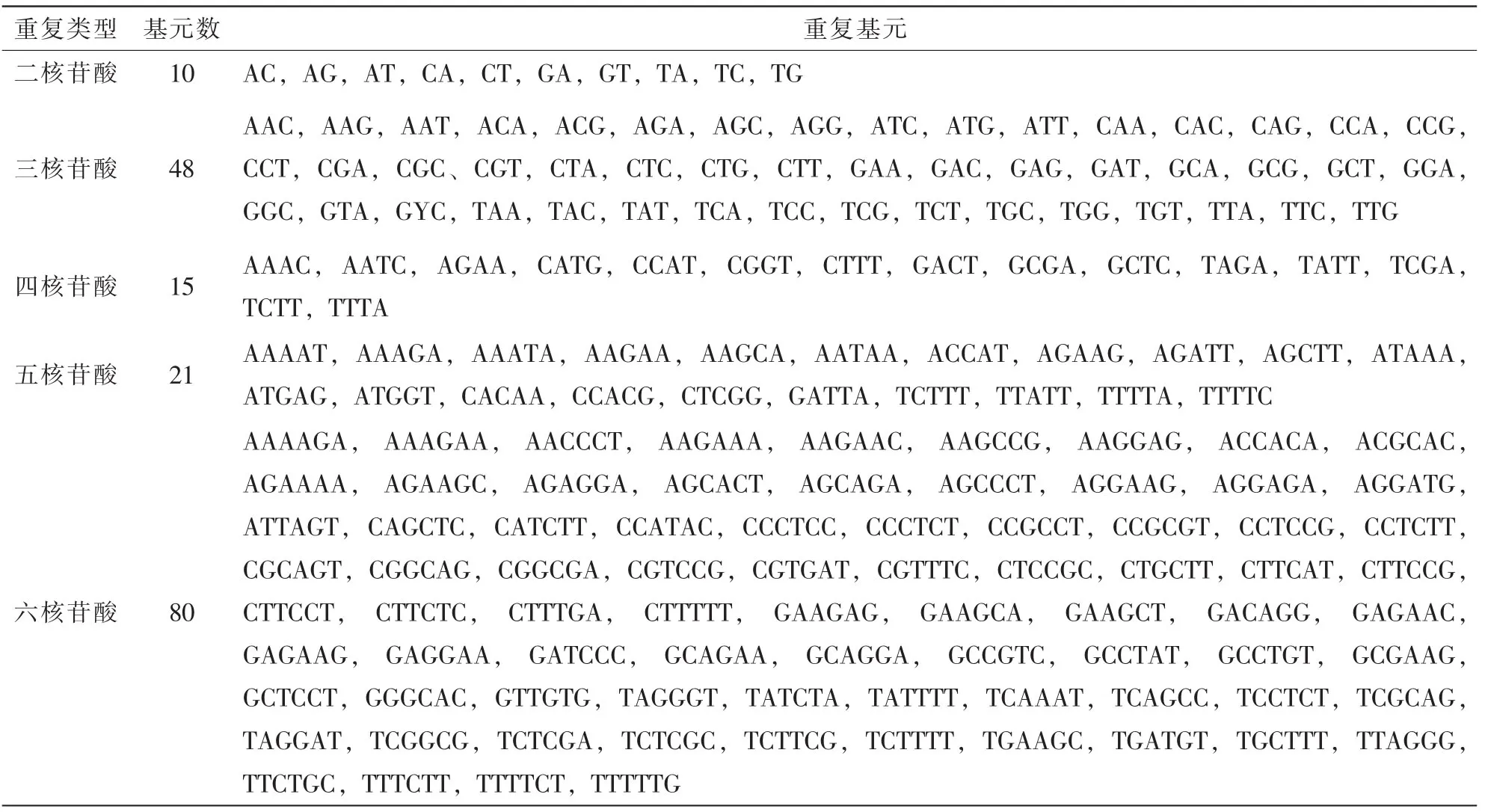
表2 菠萝EST-SSR的重复基元Table 2 Repeat motif of EST-SSRs in pineapple
菠萝的EST-SSR基元长度分布情况见图1。由于搜索标准严格,将一些兀余序列剔除(特别是一些本身序列较短或者是数据库重复登录的序列)。因此,EST-SSR的分布不是连续的。菠萝的EST-SSR基元长度分布主要集中在18~36 bp,其中18 bp在总的分布中尤为突出,共有194条,占总数的30.50%。从整体趋势来看,EST-SSR的数量是随着基元长度的增长而减少的。TEMNYKH等[8]研究发现,SSR基元长度在12 bp以下时为低多态性,长度在12~20 bp的SSR为中等多态性,长度大于或等于20 bp时为高多态性。依据以上标准,41.67%菠萝的EST-SSR为中等多态性,58.33%菠萝的EST-SSR则为高多态性。
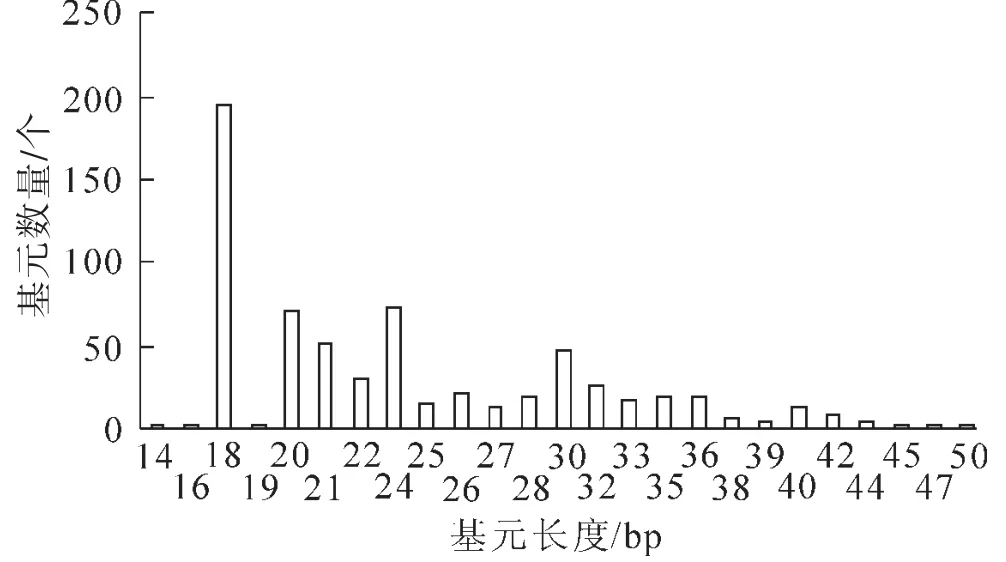
图1 菠萝EST-SSR基元长度分布Figure 1 The distribute of motif length of pineapple EST-SSR
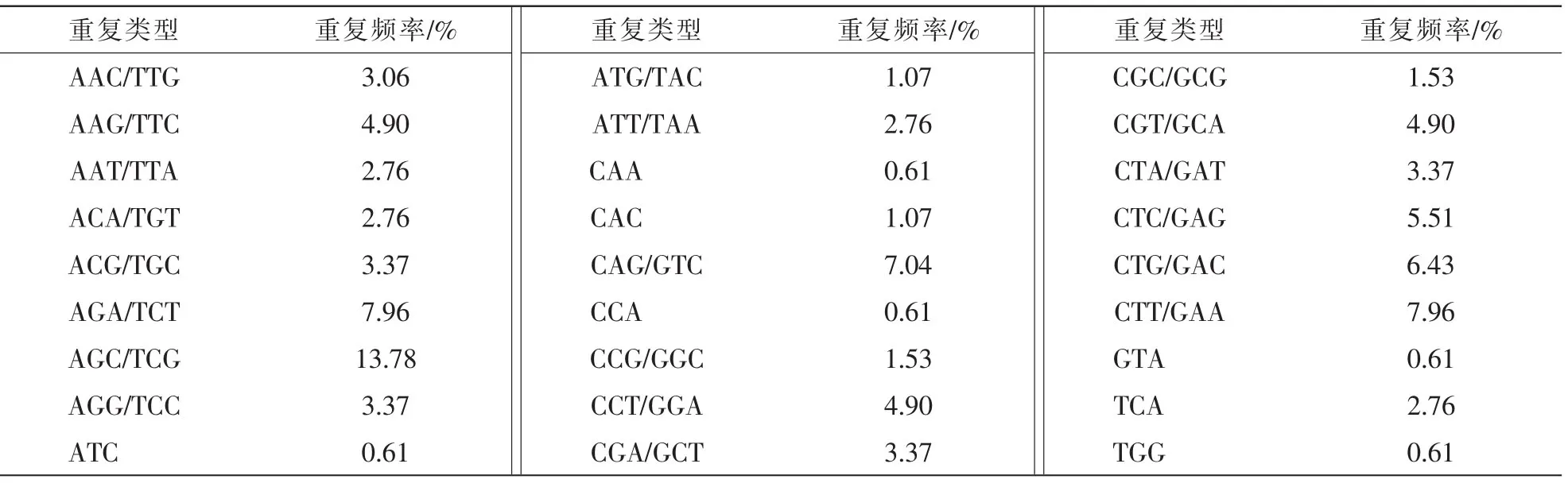
表3 菠萝EST-SSR三核苷酸不同重复基元的重复数量Table 3 Number of SSR loci in trinucleotide repeats across the entire pineapple ESTs
2.3 EST-SSR引物筛选
根据所统计的SSR位点的EST序列信息,共设计了636对引物,从中根据二、三、四、五、六核苷酸在总SSR中所占比例选取30对引物,其中包含3条重叠的SSR所对应的引物,对菠萝的基因组DNA进行PCR扩增。其中筛选出27对引物能扩增出清晰的,大小与预期片段相近的2~7条带,占扩增引物的90%,引物筛选结果见图2。筛选出的27对引物的详细信息见表4。该实验说明利用菠萝EST序列开发EST-SSR标记是高效且可行的。
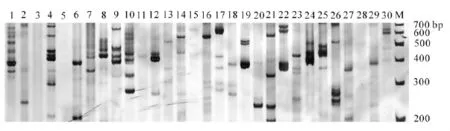
图2 菠萝30对EST-SSR引物扩增结果Figure 2 Amplification results by 30 EST-SSR primers of pineapple
2.4 EST-SSR靶向基因的功能分析
值得关注的是,EST-SSR使无功能的分子标记开始逐步向可以揭示有基因功能的分子标记发展[9],筛选出来的菠萝27对引物所对应的EST,概念性翻译后经BLASTp分析,其中有11条为未知蛋白的mRNA序列,7条为还未发现的序列,其余9条EST的功能注释中有水分胁迫诱导蛋白,甲酰转移酶,衰老相关蛋白,脱水-应答蛋白PD22前体,30S核糖体蛋白质S9,核糖体蛋白L11类似物,新生多肽相关复杂α链,质膜H+-ATP酶,pop3肽,抑制蛋白以及菠萝成熟果实cDNA,新生多肽相关复合物α链。
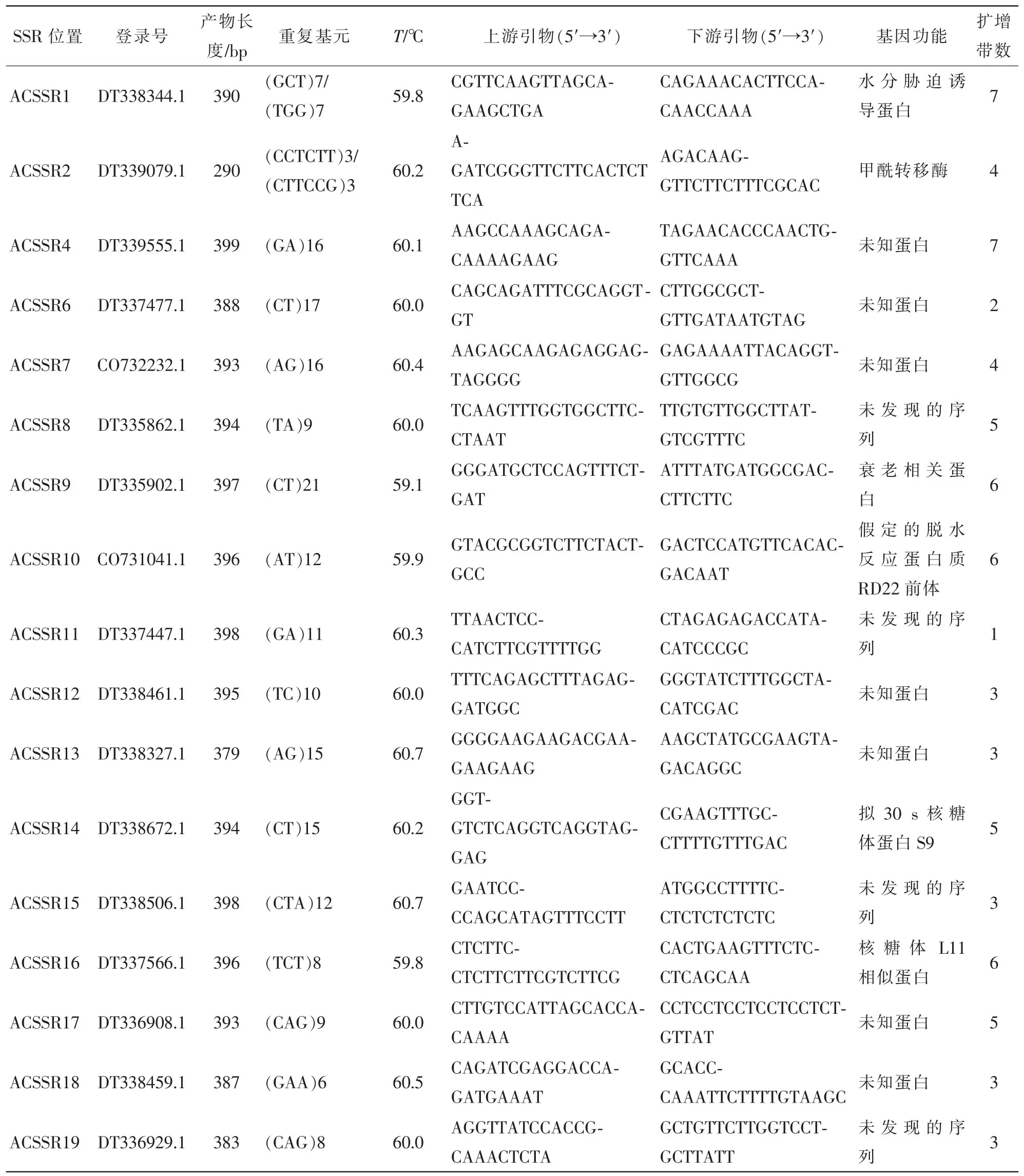
表4 菠萝EST-SSR引物筛选信息Table 4 Information of Pineapple EST-SSR primer screening
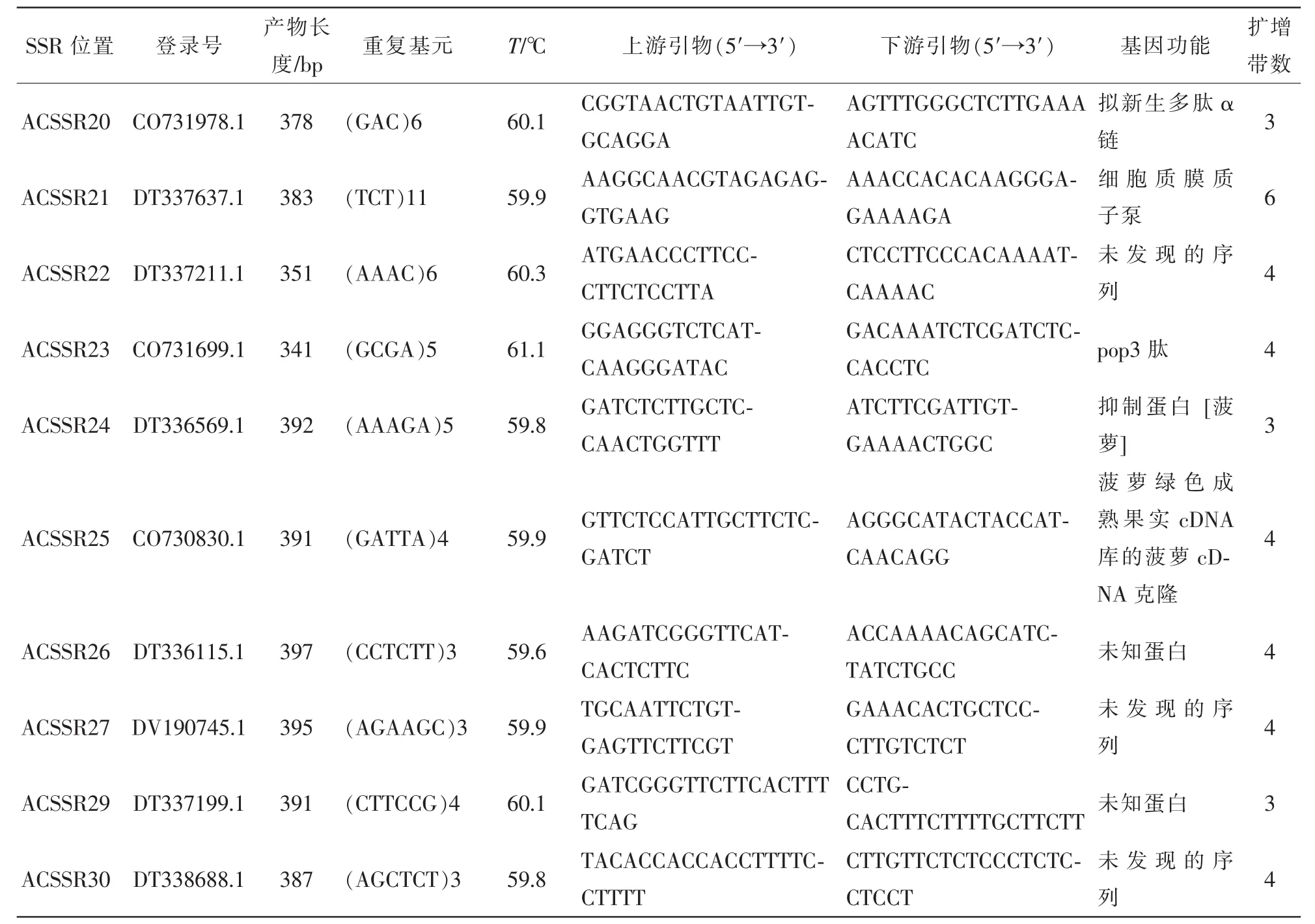
表4 (续)Table 4 Continued
3 讨论
利用扩增片段长度多态性(AFLP),限制性片段长度多态性(RFLP),随机扩增多态性DNA标记(RAPD)和简单重复间序列(ISSR)分子标记技术研究菠萝遗传多样性已有文献报道[10-14]。在菠萝栽培种上至今尚未见从EST中开发SSR的相关报道。随着近年来NCBI中EST数据库的完善,EST-SSR作为新一代分子标记展现了广阔的前景。本实验通过对菠萝5 659条EST进行SSR筛选,共发现636个SSR,分布于617条EST中,SSR占整个EST的11.24%,高于水稻Oryza sativa(4.70%)[15],甘蔗Saccharum(2.90%)[5],普通小麦Triticum aestivum(5.40%)[16],辣椒Capsicum annuum(2.97%)[17],白桦Betula platyphylla(10.20%)[18],亚麻Linum usitatissimum(2.73%)[19],花生Arachis hypogaea(7.80%)[20],香蕉Musa nana(5.30%)[21],西瓜Citrullus vulgaris(6.89%)[2],甜瓜Cucumis melo(8.36%)[22],香菇Lentinus edodes(2.96%)[4],略低于橡胶Hevea brasiliensis(11.42%)[1],核桃Juglans regia(10.75%)[23],猕猴桃Actinidia(14.08%)[24]。上述差异的原因,一是EST数据库中不同物种间基因的差异导致SSR分布的差异;二是SSR检索的软件和标准不同导致最终筛选结果的差异。本研究所得菠萝的EST中,二、三、六核苷酸是主导类型,分别占SSR总数的42.61%,29.25%,20.13%。菠萝二核苷酸重复中AG/TC是比较常见的优势基元类型,在亚麻[19]、甜瓜[22]、苹果[3]、花生[20]中也都存在这一规律;而三核苷酸的重复基元比较分散,优势基元AGC/TCG仅占三核苷酸重复类型的13.98%,六核苷酸SSR在总的EST中有128条,而六核苷酸的重复基元有80种,种类虽丰富,数量却不多。
本研究共设计了636对菠萝EST-SSR引物,合成的30对引物中有27对引物有良好的扩增结果,可以预见对剩余引物的筛选有较高成功率地保证。菠萝EST-SSR出现频率高,而且类型丰富,可为今后凤梨科Bromeliaceae植物分类、遗传作图、遗传多样性分析、功能基因定位等方面研究奠定良好基础。
[1] 安泽伟,赵彦宏,程汉,等.橡胶树EST-SSR标记的开发与应用[J].遗传,2009,31(3):311-319. AN Zewei,ZHAO Yanhong,CHENG Han,et al.Development and application of EST-SSR markers in Hevea brasiliensis Muell.Arg.[J].Hereditas,2009,31(3):311-319.
[2] 赵胜杰,刘文革,阎志红,等.西瓜EST资源的SSR信息分析[J].中国蔬菜,2009,1(24):47-51. ZHAO Shengjie,LIU Wenge,YAN Zhihong,et al.Analysis of SSR information in EST resource of watermelon(Citrullus lanatus)[J].Chin Veget,2009,1(24):47-51.
[3] 张俊娥.苹果EST中微卫星分析[J].广西农业生物科学,2008,27(4):378-380. ZHANG Jun’e.Analysis of microsatellites derived from apple ESTs[J].J Guangxi Agric Biol Sci,2008,27(4):378-380.
[4] 王艳芳,赵彦宏,王爱云,等.香菇EST资源的SSR信息分析[J].食品科学,2010,31(1):137-140. WANG Yanfang,ZHAO Yanhong,WANG Aiyun,et al.Analysis of SSR information in EST resource of Lentinus edodes[J].Food Sci,2010,31(1):137-140.
[5] CORDEIRO G M,CASU R,MCINTYRE C L,et al.Microsatellite markers from sugarcane (Saccharum spp.)ESTs cross transferable to erianthus and sorghum[J].Plant Sci,2001,160(6):1115-1123.
[6] 陈军方,任正隆,高丽锋,等.从小麦EST序列中开发新的SSR引物[J].作物学报,2005,31(2):154-158. CHEN Junfang,REN Zhenglong,GAO Lifeng,et al.Developing new SSR markers from EST of wheat[J].Acta Agron Sin,2005,31(2):154-158.
[7] 张惠云,吴青松,孙伟生,等.改良CTAB法提取菠萝DNA[J].西南农业学报,2009,22(2):440-443. ZHANG Huiyun,WU Qingsong,SUN Weisheng,et al.Method of modified CTAB for DNA extraction from pineapple[J].Southwest China J Agric Sci,2009,22(2):440-443.
[8] TEMNYKH S,DECLERCK G,LUKASHOVA A,et al.Computational and experimental analysis of microsatellites in rice(Oryza sativa L.):frequency,length variation,transposon associations,and genetic marker potential[J].Genome Res,2001,11(8):1441-1452.
[9] 张延明,曲敏,闫玉清,等.EST-SSRs在小麦研究中的应用[J].安徽农学通报,2006,12(13):79-80. ZHANG Yanming,QU Min,YAN Yuqing,et al.Application of EST-SSRs in wheat research[J].Anhui Agric Sci Bull, 2006,12(13):79-80.
[10] 刘卫国,易干军,张秋明,等.菠萝DNA的提取及AFLP反应体系的建立[J].果树学报,2006,23(1):51-54. LIU Weiguo,YI Ganjun,ZHANG Qiuming,et al.Extraction of DNA and construction of AFLP fingerprinting in pineapple[J].J Fruit Sci,2006,23(1):51-54.
[11] DUVAL M F,NOYER J L,PERRIER X,et al.Molecular diversity in pineapple assessed by RFLP markers[J]. Theor Appl Genet,2001,102(1):83-90.
[12] de FÁTIMA RUAS C,RUAS P M,CABRAL J R S.Assessment of genetic relatedness of the genera Ananas and Pseudananas confirmed by RAPD markers[J].Euphytica,2001,119(3):245-252.
[13] FEUSER S,MELER K,DAQUINTA M,et al.Genotypic fidelity of micropropagated pineapple (Ananas comosus)plantlets assessed by isozyme and RAPD markers[J].Plant Cell Tissue Organ Cult,2003,72(3):221-227.
[14] 张如莲,傅小霞,漆智平,等.菠萝17份种质的ISSR分析[J].中国农学通报,2006,22(6):428-431. ZHANG Rulian,FU Xiaoxia,QI Zhiping,et al.ISSR analysis on 17 pine apple resources[J].Chin Agric Sci Bull, 2006,22(6):428-431.
[15] KANTETY R V,la ROTA M,MATTHEWS D E,et al.Data mining for simple sequence repeats in expressed sequence tags from barley,maize,rice,sorghum and wheat[J].Plant Mol Biol,2002,48(5):501-510.
[16] GUPTA P K,RUSTGI S,SHARMA S,et al.Transferable EST-SSR markers for the study of polymorphism and genetic diversity in bread wheat[J].Mol Genet Genomics,2003,270(4):315-323.
[17] 李晶晶,王述彬,刘金兵,等.辣椒EST-SSR标记的开发[J].分子植物育种,2008,6(6):1219-1222. LI Jingjing,WANG Shubin,LIU Jinbing,et al.Development of pepper EST-SSR marker[J].Mol Plant Breed,2008, 6(6):1219-1222.
[18] 王艳敏,魏志刚,杨传平.白桦EST-SSR信息分析与标记的开发[J].林业科学,2008,44(2):78-84. WANG Yanmin,WEI Zhigang,YANG Chuanping.Data mining for SSRs in ESTs and EST-SSR marker development in Betula platyphylla[J].Sci Silv Sin,2008,44(2):78-84.
[19] 张建平,王斌,赵丽娟,等.亚麻EST序列中SSR标记的筛选[J].西北植物学报,2009,29(5):910-915. ZHANG Jianping,WANG Bin,ZHAO Lijuan,et al.Screen of SSR markers from EST of flax (Linum usitatissimum L.)[J].Acta Bot Boreal-Occident Sin,2009,29(5):910-915.
[20] 梁炫强,洪彦彬,陈小平,等.花生栽培种EST-SSRs分布特征及应用研究[J].作物学报,2009,35(2):246-254. LIANG Xuanqiang,HONG Yanbin,CHEN Xiaoping,et al.Characterization and application of EST-SSRs in peanut(Arachis hypogaea L.)[J].Acta Agron Sin,2009,35(2):246-254.
[21] 王静毅,陈业渊,刘伟良,等.香蕉EST-SSRs标记的开发与应用[J].遗传,2008,30(7):933-940. WANG Jingyi,CHEN Yeyuan,LIU Weiliang,et al.Development and application of EST-derived SSR markers for bananas(Musa nana Lour.)[J].Hereditas,2008,30(7):933-940.
[22] 胡建斌,李建吾.甜瓜EST-SSR位点信息及标记开发[J].园艺学报,2009,36(4):513-520. HU Jianbin,LI Jianwu.Information on EST-SSR loci in melon(Cucumis melo L.)and marker exploitation[J].Acta Hortic Sin,2009,36(4):513-520.
[23] 齐建勋,王克建,吴春林,等.核桃EST-SSR标记的开发[J].农业生物技术学报,2009,17(5):872-876. QI Jianxun,WANG Kejian,WU Chunlin,et al.Development of EST-SSR markers in Juglans regia[J].J Agric Biotechnol,2009,17(5):872-876.
[24] 姜春芽,徐小彪,廖娇,等.猕猴桃EST序列的SSR信息分析[J].中国农学通报,2009,25(13):37-39. JIANG Chunya,XU Xiaobiao,LIAO Jiao,et al.Analysis of SSR information in EST resources of kiwifruit(Actinidia ssp.)[J].Chin Agric Sci Bull,2009,25(13):37-39.
Development of novel EST-SSR markers in pineapple(Ananas comosus)by data mining from public EST sequences
CHEN Junhao1,LU Yang1,NI Yanjie1,ZHANG Zhijun1,ZHONG Yaping1,BAO Jingjing1,LUO Shuping2
(1.The Nurturing Station for the State Key Laboratory of Subtropical Silviculture,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.College of Agriculture,Xinjiang Agricultural University,Urumqi 830052,Xinjiang,China)
Expressed sequence tags (ESTs)are used for microsatellite development.EST derived from simple sequence repeats (EST-SSRs),one of the most common new microsatellite markers,are more likely to be embedded in functional gene sequences,to be less costly and time effective,and may provide more information.In the present study,analysis of 5 659 publicly available expressed sequence tags of pineapple(Ananas comosus)was conducted with the Webstat online program.Results of 636 (SSRs),identified electronically in 617 ESTs, showed that the average density was one SSR per 7.39 kb of ESTs screened.Dinucleotide (42.61%),trinucleotide(29.25%),and hexanucleotide(20.13%)repeats were the dominant types among the obtained motifs. The least frequent was tetranucleotide repeats (3.46%).TC/AG was most abundant in the dinucleotide motif. Of the 30 functional pairs,27 primer pairs showed polymorphisms by polymerase chain reaction(PCR)amplifications.Thus,the EST-SSRs developed here with the first large-scale development of SSR markers in pineapple have the potential to be used for development of genetic and physical maps,quantitative trait loci mapping, genetic diversity studies,association mapping,and finger printing cultivars.[Ch,2 fig.4 ref.24 ref.]
molecular biology;Ananas comosus;ESTs;SSR
S664.1;Q781
A
2095-0756(2017)02-0332-08
10.11833/j.issn.2095-0756.2017.02.018
2016-03-16;
2016-05-07
浙江省自然科学基金资助项目(LY14C160009)
陈俊浩,从事生物科学研究。E-mail:hans_chan001@163.com。通信作者:张智俊,副教授,博士,从事生物技术与种质创新研究。E-mail:397942805@qq.com
