毛桃叶片愈伤组织诱导
2017-04-15谭彬郭水欢韩亚萍郑先波叶霞�├罴潭�冯建灿
谭彬+郭水欢+韩亚萍+郑先波++叶霞�├罴潭�+冯建灿


摘要:分别以毛桃组培苗和胚培苗叶片为外植体,探讨了不同植物生长调节剂质量浓度组合对毛桃叶片愈伤组织诱导过程中愈伤组织形成率和愈伤组织相对生长量的影响,并对不同处理诱导产生的愈伤组织进行评价。结果表明适合毛桃组培苗叶片愈伤组织再生的最适培养基为MS+1.2 mg/L 2,4-D+1.0 mg/L 6-BA+ 0.5 mg/L AgNO3,其愈伤组织形成率和愈伤组织相对生长量分别为88.09%和3;适合毛桃胚培苗叶片愈伤组织再生的最适培养基为 MS+1.0 mg/L TDZ+1.5 mg/L NAA+0.5 mg/L AgNO3,其愈伤组织形成率和愈伤组织相对生长量分别为69.77%和4。2种来源叶片外植体最适培养基中诱导产生的愈伤组织其愈伤组织形成率和愈伤组织相对生长量虽有差异,但所产生的愈伤组织均为黄绿色,紧实有突起,具备良好的再生能力。
关键词:毛桃(Prunus persica);叶片;愈伤组织;诱导;再生
中图分类号: S662.104+.3文献标志码: A
文章编号:1002-1302(2017)05-0037-03
我国是世界第一产桃大国,但桃砧木的利用还处在比较原始的状态,生产上一般都是直接采用野生桃种子(如毛桃、山桃、甘肃桃等)或生产品种(如青州蜜桃)的种子做砧木[1]。其中野生毛桃(Prunus persica)是我国应用最为广泛的桃树砧木,其根系发达、生长健壮,与栽培品种嫁接亲和性好[2],抗根结线虫能力较强,而抗真菌、耐旱性一般[3-4]。与常规桃育种相比,砧木育种周期更长,更加费时费力[1]。现代生物技术,尤其是组织培养和转基因技术的出现,为通过基因工程方法提高毛桃抗性、提高育种效率提供了可能。
高效稳定再生体系是开展桃遗传转化工作的基础,由于缺乏稳定、高效的再生体系,桃基因工程、功能基因鉴定等方面研究与应用受到严重制约。基因型、外植体类型和状态、基本培养基、植物生长调节剂、碳源、培养条件等均对桃离体再生有影响。刘航空等以早熟油桃华光和曙光为试材,对影响早熟油桃叶片产生胚性愈伤的多个因素进行研究,结果表明外源激素对诱导桃叶片产生胚性愈伤组织影响显著[5]。齐贤等以黄水蜜桃为对象,研究了不同植物生长调节剂对其胚培苗茎段愈伤组织形成率的影响,结果表明添加2.0 mg/L 6-BA 和0.5 mg/L NAA的MS培养基为最适培养基,其愈伤组织形成率为85%[6]。目前国内外关于桃砧木组织培养方面的研究较少,研究对象多为GF677和 Nemaguard[7-8];所用外植体主要为茎尖、子叶[9-11]等,而叶片[8,12]报道较少。基于此,本研究分别以桃砧木类型毛桃组培苗和胚培苗叶片为外植体,探讨不同植物生长调节剂质量浓度组合对愈伤组织诱导的影响,为高效稳定再生体系建立和遗传转化奠定基础。
1材料与方法
1.1材料
试验材料毛桃幼嫩枝条和自交果实分别于2015年4月和8月采自河南农业大学三区桃资源圃。
1.2方法
1.2.1无菌组培苗的获得
毛桃幼嫩枝条在晴天10:00左右,取田间新梢装入洁净塑料袋带回室内,去掉叶片并保留部分叶柄;用洗衣粉漂洗20 min,经流水冲洗2 h。然后在无菌条件下,剪取带有腋芽的茎段(1.5~2.0 cm),用70%乙醇浸泡30 s,用无菌水冲洗2~3遍,再用0.1%的HgCl2处理 6 min,再用无菌水冲洗2~3遍,接种于初代培养基,培养2周后统计萌芽率;培养4周后将萌发的芽切下后继代培养,以获得的无菌组培苗叶片为外植体进行后续试验。初代培养所用培养基为MS+6-BA 1.0 mg/L+IBA 0.1 mg/L+GA3 0.5 mg/L+AgNO3 0.5 mg/L培养基,继代培养是在原培养基中再添加200 mg/L头孢霉素、蔗糖30 g/L、琼脂6.8 g/L,PH值5.7,培养条件为温度(26±2) ℃,相对湿度60%~70%,光照度为1 500~2 000 lx,每日光照14 h(下同)。
1.2.2胚培苗的获得
毛桃胚培苗的获得参照齐贤等的方法[6]略作修改。具体操作步骤如下:将采摘的毛桃果实去除果肉,冲洗干净后将桃核用5%(体积分数)的次氯酸钠消毒20 min,用锤子砸开桃核取出核仁,在超净工作台上用70%酒精浸泡核仁30 s,用无菌水冲洗2~3遍,然后用0.1%(质量浓度)的HgCl2消毒5 min,用无菌水冲洗5次,将灭菌的核仁接种在WPM培养基上,放进4 ℃培养箱内暗培养45 d后转入光照培养室培养。光照培养14 d和28 d后分别调查萌芽率和成苗率,并以获得的胚培苗叶片为外植体进行后续试验。
1.2.3毛桃愈伤组织的诱导
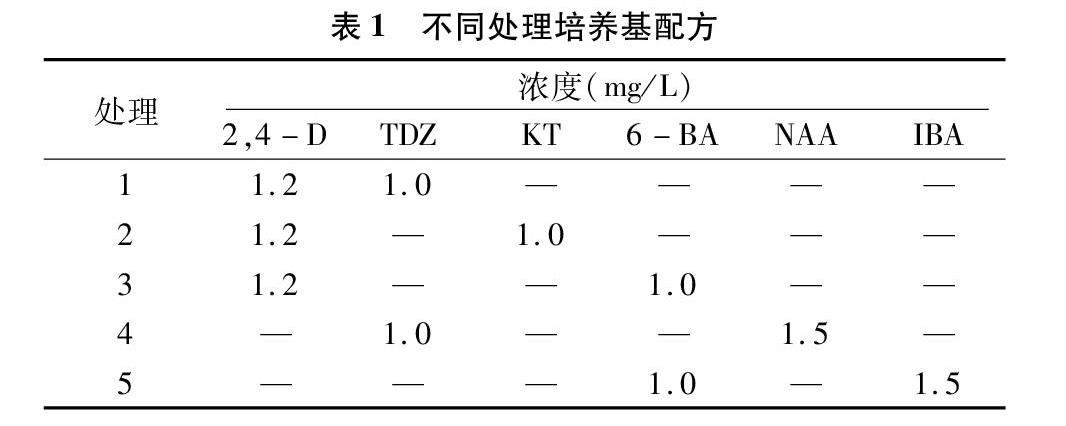
叶片外植体分别取自组培苗和胚培苗,选取生长良好、完全展开的幼嫩叶片,垂直主脉横切2~3刀,不傷及叶缘,将近轴面向上平铺于培养基上。不同处理所用基本培养基为MS+0.5 mg/L AgNO3,不同处理培养基中添加植物生长调节剂种类及浓度如表1所示。每处理接种30个外植体,重复3次。接种后进行暗培养,暗培养4周后转入光培养,光培养1周后分别调查不同处理愈伤组织形成率和愈伤组织相对生长量,并记录愈伤组织生长状态。暗培养温度为(26±2) ℃,相对湿度 60%~70%。
2结果与分析
[HTK]2.1不同植物生长调节剂对毛桃组培苗叶片愈伤组织诱导的影响[HT]
将带有腋芽的毛桃茎段经消毒处理后接种至培养基(图1-A),培养1周后腋芽开始萌发(图1-B),培养2周后统计萌芽率为69.02%,继续培养2周后将萌发的腋芽切下转移至新鲜培养基进行伸长培养,培养4周后获得生长旺盛的无菌组培苗(图1-C)。将获得的无菌组培苗叶片分别接种至添加不同种类和浓度植物生长调节剂的培养基中,暗培养1周后,部分叶片叶柄处和切口开始产生愈伤组织,随着暗培养的时间的延长,产生愈伤组织的叶片数明显增多,暗培养4周后转入光下培养1周,5个处理大部分叶片切口处均产生愈伤组织(图1-D至图1-H)。此时观察不同处理愈伤组织颜色和生长状态(图1-D至图1-H,表2),其中处理1诱导产生的愈伤组织为浅绿色,松散,轻微褐化,有光泽(图1-D);处理2诱导产生的愈伤组织为白色,较松散,成海绵状(图1-E);处理3诱导产生的愈伤组织为黄绿色,紧实有突起,表面光滑(图1-F);处理4诱导产生的愈伤组织黄绿色,且有白色,松散,成海绵状,褐化(图1-G);处理5诱导产生的愈伤组织为绿色,有突起,轻微褐化
不同植物生长调节剂种类和浓度对毛桃组培苗叶片愈伤组织形成率和愈伤组织相对生长量的影响如表2所示。MS培养基中添加1.2 mg/L 2,4-D和1.0 mg/L 6-BA组合(处理3)的愈伤组织形成率最高,为88.09%;当2,4-D浓度一定时,1.0 mg/L 6-BA组合(处理3)的愈伤组织形成率明显高于1.0 mg/L TDZ组合(处理1)和1.0 mg/L KT组合(处理2),而愈伤组织相对生长量则相反;当TDZ浓度一定时,TDZ与2,4-D组合(处理1)的愈伤组织形成率和愈伤组织相对生长量高于TDZ与NAA組合(处理4);培养基中没有添加TDZ和2,4-D时,一定浓度6-BA和IBA组合(处理5)的愈伤组织形成率和愈伤组织相对生长量最低,分别为6714%和1。综合分析可知,适合毛桃组培苗叶片愈伤组织诱导的最适培养基为MS+0.5 mg/L AgNO3+1.2 mg/L 2,4-D+1.0 mg/L 6-BA(处理3)。
[HTK]2.2不同植物生长调节剂对毛桃胚培苗叶片愈伤组织诱导的影响[HT]
将灭菌的毛桃核仁接种在WPM培养基上(图2-A),4 ℃ 培养箱内暗培养45 d后转入光照培养室培养,培养14 d和28 d后分别调查萌芽率和成苗率,均为95%。从生长健壮的胚培苗(图2-B)上取叶片接种到愈伤组织诱导培养基上,暗培养1周后,部分叶片叶柄处和切口开始产生愈伤组织,随着暗培养的进行产生愈伤组织的叶片数明显增多,暗培养4周后转入光下培养1周,发现5个处理大部分叶片切口处均产生愈伤组织(图2-C至图2-G),但不同处理产生的愈伤组织颜色和状态存在一定差异(图2 C-G,表3)。其中处理1诱导产生的愈伤组织为黄绿色,略带白色,松散(图2-C);处理2诱导产生的愈伤组织为黄色,松散,成海绵状(图2-D);处理3诱导产生的愈伤组织为黄白色,松散,轻微褐化(图2-E);处理4诱导产生的愈伤组织黄绿色,紧实有突起(图2-F);处理5诱导产生的愈伤组织为黄白色,有突起(图2-G)。此外,不同处理中愈伤组织主要产生的部位也有差异(图2-C至图2-G), 除处理5诱导产生的愈伤组织主要
植物生长调节剂种类和浓度对毛桃胚培苗叶片愈伤组织形成率和愈伤组织相对生长量的影响如表3所示。当 1.2 mg/L 2,4-D和1.0 mg/L KT(处理2)共同使用时,愈伤组织形成率最高,为80.68%,但此处理产生的愈伤组织松散、成海绵状,此种状态愈伤组织不具备再生能力;而当培养基中没有添加TDZ和2,4-D时,一定浓度6-BA和IBA组合(处理5)的愈伤组织形成率最低(66.02%),这一结果与毛桃组培苗叶片诱导产生愈伤组织结果一致(67.14%,最低),但该处理诱导产生的愈伤组织没有发生褐化;当2,4-D浓度一定时,1.0 mg/L 6-BA组合(处理3)的愈伤组织形成率低于1.0 mg/L TDZ组合(处理1)和1.0 mg/L KT组合(处理2);当TDZ浓度一定时,TDZ和2,4-D组合(处理1)的愈伤组织形成率与TDZ和NAA组合差异不显著(处理4),此结果与毛桃组培苗叶片诱导产生愈伤组织结果相反,但处理4的愈伤组织相对生长量高于处理3,且处理4产生的愈伤组织为黄绿色,紧实有突起,此种状态的愈伤组织具备良好的再生能力。综合愈伤组织颜色和状态、愈伤组织形成率和愈伤组织相对生长量可知,适合毛桃组培苗叶片愈伤组织诱导的最适培养基为MS+0.5 mg/L AgNO3+1.0 mg/L TDZ+1.5 mg/L NAA(处理4)。
3结论与讨论
外源植物生长调节剂对桃叶片的愈伤组织诱导影响显著,其中TDZ和BA被认为是诱导效果比较好的细胞分裂素,而生长素常用的有2,4-D和NAA。丛芳等以桃栽培品种曙光、金童5号和甜桃王试管苗[JP2]叶片为外植体,研究了植物生长调节剂种类及浓度对叶片再生的影响,结果表明3种基因型试管苗叶片在LP+0.4 mg/L
TDZ培养基中生长较好,且愈伤组织形成率均最高,分别达到72.2%、78.8%和71.3%[13];张永庆等以奉化玉露桃不同外植体进行离体培养试验,其中以幼叶为外植体得到的愈伤组织诱导率为70%,且得到的愈伤组织为深绿色,硬实,粉状,多次继代培养后发褐衰老[14];而本研究中以毛桃组培苗叶片为外植体研究不同植物生长调节物质对愈伤组织诱导的影响,结果表明愈伤组织诱导的最适培养基为 MS+0.5 mg/L AgNO3+1.2 mg/L 2,4-D+1.0 mg/L 6-BA,愈伤组织形成率为88.09%,明显高于丛芳等的研究结果[11-12],且诱导产生的愈伤组织为黄绿色,紧实有突起,表面光滑。
此外,同一基因型相同外植体因其来源不同其愈伤组织形成率、愈伤组织相对生长量及愈伤组织状态均有差异。现有关于桃叶片离体培养的报道中所用叶片主要取自田间枝条消毒处理后培养获得的无菌苗[8,12,15],而用胚培苗叶片的尚未见报道。本研究分别以毛桃组培苗和胚培苗叶片为外植体进行愈伤组织诱导,2种来源叶片在不同培养基中均成功诱导产生愈伤组织,不同处理中愈伤组织形成率最高分别可达88.09%和88.68%;但结合愈伤组织形成率、愈伤组织相对生长量及愈伤组织状态综合分析发现,2种来源的叶片愈伤组织诱导的最适培养基却不相同,其中组培苗叶片诱导愈伤组织的最适培养基中添加的是2,4-D和 6-BA,而胚培苗叶片诱导愈伤组织的最适培养基中添加的是TDZ和NAA,这种差异的产生可能与2种来源叶片本身的生理状态有关。
桃树通过愈伤组织和体细胞再生系统途径再生的研究进展相当缓慢,而植物遗传转化的众多研究已经证明通过愈伤组织再生系统转化率较高,因此,建立一个高效且适宜于桃遗传转化的通过愈伤组织或胚状体再生途径的再生系统已成为开展转基因工作的关键环节[16]。本研究初步获得了大量生长状态良好、稳定一致的毛桃愈伤组织,为后续通过愈伤组织途径建立再生体系和通过基因工程方法进行毛桃种质的改良奠定基础。
参考文献:
[1]王志强,牛良,刘淑娥,等. 世界桃砧木育种现状与展望[C]. 中国园艺学会桃分会成立大会暨学术研讨会论文集,2007.
[HT8.]
[2]浙江农业大学.果树育种学[M]. 上海:上海科学技术出版社,1980:270.
[3]叶航. 4种桃砧木对南方根结线虫的抗性研究[D]. 北京:中國农业大学,2006.
[4]曹艳平. 几种桃树砧木的抗旱和耐涝性研究[D]. 北京:中国农业大学,2007.
[5]刘航空,韩明玉,禹婷,等. 影响油桃叶片产生胚性愈伤组织的因素[J]. 果树学报,2006,23(3):370-374.
[6]齐贤,谭彬,郑先波,等. ‘黄水蜜桃实生苗茎段再生体系的建立[J]. 果树学报,2015,32(5):866-871.
[7]Peérez-Jimeénez M,Carrillo-Navarro A,C-Terrer J. Regeneration of peach [Prunus persica (L.) Batsch] cultivars and Prunus persica×Prunus dulcis rootstocks via organogenesis[J]. Plant Cell Tissue and Organ Culture,2012,108:55-62.
[8][JP2]Zhou H C,Li M,Zhao X,et al. Plant regeneration from in vitro leaves of the peach rootstock ‘Nemaguard(Prunus persica × P. davidiana)[J]. Plant Cell Tissue and Organ Culture,2010,101:79-87.[JP]
[9]张衡涛,李靖,宋尚伟,等. 桃矮化砧木的组织培养及植株再生[J]. 河南农业大学学报,2004,38(1):77-81.[ZK)]
[10][ZK(#]马常念,张慧琴,肖金平,等. 三种桃砧木茎尖培养技术的研究[J]. 浙江农业学报,2013,25(3):503-508.[HJ1.88mm]
[11]Pooler M.R.,Scorza R. Regeneration of peach[Prunus persica (L.) Batsch]rootstock cultivar from cotyledons of mature stored seed[J]. HortScience,1995,30(2):355-356.
[12]San B S,Li Z G,Hu J,et al. Adventitious shoot regeneration from in vitro cultured leaf explants of peach rootstock Guardian is significantly enhanced by silver thiosulfate[J]. Plant Cell Tissue and Organ Culture,2015,120:757-765.
[13]丛芳,韩明玉,赵彩平,等. 桃叶片再生不定芽的研究[J]. 果树学报,2009,26(5):614-618.
[14]张永庆,陈大明,金勇丰,等. 桃离体组织分化再生植株的研究[J]. 园艺学报,2001,28(4):342-343.
[15]Gentile A,Monticelli S,Damiano C,et al. Adventitious shoot regeneration in peach[Prunus persica (L.) Batsch][J]. Plant Cell Rep,2002,20:1011-1016.
[16]吴延军,徐昌杰,张上隆. 桃组织培养和遗传转化研究现状及展望[J]. 果树学报,2002,19(2):123-127.
[FQ)]
谭彬 郭水欢 韩亚萍 郑先波 叶霞�├罴潭� 冯建灿

摘要:分别以毛桃组培苗和胚培苗叶片为外植体,探讨了不同植物生长调节剂质量浓度组合对毛桃叶片愈伤组织诱导过程中愈伤组织形成率和愈伤组织相对生长量的影响,并对不同处理诱导产生的愈伤组织进行评价。结果表明适合毛桃组培苗叶片愈伤组织再生的最适培养基为MS+1.2 mg/L 2,4-D+1.0 mg/L 6-BA+ 0.5 mg/L AgNO3,其愈伤组织形成率和愈伤组织相对生长量分别为88.09%和3;适合毛桃胚培苗叶片愈伤组织再生的最适培养基为 MS+1.0 mg/L TDZ+1.5 mg/L NAA+0.5 mg/L AgNO3,其愈伤组织形成率和愈伤组织相对生长量分别为69.77%和4。2种来源叶片外植体最适培养基中诱导产生的愈伤组织其愈伤组织形成率和愈伤组织相对生长量虽有差异,但所产生的愈伤组织均为黄绿色,紧实有突起,具备良好的再生能力。
关键词:毛桃(Prunus persica);叶片;愈伤组织;诱导;再生
中图分类号: S662.104+.3文献标志码: A
文章编号:1002-1302(2017)05-0037-03
我国是世界第一产桃大国,但桃砧木的利用还处在比较原始的状态,生产上一般都是直接采用野生桃种子(如毛桃、山桃、甘肃桃等)或生产品种(如青州蜜桃)的种子做砧木[1]。其中野生毛桃(Prunus persica)是我国应用最为广泛的桃树砧木,其根系发达、生长健壮,与栽培品种嫁接亲和性好[2],抗根结线虫能力较强,而抗真菌、耐旱性一般[3-4]。与常规桃育种相比,砧木育种周期更长,更加费时费力[1]。现代生物技术,尤其是组织培养和转基因技术的出现,为通过基因工程方法提高毛桃抗性、提高育种效率提供了可能。
高效稳定再生体系是开展桃遗传转化工作的基础,由于缺乏稳定、高效的再生体系,桃基因工程、功能基因鉴定等方面研究与应用受到严重制约。基因型、外植体类型和状态、基本培养基、植物生长调节剂、碳源、培养条件等均对桃离体再生有影响。刘航空等以早熟油桃华光和曙光为试材,对影响早熟油桃叶片产生胚性愈伤的多个因素进行研究,结果表明外源激素对诱导桃叶片产生胚性愈伤组织影响显著[5]。齐贤等以黄水蜜桃为对象,研究了不同植物生长调节剂对其胚培苗茎段愈伤组织形成率的影响,结果表明添加2.0 mg/L 6-BA 和0.5 mg/L NAA的MS培養基为最适培养基,其愈伤组织形成率为85%[6]。目前国内外关于桃砧木组织培养方面的研究较少,研究对象多为GF677和 Nemaguard[7-8];所用外植体主要为茎尖、子叶[9-11]等,而叶片[8,12]报道较少。基于此,本研究分别以桃砧木类型毛桃组培苗和胚培苗叶片为外植体,探讨不同植物生长调节剂质量浓度组合对愈伤组织诱导的影响,为高效稳定再生体系建立和遗传转化奠定基础。
1材料与方法
1.1材料
试验材料毛桃幼嫩枝条和自交果实分别于2015年4月和8月采自河南农业大学三区桃资源圃。
1.2方法
1.2.1无菌组培苗的获得
毛桃幼嫩枝条在晴天10:00左右,取田间新梢装入洁净塑料袋带回室内,去掉叶片并保留部分叶柄;用洗衣粉漂洗20 min,经流水冲洗2 h。然后在无菌条件下,剪取带有腋芽的茎段(1.5~2.0 cm),用70%乙醇浸泡30 s,用无菌水冲洗2~3遍,再用0.1%的HgCl2处理 6 min,再用无菌水冲洗2~3遍,接种于初代培养基,培养2周后统计萌芽率;培养4周后将萌发的芽切下后继代培养,以获得的无菌组培苗叶片为外植体进行后续试验。初代培养所用培养基为MS+6-BA 1.0 mg/L+IBA 0.1 mg/L+GA3 0.5 mg/L+AgNO3 0.5 mg/L培养基,继代培养是在原培养基中再添加200 mg/L头孢霉素、蔗糖30 g/L、琼脂6.8 g/L,PH值5.7,培养条件为温度(26±2) ℃,相对湿度60%~70%,光照度为1 500~2 000 lx,每日光照14 h(下同)。
1.2.2胚培苗的获得
毛桃胚培苗的获得参照齐贤等的方法[6]略作修改。具体操作步骤如下:将采摘的毛桃果实去除果肉,冲洗干净后将桃核用5%(体积分数)的次氯酸钠消毒20 min,用锤子砸开桃核取出核仁,在超净工作台上用70%酒精浸泡核仁30 s,用无菌水冲洗2~3遍,然后用0.1%(质量浓度)的HgCl2消毒5 min,用无菌水冲洗5次,将灭菌的核仁接种在WPM培养基上,放进4 ℃培养箱内暗培养45 d后转入光照培养室培养。光照培养14 d和28 d后分别调查萌芽率和成苗率,并以获得的胚培苗叶片为外植体进行后续试验。
1.2.3毛桃愈伤组织的诱导
叶片外植体分别取自组培苗和胚培苗,选取生长良好、完全展开的幼嫩叶片,垂直主脉横切2~3刀,不傷及叶缘,将近轴面向上平铺于培养基上。不同处理所用基本培养基为MS+0.5 mg/L AgNO3,不同处理培养基中添加植物生长调节剂种类及浓度如表1所示。每处理接种30个外植体,重复3次。接种后进行暗培养,暗培养4周后转入光培养,光培养1周后分别调查不同处理愈伤组织形成率和愈伤组织相对生长量,并记录愈伤组织生长状态。暗培养温度为(26±2) ℃,相对湿度 60%~70%。
2结果与分析
[HTK]2.1不同植物生长调节剂对毛桃组培苗叶片愈伤组织诱导的影响[HT]
将带有腋芽的毛桃茎段经消毒处理后接种至培养基(图1-A),培养1周后腋芽开始萌发(图1-B),培养2周后统计萌芽率为69.02%,继续培养2周后将萌发的腋芽切下转移至新鲜培养基进行伸长培养,培养4周后获得生长旺盛的无菌组培苗(图1-C)。将获得的无菌组培苗叶片分别接种至添加不同种类和浓度植物生长调节剂的培养基中,暗培养1周后,部分叶片叶柄处和切口开始产生愈伤组织,随着暗培养的时间的延长,产生愈伤组织的叶片数明显增多,暗培养4周后转入光下培养1周,5个处理大部分叶片切口处均产生愈伤组织(图1-D至图1-H)。此时观察不同处理愈伤组织颜色和生长状态(图1-D至图1-H,表2),其中处理1诱导产生的愈伤组织为浅绿色,松散,轻微褐化,有光泽(图1-D);处理2诱导产生的愈伤组织为白色,较松散,成海绵状(图1-E);处理3诱导产生的愈伤组织为黄绿色,紧实有突起,表面光滑(图1-F);处理4诱导产生的愈伤组织黄绿色,且有白色,松散,成海绵状,褐化(图1-G);处理5诱导产生的愈伤组织为绿色,有突起,轻微褐化
不同植物生长调节剂种类和浓度对毛桃组培苗叶片愈伤组织形成率和愈伤组织相对生长量的影响如表2所示。MS培养基中添加1.2 mg/L 2,4-D和1.0 mg/L 6-BA组合(处理3)的愈伤组织形成率最高,为88.09%;当2,4-D浓度一定时,1.0 mg/L 6-BA组合(处理3)的愈伤组织形成率明显高于1.0 mg/L TDZ组合(处理1)和1.0 mg/L KT组合(处理2),而愈伤组织相对生长量则相反;当TDZ浓度一定时,TDZ与2,4-D组合(处理1)的愈伤组织形成率和愈伤组织相对生长量高于TDZ与NAA組合(处理4);培养基中没有添加TDZ和2,4-D时,一定浓度6-BA和IBA组合(处理5)的愈伤组织形成率和愈伤组织相对生长量最低,分别为6714%和1。综合分析可知,适合毛桃组培苗叶片愈伤组织诱导的最适培养基为MS+0.5 mg/L AgNO3+1.2 mg/L 2,4-D+1.0 mg/L 6-BA(处理3)。
[HTK]2.2不同植物生长调节剂对毛桃胚培苗叶片愈伤组织诱导的影响[HT]
将灭菌的毛桃核仁接种在WPM培养基上(图2-A),4 ℃ 培养箱内暗培养45 d后转入光照培养室培养,培养14 d和28 d后分别调查萌芽率和成苗率,均为95%。从生长健壮的胚培苗(图2-B)上取叶片接种到愈伤组织诱导培养基上,暗培养1周后,部分叶片叶柄处和切口开始产生愈伤组织,随着暗培养的进行产生愈伤组织的叶片数明显增多,暗培养4周后转入光下培养1周,发现5个处理大部分叶片切口处均产生愈伤组织(图2-C至图2-G),但不同处理产生的愈伤组织颜色和状态存在一定差异(图2 C-G,表3)。其中处理1诱导产生的愈伤组织为黄绿色,略带白色,松散(图2-C);处理2诱导产生的愈伤组织为黄色,松散,成海绵状(图2-D);处理3诱导产生的愈伤组织为黄白色,松散,轻微褐化(图2-E);处理4诱导产生的愈伤组织黄绿色,紧实有突起(图2-F);处理5诱导产生的愈伤组织为黄白色,有突起(图2-G)。此外,不同处理中愈伤组织主要产生的部位也有差异(图2-C至图2-G), 除处理5诱导产生的愈傷组织主要
植物生长调节剂种类和浓度对毛桃胚培苗叶片愈伤组织形成率和愈伤组织相对生长量的影响如表3所示。当 1.2 mg/L 2,4-D和1.0 mg/L KT(处理2)共同使用时,愈伤组织形成率最高,为80.68%,但此处理产生的愈伤组织松散、成海绵状,此种状态愈伤组织不具备再生能力;而当培养基中没有添加TDZ和2,4-D时,一定浓度6-BA和IBA组合(处理5)的愈伤组织形成率最低(66.02%),这一结果与毛桃组培苗叶片诱导产生愈伤组织结果一致(67.14%,最低),但该处理诱导产生的愈伤组织没有发生褐化;当2,4-D浓度一定时,1.0 mg/L 6-BA组合(处理3)的愈伤组织形成率低于1.0 mg/L TDZ组合(处理1)和1.0 mg/L KT组合(处理2);当TDZ浓度一定时,TDZ和2,4-D组合(处理1)的愈伤组织形成率与TDZ和NAA组合差异不显著(处理4),此结果与毛桃组培苗叶片诱导产生愈伤组织结果相反,但处理4的愈伤组织相对生长量高于处理3,且处理4产生的愈伤组织为黄绿色,紧实有突起,此种状态的愈伤组织具备良好的再生能力。综合愈伤组织颜色和状态、愈伤组织形成率和愈伤组织相对生长量可知,适合毛桃组培苗叶片愈伤组织诱导的最适培养基为MS+0.5 mg/L AgNO3+1.0 mg/L TDZ+1.5 mg/L NAA(处理4)。
3结论与讨论
外源植物生长调节剂对桃叶片的愈伤组织诱导影响显著,其中TDZ和BA被认为是诱导效果比较好的细胞分裂素,而生长素常用的有2,4-D和NAA。丛芳等以桃栽培品种曙光、金童5号和甜桃王试管苗[JP2]叶片为外植体,研究了植物生长调节剂种类及浓度对叶片再生的影响,结果表明3种基因型试管苗叶片在LP+0.4 mg/L
TDZ培养基中生长较好,且愈伤组织形成率均最高,分别达到72.2%、78.8%和71.3%[13];张永庆等以奉化玉露桃不同外植体进行离体培养试验,其中以幼叶为外植体得到的愈伤组织诱导率为70%,且得到的愈伤组织为深绿色,硬实,粉状,多次继代培养后发褐衰老[14];而本研究中以毛桃组培苗叶片为外植体研究不同植物生长调节物质对愈伤组织诱导的影响,结果表明愈伤组织诱导的最适培养基为 MS+0.5 mg/L AgNO3+1.2 mg/L 2,4-D+1.0 mg/L 6-BA,愈伤组织形成率为88.09%,明显高于丛芳等的研究结果[11-12],且诱导产生的愈伤组织为黄绿色,紧实有突起,表面光滑。
此外,同一基因型相同外植体因其来源不同其愈伤组织形成率、愈伤组织相对生长量及愈伤组织状态均有差异。现有关于桃叶片离体培养的报道中所用叶片主要取自田间枝条消毒处理后培养获得的无菌苗[8,12,15],而用胚培苗叶片的尚未见报道。本研究分别以毛桃组培苗和胚培苗叶片为外植体进行愈伤组织诱导,2种来源叶片在不同培养基中均成功诱导产生愈伤组织,不同处理中愈伤组织形成率最高分别可达88.09%和88.68%;但结合愈伤组织形成率、愈伤组织相对生长量及愈伤组织状态综合分析发现,2种来源的叶片愈伤组织诱导的最适培养基却不相同,其中组培苗叶片诱导愈伤组织的最适培养基中添加的是2,4-D和 6-BA,而胚培苗叶片诱导愈伤组织的最适培养基中添加的是TDZ和NAA,这种差异的产生可能与2种来源叶片本身的生理状态有关。
桃树通过愈伤组织和体细胞再生系统途径再生的研究进展相当缓慢,而植物遗传转化的众多研究已经证明通过愈伤组织再生系统转化率较高,因此,建立一个高效且适宜于桃遗传转化的通过愈伤组织或胚状体再生途径的再生系统已成为开展转基因工作的关键环节[16]。本研究初步获得了大量生长状态良好、稳定一致的毛桃愈伤组织,为后续通过愈伤组织途径建立再生体系和通过基因工程方法进行毛桃种质的改良奠定基础。
参考文献:
[1]王志强,牛良,刘淑娥,等. 世界桃砧木育种现状与展望[C]. 中国园艺学会桃分会成立大会暨学术研讨会论文集,2007.
[HT8.]
[2]浙江农业大学.果树育种学[M]. 上海:上海科学技术出版社,1980:270.
[3]叶航. 4种桃砧木对南方根结线虫的抗性研究[D]. 北京:中國农业大学,2006.
[4]曹艳平. 几种桃树砧木的抗旱和耐涝性研究[D]. 北京:中国农业大学,2007.
[5]刘航空,韩明玉,禹婷,等. 影响油桃叶片产生胚性愈伤组织的因素[J]. 果树学报,2006,23(3):370-374.
[6]齐贤,谭彬,郑先波,等. ‘黄水蜜桃实生苗茎段再生体系的建立[J]. 果树学报,2015,32(5):866-871.
[7]Peérez-Jimeénez M,Carrillo-Navarro A,C-Terrer J. Regeneration of peach [Prunus persica (L.) Batsch] cultivars and Prunus persica×Prunus dulcis rootstocks via organogenesis[J]. Plant Cell Tissue and Organ Culture,2012,108:55-62.
[8][JP2]Zhou H C,Li M,Zhao X,et al. Plant regeneration from in vitro leaves of the peach rootstock ‘Nemaguard(Prunus persica × P. davidiana)[J]. Plant Cell Tissue and Organ Culture,2010,101:79-87.[JP]
[9]张衡涛,李靖,宋尚伟,等. 桃矮化砧木的组织培养及植株再生[J]. 河南农业大学学报,2004,38(1):77-81.[ZK)]
[10][ZK(#]马常念,张慧琴,肖金平,等. 三种桃砧木茎尖培养技术的研究[J]. 浙江农业学报,2013,25(3):503-508.[HJ1.88mm]
[11]Pooler M.R.,Scorza R. Regeneration of peach[Prunus persica (L.) Batsch]rootstock cultivar from cotyledons of mature stored seed[J]. HortScience,1995,30(2):355-356.
[12]San B S,Li Z G,Hu J,et al. Adventitious shoot regeneration from in vitro cultured leaf explants of peach rootstock Guardian is significantly enhanced by silver thiosulfate[J]. Plant Cell Tissue and Organ Culture,2015,120:757-765.
[13]叢芳,韩明玉,赵彩平,等. 桃叶片再生不定芽的研究[J]. 果树学报,2009,26(5):614-618.
[14]张永庆,陈大明,金勇丰,等. 桃离体组织分化再生植株的研究[J]. 园艺学报,2001,28(4):342-343.
[15]Gentile A,Monticelli S,Damiano C,et al. Adventitious shoot regeneration in peach[Prunus persica (L.) Batsch][J]. Plant Cell Rep,2002,20:1011-1016.
[16]吴延军,徐昌杰,张上隆. 桃组织培养和遗传转化研究现状及展望[J]. 果树学报,2002,19(2):123-127.
[FQ)]
