多重RT—PCR检测蝴蝶兰3种病毒CymMV、ORSV和CMV
2017-04-15涂小云董小艳郭春梅何俊平鲍
涂小云++董小艳 +郭春梅 何俊平 +鲍恩亚

摘要:根据建兰花叶病毒(Cymbidium mosaic virus,CymMV)、齿兰轮斑病毒(Odontoglossum ringspot virus,ORSV)和黄瓜花叶病毒(cucumber mosaic virus,CMV)3种病毒外壳蛋白基因序列保守序列设计特异性引物,以病毒侵染的蝴蝶兰总RNA反转录的cDNA为模板进行扩增,建立了三重RT-PCR同时检测该3种病毒的方法。CymMV、ORSV和CMV 3种病毒特异扩增的片段分别为561、433、306 bp。用该方法对17个疑似病毒感染的蝴蝶兰样品进行檢测,结果13个材料检测出CymMV特异带,2个材料检测出ORSV病毒特异带,1个材料检测出CMV病毒特异带,1个材料同时检测出CymMV和ORSV病毒2条特异带,所检测的17个蝴蝶兰材料未发现3种病毒复合侵染的情况。
关键词:蝴蝶兰;多重RT-PCR;建兰花叶病毒;齿兰轮斑病毒;黄瓜花叶病毒;检测方法
中图分类号: S436.8+1文献标志码: A
文章编号:1002-1302(2017)05-0091-02
兰花是一种高价值的观赏花卉,但一旦感染病毒,其观赏价值和经济价值将受到严重影响。近年来,随着兰花国内外贸易和种质交流频率的增加,兰花病毒病的发生有蔓延趋势。目前,至少有28种病毒可感染兰科植物,其中我国兰科植物感染的病毒以建兰花叶病毒(Cymbidium mosaic virus,CymMV)、齿兰轮斑病毒(Odontoglossum ringspot virus,ORSV)为主,且这2种病毒复合感染占多数,也有少数蝴蝶兰感染黄瓜花叶病毒(cucumber mosaic virus,CMV)[1]。CymMV和ORSV主要借助机械性伤口进行传播,CMV 可借汁液传染,也可通过蚜虫传播。这3种病毒病感染兰花后可迅速扩散,且无有效防治药剂;因此,有必要建立多种病毒的高效检测方法,尽早检出感病植株并实施销毁,避免兰园大面积受损。
目前检测植物体内病毒的主要方法有电镜法、血清学鉴定和PCR技术等。其中PCR技术,尤其是多重PCR,具有快速、便捷、灵敏度高和特异性强等显著优点,现已广泛用于病原微生物的检测。多重PCR是在同一反应体系中,利用一对或多对引物同时扩增出多个核酸片段的PCR反应,比普通单重PCR更为高效、经济和简便。郑轩等在一个PCR体系中成功对5种病毒复合侵染的烟草材料进行多重扩增,建立了能同时检测烟草花叶病毒、黄瓜花叶病毒、烟草蚀纹病毒、马铃薯Y病毒和烟草脉带花叶病毒的多重PCR检测体系[2]。张威等[3]和罗文彬等[4]分别建立了可同时检测马铃薯3种病毒和5种病毒的多重PCR方法。
多重PCR在兰花病毒检测的利用主要集中于CymMV和ORSV的双重检测[5-9],如郑国华等利用2对特异引物在同一个PCR反应体系进行扩增的方法,建立了二温式多重 RT-PCR同时检测CymMV和ORSV 2种病毒的方法[8];章鹏程等利用1对简并引物,通过一步式IC-RT-PCR可以同时检测CymMV和ORSV复合感染情况[10]。凤仙花坏死斑病毒(impatiens necrotic spot virus,INSV)和CymMV 2种病毒也可以通过双重RT-PCR同时检测[11]。樊荣辉等通过优化三重PCR反应条件,一次扩增能同时检测文心兰CymMV、ORSV和菜豆黄花叶病毒(bean yellow mosaic virus,BYMV)的特异片段[12]。CymMV、ORSV和兰花斑点病毒(orchid fleck virus,OFV)的三重PCR检测体系最近也已有报道[13]。但CymMV、ORSV和CMV的三重PCR检测体系目前还未见报道。本研究根据CymMV、ORSV和CMV外壳蛋白基因序列保守区域设计特异性引物,建立了三重RT-PCR检测该3种病毒的方法,可准确快速、简便、经济地检测出蝴蝶兰带毒情况,为尽早发现、消除病害,减少经济损失提供了技术支持。
1材料与方法
1.1材料
CymMV、ORSV和CMV 3种病毒2013年采自江苏省连云港振兴实业集团有限公司的兰花基地。其他供试蝴蝶兰材料来源于连云港当地花卉市场。
1.2引物设计
1.3cDNA获取
取蝴蝶兰新鲜叶片,液氮研磨成粉状,用Trizol RNA试剂盒提取叶片总RNA,然后用Prime Script 1st Strand cDNA Synthesis Kit(TaKaRa)将RNA反转录为cDNA第一链,随即保存于-20 ℃备用。所有操作均按试剂盒说明书进行。
1.4单重RT-PCR确定产物的特异性
采用Vazyme Taq DNA聚合酶进行PCR扩增,20 μL反应体系的组成如下:2× Vazyme mix buffer 10.0 μL,10 μmol/L上游引物和下游引物各 1.0 μL,cDNA模板1.0 μL,无菌水 7 μL。PCR反应程序如下:95 ℃预变性3 min;93 ℃变性 30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。取5 μL PCR产物经1%琼脂糖凝胶电泳分析。
1.5多重RT-PCR检测的建立
在单重PCR基础上,将上述3种cDNA模板等量混合,保持其他条件不变,分别对模板浓度、退火温度、引物浓度和循环参数进行优化,最后确定多重PCR最优反应体系。采用Vazyme Taq DNA聚合酶进行PCR扩增,20 μL反应体系的组成如下:2× Vazyme mix Buffer 10.0 μL,10 μmol/L CymMV上游引物和下游引物各 0.8 μL,10 μmol/L ORSV上游引物和下游引物各 0.8 μL,10 μmol/L CMV上游引物和下游引物各 0.5 μL,稀释10倍的cDNA模板1.0 μL,无菌水4.8 μL。PCR反应程序如下:95 ℃预变性3 min;93 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。取5 μL PCR产物经1%琼脂糖凝胶电泳分析。
2结果与分析
2.1单重RT-PCR检测体系
分别单独采用1对引物对获得的蝴蝶兰cDNA样品进行PCR扩增,3对引物均能在相对于的样品中获得预期大小的扩增产物(扩增产物分别为561、433、306 bp),电泳呈单一明亮条带(图1),阴性水对照没有阳性条带,表明检侧结果是特异性的,适合用于病毒检侧。
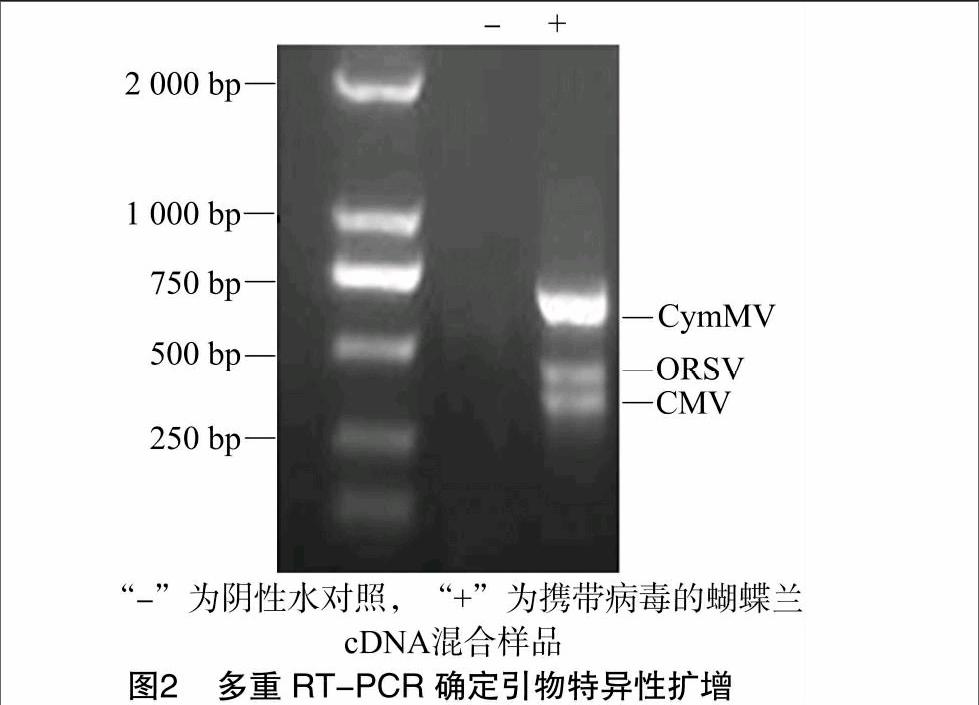
2.2三重RT-PCR检测体系
扩增CymMV、ORSV和CMV的3对引物按等量浓度混合,对蝴蝶蘭cDNA混合样品进行扩增,效果不理想。经过系列优化后,扩增CymMV、ORSV和CMV的3对引物的浓度比例为CymMV ∶[KG-*3]ORSV ∶[KG-*3]CMV= 1.6 ∶[KG-*3]1.6 ∶[KG-*3]1,蝴蝶兰cDNA混合样品稀释10倍,可以在同一个PCR反应体系中成功扩增出3个利用优化后RT-PCR体系,检测疑似病毒侵染的17个蝴蝶兰材料,结果如图3所示:13个(1~3、5~7、10~13、15~17)材料检测出CymMV特异带,2个(4、9号)材料检测出ORSV病毒特异带,1个(8号)材料检测出CMV病毒特异带,1个(14号)材料检测出CymMV和ORSV病毒2条特异带,阴性水对照(18号)无CymMV、ORSV或CMV特异带。所检测的17个蝴蝶兰材料未发现3种病毒复合侵染的情况。
3讨论
普通单重RT-PCR可以对单一病毒进行有效检测,但CymMV、ORSV等病毒广泛分布于世界各地商业生产的兰花中,感染30多种兰属花卉,且这些病毒还易于形成复合侵染,严重降低兰花的商业价值[14]。同时检测2种或多种主要兰花病毒的双重或多重PCR技术已有多个成功的报道,它们可以降低检测成本,缩短病毒检测时间,提高检测效率,包括针对CymMV和ORSV的双重PCR检测[5-10],针对INSV和CymMV双重PCR检测[11],针对CymMV、ORSV和BYMV的三重检测[12],针对CymMV、ORSV和OFV的三重PCR检测体系[13]等。对于病毒的检测,并非所有的病毒都可以用同一种方法检测,也没有一种方法可以检测出所有的病毒,应根据所研究的病毒特性及具体的试验条件、科研水平和操作人员的技[CM(25]术水平选用合适的方法。本研究针对蝴蝶兰CymMV、
ORSV和CMV 3种病毒,成功建立了RT-PCR三重检测技术,该项技术的关健是要选用合适的引物,在保证引物特异性的前提下,避免引物之间的互作干扰。本研究中所涉及3种病毒外壳蛋白基因序列同源性较高,因而用PCR方法对其进行检测可获得较稳定可靠的结果。
参考文献:
[1]苏俊明,张友强. 蝴蝶兰病毒病发生与防治(二)[N]. 中国花卉报,2008-05-24(003).
[2]郑轩,成巨龙,赵震,等. 五种烟草病毒TMV、CMV、TEV、PVY及TVBMV的多重RT-PCR同步检测[J]. 植物病理学报,2011,41(2):146-153.
[3]张威,白艳菊,范国权,等. 应用三重RT-PCR技术检测三种马铃薯病毒[J]. 中国马铃薯,2015(3):162-166.
[4]罗文彬,李华伟,汤浩,等. 马铃薯5种病毒多重PCR检测技术的建立及应用[J]. 园艺学报,2015,42(2):280-288.
[5]曾燕君,莫饶,刘志昕,等. 兰花两种主要病毒双重RT-PCR检测方法的建立[J]. 江西农业学报,2009,21(7):12-14.
[6]张妙彬,潘丽晶,肖杨,等. 双重RT-PCR同时检测兰花两种主要病毒的研究[J]. 广东农业科学,2010,37(5):166-167,180.[HJ1.75mm]
[7]闻伟刚,谭钟,崔俊霞. 实时荧光RT-PCR方法检测齿兰环斑病毒与建兰花叶病毒[J]. 植物保护,2009,35(4):101-104.
[8]郑国华,明艳林,林德钦,等. 二温式多重RT-PCR同时检测两种主要兰花病毒的研究[J]. 植物保护,2007,33(2):113-115.
[9]周国辉,陈晓琴,李梅辉,等. 双重一步法RT-PCR同时检测兰花上的两种主要病毒[J]. 农业生物技术学报,2004,12(6):743-744.[ZK)]
[10]章鹏程,陈芝娟,杨科府,等. 一步式IC-RT-PCR同时检测2种兰花病毒的探讨[J]. 浙江农业科学,2012(8):1165-1168.
[11]丁元明,张巧萍,王云月,等. 兰花上凤仙花坏死斑病毒和建兰花叶病毒双重RT-PCR检测方法的建立[J]. 植物检疫,2009,23(4):32-33.
[12]樊荣辉,黄敏玲,钟淮钦,等. 文心兰3种主要病毒多重RT-PCR检测体系的建立[J]. 福建农业学报,2015(7):697-700.
[13]Ali R,Dann A,Cross P,et al. Multiplex RT-PCR detection of three common viruses infecting orchids[J]. Archives of Virology,2014,159(11):3095-3099.
[14]万晴姣,李欲轲,马骏,等. 贵州齿兰环斑病毒的分子鉴定[J]. 贵州农业科学,2014(8):96-98.
[FQ)]
